EGFR-TKI联合化疗对晚期非小细胞肺癌患者血清IGF-1和AGR2水平的影响
岳红红,赵 亮,姜 威
(中国武警总医院,北京100039)
·论 著·
EGFR-TKI联合化疗对晚期非小细胞肺癌患者血清IGF-1和AGR2水平的影响
岳红红,赵 亮,姜 威△
(中国武警总医院,北京100039)
目的 观察表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)联合化疗对非小细胞肺癌(NSCLC)患者化疗前后血清胰岛素样生长因子1(IGF-1)和前梯度蛋白2(AGR2)水平变化的影响,探讨IGF-1和AGR2能否作为评估NSCLC化疗疗效及预后的指标。方法 选取68例晚期NSCLC患者给予EGFR-TKI联合化疗为试验组,并以30例健康人群为健康对照组,采用酶联免疫吸附试验(ELISA)分别测定化疗前、化疗3周后血清IGF-1、AGR2水平。采用Kanplan-Meier法分析血清IGF-1、AGR2水平变化对预后的影响。结果 (1)EGFR-TKI联合化疗疾病控制率(DCR)为52.9%;(2)试验组治疗前血清IGF-1水平为(329.35±88.13)μg/L,明显高于健康对照组的(146.36±41.27)μg/L(P<0.01),试验组治疗前血清AGR2水平为(16.72±6.23)ng/mL,高于健康对照组的(4.38±2.17)ng/mL(P<0.01);治疗后血清IGF-1为(211.53±52.31)μg/L、AGR2水平为(9.72±3.56)ng/mL,均比治疗前明显降低(均P<0.01);NSCLC患者血清IGF-1与AGR2水平呈正相关(r=0.489,P<0.01);(3)治疗有效组患者血清IGF-1水平为(128.62±48.24)μg/L、AGR2水平为(7.22±4.27)ng/mL,分别较治疗前IGF-1[(334.23±82.11)μg/L]、AGR2[(18.43±6.17)ng/mL]明显下降(均P<0.01)。Kanplan-Meier分析显示,治疗后血清IGF-1、AGR2水平的高低对预后有明显影响。结论 IGF-1、AGR2水平在评估EGFR-TKI联合化疗对晚期NSCLC的疗效及预后有着潜在的临床价值。
非小细胞肺癌; 胰岛素样生长因子; 前梯度蛋白2; 预后
表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)越来越普遍应用于非小细胞肺癌(NSCLC)治疗中,相当一部分的临床研究显示,EGFR-TKI联合化疗有着更好的疗效,不良反应更少[1]。其中,EGFR突变与临床疗效有一定的相关性,但由于EGFR突变检测较复杂,在临床上难以开展,因此寻找新的替代标志物来评估或预测EGFR-TKI联合化疗的疗效及预后的指标显得尤为重要。血清胰岛素样生长因子1(IGF-1)是一种多肽类生长因子,具有刺激细胞增殖、促进细胞生长等作用。IGF-1通过与其受体结合,促进肿瘤细胞的分化、生长[2]。前梯度蛋白2(AGR2)是从乳腺癌细胞系MCF7的cDNA文库中筛选出非洲爪蟾xAG2的同源基因,与肿瘤的发生、发展及预后密切相关[3]。多项研究表明,IGF-1和AGR2可作为不同肿瘤包括肺癌、乳腺癌等的生物标志物。目前,有关EGFR-TKI联合化疗对晚期NSCLC患者血清IGF-1、AGR2水平的影响及预后相关性的研究少见报道。本研究通过观察EGFR-TKI联合化疗在晚期NSCLC治疗中的疗效以及治疗前后血清IGF-1、AGR2水平变化,进一步探讨IGF-1、AGR2水平与疗效、预后的相关性,为临床上判断疗效及预后提供一个可靠的指标。
1 资料与方法
1.1 一般资料 选择2012年1月至2015年1月在本院住院治疗的肺癌患者68例,均经病理学确诊为NSCLC,其中男48例、女20例;≤60岁28例,>60岁40例;年龄42~77岁、平均53.4岁;腺癌44例,鳞癌24例;低分化癌26例,中分化癌22例,高分化癌20例;根据2009年肺癌TNM分期标准,Ⅲ期37例,Ⅳ期31例。临床上有可测量的病灶,Karnofsky评分大于60分,预计生存期大于3个月,血常规、肝肾功能、心电图正常;治疗前1个月内未行其他抗肿瘤治疗。健康对照组为同时期健康体检者30例,其中男20例、女10例,年龄31~75岁、平均52.1岁。两组性别及年龄比较,差异无统计学意义(P>0.05)。
1.2 方法与疗效评价 所有患者采用GP化疗方案:吉西他滨1 250 mg/m2,静脉滴注,第1、8天;顺铂40 mg/m2,静脉滴注,第1~3天。21 d为1个周期,至少2个周期。患者服用盐酸厄洛替尼150 毫克/次,1次/天。按世界卫生组织(WHO)实体瘤客观疗效标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),以(CR+PR+SD)为疾病控制率(DCR)。总生存期(OS)的定义是指从化疗开始至因任何原因引起死亡的时间。末次随访时间2015年12月30日为随访截止日期。
1.3 血清IGF-1、AGR2水平检测 所有患者于化疗前及化疗2个疗程结束后,以及健康对照者在清晨空腹采集静脉血5 mL,1 000 r/min离心20 min,分装,置于-80 ℃冰箱保存待测。采用酶联免疫吸附试验(ELISA)检测IGF-1、AGR2,IGF-1 ELISA及AGR2 ELISA试剂盒购自北京易科攀博生物有限公司,严格按检测说明书操作。

2 结 果
2.1 近期疗效情况 本组68例患者中,CR 0例,PR 26例,SD 10例,PD 32例,DCR为52.9%(36/68)。
2.2 两组血清IGF-1、AGR2水平 试验组治疗前血清IGF-1水平为(329.35±88.13)μg/L,明显高于健康对照组的(146.36±41.27)μg/L(P<0.01),试验组治疗前血清AGR2水平为(16.72±6.23)ng/mL,高于健康对照组的(4.38±2.17)ng/mL(P<0.01);治疗后血清IGF-1为(211.53±52.31)μg/L、AGR2水平为(9.72±3.56)ng/mL,均比治疗前明显降低(均P<0.01)。
2.3 治疗有效及无效组患者化疗前后IGF-1、AGR2水平 治疗有效组患者血清IGF-1水平为(128.62±48.24)μg/L较治疗前为(334.23±82.11)μg/L明显下降(P<0.01)。而治疗无效组患者血清IGF-1水平为(304.46±78.52)μg/L,较治疗前的(323.13±73.56)μg/L略有下降,但差异无统计学意义(P>0.05);治疗有效组患者血清AGR2水平为(7.22±4.27)ng/mL,较治疗前的(18.43±6.17)ng/mL明显下降,差异有统计学意义(P<0.01)。而治疗无效组患者血清AGR2水平为(12.69±3.56)ng/mL,低于治疗前的(15.36±2.78)ng/mL,但差异无统计学意义(P>0.05)。
2.4 血清IGF-1、AGR2水平对生存时间的影响 根据治疗前后血清IGF-1、AGR2检测结果,计算出血清IGF-1、AGR2水平中位值(IGF-1=113.74 μg/L、AGR2=6.28 ng/mL),以中位值为界,划分为高值和低值,经Kaplan-Meier法绘制生存曲线,发现,血清IGF-1、AGR2水平高于中位值,其生存率较低,表明治疗后血清IGF-1、AGR2水平的高低对预后有明显影响(P<0.01)。见图1、2。

图1 血清IGF-1水平对生存时间的影响
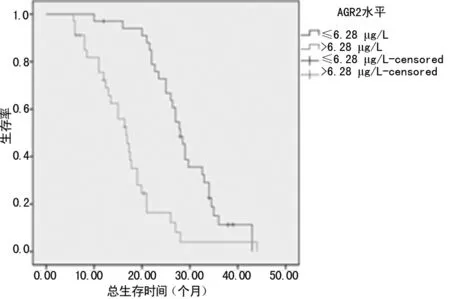
图2 血清AGR2水平对生存时间的影响
2.5 血清IGF-1与AGR2水平的相关分析 晚期NSCLC患者血清IGF-1与AGR2水平呈正相关(r=0.489,P<0.01)。见图3。

图3 IGF-1与AGR2相关的关系
3 讨 论
有研究报道,EGFR-TKI联合化疗能有效提高NSCLC患者的临床获益率,延长无进展生存时间[4]。本研究中,晚期NSCLC患者予以EGFR-TKI联合化疗,其DCR为52.9%,表明采用EGFR-TKI联合化疗有效提高了患者的疗效,却并不能使晚期NSCLC患者完全缓解,只能部分有效缓解疾病的发展。这其中大部分患者并未从中受益。有研究表明,采用EGFR-TKI治疗,EGFR突变阳性患者临床疗效好于EGFR突变阴性患者[5]。但是,EGFR突变检测受到很多因素的制约,如实验室技术、价格等,在临床实践中无法广泛地开展。因此,需要一个新的替代指标来预测或评估EGFR-TKI治疗或化疗的疗效以及预后。
IGF-1是主要由肝脏分泌的一种生长因子及促有丝分裂原。在多种肿瘤中呈高表达,与肿瘤病情进展、化疗药物的抵抗以及不良预后相关[6]。张曦等[7]利用RNA干扰(RNAi)介导胰岛素样生长因子1受体(IGF-1R)基因沉默,可逆转NSCLC细胞PC-9/ZD发生上皮-间质转化。汤敏等[8]研究发现,NSCLC患者血清IGF-1水平明显高于健康人,NSCLC危险程度随着IGF-1水平升高而增加,对于NSCLC的辅助诊断和生物学行为预测重要的价值。马望等[9]研究报道,在NSCLC患者中,化疗有效组血清IGF-1明显下降,表明IGF-1与NSCLC疾病进展密切相关,有可能成为预测化疗疗效的指标。本研究结果显示,NSCLC患者IGF-1水平明显高于健康对照组,予以联合化疗后,IGF-1水平明显下降,而化疗无效组无明显下降,与前述报道结果一致。进一步对NSCLC患者生存时间曲线分析发现,予以EGFR-TKI联合化疗后,血清IGF-1水平越高,总生存时间越短,其原因可能与血清IGF-1高表达与肺癌的侵袭、远处转移等恶性生物学行为有关。
AGR2与肿瘤的发生、发展密切相关。采用RNAi 技术特异地剔除AGR2基因可明显减少肺癌细胞的转移[10]。Chung等[11]研究发现,在Ⅰ期肺癌患者中,血清AGR2水平高于平均值。Alavi等[12]研究发现,几乎所有的NSCLC患者均有AGR2表达,并且AGR2水平与年轻患者总生存期有关。本研究结果显示,NSCLC患者治疗前AGR2水平明显高于健康对照组,这与上述的研究结果相一致,其原因可能是由于肿瘤细胞过度分泌AGR2释放入血所致。Narumi等[13]研究发现,AGR2可作为反映肺腺癌患者EGFR基因突变的辅助标志物,也是肺腺癌细胞EGFR-TKI治疗敏感性潜在的标志物。在肺癌细胞系NCI-H460中,AGR2水平降低破坏了EGFR介导的信号转导途径[14]。本研究结果显示,予以EGFR-TKI联合化疗后,血清AGR2水平明显降低。此外,治疗有效组血清AGR2水平明显下降,而无效组则下降不明显,表明血清AGR2水平可能与体内肿瘤负荷有关,可作为判断疗效的参考指标。通过生存时间曲线分析发现,予以EGFR-TKI联合化疗后,血清AGR2水平越高,生存时间越短。推测,AGR2水平越高,恶性程度越高,更快地出现肿瘤转移,从而导致患者更差的预后,生存期缩短。剔除AGR2基因,可减少IGF-1诱导的乳腺癌细胞增殖、转移和细胞周期进程[15]。AGR2是IGF-1参与肿瘤进展的关键调控者。本研究中通过相关分析发现,NSCLC患者血清IGF-1与AGR2水平呈正相关,表明IGF-1与AGR2共同参与了肺癌的进展。
综上所述,晚期NSCLC患者给予EGFR-TKI联合化疗后,血清IGF-1与AGR2水平与临床疗效及预后有密切的关系,在评估EGFR-TKI联合化疗对晚期NSCLC的疗效及预后有着潜在的临床价值。本研究不足之处在于单中心、样本量偏少,还需要多中心、大样本量的研究来证实两者在NSCLC的疗效及预后判断方面的价值。此外,如何有效降低肺癌血清中IGF-1、AGR2水平,以及如何阻断两者之间的协同作用通路,有可能成为提高肺癌疗效的重要途径之一。
[1]寻琛,王琳,边劲.EGFR-TKI与化疗药物在晚期非小细胞肺癌中最佳联合方式的探讨[J].临床肿瘤学杂志,2012,17(12):1141-1146.
[2]杜立平.非小细胞肺癌患者检测血清CA21-1、IGF-1表达对术后疗效的评估[J].临床肺科杂志,2015,20(10):1784-1786.
[3]魏龙刚,邓鸣涛,赵一楠,等.AGR2:一个新的癌症诊断标记[J].中国细胞生物学学报.2013,35(12):1-9.
[4]李佳旻,洪群英,张新,等.化疗序贯EGFR-TKI治疗晚期非小细胞肺癌EGFR-TKI获得性耐药患者的效果及安全性[J].中华医学杂志,2014,94(30):2342-2345.
[5]王芬,王洁,白桦,等.晚期非小细胞肺癌EGFR蛋白磷酸化、基因突变与EGFR-TKI疗效相关性的研究[J].中国癌症杂志,2014,24(9):657-668.
[6]Wei YH,Tang HX,Liao YD,et al.Effects of insulin-like growth factor 1 receptor and its inhibitor AG1024 on the progress of lung cancer[J].J Huazhong Univ Sci Technolog Med Sci,2015,35(6):834-841.
[7]张曦,张为民,陈蓓.RNAi介导IGF-1R基因沉默对非小细胞肺癌PC-9/ZD细胞株EMT的影响[J].山东医药,2014,54(23):1-5.
[8]汤敏,潘泓,黄耀元,等.IGF-1、IGFBP-4和PAPPA在非小细胞肺癌患者血清的浓度及其临床意义[J].中国癌症杂志,2015,25(6):439-445.
[9]马望,樊青霞,王留兴,等.非小细胞肺癌患者化疗前后血清IGF-1和IGFBP-3水平的变化[J].郑州大学学报(医学版),2010,45(4):663-665.
[10]Hu R,Huffman KE,Chu M,et al.Quantitative Secretomic Analysis Identifies Extracellular Protein Factors That Modulate the Metastatic Phenotype of Non-Small Cell Lung Cancer[J].J Proteome Res,2016,15(2):477-486.
[11]Chung K,Nishiyama N,Yamano S,et al.Serum AGR2 as an early diagnostic and postoperative prognostic biomarker of human lung adenocarcinoma[J].Cancer Biomark,2011,10(2):101-107.
[12]Alavi M,Mah V,Maresh EL,et al.High expression of AGR2 in lung cancer is predictive of poor survival[J].BMC Cancer,2015,6(15):655.
[13]Narumi S,Miki Y,Hata S,et al.Anterior gradient 2 is correlated with EGFR mutation in lung adenocarcinoma tissues[J].Int J Biol Markers,2015,30(2):234-242.
[14]Dong A,Wodziak D,Lowe AW.Epidermal growth factor receptor(EGFR)signaling requires a specific endoplasmic reticulum thioredoxin for the post-translational control of receptor presentation to the cell surface[J].J Biol Chem,2015,290(13):8016-8027.
[15]Li Z,Wu Z,Chen H,et al.Induction of anterior gradient 2(AGR2)plays a key role in insulin-like growth factor-1(IGF-1)-induced breast cancer cell proliferation and migration[J].Med Oncol,2015,32(6):577.
Effect of EGFR-TKI combined with chemotherapy on serum IGF-1 and AGR2 levels in patients with advanced non-small cell lung cancer
YUEHonghong,ZHAOLiang,JIANGWei△
(GeneralhospitalofChinesePeople′sArmyPoliceForce,Beijing100039,China)
Objective To observe the effect of EGFR-TKI combined with chemotherapy on the changes of serum insulin-like growth factor1(IGF-1)and anterior gradient-2(AGR2)levels in the patients with advanced non-small cell lung cancer(NSCLC),and to investigate whether IGF-1 and AGR2 can serve as a potential indicator of the prognosis and efficacy of chemotherapy in NSCLC.Methods Sixty-eight patients with advanced NSCLC were selected as the experimental group treated by EGFR-TKI combined chemotherapy and 30 healthy people served as the healthy control group.(treatment group).The levels of serum IGF-1 and AGR2 before chemotherapy and at 3 weeks after chemotherapy were detected by ELISA.The influence of serum IGF-1 and AGR2 levels on the prognosis was analyzed by using Kanplan-Meier method.Results (1)The disease control rate(DCR)in the EGFR-TKI combined chemotherapy was 52.9%;(2)the level of serum IGF-1 before treatment in the experimental group was(329.35±88.13)μg/L,which was significantly higher than (146.36±41.27)μg/L in the healthy control group(P<0.01); the level of serum AGR2 in experimental group was(16.72±6.23)ng/mL,which was significantly higher than(4.38±2.17)ng/mL in the healthy control group(P<0.01); serum levels of IGF-1 and AGR2 after treatment were(211.53±52.31)μg/L and (9.72±3.56)ng/mL respectively,which were significantly lower than those before treatment(P<0.01); serum IGF-1 and AGR2 in NSCLC patients were positively correlated(r=0.489,P<0.01);(3)serum levels of IGF-1 and AGR2 after chemotherapy were(128.62±48.24)μg/L and(7.22±4.27)ng/mL respectively,which were obviously lower than(334.23±82.11)μg/L and(18.43±6.17)ng/mL before chemotherapy(allP<0.01).The Kanplan-Meier analysis revealed that serum IGF-1 and AGR2 levels in advanced NSCLC had an obvious influence on the prognosis.Conclusion Serum IGF-l and AGR2 levels may have a potential clinical value to assess the therapeutic efficacy of EGFR-TKI combined chemotherapy and prognosis in advanced NSCLC.
Non-small-cell lung cancer; IGF-1; AGR2; prognosis
岳红红,女,副主任医师,主要从事过敏反应研究。△
10.3969/j.issn.1673-4130.2016.23.014
A
1673-4130(2016)23-3277-03
2016-03-03
2016-05-21)

