不同地理种群马铃薯甲虫SSR、RAPD遗传多样性分析
刘 旸,付开赟,吐尔逊·阿合买提,何 江,郭文超,周 俊
(1.石河子大学农学院,新疆石河子 832003;2.新疆农业科学院植物保护研究所,乌鲁木齐 830091;3.新疆农业科学院农业质量标准与检测技术研究所,乌鲁木齐 830091)
不同地理种群马铃薯甲虫SSR、RAPD遗传多样性分析
刘 旸1,付开赟2,吐尔逊·阿合买提2,何 江2,郭文超2,周 俊3
(1.石河子大学农学院,新疆石河子 832003;2.新疆农业科学院植物保护研究所,乌鲁木齐 830091;3.新疆农业科学院农业质量标准与检测技术研究所,乌鲁木齐 830091)
【目的】对哈萨克斯坦共和国毗邻的中国新疆伊犁河谷地区马铃薯甲虫发生区进行遗传多样性分析,研究不同地理种群的遗传分化状况,反演发生区马铃薯甲虫的传播路径。【方法】利用SSR、RAPD分子标记方法对不同地理种群的马铃薯甲虫进行遗传多样性分析。【结果】通过筛选8对有效引物进行SSR扩增得到的Shannon’s信息指数和平均基因多样性分别为(1.422 6±0.396 7)和(0.543 8±0.083 5),Nei's基因分化系数Fst为 0.206 8,即20.68%、79.32%的遗传变异存在于种群内。运用RAPD分子标记方法扩增出28个条带,其中特异性条带14个,多态位点百分率为50%,Shannon’s信息指数和平均基因多样性为(0.215 9±0.129 2)和(0.113 8±0.084 2),RAPD分子标记得出的Gst值为0.163 7,即16.37%的遗传变异存在于种群间,83.67%的遗传多样性存在于种群内。运用UPGMA聚类分析得知SSR分子标记方法中,中国东北与西北地区分为两支,乌昌地区与塔城地区聚类;RAPD聚类分析得到的结果与SSR基本一致,个别地理种群聚类结果与地理位置存在一定偏差。【结论】SSR分子标记方法重复性好且较为高效,供试马铃薯甲虫样本遗传变异性较低,RAPD方法与SSR方法研究结果也进一步验证了马铃薯甲虫在中国新疆的传播路径,即马铃薯甲虫从哈萨克斯坦共和国的塔尔巴哈台地区传入中国新疆塔城市,之后沿天山北坡逐步向东扩散。
马铃薯甲虫;SSR;RAPD;遗传多样性
0 引 言
【研究意义】马铃薯甲虫(Leptinotarsa decemlineata Say),隶属于鞘翅目,叶甲科[1],是国际公认的马铃薯毁灭性检疫害虫,1855年首次报道了马铃薯甲虫在美国科罗拉多州马铃薯产区造成严重危害[2]。马铃薯甲虫传入中国后,20多年来自西向东传播,目前已在新疆北部大部分地区均有分布,且近几年马铃薯甲虫扩散加快、危害加重。为了开发合适和有效的综合防治策略,应进一步研究其空间分布和入侵规律,利用分子遗传多样性分析可以很好解决这一问题[3]。【前人研究进展】很多学者已开展了大量关于遗传多样性的研究。高伟[4]、刘志敏等[5]运用SSR(simple sequence repeat)方法分别对四倍体棉的多态性及大麦种质资源遗传多样性进行分析,发现在棉花中,陆地棉与陆地棉野生种系中阔叶棉的亲缘关系最近;国内外大麦育种均存在遗传基础较窄的问题,需加强外来种质的引进与利用。在马铃薯甲虫的相关研究中,张润志等[3]利用SSR分子标记对新疆马铃薯甲虫遗传多样性进行了研究,发现新疆发生区的马铃薯甲虫种群遗传多样性较低。运用RAPD分子标记进行遗传多样性的研究也有报道,如张迎春[6]、杨子祥等[7]利用RAPD(random amplified polymorphic DNA)技术分别对6种瓢虫分类、倍蚜种间亲缘关系及角倍蚜种群分化进行了研究,认为6种瓢虫种、属之间亲缘关系的远近程度与形态学分类结果相一致;Sidorenko[8]等运用RAPD分子标记对马铃薯甲虫多样性进行研究,发现同一地点采集的马铃薯甲虫春季代多态性远高于夏季代。这些研究运用SSR和RAPD分子标记方法对植物与昆虫的遗传多样性进行分析,但目前国内对马铃薯甲虫的遗传多样性研究尚处在起步阶段,仍在使用早期的分子标记方法RAPD,此方法稳定性、重复性较差,实验结果不够可靠。因此,运用不同分子标记方法对马铃薯甲虫的遗传多样性进行研究,筛选出高效且更适于马铃薯甲虫的分子标记方法十分必要。【本研究切入点】目前,国内运用不同分子标记方法分析马铃薯甲虫遗传多样性并筛选出较适合此研究的分子标记方法的相关研究报道较少。应用SSR、RAPD分子标记方法对不同地理种群的马铃薯甲虫进行遗传多样性分析。【拟解决的关键问题】反演马铃薯甲虫在中国发生区传播路径,探索其传播扩散规律,为有效控制马铃薯甲虫的危害,阻止或延缓其进一步扩散提供理论依据。
1 材料与方法
1.1 材 料
RAPD与SSR分子标记所用的马铃薯甲虫样品于2014年5至8月间采集于新疆马铃薯甲虫发生区伊犁河谷地区、塔城地区、阿勒泰地区、昌吉回族自治州、乌鲁木齐等6个地州16个县市以及哈萨克斯坦塔尔迪库尔汗州、我国黑龙江省东宁市(与俄罗斯远东地区伏拉迪斯沃托克接壤),共采集1 337份标本,用于SSR、RAPD遗传多样性研究。表1

表1 供试马铃薯甲虫来源信息Table 1 The specimens tested of Leptinotarsa decemlineata
1.2 方 法
1.2.1 马铃薯甲虫DNA的提取
马铃薯甲虫基因组DNA的提取参考 DNA提取试剂盒(天根)提供的方法,匀浆马铃薯甲虫头部,10 000 r/min离心1 min,去上清,加200 μL缓冲液 GA,振荡至彻底悬浮。加入20 μL蛋白酶 K溶液,混匀。加入200 μL缓冲液 GB,混匀,70℃孵育10 min。加人200 μL无水乙醇,充分振荡混匀。转移溶液和絮状沉淀至吸附柱中,12 000 r/min离心30 s,弃废液。加入 500 μL缓冲液 GD,12 000 r/min离心30 s,弃废液。加入600 μL漂洗液 PW,12 000 r/min离心30 s,弃废液。重复漂洗一次。12 000 r/min空离 2 min。室温放置数分钟,晾干。加入50~200 μL TE缓冲液,室温放置2 min,12 000 r/min离心2 min,将溶液收集到离心管中 -20℃保存。
1.2.2 SSR与RAPD分子标记
1.2.2.1 SSR分子标记反应体系及条件
利用11对荧光标记引物,在退火温度为55℃时对20个地理种群的马铃薯甲虫样品进行扩增。反应体系为:20 μL,包括7 μL ddH2O,10 μL Premix Taq(北京奥赛博),1 μL模板DNA,各1 μL上下游引物(金唯智)。扩增程序为:95℃预变性5 min;35个循环:95℃变性30 s,55℃退火30 s,72℃下延伸40 s,循环结束后于72℃条件下完全延伸5 min,取1 μL PCR产物进行毛细管电泳(北京市六一仪器厂)。表2
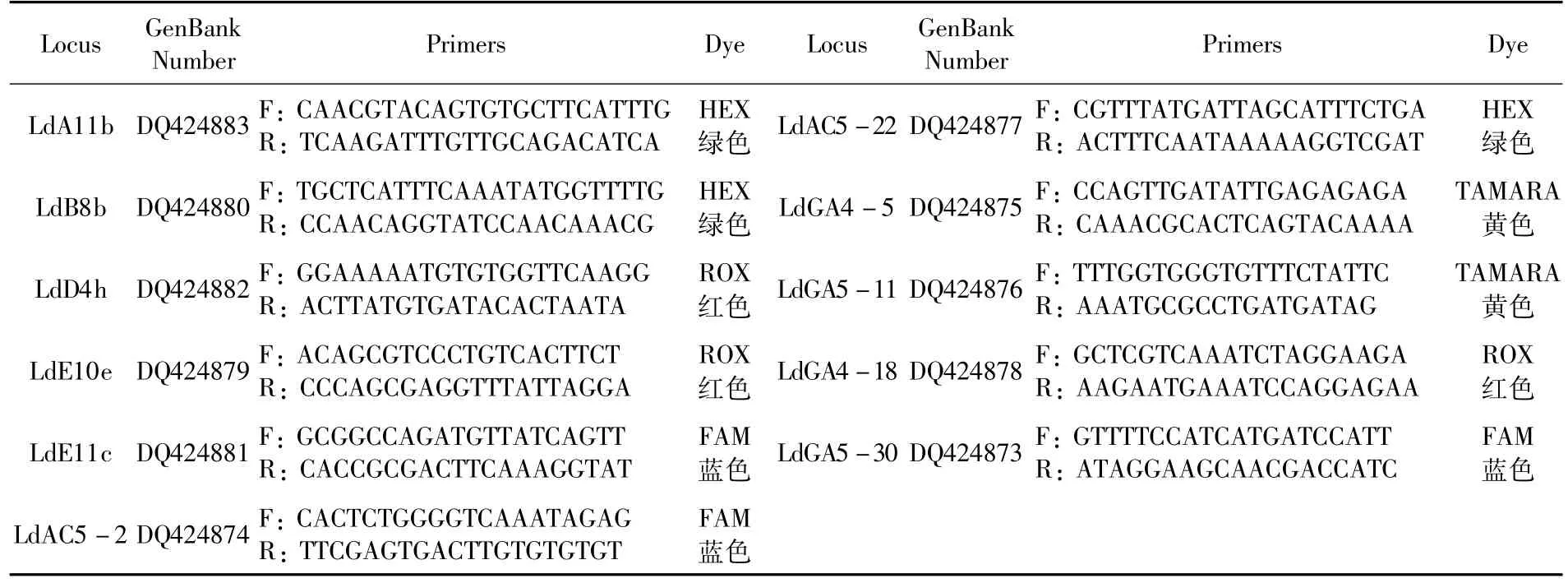
表2 SSR分子标记引物序列Table 2 SSR primer sequences
1.2.2.2 RAPD分子标记反应体系及条件
用3条随机引物(Biomed)对15个地理种群马铃薯甲虫样品的DNA进行扩增。RAPD反应体系为25 μL,其中包括10.5 μL ddH2O,12.5 μL 2xTaq PCR Master Mix(Cwbio),1 μL模板DNA,1 μL引物。扩增程序为:95℃预变性 5 min;3个循环:94℃变性 1 min,45℃退火1.5 min,72℃下延伸2 min。随后进行第二次循环,共40个循环:94℃变性 1 min,40℃1.5 min,72℃延伸 2 min。循环结束后于72℃条件下完全延伸 9 min。PCR产物用 1.0%的琼脂糖凝胶电泳检测,染料为GoldView I型核酸染色剂(Zomanbio),Marker为DL2000(Cwbio),电泳条件为100 V,45 min,随后在 Image Lab凝胶成像系统上检测拍照。
1.3 数据统计
RAPD与 SSR扩增产物中的每一条带均视为一个分子标记,有扩增条带记为1,无扩增条带记为0,建立0,1矩阵。采用POPGEEN 32对马铃薯甲虫样本各地理种群进行遗传多样性分析,包括每个地理种群的多态位点数N、每个位点的平均等位基因数Na和有效平均等位基因数Ne、Nei's基因多样性指数 H、Shannon's多样性信息指数I,种群总遗传多样性系数(Ht)和地理种群内的遗传变异Hs,地理种群遗传分化系数Gst,Nei's遗传距离D和遗传一致度I,基因流Nm。再用UPGMA方法对不同地理种群马铃薯甲虫进行聚类分析,明确各地理种群之间的遗传关系[9]。
2 结果与分析
2.1 SSR和 RAPD分子标记引物筛选结果
用11对荧光引物对部分地理种群样品进行SSR扩增,筛选出8对高效引物:LdA11b、LdB8b、LdE10e、LdE11c、LdAC5-22、LdGA4-5、LdGA5-30,用于后续 20个地理种群马铃薯甲虫SSR扩增。运用RAPD方法从3个引物中筛选出条带清晰且多态性高的引物,扩增获得28个条带,其中多态性条带14个,多态位点百分率(PPB)为50%,说明所检测的条带多态性较低。图1

图1 P4引物对部分地理种群扩增RAPD带型Fig.1 Part of RAPD bands of partal population samples
2.2 SSR、RAPD分子标记对马铃薯甲虫不同地理种群遗传多样性进行分析
采用 SSR分子标记方法对供试的马铃薯甲虫遗传多样性进行统计分析,结果表明:马铃薯甲虫在物种水平上,等位基因数(Na)为8.250 0个,有效等位基因数(Ne)为 3.555 2个,多态位点百分率为100%。不同地理种群水平上的等位基因数(Na)为2.375 0~4.250 0(察布察尔-木垒)个,平均为3.218 75个,有效等位基因数(Ne)为1.898 6~3.316 9(察布察尔 -博乐)个,平均为2.510 0个;多态位点百分率在75% ~100%(呼图壁 -黑龙江),平均为 97.5%。各地理种群的Nei's期望杂合度在 0.412 5~0.655 0(察布察尔-博乐),平均为0.543 8;Shannon's信息多样性指数(I)0.659 7~1.223 8(察布察尔-木垒),平均为0.950 5。运用POPGENE软件分析可知由SSR方法获得的不同地理种群总的近交系数 Fis=0.124 1,地理种群之间的基因分化系数Fst=0.206 8,种群间基因流Nm =0.958 8。表3
采用RAPD分子标记方法对不同地理种马铃薯甲虫的遗传多样性进行统计分析,结果表明:供试的不同地理种群水平上,等位基因(Na)为1.214 3~1.607 1(博乐 -尼勒克)个,平均值为1.407 1,有效等位基因数(Ne)为1.083 5~1.199 9(博乐 -玛纳斯)个,平均为1.138 5个,多态位点百分率在21.43%~60.71%(博州 -尼勒克),平均为40.72%,各地理种群的 Nei's基因多样性指数在0.056 1~0.121 6(博乐 -玛纳斯),平均为0.096 2,Shannon's信息多样性指数(I)0.090 7~0.193 5(博乐 -奇台),平均为0.159 4;从整体物种水平上来看,等位基因数(Na)为2.000 0个,有效等位基因数为1.139 1个,多态位点百分率为89.3%,Nei's遗传多样性指数(H)为0.113 8,Shannon's信息多样性指数(I)为(0.215 9±0.129 2)。两个代表遗传多样性大小的指数(I,H)均较小,表明所采集到的地理种群遗传多样性均较低。RAPD方法获得的总基因多样性(Ht)值、种群内基因多样(Hs)、基因分化系数(Gst)、基因流(Nm)分别为:(0.115 0±0.007 2)、(0.096 2± 0.004 4)、(0.163 7、2.554 4),即16.37%的遗传变异发生在各个种群之间,83.63%的遗传变异发生在种群内部。说明种群间的遗传分化程度较低,发现与SSR方法中所得结论基本一致。表4
2.3 SSR、RAPD分子标记方法对不同地理种群马铃薯甲虫的聚类分析
RAPD分子标记分析得出马铃薯甲虫 15个地理种群间的遗传距离,马铃薯甲虫15个种群的遗传相似度范围为 0.882 3~0.987 4,遗传距离指数范围为0.012 7~0.125 2,阿勒泰种群与察布查尔种群间遗传距离最近,为 0.012 7,其次是察布查尔种群和额敏种群,为 0.015 2,遗传距离最大的为博乐种群与霍城种群,为0.125 2。RAPD的遗传多样性分析表明,位于北疆发生区的乌鲁木齐等县市的种群均与塔城方向的额敏,博州温泉县等县市地区遗传距离最近。表5,图2
SSR分子标记方法通过运用 POPGEN 32软件分析马铃薯甲虫20个地理种群间的遗传距离,马铃薯甲虫 20个种群的遗传相似度范围为0.451 6~0.887 3,遗传距离指数范围为0.119 6~0.779 3,其中塔城种群与额敏种群间遗传距离最近,为 0.119 6,遗传距离最大的为察布查尔种群与木垒种群,为0.779 3。通过对上述遗传距离的分析,构建了SSR不同地理种群聚类分析图谱。图中东北地区与西北地区分为两支,中国新疆奇台、木垒、玛纳斯、呼图壁、阜康、乌鲁木齐县种群聚为一支,哈萨克斯坦与中国新疆额敏、博州的分支最近。表6,图3

表3 运用 SSR分子标记分析马铃薯甲虫不同地理种群遗传多样性Table 3 Genetic diversity of Leptinotarsa decemlineata popμlations

表4 运用RAPD分子标记分析马铃薯甲虫不同地理种群遗传多样性Table 4 Genetic diversity of Leptinotarsa decemlineata popμlations

图2 RAPD分子标记对15个马铃薯甲虫地理种群 UPGMA聚类图Fig.2 Thedendrogram Based Nei's(1978)Genetic distance for Leptinotarsa decemlineata using RAPD

图3 SSR分子标记对20个马铃薯甲虫地理种群聚类图Fig.3 The dendrogram Based Nei's(1978)Genetic distance for Leptinotarsa decemlineata using SSR

表5 RAPD分子标记15个种群间的遗传距离指数(下三角)与遗传相似度(上三角)Table 5 Genetic distance(above diagonal)and Nei's genetic identity(below diagonal)

表6 SSR分子标记20个种群间的遗传距离指数(下三角)与遗传相似度(上三角)Table 6 Nei's genetic identity (above diagonal) and genetic distanee (below diagonal)
3 讨 论
3.1 就分子标记技术本身而言,由于多态性产生的机制不同,SSR多态性产生的机率大于RAPD,使SSR分子标记具有高度多态性和高信息量的特点[9-10]。RAPD分子标记尽管较易受到各种因素的影响,其重复性较差,有一定的局限性[11],但技术方法简单、灵敏度高,也被广泛运用[12-13]。研究中对 SSR及RAPD方法进行了比较,最终发现SSR分子标记较为稳定,得到的多态性条带较多、信息量较大、研究结果较为可靠。
3.2 马铃薯甲虫是马铃薯毁灭性检疫害虫,其飞行能力强,在新疆北疆地区大范围分布,主要通过幼虫和成虫取食寄主茎叶对马铃薯等茄科植物造成严重为害[14-15]。1993年 5~7月马铃薯甲虫由境外入侵中国新疆伊犁河谷地区与塔城地区[2],伊犁河谷地区三面环山,其东部受到天山南支(平均海拔3 000 m)和北支(平均海拔2 500 m)的共同阻隔,使得 20多年来马铃薯甲虫在该区域无法继续向东扩散;而塔城以东地区地势平坦,马铃薯甲虫可以沿天山北坡无高山阻隔的绿洲和荒漠进行传播,因此,这种特殊的地理和气候条件使其更加容易从塔城地区沿天山北坡逐步向东传播扩散。
4 结 论
4.1 研究比较了SSR、RAPD两种分子标记方法,发现SSR分析标记具有多态性丰富、稳定性好、重复性好的特点,是较为高效且更适于马铃薯甲虫遗传多样性研究的分子标记法。
4.2 通过 UPGMA聚类分析可知,黑龙江省东宁市种群(来源于俄罗斯远东地区伏拉迪斯沃托克)与哈萨克斯坦及中国新疆发生区各地理种群明显分为两支,而哈萨克斯坦种群与中国新疆塔城地区种群聚为一支且与中国额敏、博州种群分支最近,乌昌地区与塔城地区种群聚类,结合实际入侵路径的寄主生境和传播过程中的高山屏障作用,推断马铃薯甲虫从哈萨克斯坦的塔尔巴哈台地区入侵中国新疆塔城市后,沿天山北坡逐步向东进一步扩散。
(
)
[1]郭文超,吐尔逊,许建军,等,马铃薯甲虫识别及其在新疆的分布、传播和危害[J].新疆农业科学,2010,47(5):906-909. GUO Wen-chao,Tuerxun,XU Jian-jun,et al.(2010).Research on the Identification of Colorado Potato Beetle&Its Distribution Dispersal and Damage in Xinjiang[J].Xinjiang Agricultural Sciences,47(5):906-909.(in Chinese)
[2]郭文超.重大外来入侵害虫马铃薯甲虫生物学、生态学与综合防控[M].北京:科学出版社,2013. GUO Wen-chao.(2013).The biology,ecology and intergrated control of Colorado potato beetle Leptinotarsa decemlineata[M].Beijing:Science Press.(in Chinese)
[3]Zhang,J.J.,Yang,J.,Li,Y.C.,Liu,N.,&Zhang,R. Z.(2013).Genetic relationships of introduced colorado potato beetle leptinotarsa decemlineata,populations in Xinjiang,China. Insect Science,20(5):643-654.
[4]高伟,刘方,黎绍惠,等.利用SSR分析四倍体棉种多态性[J].作物学报,2010,36(11):1 902-1 909. GAO Wei,LIU Fang,LI Shao-hui,et al.(2010).Genetic Diversity of Allotetraploid Cotton Based on SSR Markers[J].Acta Agronomica,36(11):1,902-1,909.(in Chinese)
[5]刘志敏,金能,吕超,等.大麦种质资源的SSR遗传多样性分析[J].麦类作物学报,2011,31(5):839-846. LIU Zhi-min,JIN Neng,Lü Chao,et al.(2011).Genetic Diversity Analysis of Barley Varieties by SSR[J]Journal of Tritica Crops,31(5):839-846.(in Chinese)
[6]张迎春,郑哲民.6种瓢虫的RAPD分析及在分类上应用的研究[J].西北大学学报(自然科学版),2002,32(4):409-412. ZHANG Ying-chun,HENG Zhe-min.(2002).RAPD analysis and its application to taxonomy of six species of lady beetles[J].Journal of Northwest University(Natural Science Edition),32(4):409-412.(in Chinese)
[7]杨子祥,陈晓鸣,冯颖,等.倍蚜种间亲缘关系及角倍蚜种群分化的RAPD分析[J].林业科学,2007,43(7):44-50. YANG Zi-xiang,CHEN Xiao-ming,FEN Ying,et al.(2007).RAPD Analysis of Phylogenetic Relationships in Chinese Gallnut Aphids(Homoptera:Pemphigidae)and Genetic Differentiation in Four Populations of Schlechtendalia chinensis[J]. Scientia Silvae Sinicae,43(7):44-50.(in Chinese)
[8]Sidorenko,A.P.,&Berezovskaya,O.P.(2001).Individual polymorphism for rapd markers in spring generation of colorado potato beetle leptinotarsa decemlineata(say).Russian Journal of Genetics,37(10):1,130-1,133.
[9]Powell,W.,Morgante,M.,Andre,C.,Hanafey,M.,Vogel,J.,&Tingey,S.,et al.(1996).The comparison of rflp,rapd,aflp and ssr(microsatellite)markers for germplasm analysis.Molecular Breeding,2(3):225-238.
[10]Dan,M.,Meyer,R.,Bradshaw,J.E.,Baird,E.,Bonar,N.,&Provan,J.,et al.(1997).Comparison of pcr-basedmarker systems for analysis of genetic relationships in cultivated potato.Molecular Breeding,3(2):127-136.
[11]姜自锋,林乃铨,徐梅.RAPD技术及其应用中的一些问题[J].福建农林大学学报(自然科学版),2002,31(3):356-360. JIANG Zi-feng,Lin Nai-quan,XU Mei.(2002).A revivw on some technical problems in RAPD application[J].Journal of Fujian Agricultural University,31(3):356-360.(in Chinese)
[12]李惠英,娄燕宏,胡涛,等.中国高羊茅种质资源遗传多样性的 RAPD分析[J].草业学报,2010,19(6):208-214. LI Hui-ying,LOU Yan-hong,HU Tao,et al.(2010).Genetic diversity analysis of Chinese natural tall fescue(Festuca arundinacea)germplasms by RAPD[J].Practaculture Science,19(6):208-214.(in Chinese)
[13]李晓颖,宋长年,张彦苹,等.果梅RAPD标记不同电泳指纹比较及扩增产物序列分析[J].南京林业大学学报(自然科学版),2010,34(5):29-33. LI Xiao-ying,CONG Chang-nian,ZHANG Yan-ping et al.(2010).Comparison of RAPD fingerprints of fruiting mei generated by different electrophoresis and characterization of the amplified sequences[J].Journal of Nanjing Forestry University,34(5):29-33.(in Chinese)
[14]吐尔逊·阿合买提,许建军,郭文超,等.马铃薯甲虫主要生物学特性及发生规律研究[J].新疆农业科学,2010,47(6):1 147-1 151. Tuerxun,XU Jian-jun,GUO Wen-Chao et al.(2010). Study on Major Biological Characteristics and Occurrence Regulation of Colorado Potato Beetle[J].Xinjiang Agricultural Sciences,47(6):1,147-1,151.(in Chinese)
[15]郭利娜,郭文超,吐尔逊,等.温度与取食对越冬后马铃薯甲虫飞行能力的影响[J].植物保护,2011,37(5):56-61. GUO Li-nang,GUO Wen-chao,Tuerxun,et al.(2011). Effects of temperature and feeding status on flight capacity of overwintering colorado potato beetles[J].Plant Protection,37(5):56-61.(in Chinese)
Analysis on Genetic Diversity of Different Geographical Population of the Leptinotarsa decemlineata Using RAPD and SSR Markers
LIU Yang1,FU Kai-yun2,Tuerxun Ahemaiti2,HE Jiang2,GUO Wen-chao2,ZHOU Jun3
(1.College of Agronomy,Shihezhi University,Shihezi Xinjiang 832003,China;2.Research Institute of Plant Protection,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China;3.Institute of Quality Standards&Testing Technology for Agro-Products,Xinjiang Academy of Agricultural Sciences,Urumqi 830091)
【Objective】This experiment carries out the genetic diversity analysis and validates the introduction pathway of Leptinotarsa decemlineata collected from CPB's distribution area in China and Kazakhstan area adjacent to Ili river valley.【Method】Utilizing SSR and RAPD to analyze genetic diversity of different geographical populations of Leptinotarsa decemlineata in Xinjiang.【Result】Using 8 SSR primers,average Shannon's Information Index and mean gene diversity were(1.422,6±0.396,7)and(0.543,8±0.083,5),respectively.Nei's genetic differentiation index is 0.206,8,indicating 20.68%and 79,32%genetic variation originate from within and between the populations.By using RAPD,28 bands were amplified of which 14 were polymorphic,the percentage of polymorphic bands was 50%,average Shannon's Information Index and mean gene diversity were(0.215,9±0.129,2)and(0.113,8±0.084,2),Nei'sgenetic differentiation index was 0.163,7,indicating 16.37%and 83.67%of the genetic variation derived from between and within the populations,SSR's Nei's genetic identity and UPMGA analysis showed Wuchang prefecture clusters with Tarbagatay prefecture.RAPD dendrogram analysis was essentially consistent with SSR,but there was little deviation between dendrogram result and geographical location.【Conclusion】SSR method is comparatively more effective and repeatable than RAPD method in this study.The genetic diversity of CPB population is relative low in testing samples.Both RAPD and SSR's dendrogram results validate the propagation path of the Colorado potato beetle in Xinjiang,I.e.the Colorado potato beetle invaded Tacheng,China from Tarbaghatai,Kazakhstan,then further their invasion route to the east region along the north slope of Tianshan mountains.
Leptinotarsa decemlineata;SSR;RAPD;genetic diversity
S435.32
A
1001-4330(2016)09-1608-10
10.6048/j.issn.1001-4330.2016.09.006
2016-03-24
国家重点研发计划“生物安全关键技术研发”重点专项“主要入侵生物的动态分布与资源库建设”(2016YFC1202100)
刘旸(1991-),女,新疆伊犁人,硕士研究生,研究方向为入侵害虫综合防治技术,(E-mail)ly_xj1103@163.com
(Cotresponding author):郭文超(1966-),男,河北人,研究员,研究方向为害虫生物防治和农业外来入侵生物防控,(E-mail)gwc1966@163.com周俊(1964-),女,副研究员,研究方向为农产品质量安全,(E-mail)1017917896@qq.com
Fund project:Nationalkey research and developmentprogram " Keytechnology research and developmentofbiologicalsafety "(2016YFC1202100),and the dynamic distribution and resource database construction of the main invasive alien species

