铜试剂在有机合成中的应用研究进展
郑绍军,杨丹丹,刘 静,朱 瑞,王 瑜,高玉华*(1.江苏科技大学 a.环境与化学工程学院;b.海洋装备研究院,江苏 镇江 212003)
·综合评述·
铜试剂在有机合成中的应用研究进展
郑绍军1a,1b*,杨丹丹1a,刘 静1a,朱 瑞1a,王 瑜1a,高玉华1a*(1.江苏科技大学 a.环境与化学工程学院;b.海洋装备研究院,江苏 镇江 212003)
铜试剂催化的偶联反应是直接构建碳-碳键最有效的方法之一。本文综述了铜试剂催化的偶联反应构筑六种碳-碳键的方法;重点阐述了铜试剂催化构筑C(SP2)—C(SP2)的研究进展,含分子间偶联和分子内偶联。参考文献44篇。
铜试剂;有机合成;天然产物;碳-碳偶联;综述
1901年,Ullmann[1]首次报道了铜试剂参与的反应,加热铜粉和邻位溴代硝基苯,铜转化成溴化铜,而溴代硝基苯转化成2,2-二硝基联苯(Scheme 1)。

Scheme 1
1903年,Ullmann[2]又报道了苯胺和 2-氯苯甲酸在铜催化下生成 2-苯氨基苯甲酸(Scheme 2)。Ullmann还发现,在铜和氢氧化钾共同作用下,苯酚和溴代苯发生反应,生成了二苯醚(Scheme 2~3)。

Scheme 2
1906年,Goldbery[3]报道了在铜和碳酸钾的作用下,2-氨基苯甲酸和溴代苯反应,生成了 2-苯氨基苯甲酸(Scheme 4)。同年还报道了在铜粉的催化作用下,生成酰胺化合物的反应(Scheme 5)。
前期的研究工作为现代铜试剂的迅速发展奠定了坚实的基础,特别是 Ullmann 反应。在相同卤代芳烃相互偶联时用 Ullmann 反应可以得到令人满意的对称联苯化合物,但是当偶联反应发生在两种不同的卤代芳烃分子(Ar1X和Ar2X)之间时,会形成三种产物(Ar1—Ar1,Ar2—Ar2,Ar1—Ar2)。为解决这个问题,科研工作者采用了另一种方法,即先通过金属-卤素交换反应,也就是将一种卤代芳烃 Ar1X 转化为相应的芳基金属试剂如铜试剂 Ar1Cu,随后再使其与另一卤代芳烃分子 Ar2X 低温偶联,得到单一偶联产物 Ar1—Ar2。该方法条件温和,而且当卤代芳烃的两个邻位均有取代基时亦可偶联,克服了 Ullmann 反应的缺陷,大量的实例证实其非常适合于不对称联苯衍生物的合成。

Scheme 3

Scheme 4

Scheme 5
近 20 年,铜试剂的研究取得了很大的进展,新兴的铜催化体系,使得反应条件变的更加温和,产率明显提高[4-6]。本文依据碳-碳键的构筑类型阐述通过铜试剂构筑碳-碳键的方法及其在全合成中的应用。
1 铜试剂催化构筑C(SP3)—C(SP3)健
2004年,Falck等[7]报道了以THF为溶剂,在 CuCN 的作用下,于 50 ℃ 完成了碳-碳键的形成,最终得到了具有生物活性的 11(R),12(R),15(S)-THETA,产率高达89%(Scheme 6)。
2008年,Li等[8]描述了以Cu(OTf)2为催化剂,完成了1,3-二酮与端基烯的选择性偶联反应(Scheme 7)。发现溶剂对该反应影响很大,通过大量实验筛选,最终确定在二恶烷或液体的[bmim]PF6中反应效果最佳,产率85%。
2015年,许课题组[9]以CuI为催化剂,实现了对甲苯磺酰腙与β-酮酸酯的苄基化反应(Scheme 8)。该反应条件温和、底物适用范围广、产率高(87%),为β-酮酸酯的苄基化提供了一种新的方法。

Scheme 6

Scheme 7

Scheme 8
2 铜试剂催化构筑C(SP3)—C(SP2)键
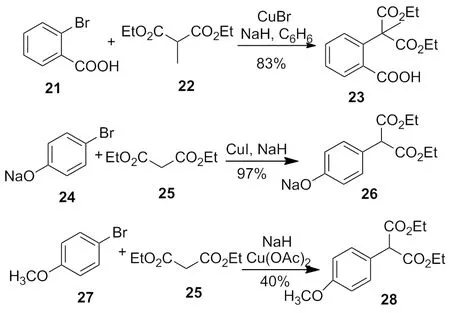
近代化学家研究表明,均相催化剂如 Cu(OAc)2、CuI或CuBr代替青铜,NaH代替甲醇钠或氢氧化钠[10-11],大大提高了反应的活性和产率,使得铜试剂在合成中得到更广泛的应用(Scheme 9)。在卤化亚铜(CuI、CuBr和CuCl)或其他更容易溶解的铜试剂(CuCl/TMEDA[6]CuBr/HMPA[7],Li2CuCl4[8],CuBr/LiBr/PhSLi)催化下,芳香环卤代烃,烯丙基卤代烃和乙烯基卤代烃形成镁的格氏试剂后[12-14],可与有机卤代烃在室温下反应,生成偶联产物(Scheme 10)。
2002年,Hennessy等[15]发现,在配体的辅助下,铜试剂催化的反应可在较低温度下和低沸点溶剂如THF中进行,产率也很高(Scheme 11)。
其余部分铜催化体系也适合此类反应,例如:CuI/DMEDA[16]体系作为分子内偶联反应的催化试剂,以85%的产率顺利得到了预期的产物(Scheme 12)。
2009年,Mino等[17]报道在5 mol%CuI和腙的共同作用下,以甲苯作为溶剂,在90 ℃下反应24 h完成了碘苯41与丙二酸二乙酯25的偶联反应(Scheme 13)。
Scheme 9

Scheme 10
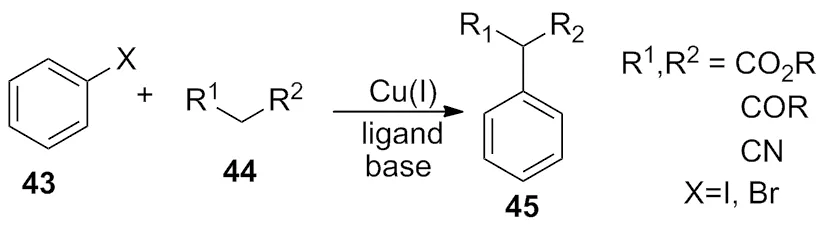
2012 年,Huang等[18)报道了以一价铜的烯醇混合物为催化体系,通过烯醇三价铜盐的中间体,最终完成了化合物43与化合物44的偶联反应(Scheme 14)。
3 铜试剂催化构筑C(SP3)—C(SP)键
2006年,Montel等[19]报道了在1,3-二甲基咪唑酮(DMI)中,10%的CuI为催化剂,很好的构建了新的C(SP3)—C(SP)键,产率达到 60%~90% (Scheme 15)。

Scheme 11

Scheme 12

Scheme 13
Scheme 14

Scheme 15
4 铜试剂催化构筑C(SP2)—C(SP2)键
4.1 铜试剂催化构筑芳基碳-碳键
联苯结构是某些天然产物的重要组成部分,也是药理活性的重要单元。按照联苯的构建方式将芳基碳-碳键偶联分为分子间偶联和分子内偶联。
(1) 分子间偶联
a.对称的分子间偶联
联苯经典的合成方法是Ullmann反应,高温条件下,缺电子的芳香卤代化合物和铜一起加热,发生分子间的偶联反应,芳香卤代物上的硝基、羧基等吸电子基团,可以加速反应的进行。
2003年,Mulrooney等[20]利用1,5二氮顺十氢化萘铜催化剂完成了一系列天然产物的全合成,如化合物51和化合物(R)Niaerone的合成(Scheme 16)。
2003年,Molander等[21]在异五味子素的全合
成中,利用Ullmann 反应,在DMF中回流反应18 h合成了关键反应中间体4,4′,5,5′,6,6′-六甲氧基-[1,1′-二苯]-2,2′-二醛(Scheme 17)。
2005年,Surry等[22]报道了在-20 ℃条件下,将芳香卤代烃和格氏试剂异丙基溴化镁溶解在THF中,通过导管将上述反应液导入至含有CuBr·SMe2的另一个反应瓶中,然后加入氧化剂57,室温反应1 h,合成碳-碳键偶联的系列化合物(Scheme 18)。
2009 年,Chen等[23]小组研究了在二价铜盐和碘的共同作用下,通过碳-氢活化,合成了一系列对称的偶联化合物,大部分官能团适用该体系(Scheme 19)。
2010年,Martinek等[24]报道了在催化量Cu(I)OCOR 的参与下,在DMF中,于50 ℃反应合成了对称的偶联产物(Scheme 20)。

Scheme 16

Scheme 17

Scheme 18

Scheme 19

Scheme 20
b.不对称的分子间偶联
2011年,Peng课题组[25]报道了利用铜试剂催化的Mizoroki-Heck偶联反应(Scheme 21)。该反应不需要配体作为辅助,但是溶剂和碱对反应影响很大,通过大量筛选发现,10 mol%Cu2O为催化剂,在DMF溶剂中,TMAB为碱是最佳的反应条件。利用分子间偶联方法构建联苯轴的主要难题是:进行交叉偶联反应时,如果缺乏区域选择性,会生成复杂的产物,而且对空间位阻要求很高。理论上,这些难题可以通过分子内偶联反应来解决。
2012年,Aves课题组[26]报道了在-40 ℃下,把芳香卤代烃和叔丁基锂溶解于THF,于-20 ℃下,通过导管将上述反应液导入到含有CuBr·SMe2的另一个反应瓶中,紧接着加入氧化剂57,于室温反应30 min,合成碳-碳偶联化合物(Scheme 22)。
(2) 分子内偶联
2000年,Piers等[27]研究CuCl 在无水DMF 中,于室温反应,成功合成了偶联化合物,产率较为理想(Scheme 23)。
2004 年,Yamada等[28]和Ikeda等[29]报道了Ullmann类型的反应,利用CuCl2与胺组成的催化体系,完成了天然产物合成中关键一步的偶联反应,并最终合成了天然产物1,9-亚壬柯里拉京(Scheme 24)。
2007年,Hosokawa[30]报道了利用CuTC催化体系,在NMP溶液中,以80%的产率完成了关键步骤的偶联反应(Scheme 25)。


EntryCatalystBaseSolventYield/%1CuIEt3NDMF192CuBrEt3NDMF213CuClEt3NDMF794Cu2OEt3NDMF855CuBr2Et3NDMF56Cu(OTf)2Et3NDMF787CuCl2Et3NDMF538Cu(OAc)2Et3NDMF359Cu2OK2CO3DMF85
Scheme 21

Scheme 22

Scheme 23

Scheme 24

Scheme 25
4.2 铜试剂催化构筑烷基C(SP2)—C(SP2)键
2001 年,Cuzzupe等[31]报道了(±)-Reveromycin B的全合成,利用CuTC与Pd2(dba)3联合催化,顺利得到偶联化合物(Scheme 26)。
5 铜试剂催化构筑C(SP2)—C(SP)键
2000年,Nandi小组[32]报道了在铜和钯试剂共同作用下,完成了碘苯41和化合物79的偶联反应(Scheme 27)。
2005年,Hoshi等[33]利用Suzuki和Sonogashira类型的反应,在温和的条件下,Cu(acac)2作为催化剂,高效高立体选择性的合成了1-arylalk-3-en-1-ynes(83),大部分官能团不受该体系的影响(Scheme 28)。

Scheme 26
2006年,Yu等[34]报道了Sonogashira类型的偶联反应,催化体系是CuI与氮氮二甲基甘氨酸混合物,高效完成了86的全合成(Scheme 29)。
2011年,Yuan等[35]报道了纳米CuO催化的Sonogashira反应(Scheme 30),高效的促使端基炔和卤代烃发生偶联反应。
2011年,Zhu小组[36]报道了在碘化亚铜的作用下,使乙烯基卤化烃与端基炔化合物发生偶联反应。该反应的显著优点是,双键的构型在反应前后保持不变,具有很大的应用价值(Scheme 31)。
2012年,Zhou[37]小组开发了一种新的合成反应体系,即在 PdCl2(PPh3)2(5%)/CuI,THF 和TEA的条件下,合成了一系列的对称偶联分子(Scheme 32)。此反应催化体系大大的提高了合成Bis(arylethynyl)benzene的产率 。
2012年,Shang小组[38]利用二价铜盐活化芳基碳-氢键,或一价铜插入到碳-碘键中间,形成三价铜中间体,与端基炔化合物反应,生成偶联化合物(Scheme 33)。
6 铜试剂催化构筑C(SP)—C(SP)键
2009年,Nador等[39]报道了在没有钯、配体、氧化剂存在条件下,利用准备好的纳米级铜为催化剂合成了对称的1,3二炔化合物(Scheme 34)。当炔为脂肪链端基炔时,以碳酸钠为碱,产率较高,并且只需要催化量的铜试剂。

Scheme 27

Scheme 28

Scheme 29

Scheme 30


Scheme 31

Scheme 32

Scheme 33

Scheme 34

Scheme 35

Scheme 36

Scheme 37

Scheme 38

Scheme 39
2010年,Wang小组[40]利用二价铜盐为催化剂,在没有溶剂的条件下,将末端炔基偶联成1,3二炔化合物(Scheme 35),该反应不仅适用于对称分子的合成,还可以合成不对称的二炔化合物,并且催化剂可以重复使用。
2011年,Zhang等[41]描述了在碘化亚铜和配体TMEDA共同作用下,空气为氧化剂,室温下发生偶联反应,生成对称的化合物(Scheme 36)。
2011年,Jia等[42]在研究端基炔对称偶联形成1,3二炔化合物的过程中,在没有配体存在的条件下,利用碘化亚铜为催化剂,NaOAc为碱,依然用空气为氧化剂,高产率的完成了偶联反应,并且没有副产物产生(Scheme 37)。
2011年,Kusuda[43]小组报道了利用氯化亚铜完成了Glaser类型的反应,以Solkane 365 mfc 为载体,得到了偶联化合物(Scheme 38)。
2015年,杨振平等[44]报道了端炔烃的二聚偶联反应是合成含有共轭碳-碳叁键化合物的一个重要方法。在CuI的催化下,以催化量的N-甲基咪唑为碱,在偶氮二甲酸二乙酯(DEAD)的协助下,各种不同的芳香族和脂肪族端炔都能顺利的发生二聚Glaser偶联反应(Scheme 39)。考察了不同铜催化剂和溶剂对该反应的影响。反应具有收率高、操作简单、条件温和等优点。
7 结论
主要依据构筑碳-碳键的类型进行分类,总结了典型的铜试剂构筑碳-碳键的方法及其在全合成中的应用,包含经典的Ullmann反应、Stille反应和本小组开发的新方法等。由于铜试剂具有价格低廉、对环境友好、后处理简单等优点,使其在天然产物合成和药物先导化合物的结构优化等方面的应用价值很高,随着有机化学的不断发展,必将有越来越多的铜试剂及其新的合成方法被开发出来,这将大大丰富有机化学的内容。
[1] Ullmann F.Ueber synthesen in der biphenylreihe.Bielecki J Ber Dtsch Chem Ges[J].1901,34:2174-2185.
[2] Ullmann F.Ueber symmetrische biphenylderivate.Over symmetrical Diphenyl derivative[J].Liebigs Ann Chem.1904,332:38-81.
[3] Goldberg I D.Ueber phenylirungen bei gegenwart von kupfer als katalysator[J].B Chem Ges.1906,39:1691-1692.
[4] Strieter E R,Blackmond D G,Buchwald S L.The role of chelating diamine ligands in the goldberg reaction:A kinetic study on the copper-catalyzed amidation of aryl iodides[J].J Amer Chem Soc,2005,127:4120-4121.
[5] Ouali A,Taillefer M,Spindler J F,etal.Precatalysts involved in copper-catalyzed arylations of nucleophiles[J].Organometallics,2006,26:65-74.
[6] Zhang S L,Liu L,Fu Y,etal.Theoretical study on copper(I)-catalyzed cross-coupling between aryl halides and amides[J].Organometallics,2007,26:4546-4554.
[7] Falck J R,Barma D,Mohapatra S,etal.Asymmetric synthesis of the stereoisomers of 11,12,15(S)-trihydroxyeicosa-5(Z),8(Z),13(E)-trienoic acid,a potent endothelium-derived vasodilator[J].Bioorg Med Chem Lett,2004,14:4987-4990.
[8] Li Y,Yu Z,Wu S.Efficient copper(II)-catalyzed addition of activated methylene compounds to alkenes[J].J Org Chem,2008,73:5647-5650.
[9] 许恺,沈冲,盛卫坚,等.铜催化β-酮酸酯的苄基化反应[J].有机化学,2015,35:633-637.
[10] McKillop A,Rao D P.Copper-catalysed condensation ofβ-Dicarbonyl compounds with 2-Bromobenzaldoximes:A simple,one-step synthesis of 3-hydroxyisoquinolineN-Oxides[J].Synthesis,1977:760,761-765.
[11] McKillop A,Rao D P.Copper-catalysed direct arylation ofα-substitutedβ-dicarbonyl compounds with 2-bromobenzoic acid[J].Synthesis,1977:759,760-763.
[12] Vyvyan J R,Holst C L,Johnson A J,etal.Total synthesis of gibbilimbols A-D[J].J Org Chem,2002,67:2263-2265.
[13] Shimizu R,Yoneda E,Fuchikami T.Copper catalyzed grignard cross-coupling reaction withβ-perfluoroalkyl-substituted alkyl halides[J].Tetrahedron Lett,1996,37:5557-5560.
[14] Johnson D K,Ciavarri J P,Ishmael F T,etal.A novel copper (i) mediated,symmetrical coupling procedure for alkyl,aryl,benzyl,and thiophenyl dihalides[J].Tetrahedron Lett,1995,36:8565-8568.
[15] Hennessy E J,Buchwald S L.A general and mild copper-catalyzed arylation of diethyl malonate[J].Org Lett,2002,4:269-272.
[16] Fang Y,Li C.O-Arylation versus C-arylation:Copper-catalyzed intramolecular coupling of aryl Bromides with 1,3-dicarbonyls[J].J Org Chem,2006,71:6427-6431.
[17] Mino T,Yagishita F,Shibuya M.Copper(I)-catalyzed C-C and C-O coupling reactions using hydrazone ligands[J].Synlett,2009:2457-2460.
[18] Huang Z,Hartwig J F.Copper(I) enolate complexes inα-arylation reactions:Synthesis,reactivity,and mechanism[J].Angew Chem Int Ed,2012,51:1028-1032.
[19] Montel F,Beaudegnies R,Kessabi J,etal.New method based on 1-(trimethysilyl)alk-1-yne to prepare 1,4-skipped diynes[J].Org Lett,2006,8:1905-1908.
[20] Mulrooney C A,Li X,DiVirgilio E S,etal.General approach for the synthesis of chiral perylenequinones via catalytic enantioselective oxidative biaryl coupling[J].J Amer Chem Soc,2003,125:6856-6857.
[21] Molander G A,George K M,Monovich L G.Total synthesis of (+)-isoschizandrin utilizing a samarium(II) iodide-Promoted 8-Endo Ketyl-Olefin cyclization[J].J Org Chem,2003,68:9533-9540.
[22] Surry D S,Su X,Fox D J,etal.Synthesis of medium-ring and iodinated biaryl compounds by organocuprate oxidation[J].Angew Chem Int Ed,2005,44:1870-1873.
[23] Chen X,Dobereiner G,Hao X S,etal.Cu(II)-mediated oxidative dimerization of 2-phenylpyridine derivatives[J].Tetrahedron,2009,65:3085-3089.
[24] Martinek M,Korf M,Srogl J.Ascorbate mediated copper catalyzed reductive cross-coupling of disulfides with aryl iodides[J].Chem Commun,2010,46:4387-4389.
[25] Peng Y,Chen J,Ding J,etal.Ligand-free copper-catalyzed arylation of olefins by the Mizoroki-Heck reaction[J].Synthesis,2011,2:213-216.
[26] Aves S J,O'Connell K M G,Pike K G,etal.Synthesis of highly substituted symmetrical 1,3-dienes via organocuprate oxidation[J].Synlett,2012:298,300.
[27] Piers E,Yee J G K,Gladstone P L.CuCl-mediated intramolecular oxidative coupling of aryl- and alkenyltrimethylstannane functions[J].Org Lett,2000,2:481-484.
[28] Yamada H,Nagao K,Dokei K,etal.Total synthesis of (-)-corilagin[J].J Amer Chem Soc,2008,130:7566-7567.
[29] Ikeda Y,Nagao K,Tanigakiuchi K,etal.The first construction of a 3,6-bridged ellagitannin skeleton with 1C4/B glucose core;synthesis of nonamethylcorilagin[J].Tetrahedron Lett,2004,45:487-489.
[30] Hosokawa S,Fumiyama H,Fukuda H,etal.The first total synthesis and structural determination of TMC-66[J].Tetrahedron Lett,2007,48:7305-7308.
[31] Cuzzupe A N,Hutton C A,Lilly M J,etal.Total synthesis of the epidermal growth factor inhibitor (-)-reveromycin B[J].J Org Chem,2001,66:2382-2393.
[32] Nandi B,Kundu N G.Heteroannulation through copper catalysis:A novel cyclization leading to a highly regio-and stereoselective synthesis of 2-substituted benzothiazolines[J].Org Lett,2000,2:235-238.
[33] Hoshi M,Nakayabu H,Shirakawa K.Stereoselective syntheses of (E)- and (Z)-1-arylalk-3-en-1-ynes and (E,E)-,(Z,E)-,(E,Z)-,and (Z,Z)-alka-1,5-dien-3-ynes via a one-pot multicomponent coupling reaction[J].Synthesis,2005:1991-2007.
[34] Yu S,Liu F,Ma D A.Flexible route to immunosuppressive agent FR252921.Asymmetric total synthesis of its (13R,14R,19R)-isomer[J].Tetrahedron Lett,2006,47:9155-9157.
[35] Yuan Y,Zhu H,Zhao D,etal.Ligand-free copper oxide nanoparticle-catalyzed sonogashira coupling reaction[J].Synthesis,2011:1792-1798.
[36] Zhu Y,Li T,Qu X,etal.Copper(I)-catalyzed synthesis of 1,3-enynes via coupling between vinyl halides and alkynes or domino coupling of vinyl halides[J].Org Biomol Chem,2011,9:7309-7312.
[37] Zhou Z L,Zhao L,Zhang S,etal.Facile synthesis of functionalized bis(arylethynyl)benzene derivatives via sila-Sonogashira reaction[J].Synth Commun,2012,42:1622-1631.
[38] Shang J,Wang W M,Wang W M.Synthesis,crystal structure,invitroacetohydroxyacid synthase inhibition,in vivo herbicidal activity,and 3D-QSAR of new asymmetric aryl Disulfides[J].J Agric Food Chem.2012,60:8286-8293.
[39] Nador F,Fortunato L,Moglie Y,etal.A simple one-pot procedure for the direct homocoupling of terminal alkynes promoted by copper nanoparticles[J].Synthesis,2009:4027-4031.
[40] Wang D,Li J,Li N,etal.An efficient approach to homocoupling of terminal alkynes.Solvent-free synthesis of 1,3-diynes using catalytic Cu(II) and base[J].Green Chem,2010,12:45-48.
[41] Zhang S,Liu X,Wang T.An efficient copper-catalyzed homocoupling of terminal alkynes to give symmetrical 1,4-disubstituted 1,3-diynes[J].Adv Synth Catal,2011,353:1463-1466.
[42] Jia X,Yin K,Li C,etal.Copper-catalyzed oxidative alkyne homocoupling without palladium,ligands and bases[J].Green Chem,2011,13:2175-2178.
[43] Kusuda A,Xu X H,Wang X,etal.Organic reaction in solkane 365 mfc:Homocoupling reaction of terminal alkynes[J].Green Chem,2011,13:843-846.
[44] 杨振平,王兵南,许孝良,等.CuI/DEAD促进的端炔的二聚偶联反应[J].有机化学,2015:207-211.
Research Progress on the Application of Copper Reagents in Organic Synthesis
ZHENG Shao-jun1a,1b*,YANG Dan-dan1a,LIU Jing1a, ZHU Rui1a,WANG Yu1a,GAO Yu-Hua1a*
(a.School of Environmental and Chemical Engineering;b.Marine Equipment and Technology Institute, 1.Jiangsu University of Scince and Technology,Zhenjiang 212003,China)
The copper reagent-catalyzed coupling reaction is one of the most effective way to construct the carbonk-carbon bond.Six kinds of C—C bond coupling catalyzed by copper were reviewed with 44 references.The progress of C(SP2)—C(SP2) coupling,including intermolecular C—C bond coupling and intramolecular coupling C—C bond coupling,were described in detail.
copper reagent;organic synthesis;nature product;C—C bond coupling;review
2016-08-15
国家自然科学基金资助项目(21502073);江苏省自然科学基金资助项目(BK20150465);江苏高校(高技术船舶)协同创新中心及江苏科技大学海洋装备研究院资助项目(HZ2016012)
郑绍军(1980-),男,汉族,江苏连云港人,博士,主要从事天然产物全合成研究。 E-mail:sz281cam@just.edu.cn
高玉华,副教授,Tel.0511-85605150,E-mail:gaoyuhua1964@163.com
O621.3
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.12.16208

