穗发芽抗性相关分子标记在73个小麦品种中的有效性评价
白宇皓,陈真真,谈宏斌,刁慧珊,梁邦平,李家创,刘 洋,武 军,赵继新,杨群慧,陈新宏
(1.西北农林科技大学农学院/陕西省植物遗传工程育种重点实验室,陕西杨凌 712100; 2.山西省农业科学院玉米研究所,山西忻州 034000; 3.陕西省种业集团有限责任公司,陕西杨凌 712100)
穗发芽抗性相关分子标记在73个小麦品种中的有效性评价
白宇皓1,2,陈真真1,谈宏斌3,刁慧珊1,梁邦平1,李家创1,刘 洋1,武 军1,赵继新1,杨群慧1,陈新宏1
(1.西北农林科技大学农学院/陕西省植物遗传工程育种重点实验室,陕西杨凌 712100; 2.山西省农业科学院玉米研究所,山西忻州 034000; 3.陕西省种业集团有限责任公司,陕西杨凌 712100)
为发掘小麦抗穗发芽种质资源,并对与抗穗发芽相关的分子标记的有效性进行验证,对73个国内外小麦品种进行了穗发芽抗性鉴定,同时利用4对穗发芽抗性相关分子标记(Vp-1B3、wmc104、Xbarc170、Xgwm155)对上述品种进行PCR检测。结果表明,73个品种的穗发芽抗性差异明显,发芽指数变化范围为0.29%~88.48%,其中13个品种的发芽指数小于10%。分析发芽指数与分子标记检测结果之间的相关性表明,Vp-1B3标记与穗发芽抗性相关,wmc104、Xbarc170、Xgwm155标记与穗发芽抗性相关性不显著。烟农23、兰考181、陕农33、西农585、美105、美231、PBW550、DL788-2等8个品种为具有 Vp-1Bb基因型的高抗穗发芽品种。
小麦;穗发芽;发芽指数;分子标记
小麦在收获前遇到潮湿阴雨天气而在穗上发芽称作成熟期穗发芽(pre-harvest sprouting,PHS),发生穗发芽的小麦在产量、品质、加工价值上都相应下降,同时对下年的种子品质也有较大影响[1]。在我国,受小麦穗发芽影响的区域十分广泛,长江中下游地区、西南冬麦区、东北春麦区、黄淮冬麦区等在小麦成熟期易出现连续阴雨的地区穗发芽发生较为严重。统计数据表明,受穗发芽影响的小麦种植面积占全国总小麦种植面积的83%[2]。因此,穗发芽抗性材料的发掘与抗穗发芽品种的选育是小麦抗性育种的重要课题之一。
穗发芽抗性的机理较为复杂,抗性性状受到多种因素影响,其中种子自身因素包括种子休眠水平、种子结构、穗部形态、干燥能力等[3];环境因素包括环境温度、水分、光照、土壤氮含量等[4]。种子的休眠特性是影响穗发芽抗性的主要因素[5],有一系列调控种子休眠的基因和QTL被定位到了小麦基因组染色体上。Groos等[6]用不抗穗发芽的白皮品种与抗穗发芽的红皮品种杂交后构建连锁图谱,在控制种皮颜色的R基因和 taVp1基因位点附近定位了3个与穗发芽相关的QTL,位于第三同源群长臂上。Flintham等[7]将1个与休眠相关的主效基因Phs定位于4AL上,并分析了白皮小麦和红皮小麦中近等R基因的差异与休眠水平的关系,解释了红皮小麦有较好的穗发芽抗性的原因。Chao等[8]在2A、2B、3A、4A和7B染色体上发现了与种子休眠和穗发芽抗性相关的基因,但同时认为穗发芽抗性受多基因控制且与种子休眠特性呈弱相关。Yang等[9]发现 Vp-1基因的等位变异 Vp-1B与穗发芽抗性相关,并开发出定位于3BL上的Vp-1B3标记。Vp-1B3标记对89份白皮小麦品种进行验证,抗穗发芽品种可扩增出845 bp或569 bp片段,感穗发芽品种扩增出652 bp片段。Roy等[10]通过对分别由5个重组自交系构建的抗感池进行分离群体分组分析,发现定位于6B染色体上的STS标记wmc104与穗发芽抗性显著相关。Mares等[11]在4A染色体上发现1个与种子休眠相关QTL,并证明位于其一侧的SSR标记Xbarc170与种子休眠有关。Kulwal等[12]发现1个定位于3AL染色体上与种子休眠相关的主效QTL,与SSR标记Xgwm155紧密连锁。
育种过程中应用分子标记辅助选择技术能较为高效地对目标性状进行选择,但穗发芽抗性易受环境因素影响,且在基因水平上又受多基因位点调控,因此,已开发的标记对于其他不同遗传背景的小麦的适用性和有效性还需要进一步检验,单一鉴定方法所得出的鉴定结果的可靠性也值得商榷。鉴于此,本研究采用籽粒鉴定法对73个小麦品种的穗发芽抗性进行鉴定,并选择4对与穗发芽抗性相关的分子标记对上述品种进行检验。这4对分子标记分别定位于小麦4条染色体上,且均在一定范围内进行过有效性验证,其中Vp-1B3标记在已有报道中有效性验证得到一致的结论,其他3对标记在不同的品种中的有效性需要进一步验证。本研究进一步扩大验证范围,确定4对标记在实际应用中的适应性,以期筛选出能够广泛利用的穗发芽抗性标记。
1 材料与方法
1.1 试验材料
供试的73份小麦品种遗传背景较为广泛,8份为美国品种,14份为印度品种,51份为国内品种(表2),于2014年10月种植于西北农林科技大学杨凌小麦试验示范基地。
1.2 试验方法
1.2.1 发芽指数测定
各小麦品种蜡熟期时取穗,自然干燥7 d后脱粒。籽粒经1%次氯酸钠溶液浸泡消毒后用无菌水冲洗干净。将籽粒腹沟向下置于铺有湿润滤纸的培养皿内,25 ℃恒温培养箱内发芽。第2天起记录各品种每天发芽的籽粒数,以观察到种皮明显裂开作为发芽的标准[14],观察记录7 d。每个品种设置3次重复,取3次重复的平均值作为各品种发芽指数(germination index,GI)。
GI =(7×N1+6×N2+5×N3+…+1×N7)/(7×籽粒总数)×100%
其中,N1至N7分别代表第1天至第7天籽粒的发芽数。
1.2.2 抗穗发芽分子标记检测
采用CTAB法[15]提取73份供试材料叶片的基因组总DNA。选用Vp-1B3、wmc104和Xbarc170、Xgwm155四对穗发芽抗性分子标记(表1)进行PCR扩增。PCR反应体系为25 μL,包括10×PCR buffer 2.5 μL、上下游引物(10 μmol·L-1)各1 μL、dNTPs 2 μL、Taq酶0.25 μL、模板DNA 100 ng,ddH2O补足至25 μL。Vp-1B3标记的PCR反应程序:94 ℃ 4 min;94 ℃ 40 s,59 ℃ 1 min,72 ℃ 2 min,36个循环;72 ℃ 10 min。Xbarc170和Xgwm155标记的PCR反应程序:94 ℃ 4 min;94 ℃ 40 s,58 ℃ 1 min,72 ℃ 2 min,36个循环;72 ℃ 10 min。wmc104标记的PCR反应程序:94 ℃ 4 min;94 ℃ 40 s,61 ℃ 1 min (每个循环降低0.25 ℃),72 ℃ 2 min,36个循环;72 ℃ 10 min。Vp-1B3标记扩增产物经1%琼脂糖凝胶电泳检测,wmc104、Xbarc170和Xgwm155标记扩增产物经8%聚丙烯酰胺凝胶电泳检测[16]。
表1 本研究选用的4对穗发芽抗性标记
Table 1 Four markers associated with pre-harvest sprouting resistance in this study

标记名称Markername引物序列(5'-3')Primersequence(5'-3')染色体Chromosome标记类型Markertype抗性条带Resistantfragment参考文献ReferenceVp-1B3F:TGCTCCTTTCCCAATTGG3BLSTS845bp/569bp[9]R:ACCCTCCTGCAGCTCATTGwmc104F:TCTCCCTCATTAGAGAGTTGTCCA6BSTMSβ[10]R:ATGCAAGTTTAGAGCAACACCAXbarc170F:CGCTTGACTTTGAATGGCTGAACA4ASSRC[11]R:CGCCCACTTTTTACCTAATCCTTTTGAAXgwm155F:CAATCATTTCCCCCTCCC3ALSSRc[12]R:AATCATTGGAAATCCATATGCC
1.2.3 数据统计分析
用SPSS 23.0对试验数据进行统计及单因素ANOVA检验。
2 结果与分析
2.1 73个品种穗发芽抗性表现
73个品种按GI值可分为4类,高抗(GI<10%)、中抗(10%
2.2 4对穗发芽抗性相关分子标记的有效性
2.2.1 STS标记Vp-1B3的有效性
73个品种中有68个品种用Vp-1B3标记可扩增出569 bp或652 bp两种类型的产物,分别是抗穗发芽和感穗发芽品种的特异性产物。其中,可扩增出569 bp产物的品种有31个,平均GI值为19.34%,变异范围为1.90%~61.81%;可扩增出652 bp产物的品种有37个,平均GI值为37.54%,变异范围为0.29%~88.48%。5个品种没有扩增出这2个类型的产物。图1为部分品种扩增产物的电泳检测结果。方差分析表明,检测出这2类产物的品种之间GI值的差异达到显著水平(F=16.60,P=0.000 1)。
2.2.2 STMS标记wmc104的有效性
73个品种中有69个品种用wmc104标记可扩增出α、β、γ、δ四种类型产物中的一种,β型扩增产物是抗穗发芽品种的特异性产物,α、γ、δ三种类型产物是感穗发芽品种的特异性产物。其中,可扩增出α型产物的品种13个,平均GI值为26.93%,变异范围为0.29%~72.10%;扩增出β型产物的品种34个,平均GI值为32.33%,变异范围为3.05%~69.81%;扩增出γ型产物的品种16个,平均GI值为32.17%,变异范围为1.90%~88.48%;扩增出δ型产物的品种6个,平均GI值为19.86%,变异范围为2.38%~32.00%。4个品种没有扩增出这4个类型的产物。图2为部分品种扩增产物的电泳检测结果。方差分析表明,检测出这4类产物的品种之间GI值的差异没有达到显著水平(P=0.49)。
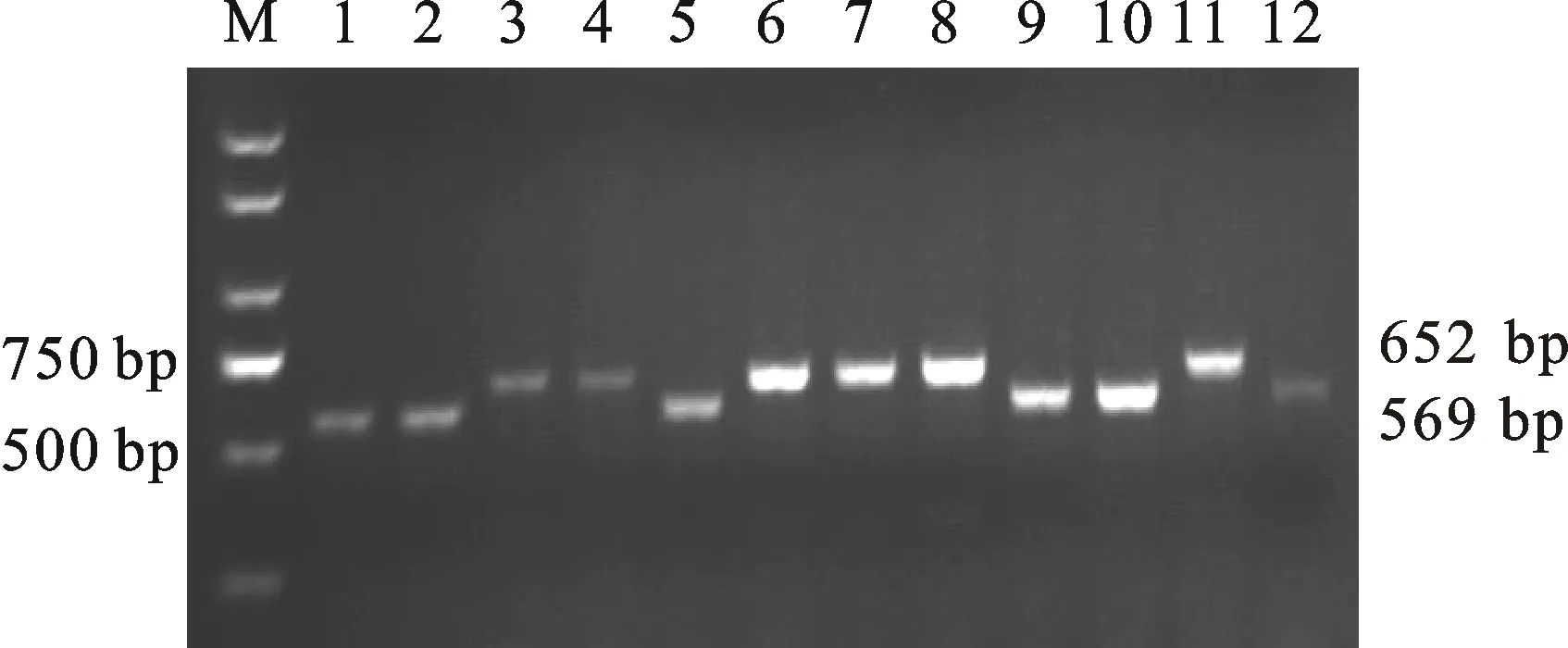
M:DL2000;1:小偃503;2:兰考7号;3:周麦18;4:西农8006;5:西农9871;6:西农3517;7:西农2000;8:美6;9:美105;10:美231;11:PBW343;12:DBW-17。
M:DL2000;1:Xiaoyan 503;2:Lankao 7;3:Zhoumai 18;4:Xinong 8006;5:Xinong 9871;6:Xinong 3517;7:Xinong 2000;8:Mei 6;9:Mei 105;10:Mei 231;11:PBW343;12:DBW-17.
图1 VP-1B3标记扩增出的两种片段类型
Fig.1 Two types of fragments amplified by Vp-1B3 marker
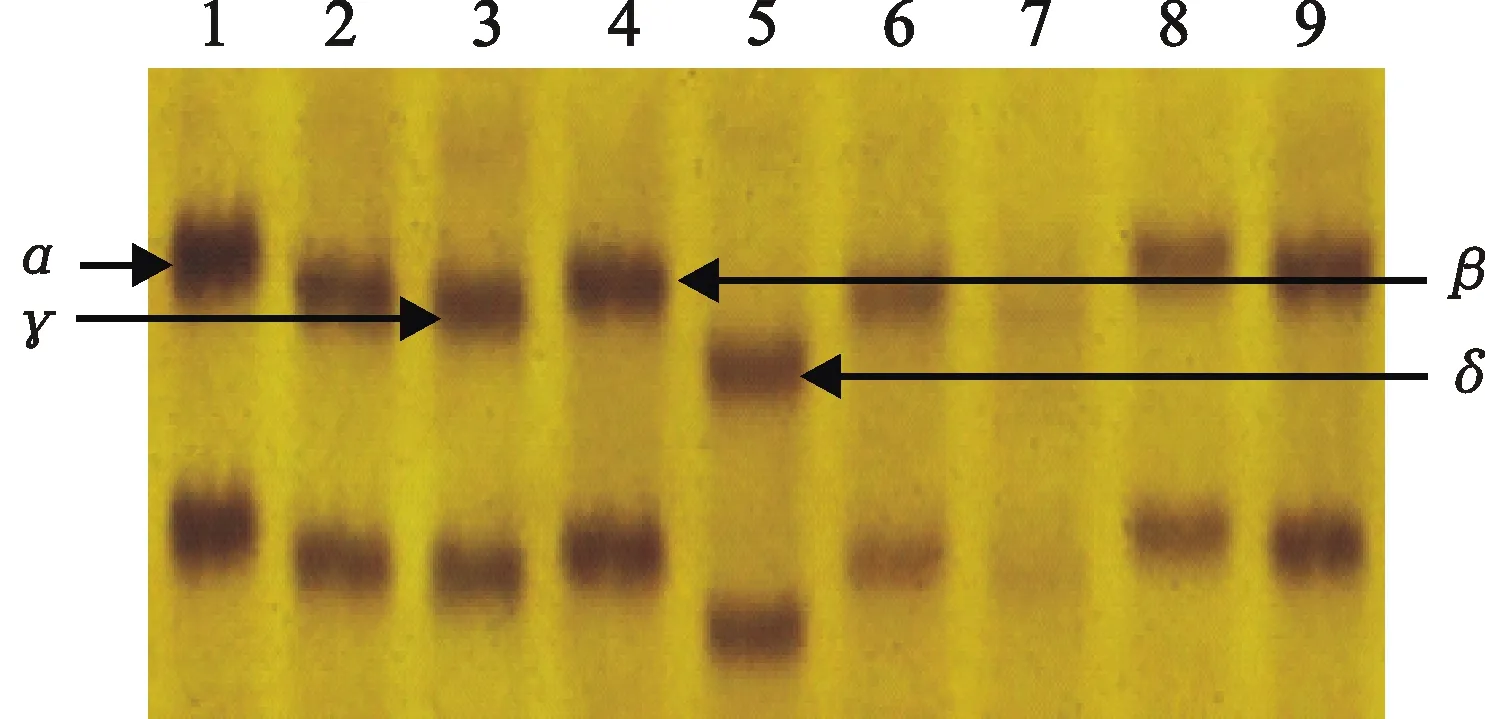
1:小偃503;2:兰考7号;3:周麦18;4:西农8006;5:西农9871;6:西农3517;7:西农2000;8:中育9037;9:郑0856。
1:Xiaoyan 503;2:Lankao 7;3:Zhoumai 18;4:Xinong 8006;5:Xinong 9871;6:Xinong 3517;7:Xinong 2000;8:Zhongyu 9037;9:Zheng 0856.
图2 分子标记wmc104扩增出的四种片段类型
Fig.2 Four types of fragments amplified by wmc104 marker
2.2.3 SSR标记Xbarc170的有效性
有63个品种用Xbarc170标记可扩增出A、B、C、D、E五种类型产物之一,C型产物是抗穗发芽品种的特异性产物,A、B、D、E型产物是感穗发芽品种的特异性产物。其中,可扩增出A型产物的品种2个,平均GI值为26.62%,变异范围为12.57%~40.67%;扩增出B型产物的品种11个,平均GI值为35.19%,变异范围为6.57%~79.71%;扩增出C型产物的品种28个,平均GI值为24.88%,变异范围为2.38%~88.48%;扩增出D型产物的品种10个,平均GI值为24.43%,变异范围为0.29%~45.81%;扩增出E型产物的品种12个,平均GI值为35.90%,变异范围为3.71%~72.10%。10个品种没有扩增出这5个类型的产物。图3为部分品种扩增产物的电泳检测结果。方差分析表明,检测出这5类产物的品种之间GI值的差异没有达到显著水平(P=0.38)。
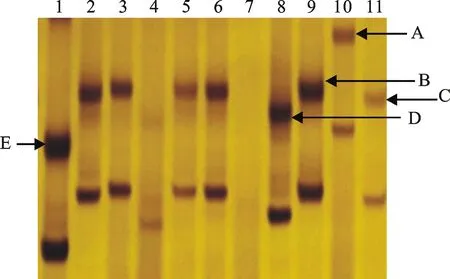
1:陕农156;2:美6;3:美32;4:美105;5:美114;6:美129;7:美142;8:美215;9:美231;10:LOK-1;11:9W-273。
1:Shannong 156;2:Mei 6;3:Mei 32;4:Mei 105;5:Mei 114;6:Mei 129;7:Mei 142;8:Mei 215;9:Mei 231;10:LOK-1;11:9W-273.
图3 Xbarc170标记扩增出的五种片段类型
Fig.3 Five types of fragments amplified by Xbarc170
2.2.4 SSR标记Xgwm155的有效性
有68个品种用Xgwm155标记可扩增出a、b、c、d四种类型的产物之一,c型产物是抗穗发芽品种的特异性产物,a、b、d型产物是感穗发芽品种的特异性产物。其中,可扩增出a型产物的品种18个,平均GI值为27.25%,变异范围为9.24%~88.48%;扩增出b型产物的品种30个,平均GI值为27.57%,变异范围为0.29%~65.24%;扩增出c型产物的品种10个,平均GI值为47.03%,变异范围为16.19%~79.71%;扩增出d型产物的品种10个,平均GI值为28.96%,变异范围为3.05%~61.81%。5个品种没有扩增出这4个类型的产物。图4为部分品种扩增产物的电泳检测结果。方差分析表明,检测出这4类产物的品种之间GI值的差异没有达到显著水平(P=0.26)。
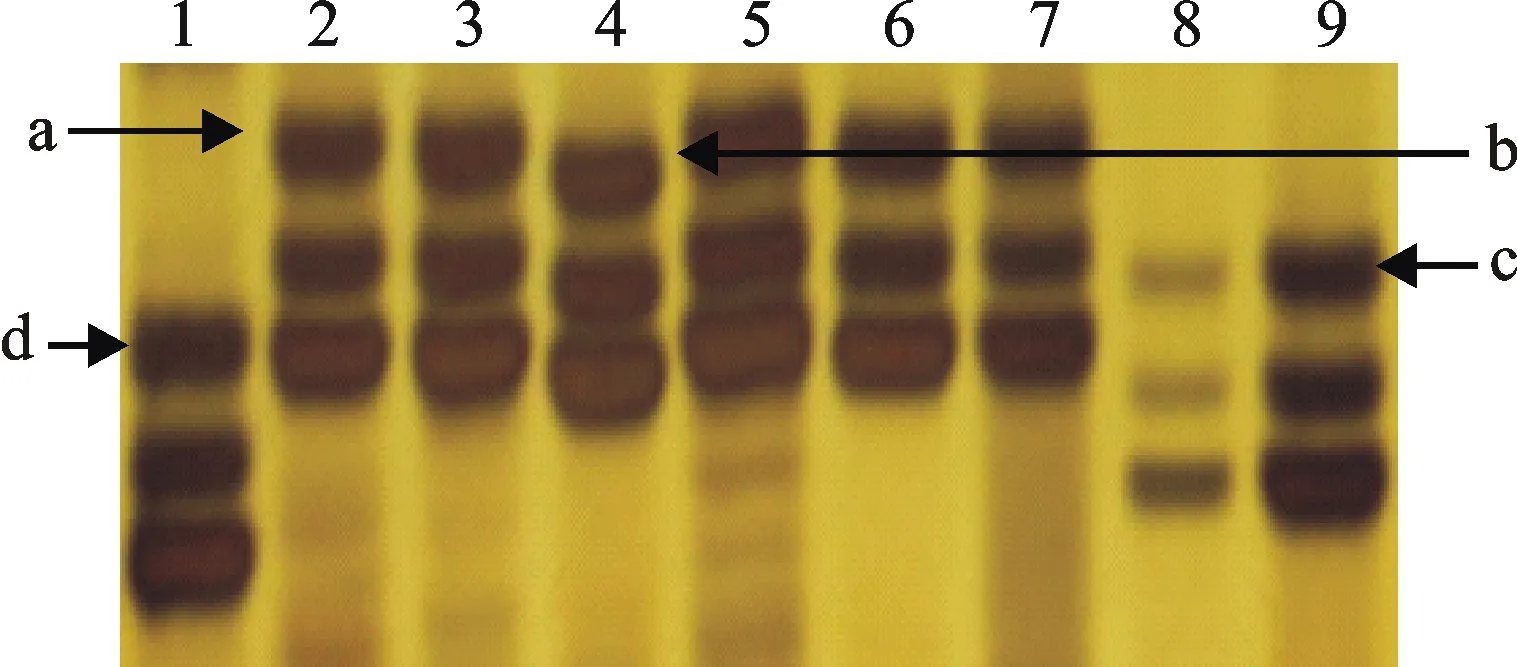
1:小偃503;2:兰考7号;3:周麦18;4:西农8006;5:西农9871;6:西农3517;7:西农2000;8:中育9037;9:郑0856。
1:Xiaoyan 503;2:Lankao 7;3:Zhoumai 18;4:Xinong 8006;5:Xinong 9871;6:Xinong 3517;7:Xinong 2000;8:Zhongyu 9037;9:Zheng 0856.
图4 Xgwm155标记扩增出的四种片段类型
Fig.4 Four types of fragments amplified by Xgwm155 marker
表2 73个品种的发芽指数和4对抗性标记检测结果
Table 2 Germination index(GI) and the results of four markers detected in 73 cultivars
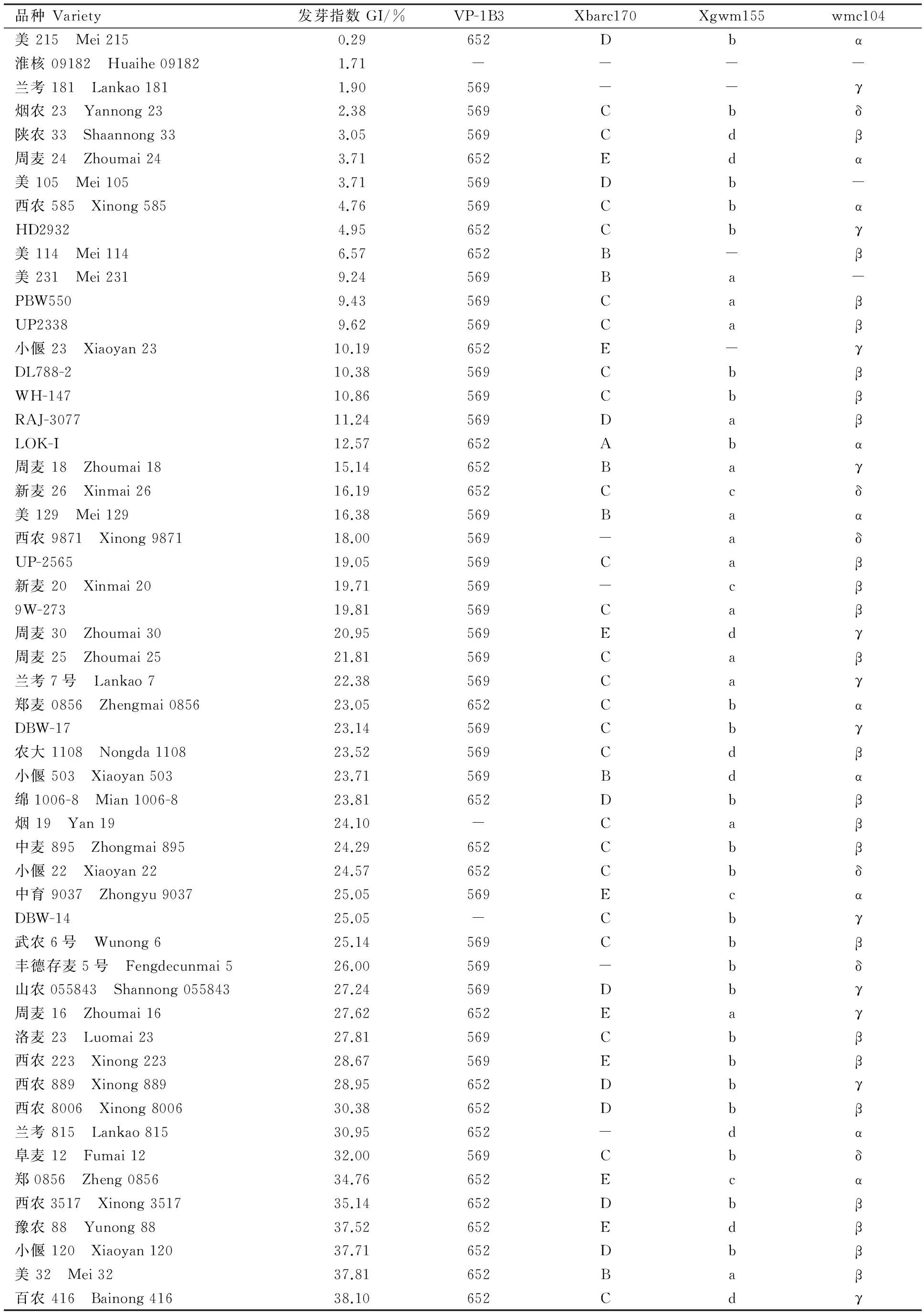
品种Variety发芽指数GI/%VP-1B3Xbarc170Xgwm155wmc104美215 Mei2150.29652Dbα淮核09182 Huaihe091821.71----兰考181 Lankao1811.90569--γ烟农23 Yannong232.38569Cbδ陕农33 Shaannong333.05569Cdβ周麦24 Zhoumai243.71652Edα美105 Mei1053.71569Db-西农585 Xinong5854.76569CbαHD29324.95652Cbγ美114 Mei1146.57652B-β美231 Mei2319.24569Ba-PBW5509.43569CaβUP23389.62569Caβ小偃23 Xiaoyan2310.19652E-γDL788-210.38569CbβWH-14710.86569CbβRAJ-307711.24569DaβLOK-I12.57652Abα周麦18 Zhoumai1815.14652Baγ新麦26 Xinmai2616.19652Ccδ美129 Mei12916.38569Baα西农9871 Xinong987118.00569-aδUP-256519.05569Caβ新麦20 Xinmai2019.71569-cβ9W-27319.81569Caβ周麦30 Zhoumai3020.95569Edγ周麦25 Zhoumai2521.81569Caβ兰考7号 Lankao722.38569Caγ郑麦0856 Zhengmai085623.05652CbαDBW-1723.14569Cbγ农大1108 Nongda110823.52569Cdβ小偃503 Xiaoyan50323.71569Bdα绵1006-8 Mian1006-823.81652Dbβ烟19 Yan1924.10-Caβ中麦895 Zhongmai89524.29652Cbβ小偃22 Xiaoyan2224.57652Cbδ中育9037 Zhongyu903725.05569EcαDBW-1425.05-Cbγ武农6号 Wunong625.14569Cbβ丰德存麦5号 Fengdecunmai526.00569-bδ山农055843 Shannong05584327.24569Dbγ周麦16 Zhoumai1627.62652Eaγ洛麦23 Luomai2327.81569Cbβ西农223 Xinong22328.67569Ebβ西农889 Xinong88928.95652Dbγ西农8006 Xinong800630.38652Dbβ兰考815 Lankao81530.95652-dα阜麦12 Fumai1232.00569Cbδ郑0856 Zheng085634.76652Ecα西农3517 Xinong351735.14652Dbβ豫农88 Yunong8837.52652Edβ小偃120 Xiaoyan12037.71652Dbβ美32 Mei3237.81652Baβ百农416 Bainong41638.10652Cdγ
(续表2 Continued table 2)
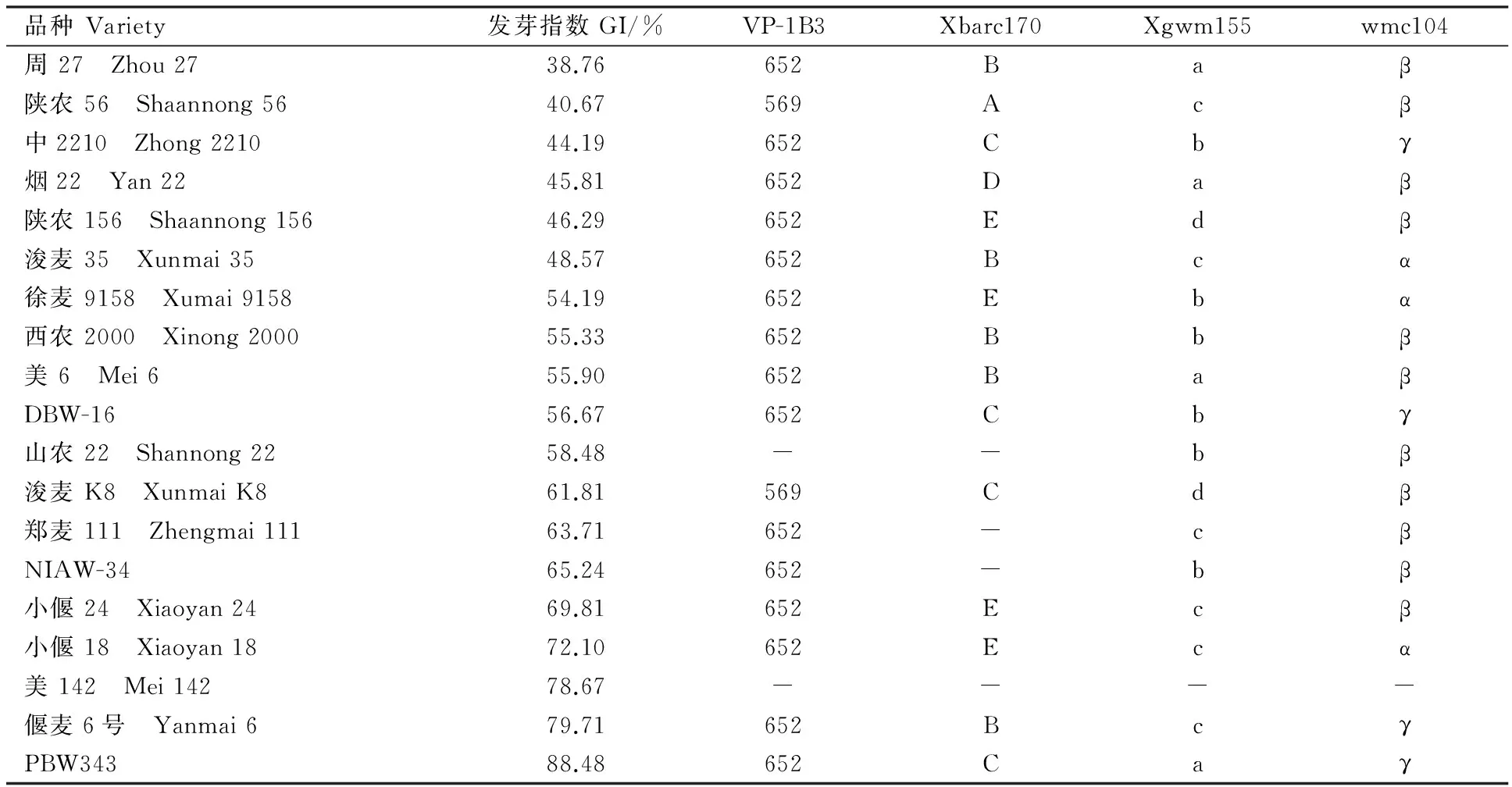
品种Variety发芽指数GI/%VP-1B3Xbarc170Xgwm155wmc104周27 Zhou2738.76652Baβ陕农56 Shaannong5640.67569Acβ中2210 Zhong221044.19652Cbγ烟22 Yan2245.81652Daβ陕农156 Shaannong15646.29652Edβ浚麦35 Xunmai3548.57652Bcα徐麦9158 Xumai915854.19652Ebα西农2000 Xinong200055.33652Bbβ美6 Mei655.90652BaβDBW-1656.67652Cbγ山农22 Shannong2258.48--bβ浚麦K8 XunmaiK861.81569Cdβ郑麦111 Zhengmai11163.71652-cβNIAW-3465.24652-bβ小偃24 Xiaoyan2469.81652Ecβ小偃18 Xiaoyan1872.10652Ecα美142 Mei14278.67----偃麦6号 Yanmai679.71652BcγPBW34388.48652Caγ
-表示没有检测到相应的扩增产物。
- indicated no specific products were detected.
3 讨 论
穗发芽的抗性是一个受多因素影响的复杂性状,与种子自身因素和环境因素均有密切关系,种子在萌发时α-淀粉酶活力、ABA含量、GA含量等也与穗发芽和种子休眠特性密切相关[17]。基因水平上受微效多基因和主基因的共同作用,抗性机理十分复杂。
目前虽然已经开发出很多与抗穗发芽或种子休眠相关的分子标记,但能应用到实际育种环节中的分子标记很少,一方面因为某些标记在筛选过程中应用了特定遗传背景的品种或品系,且大多数标记是基于某个数量性状位点开发[6-7],而穗发芽抗性受多基因控制,在其他遗传背景品种中这些标记的有效性有待进一步验证;另一方面,许多标记基于材料的非休眠特性开发[10],如种皮颜色、穗部形态等,在其他背景的材料中对种子休眠特性或穗发芽抗性做有效验证的结果并不可靠。如本研究中采用的wmc104标记,是通过感穗发芽的白皮小麦和抗穗发芽的红皮小麦品种杂交所构建的重组自交系中筛选出的,Roy等[10]认为其与穗发芽抗性有显著相关性。张兆萍等[18]对309份小麦品种进行分析后表明,wmc104标记与穗发芽抗性有相关性,可以用于穗发芽抗性筛选,但杨 燕等[19]认为其与穗发芽抗性无关。本研结究中该标记与穗发芽抗性没有显著相关性,可能由于标记开发所用材料与验证材料遗传背景差异较大,或者因为穗发芽抗性的表达是多基因间互作的结果,单一位点的分子标记检测无法解释表型变异。可通过增加不同位点的其他分子标记进行验证,即综合多位点分子标记验证对品种穗发芽抗性进行综合评价,需要做进一步研究。
Xbarc170标记经验证与穗发芽抗性无关,可能因为开发标记所用材料穗发芽抗性的表达是相应的QTL与其他基因间互作的结果,不适合对基因型差异较大的其他品种进行筛选。此外,各品种的田间生育期不完全一致,在蜡熟期取穗时所处生育期不能做到完全相同,对于种子休眠特性的影响需要做进一步的研究。
Xgwm155标记是由Kulwal等[12]发现的与1个抗穗发芽主效QTL紧密连锁的分子标记,并且在6个不同环境条件下得到有效性验证,但在本研究中其与穗发芽抗性相关性不显著,其有效性还需要进一步验证。
Yang等[9]开发的Vp-1B3标记可以检测出含有 Vp-1B基因等位变异的 Vp-1Ba、 Vp-1Bb、 Vp-1Bc三种基因型,其中 Vp-1Bb基因型对穗发芽有较高抗性。 Vp-1基因是调控种子成熟、休眠的重要基因[20]。三种基因型表现出不同的穗发芽抗性可能与Vp-1蛋白转录本的量有关。本研究的结果表明,Vp-1B3标记的有效性得到验证,并筛选出烟农23、兰考181、陕农33、西农585、美105、美231、PBW550、DL788-2等8个品种,均为具有 Vp-1Bb基因型的高抗穗发芽品种,可作为穗发芽抗性育种中的重要种质资源。
[1] 原亚萍,陈 孝,肖世和.小麦穗发芽的研究进展[J].麦类作物学报,2003,23(3):136.
YUAN Y P,CHEN X,XIAO S H.Advances in the study on wheat pre-harvest sprouting [J].JournalofTriticeaeCrops,2003,23(3):136.
[2]XIAO S H,ZHANG X Y,YAN C S,etal.Germplasm improvement for preharvest sprouting resistance in Chinese white-grained wheat:An overview of the current strategy [J].Euphytica,2002,126(1):35.
[3]KING R,RICHARDS R.Water uptake in relation to pre-harvest sprouting damage in wheat:ear characteristics [J].AustralianJournalofAgriculturalResearch,1984,35(3):327.
[4]DETJE H.Effects of varying nitrgen rates on pre-harvest sprouting and alpha-amylase activity in cereals [J].JournalofAgronomyandCropScience,1992,169:38.
[5]MARES D J,MRVA K.Mapping quantitative trait loci associated with variation in grain dormancy in Australian wheat [J].AustralianJournalofAgriculturalResearch,2001,52(12):1257.
[6]GROOS C,GAY G,PERRETANT M R,etal.Study of the relationship between pre-harvest sprouting and grain color by quantitative trait loci analysis in a white×red grain bread-wheat cross [J].TheoreticalandAppliedGenetics,2002,104(1):39.
[7]FLINTHAM J,ADLAM R,BASSOI M,etal.Mapping genes for resistance to sprouting damage in wheat [J].Euphytica,2002,126(1):39.
[8]CHAO S,XU S S,ELIAS E M,etal.Identification of chromosome locations of genes affecting preharvest sprouting and seed dormancy using chromosome substitution lines in tetraploid wheat(TriticumturgidumL.) [J].CropScience,2010,50(4):1180.
[9]YANG Y,ZHAO X L,XIA L Q,etal.Development and validation of a Viviparous-1 STS marker for pre-harvest sprouting tolerance in Chinese wheats [J].TheoreticalandAppliedGenetics,2007,115(7):971.
[10]ROY J K,PRASAD M,VARSHNEY R K,etal.Identification of a microsatellite on chromosomes 6B and a STS on 7D of bread wheat showing an association with preharvest sprouting tolerance [J].TheoreticalandAppliedGenetics,1999,99(1):336.
[11]MARES D,MRVA K,CHEONG J,etal.A QTL located on chromosome 4A associated with dormancy in white- and red-grained wheats of diverse origin [J].TheoreticalandAppliedGenetics,2005,111(7):1357.
[12]KULWAL P L,KUMAR N,GAUR A,etal.Mapping of a major QTL for pre-harvest sprouting tolerance on chromosome 3A in bread wheat [J].TheoreticalandAppliedGenetics,2005,111(6):1052.
[13] 王凤宝,董立峰,付金锋.小麦抗穗发芽酶反应生化标记选择法[J].农业生物技术学报,2007,15(3):482.
WANG F B,DONG L F,FU J F.New selecting method of polyphenol oxidase pigmentation to improve wheat breeding process for pre-harvest sprouting resistance [J].JournalofAgriculturalBiotechnology,2007,15(3):482.
[14]MARES D.Temperature dependence of germinability of wheat(TriticumaestivumL.) grain in relation to pre-harvest sprouting [J].AustralianJournalofAgriculturalResearch,1984,35(2):115.
[15]SPRINGER N M.Isolation of plant DNA for PCR and genotyping using organic extraction and CTAB [J].ColdSpringHarborProtocols,2010,doi:10.1101/pdb.prot5515.
[16] 韩永亮,常金华.聚丙烯酰胺凝胶电泳的两种染色方法对SSR标记的影响[J].杂粮作物,2006,26(3):176.
HAN Y L,CHANG J H.Comparative analysis of two kinds of methods to detect SSRs on polyacrylamide gel electrophoresis systems [J].RainFedCrops,2006,26(3):176.
[17]DERERA N F,BHATT G M,MCMASTER G J.On the problem of pre-harvest sprouting of wheat [J].Euphytica,1977,26(2):299.
[18] 张兆萍,周丽敏,宋晓朋,等.小麦穗发芽抗性鉴定及相关分子标记的有效性验证[J].麦类作物学报,2015,35(3):300.
ZHANG Z P,ZHOU L M,SONG X P,etal.Identification of PHS tolerance in wheat varieties and validation of molecular markers associated with PHS tolerance [J].JournalofTriticeaeCrops,2015,35(3):300.
[19] 杨 燕,赵献林,张 勇,等.四个小麦抗穗发芽分子抗性标记有效性的验证与评价[J].作物学报,2008,34(1):17.
YANG Y,ZHAO X L,ZHANG Y,etal.Evaluation and validation of four molecular markers associated with pre-harvest sprouting tolerance in Chinese wheats [J].ActaAgronomicaSinica,2008,34(1):17.
[20]GIRAUDAT J,HAUGE B M,VALON C,etal.Isolation of the Arabidopsis ABI3 gene by positional cloning [J].ThePlantCell,1992,4(10):1251.
[21]HIMI E,MAEKAWA M,MIURA H,etal.Development of PCR markers for Tamyb10 related to R-1,red grain color gene in wheat [J].TheoreticalandAppliedGenetics,2011,122(8):1561.
Validation of Molecular Markers Associated with Pre-harvest Sprouting Tolerance in 73 Wheat Cultivars
BAI Yuhao1,2,CHEN Zhenzhen1,TAN Hongbin3,DIAO Huishan1,LIANG Bangping1,LI Jiachuang1,LIU Yang1,WU Jun1,ZHAO Jixin1,YANG Qunhui1,CHEN Xinhong1
(1.College of Agronomy,Northwest A&F University/Shaanxi Key Laboratory of Plant Genetic Engineering Breeding,Yangling,Shaanxi 712100,China; 2.Maize Research Institute,Shanxi Academy of Agricultrue Sciences,Xinzhou,Shanxi 034000,China;3.Shaanxi Seed Industry Group Co.,Ltd.,Yangling,Shaanxi 712100,China)
In order to select germplasms with pre-harvest sprouting (PHS) tolerance in wheat and validate the effectiveness of correlated markers,73 domestic and overseas wheat varieties including eight American varieties,14 Indian varieties and 51 Chinese varieties were evaluated by seed germination index (GI) and four molecular markers (Vp-1B3,wmc104,Xbarc170,Xgwm155) associated with PHS tolerance. The correlation between the PCR amplification results and GI among 73 varieties was analyzed by one-way ANOVA test and the result showed that significant difference in seed GI was found among these varieties mentioned above,with a range between 0.29% and 88.48%. Thirteen varieties have GI lower than 10%,which can be categorized as high resistant varieties. STS marker Vp-1B3 was significantly correlated with PHS tolerance. Other three markers were not related to PHS resistant in this study. Eight wheat varieties (Yannong 23,Lankao 181,Shannong 33,Xinong 585,Mei 105,Mei 231,PBW550 and DL788-2) have GI lower than 10% and were detected as high resistant varieties with Vp-1Bb gene by using PCR amplification method. The effectiveness of STS marker Vp-1B3 was validated and can be used to select PHS resistant varieties.
Wheat;Pre-harvest sprouting;Germination index (GI);Molecular marker
时间:2016-11-04
2016-05-08
2016-10-15
国家自然科学基金项目(31571650);西北农林科技大学唐仲英育种基金项目
E-mail:byh@nwsuaf.edu.cn
陈新宏(E-mail:cxh2089@126.com)
S512.1;S330
A
1009-1041(2016)11-1449-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20161104.0924.010.html

