介孔分子筛MCM-41负载钌配合物的合成及其对醇氧化反应的催化性能
江亚芹,张宏宇,孙晓辰,张月成,赵继全
(河北工业大学 化工学院,天津 300130)
介孔分子筛MCM-41负载钌配合物的合成及其对醇氧化反应的催化性能
江亚芹,张宏宇,孙晓辰,张月成,赵继全
(河北工业大学 化工学院,天津 300130)
通过多步接枝法将钌配合物Ru Terpyridine PPh3Cl2(Ru Terpy PPh3Cl2)负载到MCM-41分子筛上,得到固载化的MCM-41/Ru Terpy PPh3Cl2催化剂.采用FT-IR、UV-Vis、XRD、ICP、N2吸附等手段对催化剂及其中间体进行了表征.将其与TBHP组成催化氧化体系,用于仲醇的选择性氧化反应.考察了该催化氧化体系的催化性能,结果表明,在80℃无溶剂条件下可高活性地催化仲醇氧化生成相应的酮.实验结果还表明该催化剂的循环使用性能较差.红外光谱分析表明其之所以失活是因为在反应过程中发生有机配体三苯基膦的脱落.
Ru Terpy PPh3Cl2;固载化;醇氧化;TBHP;MCM-41
0 引言
将醇氧化为相应的羰基化合物是化工领域最基本的、最重要的氧化反应之一,在有机合成、精细化工以及医药工业等领域中具有非常广泛的应用[1-2].世界上年产羰基化合物超过107t,其中绝大多数由醇选择性氧化得到.传统的氧化方法大多采用化学计量的过渡金属盐或氧化物如氧化铬[3],铬盐[4],氧化铜[5],高锰酸钾[6]以及高价碘化合物为氧化剂[7]等.这些氧化剂用量大,原子利用率低,在工业生产中产生大量废弃物,对环境污染相当严重,不符合“绿色化学”的要求.近年来,人们为寻求绿色、廉价、高效的醇氧化方法做了很多努力[8-9].目前,诸多以分子氧、过氧化氢和叔丁基过氧化氢为氧化剂的醇的催化氧化体系已见诸报道[9-11].研究发现,金属与有机小分子催化剂2,2,6,6-四甲基哌啶氮氧自由基(TEMPO)组合而成的催化体系可以很好地用于催化分子氧氧化醇的反应[12],但是大部分催化体系对仲醇的氧化并不适用.双氧水和叔丁基过氧化氢与过渡金属配合物组成的催化体系则可以高效、高选择性地将仲醇氧化为相应的酮[13].
在醇的催化氧化反应中,人们发现贵金属钌更易于形成有机配合物.2016年,Zhao等[14]将钌配合物催化剂Ru pymieb pydic应用于催化双氧水氧化仲醇的反应中,该催化体系在40℃无溶剂条件下就可以高效地将仲醇氧化成相应的酮.但是由于钌配合物催化剂与氧化产物难分离,使其大规模使用受到制约.
为克服上述困难,人们尝试将均相化催化剂负载到各种载体上,使其易于分离.常用的载体有碳纳米管[15-16]、硅胶SBA-15[17]、羟基磷灰石[18]、三氧化二铝[19]、不溶性有机高分子[20]、沸石[21]等.而介孔分子筛MCM-41以其比表面积大、孔道结构规则、孔径分布均一且可调以及良好的化学稳定性和热稳定性等优点在均相催化剂多相化方面潜力巨大.基于上述,本文采用接枝法将钌配合物Ru Terpy PPh3Cl2负载在MCM-41分子筛上,得到固载化的MCM-41/Ru Terpy PPh3Cl2催化剂,并考察了其对醇氧化反应的催化性能.
1 实验部分
1.1 实验仪器与试剂
主要仪器及测试内容:核磁共振波谱由德国BrukerAC-P400型核磁共振仪测定;红外光谱由德国Bruker Vector22型傅立叶变换红外光谱仪测定(KBr压片);紫外光谱由美国瓦里安公司的Cary 300型紫外-可见分光光度计(200~800 nm)测定;X-射线粉末衍射由德国布鲁克AXS公司的D8 FOCUS型多晶衍射仪测定(管电压:铜靶40 kV,40 mA,线光源,扫描角度0~10º(2));氮气吸附由美国 Micromeritics公司的ASAP2020M+C型比表面及孔隙度分析仪测定;电感耦合等离子体发射光谱由美国Thermo Fisher公司的X7Series型电感耦合等离子体质谱仪测定;反应液组成由山东鲁南瑞虹SP-6800A型气相色谱仪进行测定,其中检测器为氢火焰离子化检测器(FID)、色谱柱为极性毛细管柱(PEG-20M)、载气为高纯氮气.汽化室、检测器温度280℃,柱头压0.05MPa.v H2∶v N2∶v空气 =1∶1∶10(流速比),其中H2流速为20m L/min.采用浙大智达有限公司研发的N-2000双通道色谱工作站进行数据处理,在误差范围允许内,采用峰面积归一化法对反应各组分进行计算,以此来确定反应底物的转化率、目标产物的选择性.
主要试剂如表1所示.

表1 主要化学试剂Tab.1 Major chem ical reagents
1.2 固载化MCM-41/Ru Terpy PPh3Cl2的合成
1.2.1 固载化MCM-41/Ru Terpy PPh3Cl2的合成路线
固载化MCM-41/Ru Terpy PPh3Cl2的合成路线如图1所示.
1.2.2 合成方法
4'-(4-甲基苯基)-2,2':6',2''三联吡啶(a)的合成:向1000m L四口烧瓶中,加入19.4g(0.16mol)4-甲基苯甲醛、300m L乙醇和37.8 g(0.32mol)2-乙酰吡啶.将溶有12.2 g(0.30mol)氢氧化钠的460m L25%氨水加入上述反应液中,将反应体系加热至34℃,搅拌24 h.冷却,过滤,滤饼用冰乙醇洗涤,乙醇重结晶,于80℃下干燥8 h,得白色晶体a20.80 g,收率40%,熔点166.7~167.3℃.(文献值:164~165℃)[22].1H NMR(CDCl3,400MHz): (ppm)=2.44(s,-CH3,3H),7.32(d,J=8.0Hz,Py-H,2 H),7.31~7.38(m,Ar-H,2H),7.84(d,J=8.0 Hz,Ar-H,2H),7.89(dd,J=8.0 Hz,Py-H,2 H),8.68(d,J=8.0Hz,Py-H,2H),8.67~8.74(m,Py-H,4H).

图1 固载化MCM-41/Ru Terpy PPh3Cl2的合成路线Fig.1 Synthetic route forMCM-41/Ru Terpy PPh3Cl2complex
4'-[4-(溴甲基)苯基]-2,2’:6',2''-三联吡啶 (b)的合成:氮气保护下,向250m L四口烧瓶中,依次加入19.4 g(0.06mol)(a)、12.8 g(0.07mol)N-溴代琥珀酰亚胺、0.8 g(0.005mol)偶氮二异丁腈和280m L无水四氯化碳,加热至回流反应9h.热过滤除去琥珀酰亚胺,旋蒸除去溶剂得到黄色粉末,用乙醇/丙酮混合溶剂重结晶得浅黄色固体b14.50g,收率60%,熔点152.3~152.9℃.(文献值:152~153℃)[22].1HNMR (CDCl3,400MHz): (ppm)=4.56(s,-CH2,2H),7.37(dd,J1=J2=8.0Hz,Py-H,2H),7.54(d,J=8.0 Hz,Ar-H,2 H),7.87~7.91(m,Py-H and Ar-H,4H),8.68(d,J=8.0Hz,Py-H,2H),8.67 ~8.74(m,Py-H,4H).
表面氨基官能化的MCM-41(B)的合成:氮气保护下,向500m L四口烧瓶中,加入8.0 g MCM-41、2.6m L(0.01mol)3-氨丙基三乙氧基硅烷和300m L除水甲苯,加热至回流反应24 h,过滤,滤饼用无水乙醇抽提,90℃干燥8 h,得白色粉末B.
MCM-41-NH-Terpy(C)的合成:氮气保护下,向500m L四口烧瓶中,依次加入7.5g B和120m L除水甲苯,加热至回流.缓慢滴加溶有4.3 g(0.01mol)b的95m L甲苯溶液.滴加完毕后,回流10 h,冷却至室温.过滤,滤饼用四氢呋喃抽提,干燥得暗白色粉末C.
MCM-41/Ru Terpy Cl3(D)的合成:氮气保护下,向500m L三口烧瓶中,依次加入6.0 g MCM-41-NHTerpy、3.0g(0.01mol)三水合三氯化钌、460m L乙醇,油泵抽真空,氮气置换8次,加热至回流反应10h后冷却至室温.过滤,滤饼依次用乙醇、乙醚洗涤,并用乙醇抽提,得砖红色粉末D.
MCM-41/Ru Terpy PPh3Cl2(E)的合成:氮气保护下,向500m L三口烧瓶中,依次加入5.0 g D、200m L三氯甲烷.缓慢滴加溶有18.2 g(0.07 mol)三苯基膦的100 m L三氯甲烷,2.5小时滴毕.随后加入24 m L三乙胺,回流6 h,冷却至室温,过滤滤饼用三氯甲烷抽提、干燥,得紫罗兰色粉末E.
1.2.3 催化醇氧化反应
典型的催化氧化步骤如下:向5m L两口瓶中,加入催化剂MCM-41/Ru Terpy PPh3Cl20.02 g、底物醇2mmol,开启磁力搅拌,加热至80℃,然后缓慢滴加TBHP(3mmol),气相色谱监测反应进程.反应结束后通过柱色谱分离得产品.
2 结果与讨论
2.1 固载化MCM-41/Ru Terpy PPh3Cl2的合成与表征
2.1.1 MCM-41/Ru Terpy PPh3Cl2及各中间体的合成
首先,参照文献 [22]合成4'-[4-(溴甲基)苯基]-2,2':6',2''-三联吡啶;然后,参照文献 [23],合成表面氨基官能化的 MCM-41和三联吡啶官能化的 MCM-41.最后,参照文献 [24]合成负载到氨基官能化MCM-41上的Ru Terpy Cl3配合物和MCM-41/Ru Terpy PPh3Cl2催化剂.此催化剂用三氯甲烷充分抽提,除去吸附在其表面的有机物,ICP测试结果显示,钌的含量为0.16%.
2.1.2 FT-IR光谱
各中间体及配合物的FT-IR光谱图如图2所示.在红外谱图A中,波数1 081 cm1处并在1 200 cm1伴有肩峰的吸收峰,以及746 cm1、459 cm1处的吸收峰是MCM-41 上Si-O-Si的拉伸和变形振动吸收峰,肩峰是MCM-41的多孔所致的吸收峰[25].960 cm1处的吸收峰是Si-O-H的弯曲振动特征峰[26],随着氨丙基的修饰,其收强度减弱.3 433 cm1和1 632 cm1处的吸收峰为MCM-41表面物理吸附水的H-O-H的弯曲振动吸收峰[27].在红外谱图B中,2 973 cm1、2 928 cm1处的吸收峰为-CH2-的伸缩振动峰,说明3-氨丙基接枝到了MCM-41上.与谱图B相比,MCM-41-NH-Terpy的红外谱图C中新增的1 487 cm1、1 402 cm1吸收峰为吡啶环[28]上C-N键的伸缩振动吸收峰,说明三联吡啶接枝到了氨基官能化的 MCM-41上.由于Ru-Cl的振动吸收峰比较弱,MCM-41/Ru Terpy Cl3的红外谱图 D与 C基本一致.MCM-41/Ru Terpy PPh3Cl2的谱图 E中,1586 cm1处的吸收峰为三苯基膦配体的特征峰[29],说明氯原子被三苯基膦取代.使用过的催化剂谱图F 1 586 cm1处没有吸收,说明三苯基膦配体脱落,其为催化剂失活的主要原因.

图2 MCM-41(A),MCM-41-NH2(B),MCM-41-NH-Terpy(C),MCM-41/Ru Terpy Cl3(D),MCM-41/Ru Terpy PPh3Cl2(E)及用过的MCM-41Ru Terpy PPh3Cl2(F)的FT-IR光谱图Fig.2 FT-IR spectraofMCM-41(A),MCM-41-NH2(B),MCM-41-NH-Terpy (C),MCM-41/Ru Terpy Cl3(D),MCM-41/Ru Terpy PPh3Cl2(E)and theused MCM-41/Ru Terpy PPh3Cl2(F)
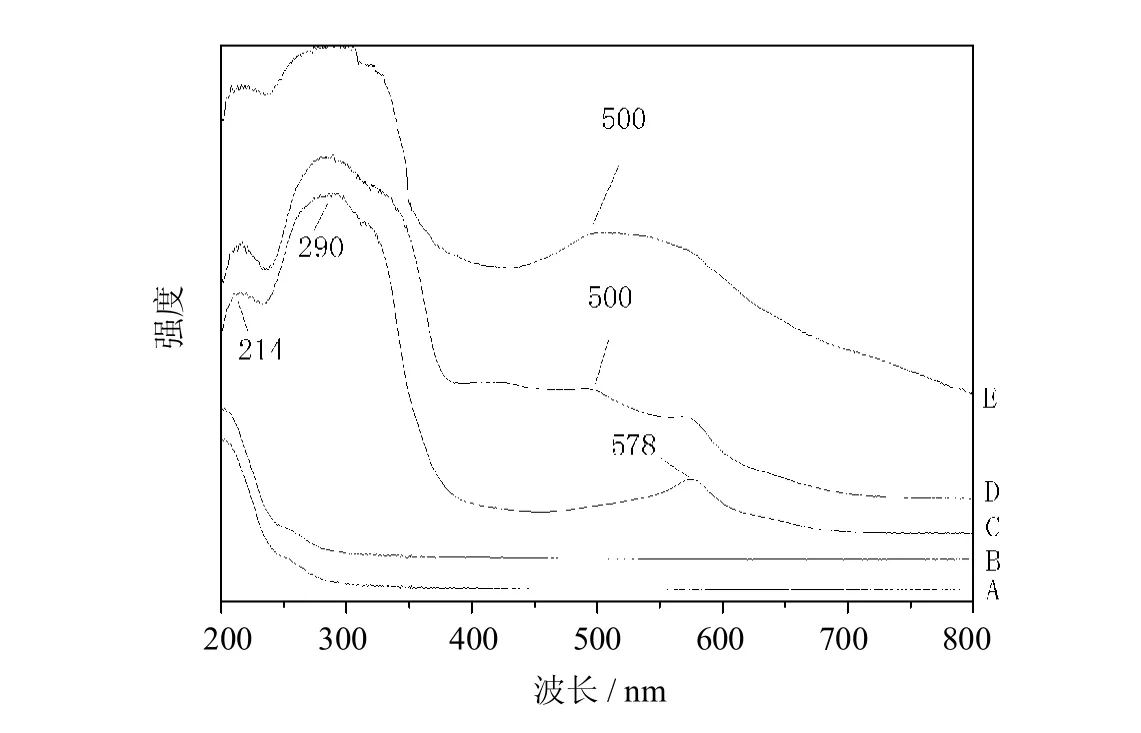
图3 MCM-41(A),MCM-41-NH2(B),MCM-41-NH-Terpy(C),MCM-41/Ru Terpy Cl3(D)和MCM-41/Ru Terpy PPh3Cl2(E)的UV-ViEs光谱图Fig.3 UV-visspectraofMCM-41(A),MCM-41-NH2(B),MCM-41-NH-Terpy (C),MCM-41/Ru Terpy Cl3(D)and MCM-41/Ru Terpy PPh3Cl2(E)
2.1.3 紫外光谱
各中间体及配合物的紫外可见光谱如图3所示.MCM-41的谱图A和MCM-41-NH2的谱图B在波长大于300nm,没有紫外吸收.MCM-41-NH-Terpy的谱图C中,214、 290 nm是苯环由跃迁所产生的K、B带吸收峰[30],578 nm是吡啶环跃迁的吸收峰.MCM-41/Ru Terpy Cl3的谱图D和MCM-41/Ru Terpy PPh3Cl2的谱图 E中,500 nm是钌与配体之间的d-d电子跃迁的吸收峰[31],说明合成了固载化的钌配合物.
2.1.4 XRD分析
各中间体及配合物的XRD谱图如图4所示,随着每一步的接枝,峰强度降低,但均保持着典型的MCM-41衍射特征.说明官能化分子筛MCM-41在接枝的过程中其孔道结构没有被破坏,仍为六方规则排列的一维孔道.
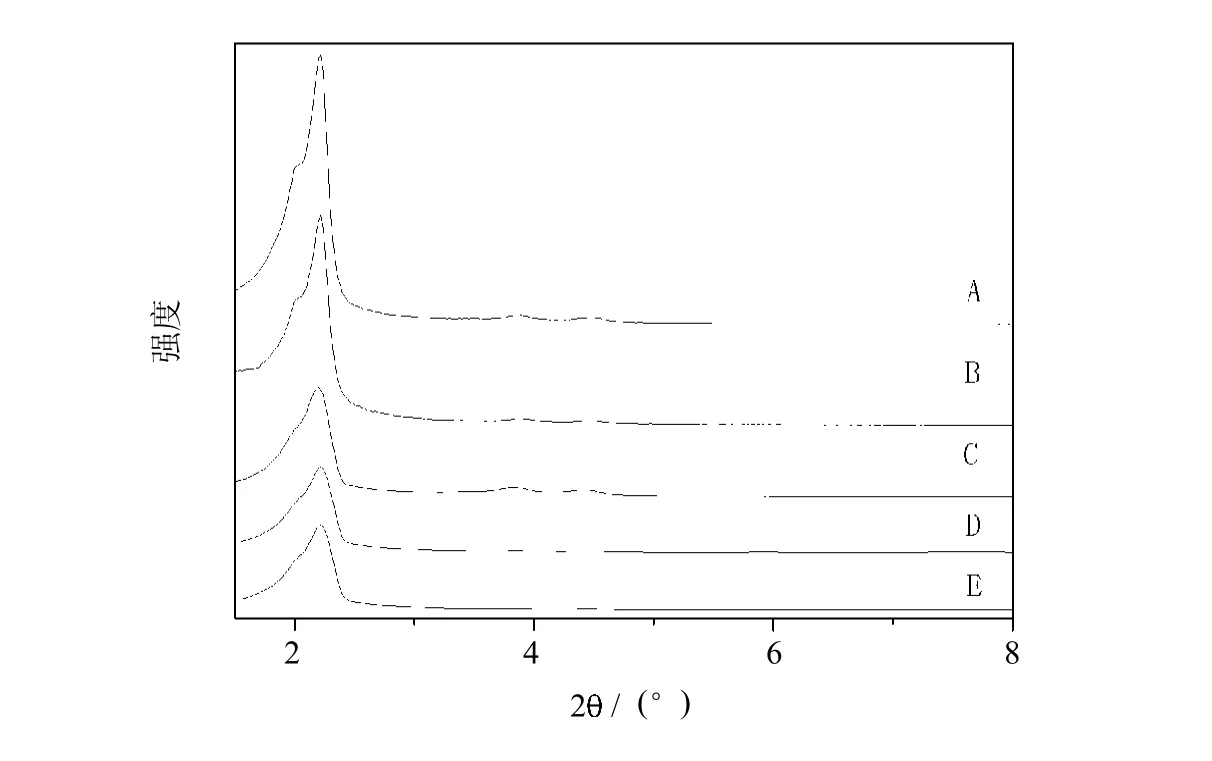
图4 MCM-41(A),MCM-41-NH2(B),MCM-41-NH-Terpy(C),MCM-41/ Ru Terpy Cl3(D)和MCM-41/Ru Terpy PPh3Cl2(E)的XRD谱图Fig.4 XRD analysisofMCM-41(A),MCM-41-NH2(B),MCM-41-NH-Terpy (C),MCM-41/Ru Terpy Cl3(D)and MCM-41/Ru Terpy PPh3Cl2(E)
2.1.5 N2吸附
图5分别给出了MCM-41,MCM-41-NH2,MCM-41-NH-Terpy,MCM-41/Ru (Terpy)Cl3和MCM-41/Ru(Terpy)(PPh3) Cl2的吸附脱附等温线,5种样品均显示IV型等温线,表明催化剂的孔结构为介孔结构(2~50 nm),且其等温线均具有H4型迟滞回线,说明孔的形状为狭窄的缝形孔.
各中间体及配合物的比表面积、孔体积、孔径列于表2.MCM-41具有较大的比表面积和孔容,随着接枝反应的进行,比表面积和孔体积均明显降低.
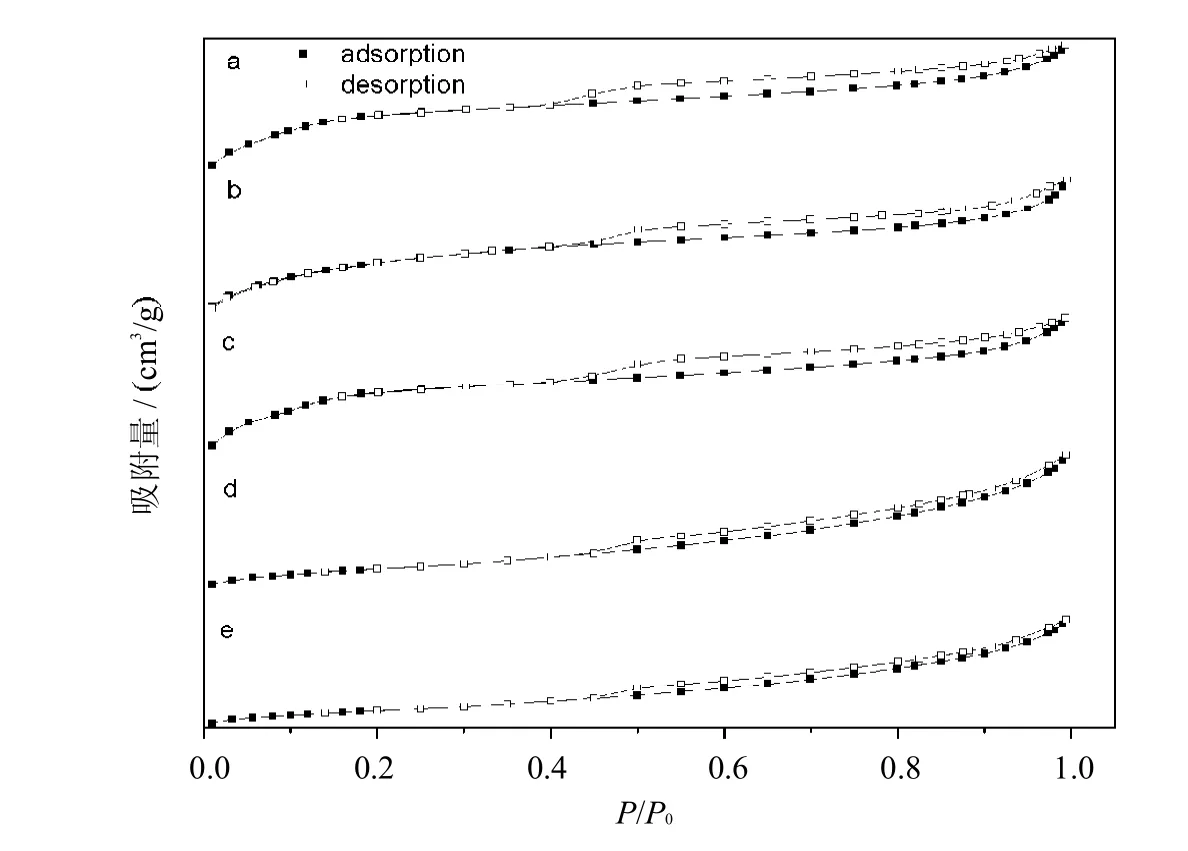
图5 催化剂样品的吸附脱附等温线MCM-41(a),MCM-41-NH2(b),MCM-41-NH-Terpy(c),MCM-41/Ru Terpy Cl3(d)和MCM-41/Ru Terpy PPh3Cl2(e)Fig.5 Adsorption-Desorption isothermsof thecatalystsamplesMCM-41(a),MCM-41-NH2(b),MCM-41-NH-Terpy(c),MCM-41/Ru Terpy Cl3(d) 和MCM-41/Ru Terpy PPh3Cl2(e)
图 6为 MCM-41,MCM-41-NH2,MCM-41-NH-Terpy,MCM-41/Ru Terpy Cl3和 MCM-41/Ru Terpy PPh3Cl25种样品的孔径分布图.MCM-41的最可几孔径为3.4 nm,随着接枝反应的进行孔径略有减小.负载金属钌后平均孔径由2.0nm增加到7.2 nm,最可几孔径增加到3.9 nm.分析原因可能是因为钌接枝到了介孔分子筛 MCM-41孔道内,小孔径孔道被接枝臂和配合物占据,而孔径大小结果是各种孔径孔道的平均值,因而导致其表观孔径增大.
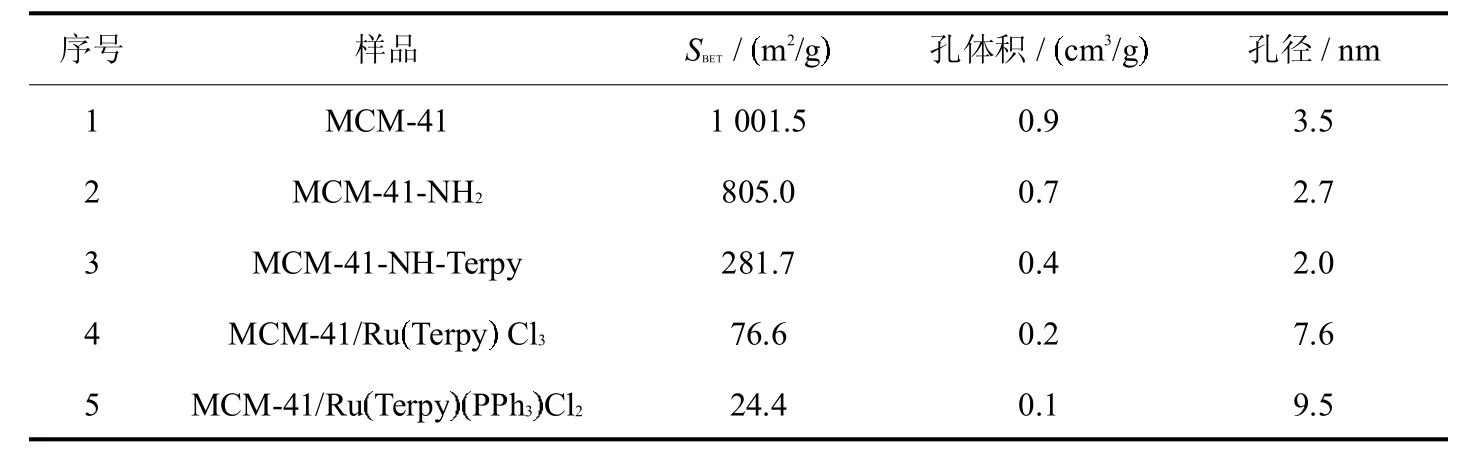
表2 MCM-41,MCM-41-NH2,MCM-41-NH-Terpy,MCM-41/Ru Terpy Cl3和MCM-41/Ru Terpy PPh3Cl2的比表面积、孔体积、孔径aTab.2 The BET surface area,pore volume and pore sizeofMCM-41,MCM-41-NH2,MCM-41-NH-Terpy,MCM-41/Ru Terpy Cl3and MCM-41/Ru Terpy PPh3Cl2a
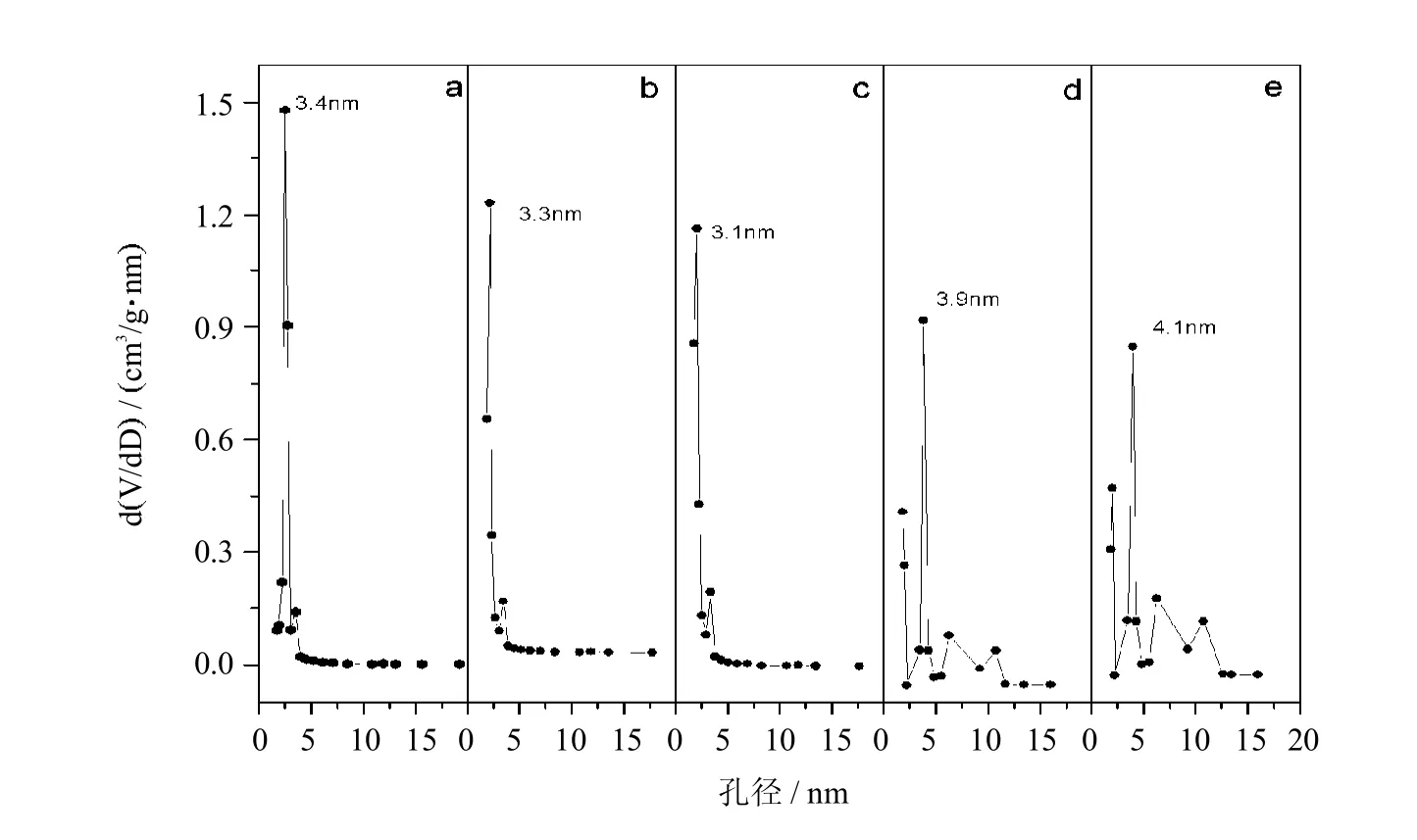
图6 催化剂样品的孔径分布MCM-41(a),MCM-41-NH2(b),MCM-41-NH-Terpy(c),MCM-41/ Ru Terpy Cl3(d)和MCM-41/Ru Terpy PPh3Cl2(e)Fig.6 Pore size distribution curvesasa function of pore diameterMCM-41(a),MCM-41-NH2(b),MCM-41-NH-Terpy(c),MCM-41/Ru Terpy Cl3(d)和MCM-41/Ru Terpy PPh3Cl2(e)
2.2 催化性能的考察
2.2.1 催化氧化体系的构建
首先以1-苯乙醇的氧化为模型反应,MCM-41/Ru Terpy PPh3Cl2为催化剂,考察了不同氧化剂对1-苯乙醇催化氧化反应的影响,结果列于表3.由表3可知,分子氧作氧化剂时,1-苯乙醇几乎不反应(表3,序号1);30%双氧水作氧化剂时,反应12 h,1-苯乙醇转化率只有10.9%(表3,序号2);70%TBHP作氧化剂时,反应6 h,1-苯乙醇的转化率大于99%(表3,序号3).因此,选用TBHP作为氧化剂.随后,又以TBHP为氧化剂,考察了不同催化剂对1-苯乙醇催化氧化反应的影响.由表3可知,MCM-41和 MCM-41-NH-Terpy作催化剂时,反应10h,1-苯乙醇转化率与不加任何催化剂相比没有促进作用(表3,序号5、7),MCM-41-NH2的加入甚至会抑制反应进行(表3,序号6).MCM-41/Ru Terpy Cl3作催化剂时,1-苯乙醇的转化率也能达到99%,但反应时间较MCM-41/Ru Terpy PPh3Cl2催化剂长(表3,序号3、8).因此,催化氧化体系中MCM-41/Ru Terpy PPh3Cl2和TBHP缺一不可.
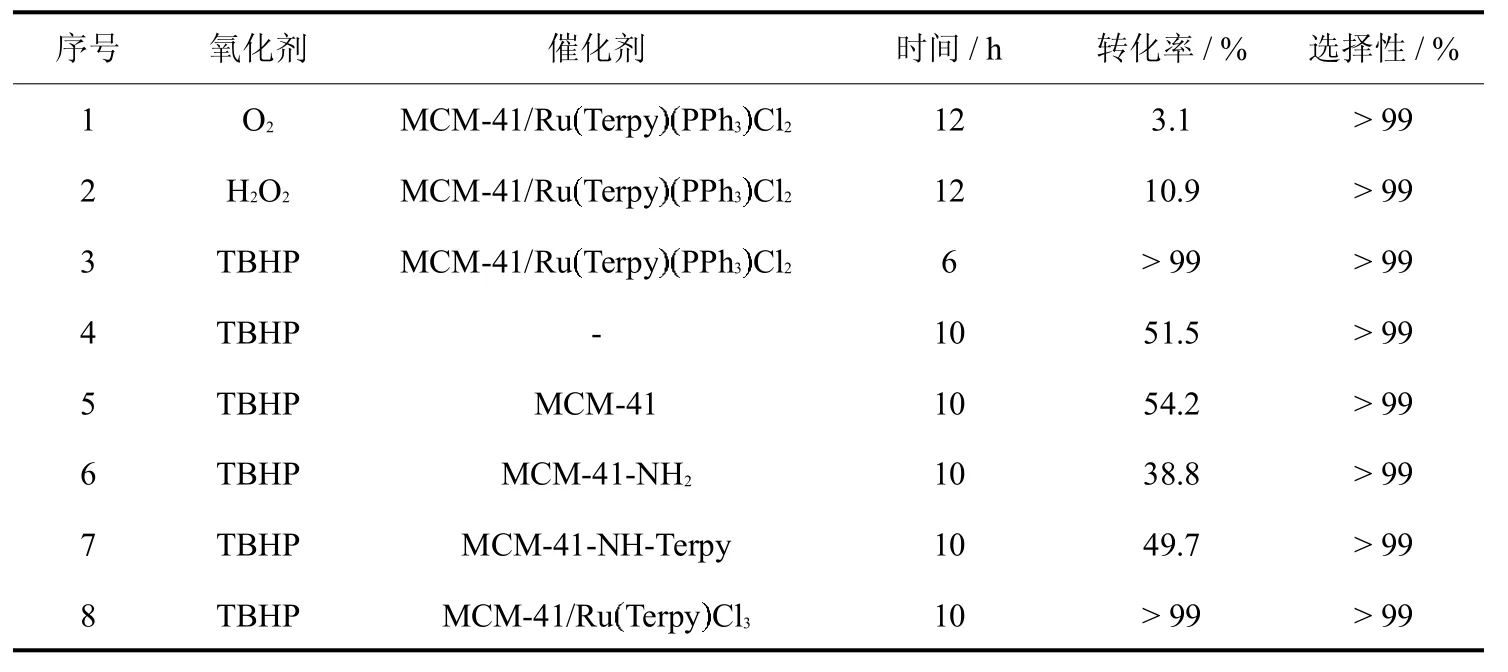
表3 氧化剂与催化剂的筛选Tab.3 Selection of oxidant and catalyst
2.2.2 反应条件的优化
考察了催化剂用量(摩尔分数)对反应的影响,结果如表4所示.当催化剂用量由0.008%增加到0.02%,1-苯乙醇完全转化所需时间由16.5 h缩短至5.5 h(表4,序号1~4),但由0.016%增加到0.02%时,时间缩短的不明显,为了节约成本,催化剂用量以0.016%为宜.
随后考察了TBHP的用量对反应的影响,结果如表4所示.当TBHP用量为1-苯乙醇的1倍量时,即使延长时间,1-苯乙醇的转化率也仅能达到87.2%(表4,序号5),分析原因可能是TBHP部分分解;当TBHP用量为1-苯乙醇的1.3和1.5倍时,1-苯乙醇转化完全所需时间分别为10 h和6.5 h,TBHP用量增加到1-苯乙醇的2倍时,转化完全所需时间没有明显缩短.(表4,序号6~8),综合考虑,TBHP的用量以1-苯乙醇的1.5倍量为宜.
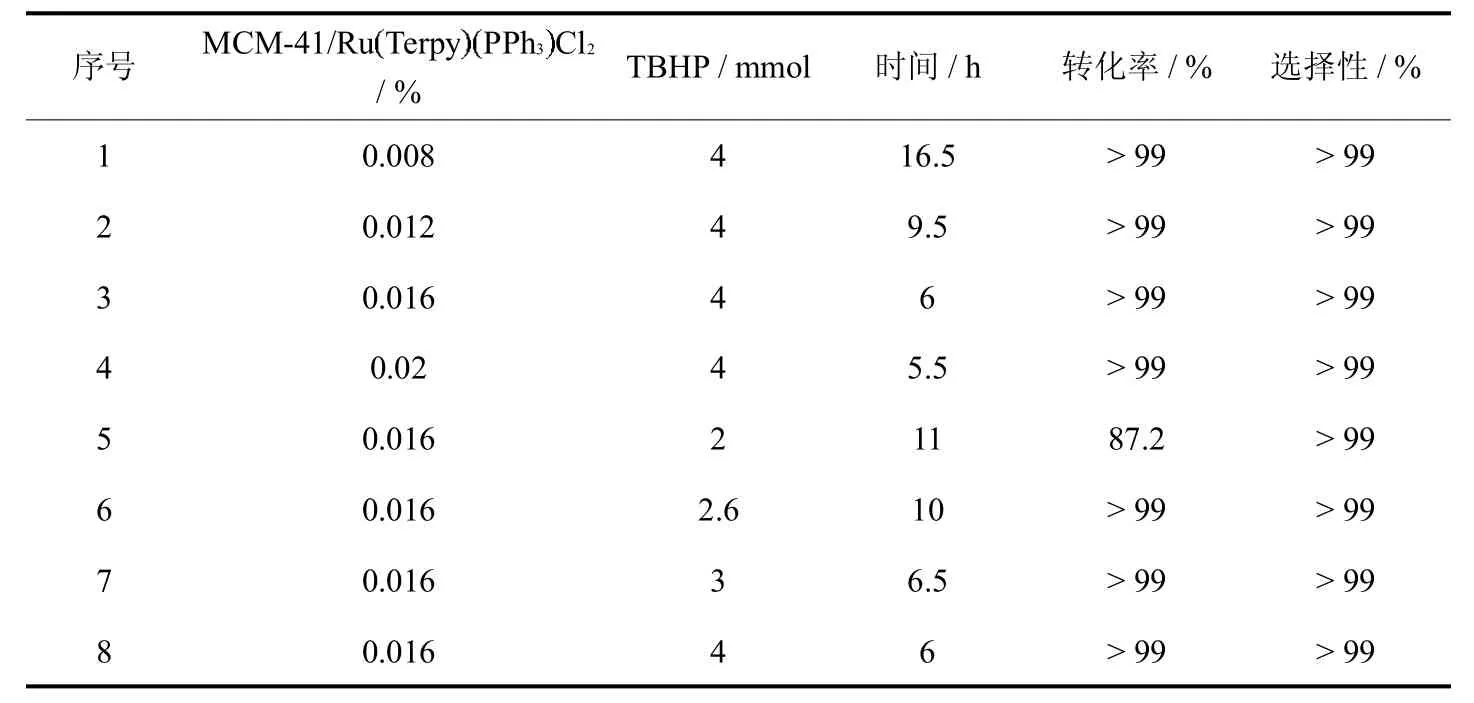
表4 催化氧化体系中各组分的量对反应的影响Tab.4 Effects of the loading amounts of the components in the catalytic oxidation system on the reaction
最后,考察了温度对反应的影响,结果如表5所示.温度由60℃增加到80℃,1-苯乙醇完全转化所需时间逐渐缩短(表5,序号1~3),当温度继续升高,反应时间不变(表5,序号4).因此,反应温度以80℃为宜.

表5 温度对1-苯乙醇氧化反应的影响Tab.5 Effect of reaction temperature on oxidation of 1-phenylethanol
2.2.3 底物适用范围的考察
在优化的反应条件下,考察了MCM-41/Ru Terpy PPh3Cl2/TBHP催化体系对各种芳香族和脂肪族仲醇的催化性能,结果如表6所示.
该催化体系对大部分芳香族仲醇的氧化有很好的催化性能.1-(4-甲基苯基)乙醇、1-(4-氯苯基)乙醇、1-(4-氟苯基)乙醇在5.5~7 h能转化完全(表6,序号2、4、5),而1-(4-甲氧基苯基)乙醇则需要14.5 h才能转化完全(表6,序号3).说明吸电子基和弱供电子基的电子效应对仲醇的氧化反应影响不明显,而强供电子基则阻碍反应的进行.除此之外,苯环上取代基的位阻效应对仲醇的反应活性也有明显影响,带有邻位取代基的底物与相应带有对位或间位取代基的底物相比仲醇的反应活性降低,如1-(4-氯苯基)乙醇、1-(3-氯苯基)乙醇在7~8 h转化完全,而1-(2-氯苯基)乙醇反应5 h只转化了48.1%(表6,序号4、6、8),延长时间不再反应.其他类型的醇,如1-苯基-1-丙醇、1-茚醇和二苯甲醇的反应活性也很高(表6,序号9~11);该催化体系对脂肪族仲醇也表现出比较好的催化活性,如2-辛醇反应7 h转化80.8%(表6,序号12).由于大的空间位阻薄荷醇的反应活性很低,反应3 h只转化了22.1%(表6,序号13),延长时间反应不再进行.
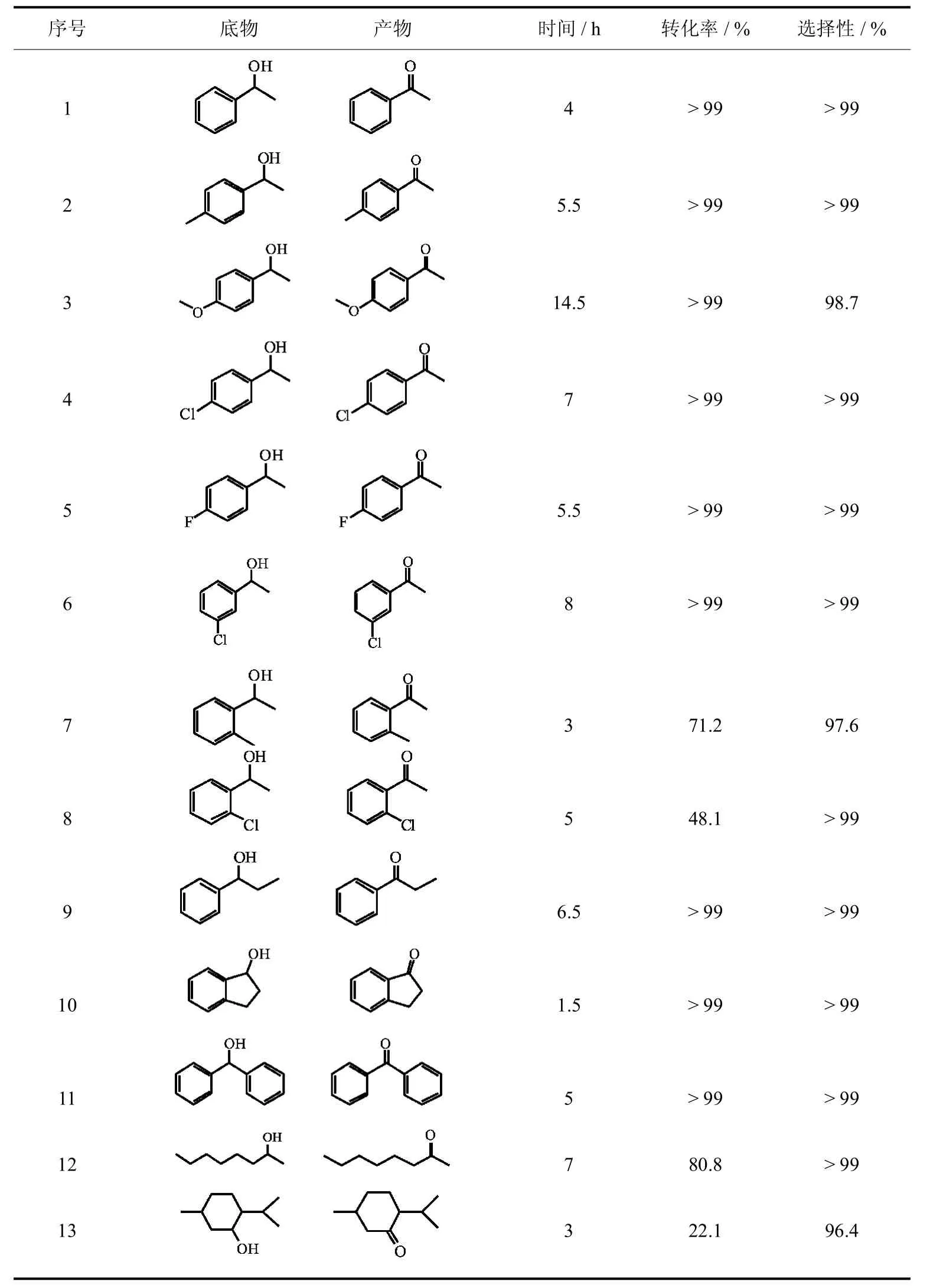
表6 MCM-41/Ru Terpy PPh3Cl2/TBHP催化不同醇的氧化Tab.6 Oxidation of various alcohols with TBHP catalyzed by MCM-41/Ru Terpy PPh3Cl2
2.2.4 催化剂循环使用性能的考察
最后,在最优条件下,考察了催化剂 MCM-41/Ru Terpy PPh3Cl2的循环使用性能.回收方法是在每一次反应完成之后将反应液过滤,滤饼用二氯甲烷洗涤,80℃干燥2 h,用于下1次反应.结果如表7所示,前3次循环,1-苯乙醇完全转化所需时间分别为4 h、10 h和12 h(表7,序号1~3),第4次循环反应10 h 1-苯乙醇的转化率达95.3%(表7,序号4),但继续延长反应时间转化率不再提高.结果表明,催化剂在循环过程中活性逐渐降低.对失活的催化剂进行红外光谱表征,发现红外光谱中无三苯基膦的特征吸收峰,因此三苯基膦脱落是催化剂失活的原因之一.

表7 MCM-41/Ru Terpy PPh3Cl2在1-苯乙醇氧化反应中的回收利用Tab.7 Recycling of MCM-41/Ru Terpy PPh3Cl2in the oxidation of 1-phenylethanol
3 结论
制备了固载化的MCM-41/Ru Terpy PPh3Cl2催化剂,并与TBHP组成催化氧化体系,用于仲醇的氧化反应.通过对1-苯乙醇的催化氧化反应,得到了MCM-41/Ru Terpy PPh3Cl2/TBHP催化氧化仲醇生成相应酮的优化反应条件,即:0.016%MCM-41/Ru Terpy PPh3Cl2、1.5倍量TBHP、反应温度80℃.在优化的反应条件下对各种不同底物仲醇进行氧化,取得了令人满意的结果.循环使用结果表明MCM-41/Ru Terpy PPh3Cl2催化剂的循环再利用性能较差.红外光谱分析表明 MCM-41/Ru Terpy PPh3Cl2催化剂失活的主要原因是在催化反应中三苯基膦的脱落.
[1]Pagliaro M,Campestrini S,Ciriminna R.Ru-based oxidation catalysis[J].Chemical Society Reviews,2005,34:837-845.
[2]Vazylyev M,Sloboda-Rozner D,Haimov A,et al.Strategies for oxidation catalyzed by polyoxometalatesat the interface of homogeneous and heterogeneous catalysis[J].Topics in Catalysis,2005,34:93-99.
[3]Ratcliffe R,Rodehorst R.Improved procedure for oxidations with the chromium trioxide-pyridine complex[J].J Org Chem,1970,35(11):4000-4002.
[4]Shahriare G,Wong W,Kheiroallah M,et al.Synthesis,characterization,X-ray structural analysis and study of oxidative properties of tetraethylammonium chlorochromate[J].J Coord Chem,2008,61(20):3225-3236.
[5]Sheikh,Muhammed Y,Eadon,et al.Vapor phase oxidation of alcohols by cupric oxide.Convenient preparation of aldehydes and ketones[J].Tetrahedron Lett,1972(4):257-60.
[6]Shaabani A,Lee D G.Solvent free permanganate oxidations[J].Tetrahedron Lett,2001,42(34):5833-5836.
[7]Dess D B,Martin JC.Readily accessible12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones[J].J Org Chem,1983,48,4155-4156.
[8]MarkóIE,Giles PR,Tsukazaki M,et al.Copper-catalyzed oxidation of alcohols to aldehydes and ketones:an efficient,aerobic alternative[J].Science,1996,274(5295):2044-2046.
[9]Hoover J M,Stahl SS.Highly practical copper(I)/TEMPO catalyst system for chemoselective aerobic oxidation of primary alcohols[J].JAm Chem Soc,2011,133:16901-16910.
[10]Kwong H-K,Lo P-K,Lau K-C,et al.Epoxidation of alkenes and oxidation of alcohols with hydrogen peroxide catalyzed by amanganese(V)nitrido complex[J].Chem Commun,2011,47:4273-4275.
[11]Ferguson G,Ajjou A N.Solvent-free oxidation of alcohols by t-butyl hydroperoxide catalyzed by water-soluble copper complex[J].Tetrahedron Letters,2003,44(51):9139-9142.
[12]Cao Q,Dornan L M,Rogan L,et al.Aerobic oxidation catalysis with stable radicals[J].Chemical Communications,2014,50(35):4524-4543.
[13]Mobley J,Crocker M.Catalytic oxidation of alcohols to carbonyl compounds over hydrotalcite and hydrotalcite-supported catalysts[J].RSC Advances,2015,5(81):65780-65797.
[14]Zhang Y,Liu L,Cao X,et al.Synthesis,single crystal structure and efficient catalysis for alcohol oxidation of a novel Ru(II)complex with both a N,N,N-tridentate ligand and a pyridinedicarboxylate[J].Polyhedron,2016,105:170-177.
[15]Hosseini M G,Zardari P.Electrocatalysis of oxygen reduction on multi-walled carbon nanotube supported Ru-based catalysts in alkaline media[J].International Journal of Hydrogen Energy,2016,41:8803-8818.
[16]Reuillard B,Le Goff A,Cosnier S.Polypyrrolic bipyridine bis(phenantrolinequinone)Ru(II)complex/carbon nanotube composites for naddependent enzyme immobilization and wiring[J].Analytical chemistry,2014,86(9):4409-4415.
[17]Karimi B,Biglari A,Clark J H,et al.Green,transition-metal-free aerobic oxidation of alcohols using a highly durable supported organocatalyst [J].Angewandte Chemie International Edition,2007,46(32):7210-7213.
[18]Opre Z,Ferri D,Krumeich F,et al.Aerobic oxidation of alcohols by organically modified ruthenium hydroxyapatite[J].Journal of Catalysis,2006,241(2):287-295.
[19]Yamaguchi K,Mizuno N.Supported ruthenium catalyst for the heterogeneous oxidation of alcohols with molecular oxygen[J].Angewandte ChemieInternational Edition,2002,41(23):4538-4542.
[20]Yu Y L,Gao B J,Li Y F.Immobilized 2,2,6,6-tetramethyl-piperidinyl-1-oxy catalyst on polymer microspheres and its catalytic oxidation of benzyl alcohol with molecular oxygen[J].Chinese Journal of Catalysis,2013,34(9):1776-1786.
[21]Zhan B-Z,White M A,Sham T-K,et al.Zeolite-confined nano-RuO2:a green,selective,and efficient catalyst for aerobic alcohol oxidation [J].Journal of the American Chemical Society,2003,125(8):2195-2199.
[22]Tang B,Yu F,LiP,et al.A near-infrared neutral pH fluorescent probe for monitoring minor pH changes:imaging in living HepG2 and HL-7702 cells[J].Journal of the American Chemical Society,2009,131(8):3016-3023.
[23]刘晓莉,张月成,高宇,等.MCM-41负载甲基三氧化铼的制备及其对环氧化反应的催化性能 [J].分子催化,2012,26(3):239-245.
[24]Sullivan B P,Calvert J M,Meyer T J.Cis-trans isomerism in(trpy)(PPh3)RuC12.Comparisons between the chemical and physical properties of a cis-trans isomeric pair[J].Inorganic Chemistry,1980,19(5):1404-1407.
[25]Caps V,Tsang S C.Heterogenisation of Os species on MCM-41 structure for epoxidation of trans-stilbene[J].Applied Catalysis A:General,2003,248(1):19-31.
[26]Rahman I,Vejayakumaran P,Sipaut C,et al.Anoptimized sol-gel synthesis of stable primary equivalent silica particles[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2007,294(1):102-110.
[27]Maurya M R,Kumar A,Pessoa J C.Vanadium complexes immobilized on solid supports and their use as catalysts for oxidation and functionalization of alkanes and alkenes[J].Coordination Chemistry Reviews,2011,255(19):2315-2344.
[28]Patel A,Singh S.Undecatungstophosphate anchored to MCM-41:An ecofriendly and efficient bifunctional solid catalyst for non-solvent liquidphase oxidation as well as esterification of benzyl alcohol[J].Microporous and Mesoporous Materials,2014,195:240-249.
[29]Karvembu R,Natarajan K.Synthesis and spectral studies of binuclear ruthenium(II)carbonyl complexes containing bis( -diketone)and their applications[J].Polyhedron,2002,21(2):219-223.
[30]Wang J-L,Wang C,Dekrafft K E,et al.Cross-linked polymers with exceptionally high Ruloadings for efficient heterogeneous photocatalysis [J].ACS Catalysis,2012,2(3):417-424.
[31]Tamizh M M,Mereiter K,Kirchner K,et al.Ruthenium (II) carbonyl complexes containing'pincer like'ONS donor Schiff base and triphenylphosphine as catalyst for selective oxidation of alcohols atroom temperature[J].Journal of Organometallic Chemistry,2012,700:194-201.
[责任编辑 田 丰]
Synthesis and efficient catalysis for alcohol oxidaton of mesoporous molecular sieves MCM-41 immobilized ruthenium complex
JIANG Yaqin,ZHANG Hongyu,SUN Xiaochen,ZHANG Yuecheng,ZHAO Jiquan
(School of Chemical Engineering and Technology,Hebei University of Technology,Tianjin 300130,China)
The ruthenium complex Ru Terpy PPh3Cl2was successfully grafted onto MCM-41 by amulti-step grafting method to obtain the immobilized MCM-41/Ru Terpy PPh3Cl2catalyst.The immobilized ruthenium complex and the intermediates were characterized by FT-IR,UV-Vis,XRD,ICP analysis and N2adsorption.The catalytic system was used for the oxidation of secondary alcohols with TBHP as terminal oxidant.The results showed that the secondary alcohols could be efficiently oxidized to the corresponding ketones at80℃without presence of solvent.Unfortunately,the catalyst showed poor reusability and its activity decreased quickly due to the leaking of the triphenylphosphine ligand during the catalytic run.
Ru Terpy PPh3Cl2;immobilization;alcohol oxidation;TBHP;MCM-41
O643.32
A
1007-2373(2016)05-0064-10
10.14081/j.cnki.hgdxb.2016.05.010
2016-09-12
国家自然科学基金(21276061)
江亚芹(1990-),女(汉族),硕士生.通讯作者:赵继全(1963-),男(汉族),教授,zhaojq@hebut.edu.cn.

