N-(4-磺酸丁基)吡啶硫酸氢盐离子液体的结构分析
张文林,钱浩智,陈 瑶,李俊飞,李春利
(河北工业大学 化工学院,天津 300130)
N-(4-磺酸丁基)吡啶硫酸氢盐离子液体的结构分析
张文林,钱浩智,陈 瑶,李俊飞,李春利
(河北工业大学 化工学院,天津 300130)
采用密度泛函理论(DFT),在基组6-31+G*的作用下,对 N-(4-磺酸丁基)吡啶硫酸氢盐离子液体的两性化合物 [C4SO3Py]±、阳离子 [C4SO3HPy]+、离子液体 [C4SO3HPy]HSO4进行了结构优化、频率分析及能量计算,并进行了相互作用能计算和电荷分析.研究发现:在两性离子、阳离子、离子液体的稳定构型中,分子间和分子内单一或同时存在着氢键.离子液体结构最稳定时,阴阳离子在功能基团附近相互作用形成氢键,HSO3中的氢与HSO4中的氧结合,最后以两性离子与 H2SO4相互作用的形式存在.电荷分析显示离子液体中阴阳离子功能基团上的氢具酸性,吡啶环中的氢原子也显一定酸性.
离子液体;结构分析;密度泛函;氢键;算法
0 引言
离子液体是由有机阳离子和无机或有机阴离子组成,在室温或室温附近的温度下呈液体状态的盐类[1-2].由于其优于常规有机溶剂及催化剂的特性,逐渐成为国际绿色高新科技前沿研究热点,离子液体构型关系与分子设计是当今离子液体亟待解决的关键技术之一[3].大量有关离子液体的研究仅集中在催化反应[4-10]方面,理论研究较少.Elizabeth等[11]运用abinitio法研究了二烷基咪唑离子液体的构型及阴阳离子间的相互作用关系.李浩然等[12]通过密度泛函理论DFT对离子液体与水间的作用模型进行了系统的研究.张锁江等[13]用DFT对不同阴离子的咪唑类离子液体结构、阴阳离子构型、氢键作用及氢键网络进行研究分析.
目前对离子液体的理论研究主要集中在咪唑类离子液体[14-16],对其他类型的离子液体及功能化离子液体的研究较少.只有从分子层面[17]上了解离子液体的微观结构及相互作用关系,才能深入理解其优越特性的深层次原因,具有重要的研究价值与科学意义.
本文以N-(4-磺酸丁基)吡啶硫酸氢盐 [C4SO3HPy]HSO4为研究对象,采用DFT对离子液体的两性离子 [C4SO3Py]±、阳离子 [C4SO3HPy]+及离子对[C4SO3HPy]HSO4的结构进行全优化,并对其进行频率分析、相互作用能计算及电荷分析,探讨功能基团对离子液体构型的影响及功能化离子液体相互作用特点.
1 计算方法
在离子液体的量化计算中,密度泛函理论(DFT)方法是基于电荷密度自洽的方法,此方法考虑了电子之间的相关作用,因此得到的能量要较哈特里—福克方程(Hartree-Fock,HF)方法来得精确,它是目前最常用的量子化学计算方法.其中,DFT理论中的B3LYP(hyPrid Pecke3-Lee-Yang-Parr)方法,既保持了从头算MO法的很多优点,又节省了机时.考虑到 [C4SO3HPy]HSO4离子液体的环状结构及离子对的相互作用,选用的基组为6-31+G*[18-21].
通过对所有可能构型进行全优化,在优化结构的基础上对其进行振动频率分析,没有虚频则为稳定结构.使用经过零点能(Zero pointenergy,ZPE)校正后的能量比较各构型间的稳定性顺序.对于同一物质的不同构型,能量越低结构的稳定性越高,也就是说总能量最低的构型为最优构型.
在计算离子对间的相互作用能时,考虑了基组重叠误差(Pasissetsuperpositionerror,PSSE)的影响,基组叠加误差采用Poys和Pornardi提出的Counterpoise(CP)方法消除.对于AB作用体系,其相互作用能可用式 (1)表示

在计算相互作用能时,为了使计算结果更准确,所用的计算能量均为经过零点能校正后的能量.
本文以N-(4-磺酸丁基)吡啶硫酸氢盐 [C4SO3HPy]HSO4为研究对象,采用DFT对离子液体的两性离子 [C4SO3Py]±、阳离子 [C4SO3HPy]+及离子液体 [C4SO3HPy]HSO4的结构进行了全优化及能量计算,并对其进行频率分析、相互作用能计算及电荷分析,确定了功能基团对离子液体构型的影响及功能化离子液体相互作用特点.
2 结果与讨论
2.1 两性离子液体的结构分析
首先对两性离子液体的结构进行考察.为了得到离子液体[C4SO3HPy]HSO4前体化合物的稳定结构,参考前人的计算方法[11],在吡啶环的稳定构型上依次引入甲基,最后优化得到离子液体阳离子 [C5Py]+的所有稳定结构,然后将 [C5Py]+阳离子碳链末端的甲基换成 SO3,并对得到的所有构型进行优化计算,通过频率分析,无虚频确定为稳定结构.图1为两性离子液体的最稳定构型.对所得稳定构型进行分析,表1列出其主要的结构参数及相对能量.
从图1可以看出,由于静电作用的影响,功能基团上带负电荷的SO3具有较强的形成分子内氢键的能力.对于形成分子内氢键的两性离子液体,同一个氧原子可以同时与2个不同的氢原子形成氢键(a1中的25O、26O;a2中的26O),而同一个氢原子也可以同时是2个氧原子的氢键给予体(a1中的11H).
通过对比所形成的两性离子液体稳定构型的能量发现分子内形成的氢键数目越多,体系能量越低,结构越稳定.不含分子内氢键的构型经频率计算也无虚频,确定为稳定结构(如a3).通过对计算结果,如键长(O26…H11)、键角(∠C5-H11…O26)以及二面角(DN6-C12-C15-C18)的比较,可知不同稳定结构的键长键角是不同的,主要是因为分子内氢键的影响,而吡啶侧链上的氢影响更大,由此可以推知,两性离子液体不同稳定结构的形成主要是受吡啶侧链烷基空间位置的影响.
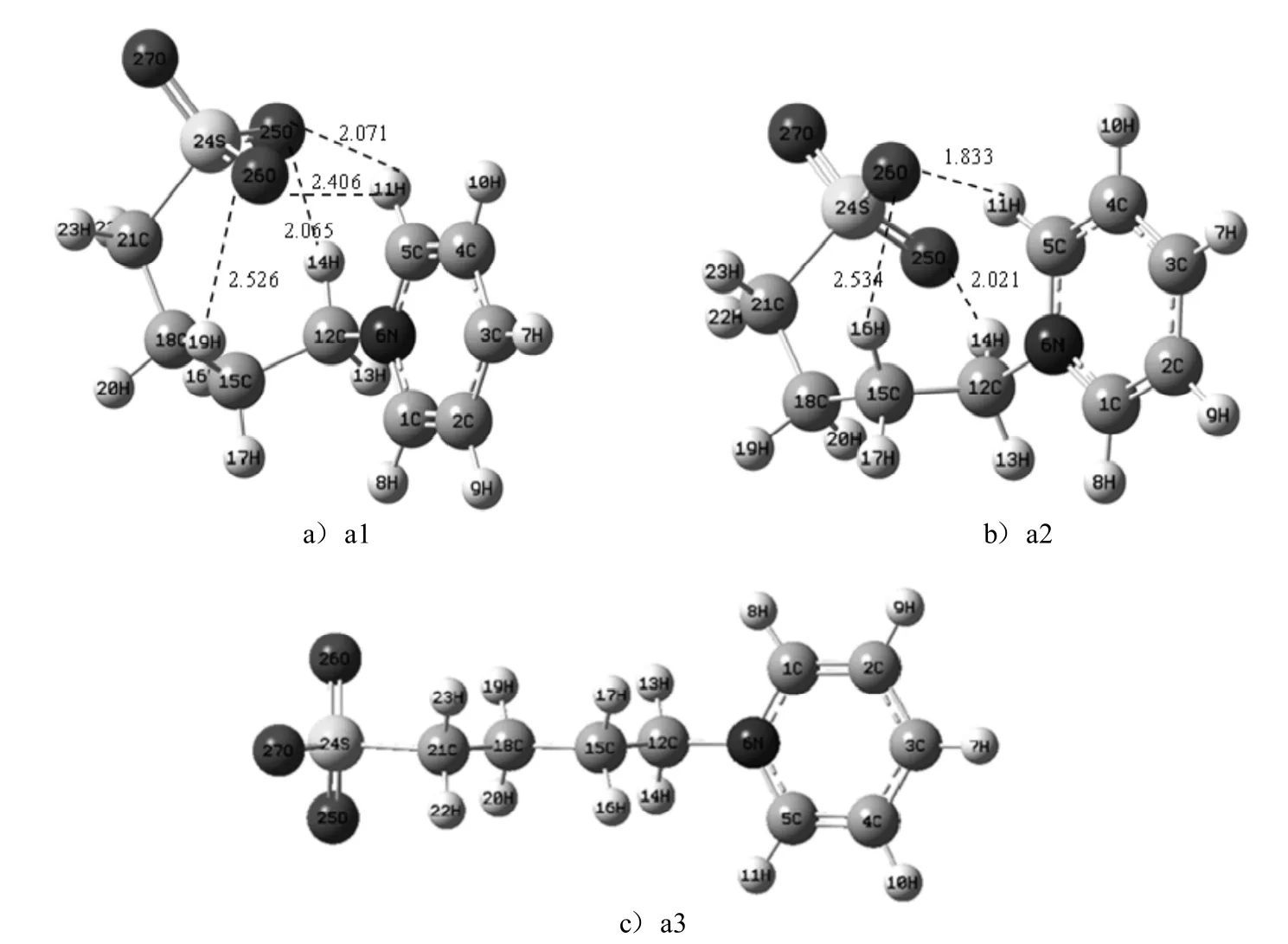
图1 [C4SO3Py]±两性离子的最稳定构型Fig.1 Themoststable configurationsof the zw itterion[C4SO3Py]±
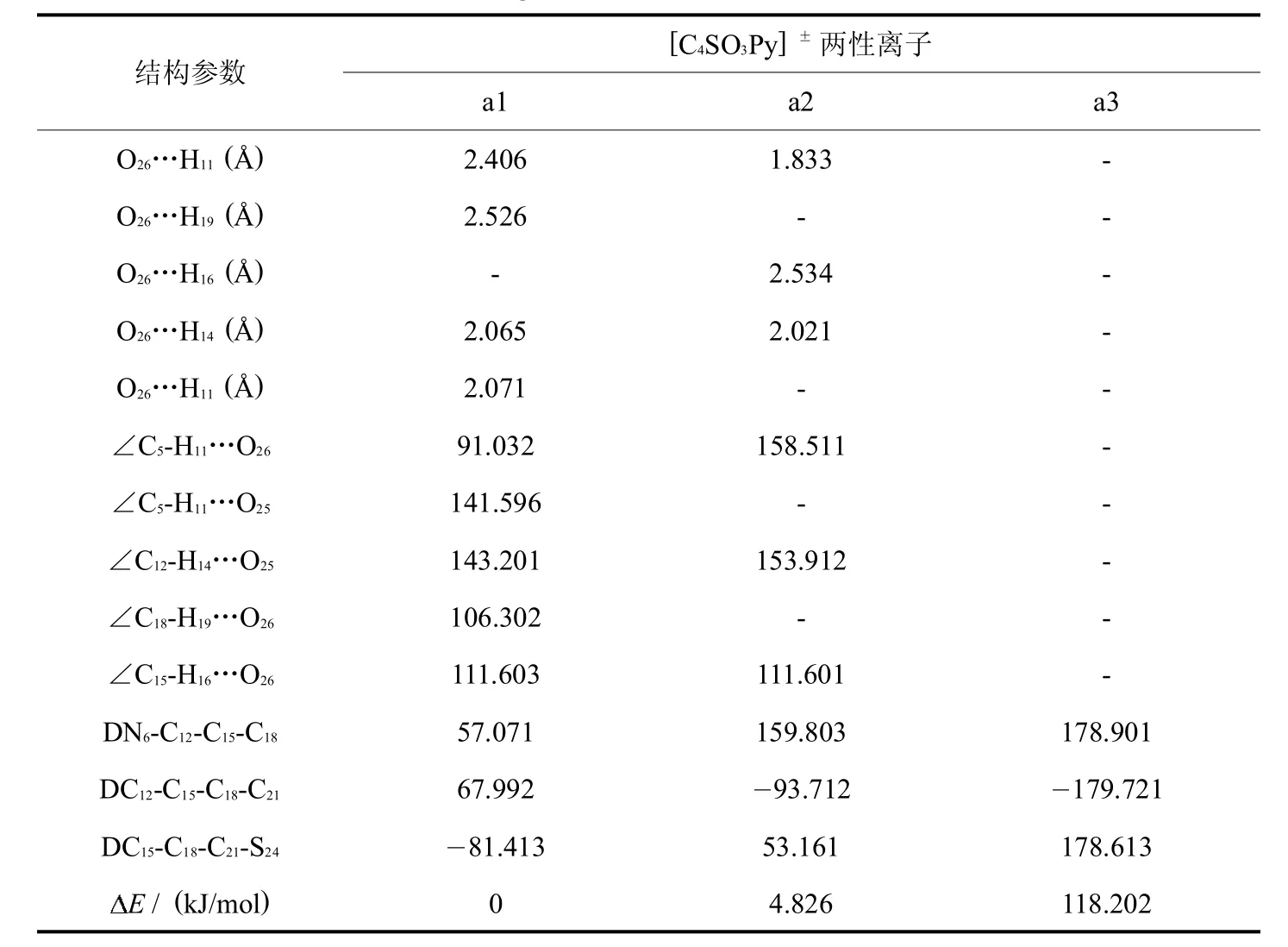
表1 [C4SO3Py]±两性离子的最稳定构型结构参数及能量差Tab.1 The parameterand energy differencesof themoststable configurationsof the zw itterion
2.2 阳离子的结构分析
对离子液体的阳离子 [C4SO3Py]+进行结构全优化计算,得到含有分子内氢键及不含分子内氢键的稳定结构,如图2所示.阳离子最稳定构型的主要结构参数及相对能量如表2所示.
计算结果表明,当SO3获得一个氢原子变为 SO3H后,整个体系的能量降低,且体系内的氢键无论从键数和键能上都削弱了.b1构型中C5-H11…O25的氢键和C12-H14…O25的氢键距离都比相应的两性离子长,说明所形成氢键的键能减弱了.阳离子 [C4SO3Py]+只形成分子内三氢键而没有四氢键的稳定构型.通过对比所有阳离子稳定结构的能量发现,阳离子内氢键数目越多,总能量越低,结构越稳定.
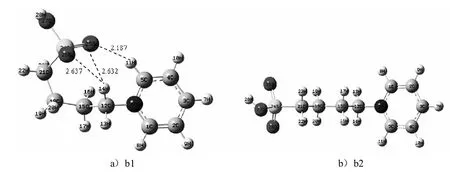
图2 [C4SO3Py]+阳离子的最稳定构型Fig.2 Themoststable configurationsof the cations[C4SO3Py]+
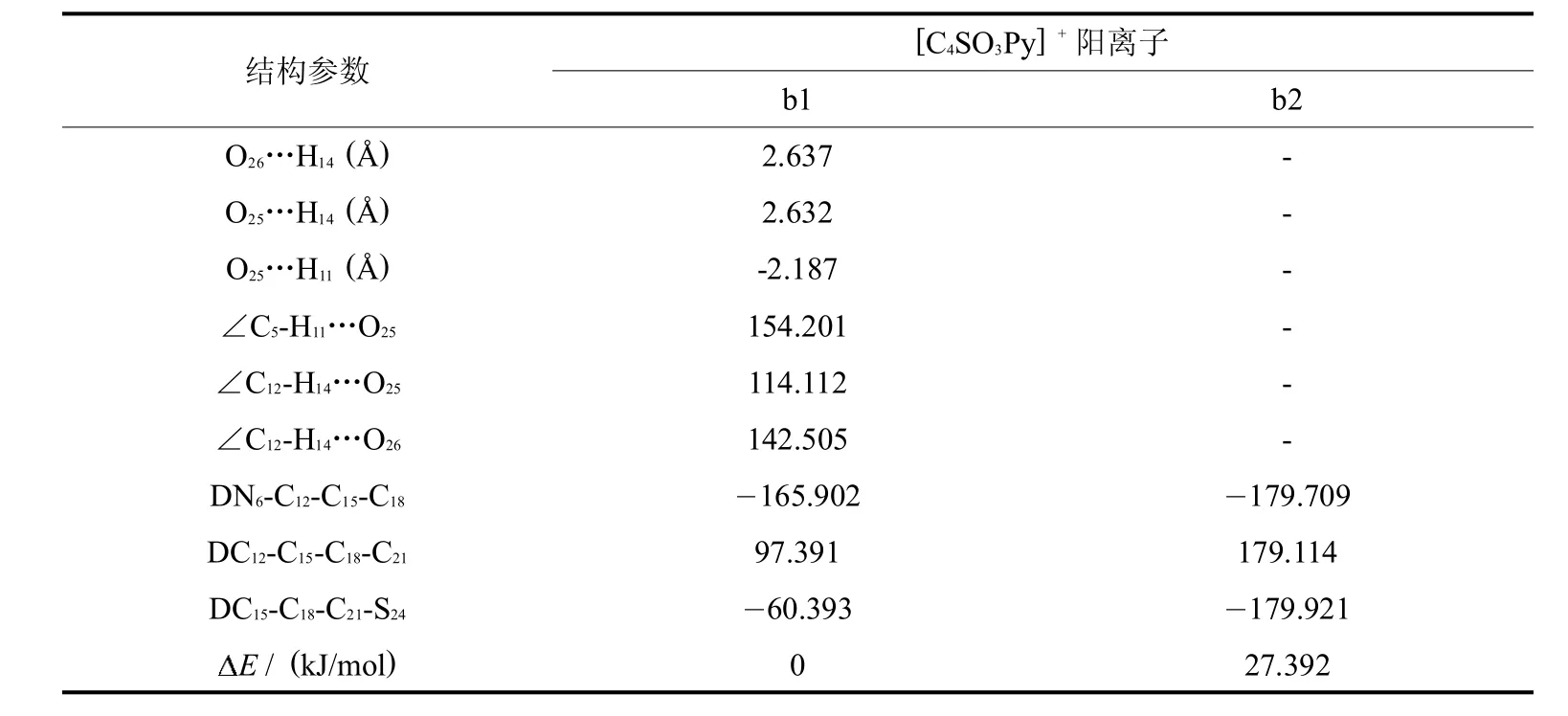
表2 [C4SO3HPy]+阳离子的最稳定构型结构参数及能量差Tab.2 The parameterand energy differencesof themoststable configurationsof the cations
2.3 离子液体的结构分析
将阴离子HSO4放在阳离子附近不同位置,对其可能的初始结构进行优化,得到代表性的几种构型如图3所示.
由图3可以看出,离子液体中阴离子能从吡啶环阳离子附近不同位置与其碳原子及硫原子上的氢相互作用形成氢键,在所有构型中c1的能量最低,所形成的氢键最强(25O…34H的键长仅为1.659Å),构型最稳定.从 c1结构中可以看出,除阳离子本身形成氢键外,离子对间也形成了三氢键的稳定构型,在模拟计算过程中,阳离子功能基团HSO3上的28H会与27O发生断裂,而与阴离子HSO4上的32O结合,在此期间,键长由27O-28H的0.979Å拉长到27O…28H的1.738Å.与此同时28H与阴离子HSO4上的32O形成键长为1.004Å的28H-32O键.阴离子HSO4上原有的32O-34H之间的键长由0.972Å拉长到1.009Å.此时离子液体体系中硫酸的H-O键长(1.004Å、1.009Å)较纯硫酸液体中键长(0.977Å、0.977Å)增加,键能降低,但由于其与两性离子液体 [C4SO3Py]±之间形成氢键作用而致使氢原子不易解离下来.从计算结果可以看出,当阴离子与阳离子相互作用时,其主要作用位置在阴离子HSO4与阳离子功能基团上的HSO3之间,而当它们之间形成氢键时,HSO3中的氢更易与HSO4中的氧结合,最后以两性离子与H2SO4相互作用的形式存在.
2.4 相互作用能计算
对离子液体 [C4SO3HPy]HSO4进行相互作用能的计算时,采用counterpoise(CP)理论对其进行了基组重叠误差的校正,通过公式 (1)计算求得.EAB、EA、EB分别为离子液体 [C4SO3HPy]HSO4、阳离子[C4SO3HPy]+、阴离子稳定构型的能量.对所得上述8种离子液体的稳定构型进行相互作用能计算,结果列于表3.

图3 离子液体 [C4SO3HPy]HSO4的稳定构型Fig.3 Themoststable configurationsof the ionic liquid[C4SO3HPy]HSO4
表3 离子液体 [C4SO3HPy]HSO4不同构型的总能量,相对能量及相互作用能Tab.3 The totalenergies EZPE,the relative energies,the interaction energies
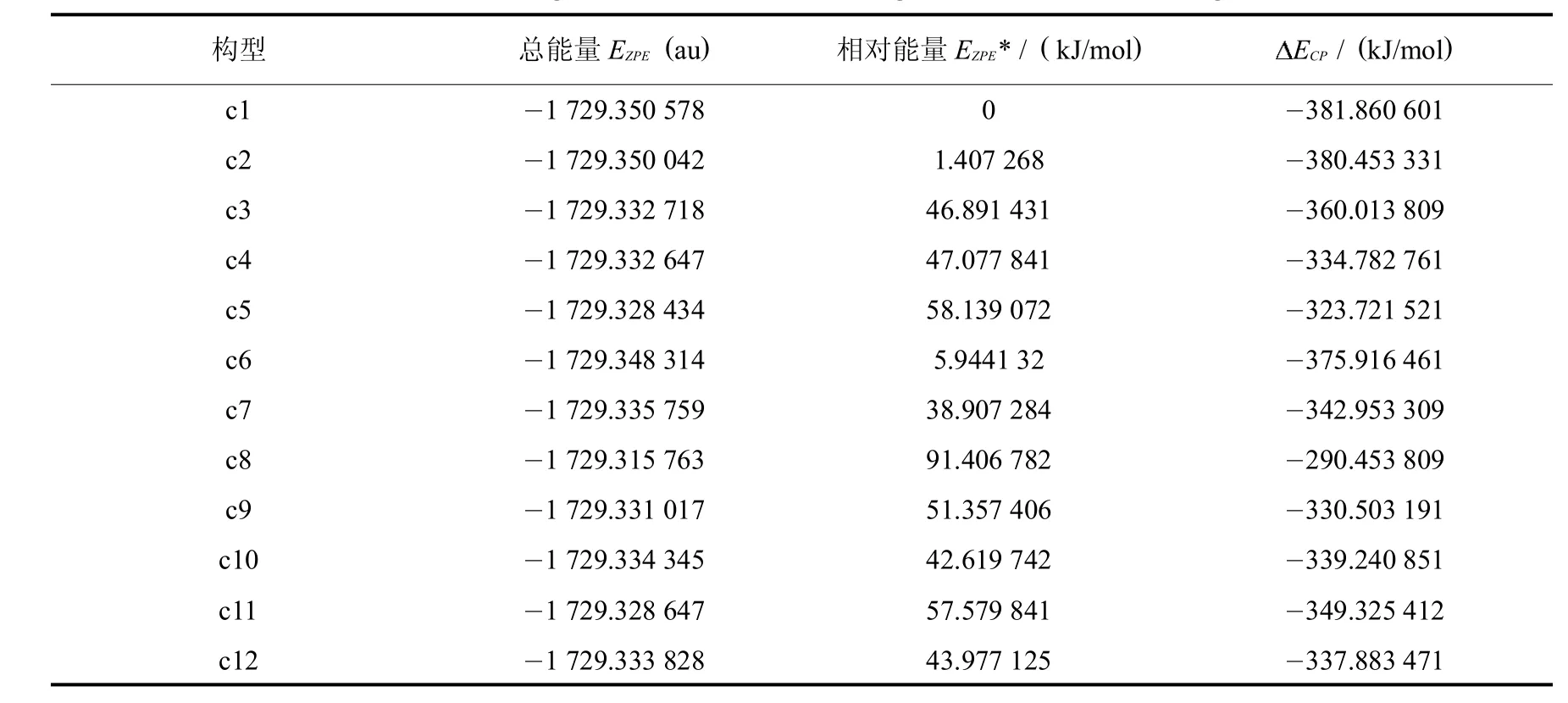
表3 离子液体 [C4SO3HPy]HSO4不同构型的总能量,相对能量及相互作用能Tab.3 The totalenergies EZPE,the relative energies,the interaction energies
构型 总能量EZPE( a u) 相对能量EZPE* / ( k J / m o l ) ECP/ ( k J / m o l ) c 1 1 7 2 9 . 3 5 0 5 7 8 0 3 8 1 . 8 6 0 6 0 1 c 2 1 7 2 9 . 3 5 0 0 4 2 1 . 4 0 7 2 6 8 3 8 0 . 4 5 3 3 3 1 c 3 1 7 2 9 . 3 3 2 7 1 8 4 6 . 8 9 1 4 3 1 3 6 0 . 0 1 3 8 0 9 c 4 1 7 2 9 . 3 3 2 6 4 7 4 7 . 0 7 7 8 4 1 3 3 4 . 7 8 2 7 6 1 c 5 1 7 2 9 . 3 2 8 4 3 4 5 8 . 1 3 9 0 7 2 3 2 3 . 7 2 1 5 2 1 c 6 1 7 2 9 . 3 4 8 3 1 4 5 . 9 4 4 1 3 2 3 7 5 . 9 1 6 4 6 1 c 7 1 7 2 9 . 3 3 5 7 5 9 3 8 . 9 0 7 2 8 4 3 4 2 . 9 5 3 3 0 9 c 8 1 7 2 9 . 3 1 5 7 6 3 9 1 . 4 0 6 7 8 2 2 9 0 . 4 5 3 8 0 9 c 9 1 7 2 9 . 3 3 1 0 1 7 5 1 . 3 5 7 4 0 6 3 3 0 . 5 0 3 1 9 1 c 1 0 1 7 2 9 . 3 3 4 3 4 5 4 2 . 6 1 9 7 4 2 3 3 9 . 2 4 0 8 5 1 c 1 1 1 7 2 9 . 3 2 8 6 4 7 5 7 . 5 7 9 8 4 1 3 4 9 . 3 2 5 4 1 2 c 1 2 1 7 2 9 . 3 3 3 8 2 8 4 3 . 9 7 7 1 2 5 3 3 7 . 8 8 3 4 7 1
从表3可以看出,在所有稳定构型中,c1的总能量最低,相互作用能量最大,证明c1的稳定性最好.
2.5 电荷分析
在离子液体稳定构型基础上,对其进行频率分析,得到[C4SO3HPy]HSO4中所有原子电荷,如表4所示.
从表4可以看出,阳离子功能基团磺酸基中氧原子(25O、26O、27O)上带有部分负电荷,而与之相连的硫原子上带有部分正电荷,离子液体阴阳离子间发生相互作用,从计算得到的各原子的电荷布局分析可以预测阳离子磺酸根上的氧原子在与其它物质作用时更容易参与配位;对于氢原子除了阴离子HSO4中34H及阳离子功能基团中的28H外,吡啶环中的11H也有较高的电荷,有较强形成分子内氢键的趋势,同样表现出一定的酸性.由酸量测定结果可知,由于11H呈现酸性,故多消耗了NaOH.
从模拟结果结合电荷分析可以看出,离子液体阴阳离子间发生相互作用,由功能基团及阴离子中的O原子提供孤对电子与H原子形成氢键.氢键越强,氢键构型越稳定,此时形成氢键的H原子的电荷密度较高(c1中28H、34H的电荷密度较其它氢原子的大).从而进一步说明了对于不同类型离子液体氢原子酸性的强弱与其稳定性和电子密度有关,其稳定性和电子密度越低时,酸性越强.对于一类离子液体,当离子液体中所形成的氢键被削弱时,H原子的酸性则会增强.因此可以通过削弱离子对中所形成的氢键,使氢更容易解离下来,从而增强离子液体的酸性.
3 结论
1)对N-(4-磺酸丁基)吡啶硫酸氢盐 [C4SO3HPy]HSO4的理论分析表明,以两性离子a1,阳离子b1,离子液体c1结构最稳定,能量最低,其能量分别为 1029.123306au、 1029.506576au、 1029.350578au.
在审美由城市主导、伪文艺开始崩塌的时代,滋生于民间的土味文化,其野性、真诚和卖力正在刺激大批城市人口以旁观者的猎奇心理加入其中,逐步形成新一轮的审丑文化潮流。
2)在两性离子中,形成了含有分子内四氢键、三氢键及不含分子内氢键的稳定结构,当两性离子中的SO3接受一个氢变为阳离子之后,形成了含有分子内三氢键及不含分子内氢键的稳定结构,由于氢原子的引入,分子内的氢键无论从键数和键能上均被削弱.结果表明,在两性离子、阳离子、离子液体的稳定构型中,同一体系不同稳定构型,氢键数目越多,能量越大,构型越稳定.
3)离子液体最稳定构型是阴离子与阳离子功能基团发生相互作用时形成的,而当它们之间形成氢键时,HSO3中的氢更易与HSO4中的氧结合,最后以两性离子与H2SO4相互作用的形式存在.
4)通过电荷分析,离子液体中阴离子及阳离子功能基团上的氢体现酸性,吡啶环中的11H也有一定的酸性.对于磺酸类功能化离子液体,当离子液体中氢键被削弱时,离子液体的酸性将会增强.为对其进行酸性调变并找到结构对催化活性和目标产物选择性的影响规律提供理论基础.
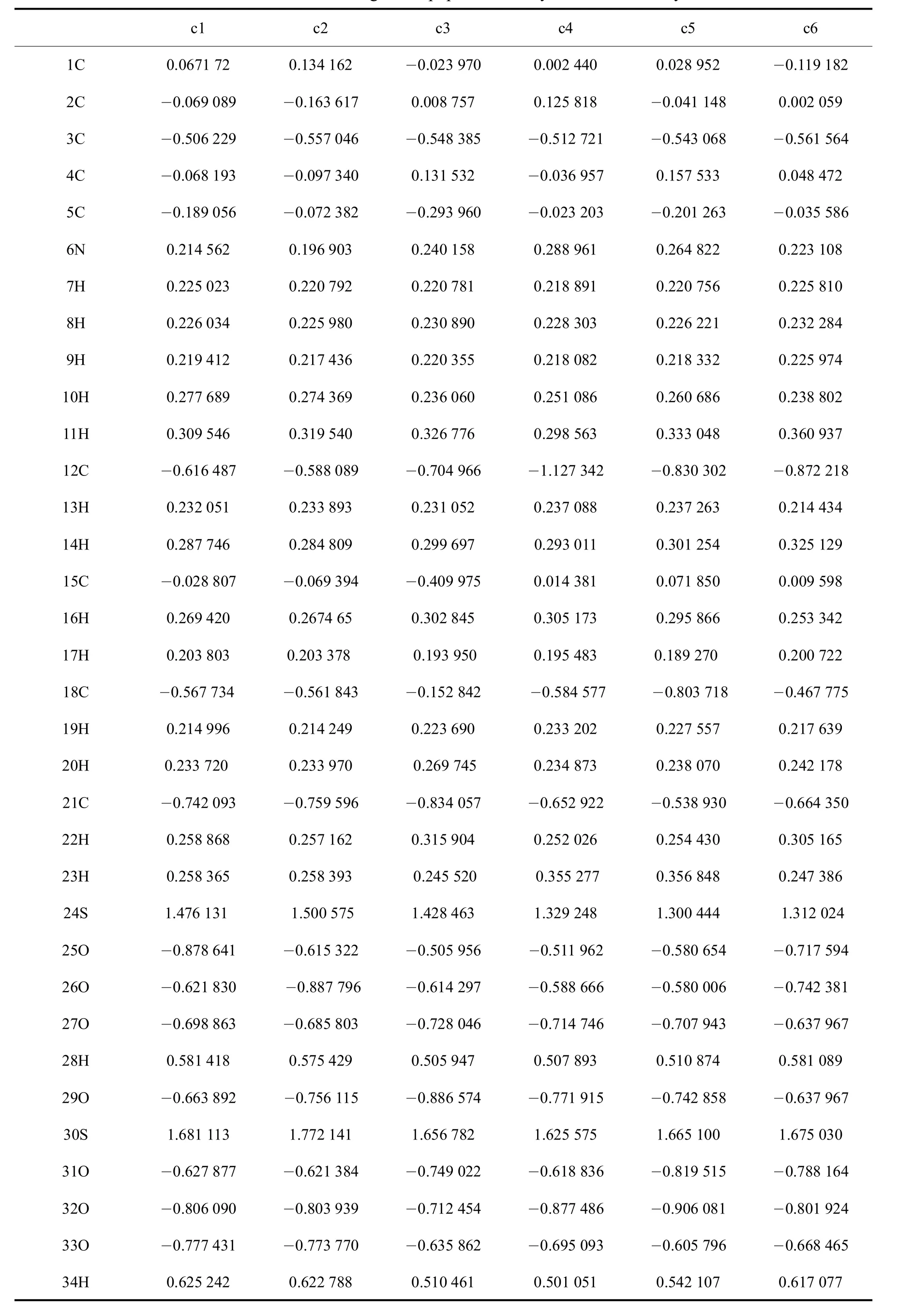
表4 离子液体 [C4SO3HPy]HSO4的Mulliken电荷布局分析Tab.4 Mulliken atomic chargesand population analysisof[C4SO3HPy]HSO4
参考文献:
[1]Seddon KR.Ionic Liquids for Clean Technology[J].Journalof Chem ical Technology&Biotechnology,1997,68(4):351-356.
[2]Welton T.Room-temperature ionic liquids.Solvents for synthesisand catalysis[J].Chemical reviews,1999,99(8):2071-2084.
[3]张锁江,刘晓敏,姚晓倩,等.离子液体的前沿、进展及应用 [J].中国科学(B辑:化学),2009(10):1134-1144.
[4]ColeAC,Jensen JL,Ntai I,etal.NovelBrønsted acidic ionic liquidsand theiruseasdualsolvent-catalysts[J].Journalof theAmericanChem ical Society,2002,124(21):5962-5963.
[5]Welton T.Ionic liquids in catalysis[J].Coordination Chemistry Reviews,2004,248(21):2459-2477.
[6]Now icki J,MuszynskiM,Gryglew icz S.Novelbasic ionic liquids from cyclic guanidinesand amidines-new catalysts for transesterification of oleochem icals[J].Journalof Chem ical Technology and Biotechnology,2014,89(1):48-55.
[7]Olivier-Bourbigou H,Magna L,Morvan D.Ionic liquidsand catalysis:recentprogress from know ledge toapplications[J].Applied CatalysisA:General,2010,373(1):1-56.
[8]Wasserscheid P,Welton T.Ionic liquids in synthesis[M/OL].Wiley Online Library,2008.
[9]Plechkova NV,Seddon KR.Applicationsof ionic liquids in the chem ical industry[J].Chem icalSociety Reviews,2008,37(1):123-150.
[10]ZhangWL,Yue Y,SuWY,etal.Metalchloridesor sulfuric acid in ionic liquid solvents convertcatechol to p-tert-Butylcatechol[J].Catalysis Communications,2015,65:113-116.
[11]TurnerEA,Pye CC,Singer RD.Useofab initio calculations toward the rationaldesign of room temperature ionic liquids[J].Journalof Physical Chem istry A,2003,107(13):2277-2288.
[12]Wang Y,LiH,Han S.A theoreticalinvestigationof the interactionsbetweenwatermoleculesand ionic liquids[J].Journalof PhysicalChemistry B,2006,110(48):24646-24651.
[13]Ding K,Zhang S,WangD,etal.Hydrogenbondsin im idazolium ionic liquids[J].JournalofPhysicalChemistry A,2006,110(31):9775-9782.
[14]UmebayashiY,M itsugiT,FujimoriT,eral.Lithium ion solvationn in room-temperature ionic liquids involving bis(trifluoromethanesulfonyl)im ideanion studied by Raman spectroscopy and DFT calculation[J].The Journalof PhysicalChem istry B,2007,111(45):13028-13032.
[15]FredlakeCP,Crosthwaite JM,HertDG,etal.Thermophysicalpropertiesof imidazolium-based ionic liquids[J].JournalofChemical&Engineering Data,2004,49(4):954-964.
[16]Urahata SM,Ribeiro MCC.Structure of ionic liquidsof 1-alkyl-3-methylim idazolium cations:A systematic computer simulation study[J].The Journalof Chem icalPhysics,2004,120(4):1855-1863.
[17]Weingartner H.Understanding ionic liquids at themolecular level:facts,problems,and controversies[J].Angewandte Chem ie International Edition,2008,47(4):654-670.
[18]苏培峰,谭凯,吴安安,等.理论与计算化学研究进展 [J].厦门大学学报(自然科学版),2011,50(2):311-318.
[19]鲁萍,谭振江.对量子化学计算软件性能的分析及对比 [J].吉林师范大学学报(自然科学版),2011,32(2):107-109.
[20]韩晓刚,廖奕.Gaussian和Multiw fn软件在结构化学教学中的应用 [J].首都师范大学学报(自然科学版),2012,33(5):23-26.
[21]ZhangWL,DuW,Wang XW,etal.Progress in adjustmentof ionic liquidsacidity based on thealkylation[J].Advanced MaterialsResearch,2013,634-638:581-586.
[责任编辑 田 丰 夏红梅]
Theoreticalstudy of N-(4-sulfonic acid butyl)pyridine bisulfate ionic liquids
ZHANGWenlin,QIAN Haozhi,CHEN Yao,LIJunfei,LIChunli
(Schoolof Chem ical Engineering,HebeiUniversity of Technology,Tianjin 300130,China)
The precursor compound[C4SO3Py]±,cation[C4SO3HPy]+and the ion pairsof SO3H functionalized acidic ionic liquids[C4SO3HPy]HSO4werestudied systematically by theDensity FunctionalTheory(DFT)at6-31+G*level. Thestructureoptim ization,frequency analysisand energy calculationwereobtained,then interactionenergywascalculated and atom ic chargewasanalyzed.The resultsindicated thattheintramolecularhydrogen bondsand intermolecularhydrogen bonds single existed or co-existed in the stable configuration of the zw itterion,cation and ionic liquid.The strongest interaction in the ionic liquidwas found between theanion and the functionalgroup.When the strong intramolecularhydrogen bondswere formed,the hydrogen of HSO3was prone to combined w ith oxygen atom of HSO4.The final existing form was the interaction between zw itterion and H2SO4.Charge analysis showed that the hydrogen in anion and cation functioned groupswere acidic,besides,the hydrogen in the pyridine ring also show a certain acidic charge.
ionic liquids;structuralanalysis;DFT;hydrogen bond;algorithm
TE667
A
1007-2373(2016)04-0045-08
10.14081/j.cnki.hgdxb.2016.04.008
2016-03-10
河北省高等学校科学技术研究项目(ZD2015118)
张文林(1968-),男(汉族),教授,博士.

