饲料中大豆油替代鱼油对银鲳运输前后应激指标及组织抗氧化能力的影响
张晨捷 高权新 彭士明 施兆鸿 王建钢
(中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海200090)
饲料中大豆油替代鱼油对银鲳运输前后应激指标及组织抗氧化能力的影响
张晨捷 高权新 彭士明*施兆鸿 王建钢
(中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海200090)
本试验通过检测运输胁迫前后血清皮质醇、葡萄糖和乳酸浓度以及组织抗氧化性能的变化,以研究饲料中大豆油替代鱼油对银鲳运输前后应激指标及组织抗氧化能力的影响。试验配制4种试验饲料,分别以100%鱼油(FO组)、70%鱼油+30%大豆油(FSO组)、30%鱼油+70%大豆油(SFO组)、100%大豆油(SO组)为脂肪源,饲喂平均体重(17.2±6.7) g银鲳60 d后进行4 h运输胁迫。每种饲料饲喂3个水泥池(重复),每池投放50尾试验鱼。结果显示:4 h运输胁迫后,各组血清皮质醇浓度均有所增加,其中SO组变化显著(P<0.05),升高1.89倍,SFO组变化程度最小;各组血清葡萄糖浓度均略有增加,其中SFO组增加最少,但变化均不显著(P>0.05);各组乳酸浓度则均出现显著增加(P<0.05),尤其是SO组;各组脑部乙酰胆碱酯酶(AChE)活力均出现显著减弱(P<0.05),而SFO组无论是在胁迫前还是在胁迫后在各组中均有最高活力;各组血清超氧化物歧化酶(SOD)活力均显著增强(P<0.05),其中SO组上升幅度最大;虽然各组血清过氧化氢酶(CAT)活力均有所增强,但只有SO组变化显著(P<0.05);肝脏和肌肉CAT活力仅SO组显著增强(P<0.05),其余各组变化不显著(P>0.05);SO组血清SOD和CAT活力显著增强(P<0.05)。由此可见,SO组银鲳在运输后机体健康情况较差,应激反应较为剧烈,说明投喂过量添加大豆油的饲料不利于银鲳的机体健康和长途运输,而在保持鱼油含量的前提下适当添加大豆油的效果较好。
银鲳;运输;脂肪酸;应激;抗氧化能力
银鲳(Pampusargenteus)隶属鲳科(Stromateidae)鲳属(Pampus),在我国各海域均有分布[1],以东海北部近海即吕四和舟山渔场的资源量最高,是沿海地区重要的经济鱼类,具有较高的养殖开发潜力[2]。自21世纪初,国内陆续开展了针对银鲳人工繁育及养殖方面的研究,尽管在人工繁育及养殖方面取得了一定的科技成果[3-4],但规模化养殖及技术推广仍存在较大难度,其中运输问题是主要的限制因子之一,原因在于银鲳对闪光、噪声、人工操作、运输等都有明显的应激反应,且反应强烈,造成体表大量分泌黏液、粉鳞脱落、擦伤和撞伤,极易死亡。长链多不饱和脂肪酸(long-chain polyunsaturated fatty acids,LC-PUFA)分为n-3和n-6系列,是鱼类维持正常生长发育和生理功能的重要营养物质,且主要从外界获取[5]。鱼油中n-3 LC-PUFA含量较高,鱼类饲料中常通过添加鱼油补充LC-PUFA。由于目前鱼油原料短缺且价格昂贵,而植物油资源较丰富且价格低廉,因此植物油在饲料工业上常被用作鱼油替代品,但大部分植物油中n-6 PUFA含量较高,n-3 PUFA含量较少甚至没有[6-7]。Villasante等[8]研究显示:n-6 PUFA与n-3 PUFA摄入比例不均衡会影响脂类代谢,造成某些脂类大量积累,进而增加鱼体组织中发生脂质过氧化的风险。另外,n-3 PUFA比n-6 PUFA更容易发生脂质过氧化作用[9]。因此,饲料中保持适当的n-3/n-6 PUFA十分重要。组织中脂肪酸组成的改变会引起机体抗氧化水平的相应变化,其产生的氧化压力将削弱机体抗应激和抗氧化的能力。
应激反应是一种对外界刺激的保护性措施,包括运动协调性、激素水平、能量代谢和电解质平衡等的变化[10]。但持续处于应激状态会导致机体的需氧代谢紊乱,产生氧化自由基,并且免疫防御体系将会受到抑制,导致鱼体对病原敏感性的增加[11-12]。血液中皮质醇(COR)、葡萄糖(GLU)以及乳酸(LD)浓度随应激程度的不同呈规律性变化,可作为反映应激程度的指标[13]。另外,运输过程中的机械损伤也会引发细菌和真菌感染,导致运输后一段时间内发生持续死亡现象[14]。乙酰胆碱酯酶(acetyl-cholinesterase,AChE)是神经传导中的关键酶,在突触间降解乙酰胆碱,终止神经递质对突触后膜的兴奋作用,保证神经信号的正常传递。银鲳应激反应强烈,运输存活率低,运输后存活个体也会出现行为和生理异常,例如:受刺激后通常会越出水面、撞击池壁或网箱,过度兴奋后又会原地打转或打漂,并难以恢复正常。因此,本试验通过在饲料添加大豆油替代不同比例的鱼油饲喂银鲳,研究其在运输胁迫前后血清皮质醇、葡萄糖、乳酸浓度以及AChE活力和组织抗氧化能力的变化情况,旨在为银鲳运输前饲料组成配比和体质强化提供参考。
1 材料与方法
1.1 饲料制备
分别以100%鱼油(FO组)、70%鱼油+30%大豆油(FSO组)、30%鱼油+70%大豆油(SFO组)、100%大豆油(SO组)为脂肪源配制等氮等能等脂的4种试验饲料,其组成及营养水平见表1,脂肪酸组成见表2。4种试验饲料的蛋白质水平均在50%左右,脂肪水平均在16%左右。所有饲料原料经过充分混合后经绞肉机制成粒径为2 mm的颗粒料,于25 ℃烘箱中风干后,放于-20 ℃冰箱中保存备用。
1.2 试验设计与取样
挑选600尾体表无伤、体色正常的银鲳幼鱼(4月龄)为试验鱼,初始规格:平均体重(17.2±6.7) g,平均叉长(8.5±0.9) cm。将600尾试验鱼平均分配于12个16 m3的圆形水泥池中,并随机分为4个饲料组,每组3个重复(水泥池),每池50尾试验鱼。预饲1周,饲养试验自2013年8月开始,于2013年9月结束,共计60 d。饲养期间,养殖水泥池24 h不间断充气,每天饱食投喂2次(08:00和16:00),日换水量为40%。整个试验期间水温变化范围为24~29 ℃,盐度为24~27。
饲养试验结束后从每个水泥池取3尾鱼作为胁迫前样本(n=9)。而后从每个水泥池取3尾鱼进行4 h运输胁迫,将3尾鱼放入40 L塑料打包袋,加15 L新鲜海水并充满氧气,用橡皮筋扎住袋口密封,放入50 L容积泡沫箱,共12箱。用卡车运输4 h,以碎冰保持运输水温为22~24 ℃,4 h运输胁迫后,出现少量死亡,故每袋取2尾作为胁迫后样本(n=6)。样品鱼随机选取,规格相近,平均体重为(34.8±5.8) g,平均叉长为(10.9±1.1) cm。
样品鱼捞取后立即经100 mg/L MS-222麻醉,然后用1 mL无菌注射器尾静脉采血,置于无菌离心管中,4 ℃静止12 h,4 000 r/min离心15 min,取其上清液。采血后,在碎冰上解剖取两侧肌肉、肝脏、组织,从头后部剖开取脑组织。用生理盐水润洗并用滤纸片吸干水分,血清、肌肉、肝脏和脑部组织置于-70 ℃保存备用。
1.3 指标检测
血清皮质醇浓度的测定采用酶联免疫吸附测定(ELISA)法,试剂盒为美国R&D公司生产的海水鱼皮质醇ELISA试剂盒。血清葡萄糖和乳酸浓度采用分光光度法测定。
AChE活力采用胆碱巯基显色剂法测定,酶活力单位(U/mg prot或U/mL)定义为:每毫克组织蛋白质或每毫升血清在37 ℃保温6 min,水解1 mol基质为1个活力单位。超氧化物歧化酶(SOD)活力采用黄嘌呤氧化酶法测定,酶活力单位(U/mg prot或U/mL)定义为:每毫克组织蛋白质或每毫升血清在1 mL反应液中超氧自由基抑制率达50%时所对应的SOD量为1个活力单位。过氧化氢酶(CAT)活力采用比色法测定,酶活力单位(U/mg prot或U/mL)定义为:每毫克组织蛋白质或每毫升血清每秒钟分解1 μmol H2O2的量为1个活力单位。上述酶活力采用南京建成生物工程研究所生产的试剂盒测定,按说明书操作。

表1 试验饲料组成及营养水平(干物质基础)
1)鱼粉、豆粕和面粉的粗蛋白质与粗脂肪含量(干物质基础)分别为67%、10.0%,43%、1.9%,12%、1.6%。The contents of crude protein and crude fat (DM basis) in fish meal, soybean meal and wheat flour were 67% and 10.0%, 43% and 1.9%, 12% and 1.6%, respectively.
2)维生素预混料为每千克饲料提供Vitamin premix supplied the following per kg of diets:肌醇myo-inositol 400 mg,烟酸 nicotinic acid 150 mg,泛酸钙 calcium pantothenate 44 mg,VB220 mg,VB612 mg,VK310 mg,VB110 mg,VA 7.3 mg,叶酸 folic acid 5 mg,生物素 biotin 1 mg,VD30.06 mg,VB120.02 mg,VC 400 mg,VE 500 mg。
3)矿物质预混料为每千克饲料提供Mineral premix supplied the following per kg of diets:KH2PO422 g,FeSO4·7H2O 1.0 g,ZnSO4·7H2O 0.13 g,MnSO4·4H2O 52.8 mg,CuSO4·5H2O 12 mg,CoSO4·7H2O 2 mg,KI 2 mg。
4)依据饲料粗脂肪含量×总n-3长链多不饱和脂肪酸百分比计算。Calculated from dietary crude lipid content×Σn-3 LC-PUFA percentage.
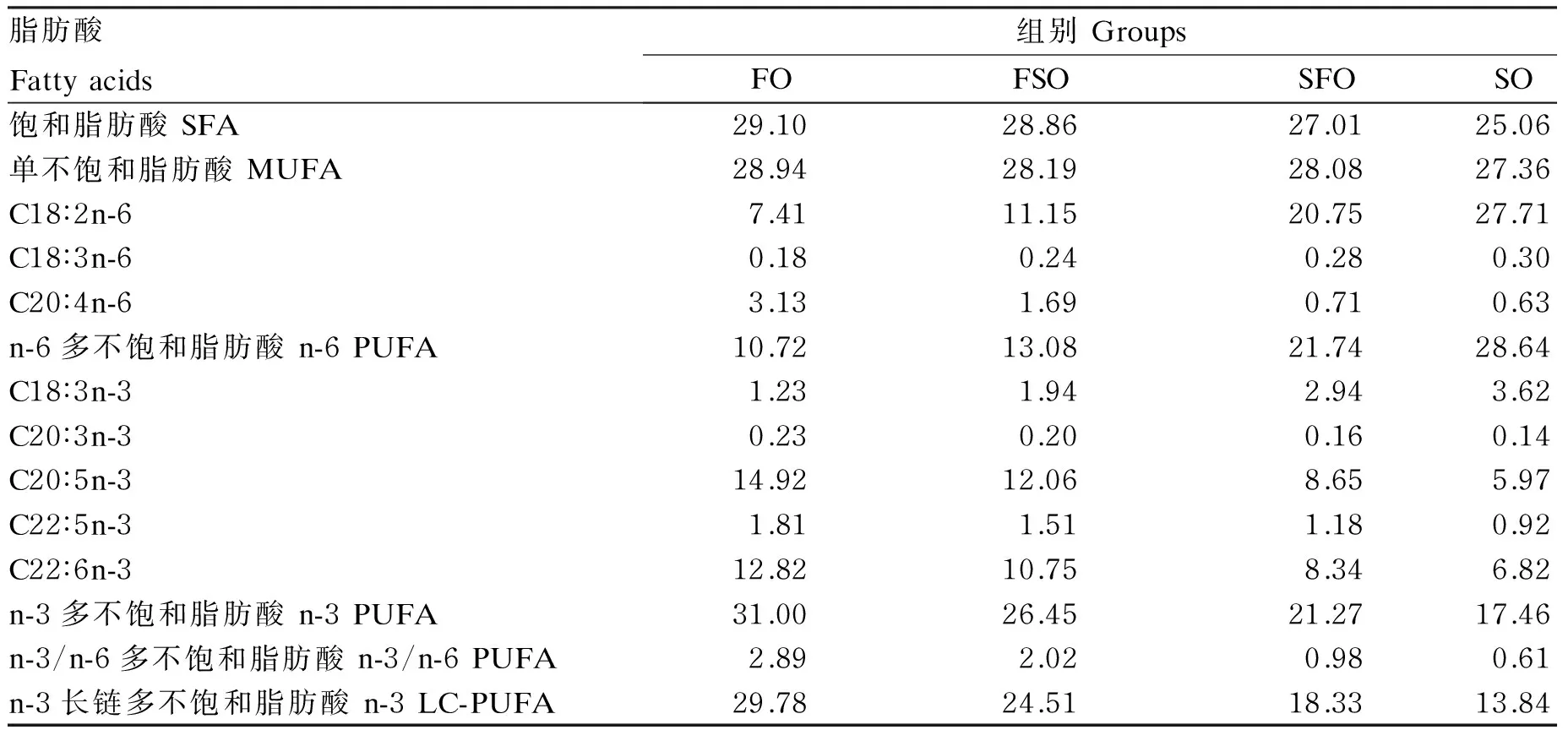
表2 试验饲料脂肪酸组成(占总脂肪酸的百分比)
1.4 数据处理与分析
试验数据以平均值±标准差(mean±SD)表示,采用SPSS 19.0软件对银鲳各项指标数据进行统计与分析,运用单因素方差分析和双因素方差分析,先进行方差齐性检验,不满足方差齐性时,对数据进行自然对数或平方根转换,采用Duncan氏法对各组数据进行多重比较,P<0.05为存在显著性差异。用t检验检测运输胁迫前后的变化,P<0.05为存在显著性差异。用Excel 2007绘制图表。
2 结果与分析
2.1 银鲳血清皮质醇浓度
4 h运输胁迫前后各组银鲳血清皮质醇浓度变化情况如图1所示。运输胁迫前各组血清皮质醇浓度差异不显著(P>0.05)。4 h运输胁迫后,各组血清皮质醇浓度都有所升高,其中SO组上升显著(P<0.05),并且显著高于SFO组(P<0.05)。血清皮质醇浓度最高值出现在胁迫后SO组,为(20.45±3.31) ng/mL,最低值出现在胁迫前SO组,为(10.81±1.75) ng/mL。
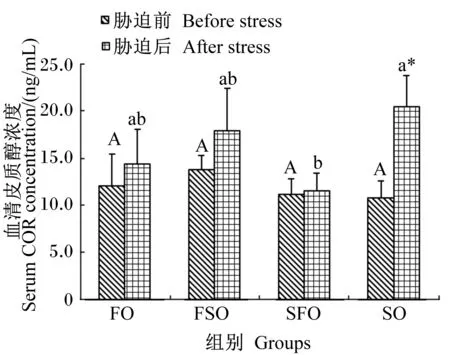
数据柱标注不同大写字母表示胁迫前各组间存在显著差异(P<0.05),不同小写字母表示胁迫后各组间存在显著差异(P<0.05),*表示胁迫后与胁迫前存在显著差异(P<0.05)。下图同。
Date column with different capital letters indicated significant difference among groups before stress (P<0.05), with different small letters indicated significant difference among groups after stress (P<0.05), and with * indicated significant difference between before and after stress. The same as below.
图1 运输胁迫对银鲳血清皮质醇浓度的影响
Fig.1 Effects of transportation stress on serum COR concentration of silver pomfret (Pampusargenteus)
2.2 银鲳血清葡萄糖浓度
4 h运输胁迫前后各组银鲳血清葡萄糖浓度变化情况如图2所示。运输胁迫前各组银鲳血清葡萄糖浓度差异不显著(P>0.05)。4 h运输胁迫后各组血清葡萄糖浓度都出现了上升,但胁迫前后差异不显著(P>0.05),各组间也不存在显著差异(P>0.05)。血清葡萄糖浓度最高值出现在胁迫后SO组,为(3.37±0.44) mmol/L,最低值出现在胁迫前SFO组,为(2.53±0.42) mmol/L。
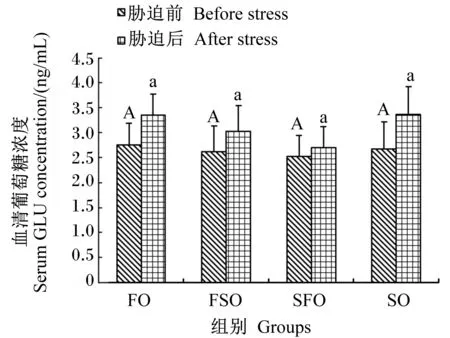
图2 运输胁迫对银鲳血清葡萄糖浓度的影响
2.3 银鲳血清乳酸浓度
4 h运输胁迫前后各组银鲳血清乳酸浓度变化情况如图3所示。运输胁迫前各组血清乳酸浓度差异不显著(P>0.05)。4 h运输胁迫后,各组乳酸浓度都出现显著增加(P<0.05),而各组间不存在显著差异(P>0.05)。血清乳酸浓度最高值出现在胁迫后FO组,为(3.14±0.52) mmol/L,最低值出现在胁迫前SO组,为(1.18±0.54) mmol/L。
2.4 银鲳血清、脑部AChE活力
4 h运输胁迫前后各组银鲳血清AChE活力变化情况如图4所示。胁迫前SFO组血清AChE活力显著高于其他组(P<0.05)。4 h运输胁迫后,FO、FSO和SFO组血清AChE活力出现了下降,其中FSO组下降显著(P<0.05);而SO组略有上升,但差异不显著(P>0.05);SFO和SO组显著高于其他组(P<0.05)。血清AChE活力最高值出现在胁迫前SFO组,为(1.30±0.25) U/mL,最低值出现在胁迫后FSO组,为(0.66±0.10) U/mL。
4 h运输胁迫前后各组银鲳脑部AChE活力变化情况如图5所示。胁迫前FSO和SFO组脑部AChE活力显著高于SO和FO组(P<0.05)。4 h运输胁迫后,各组脑部AChE活力都出现了显著下降(P<0.05),下降后SFO组依然显著高于FO组(P<0.05)。脑部AChE活力最高值出现在胁迫前SFO组,为(2.39±0.22) U/mg prot,最低值出现在胁迫后FO组,为(1.19±0.20) U/mg prot。
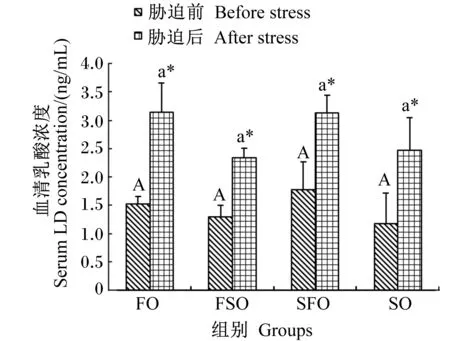
图3 运输胁迫对银鲳血清乳酸浓度的影响
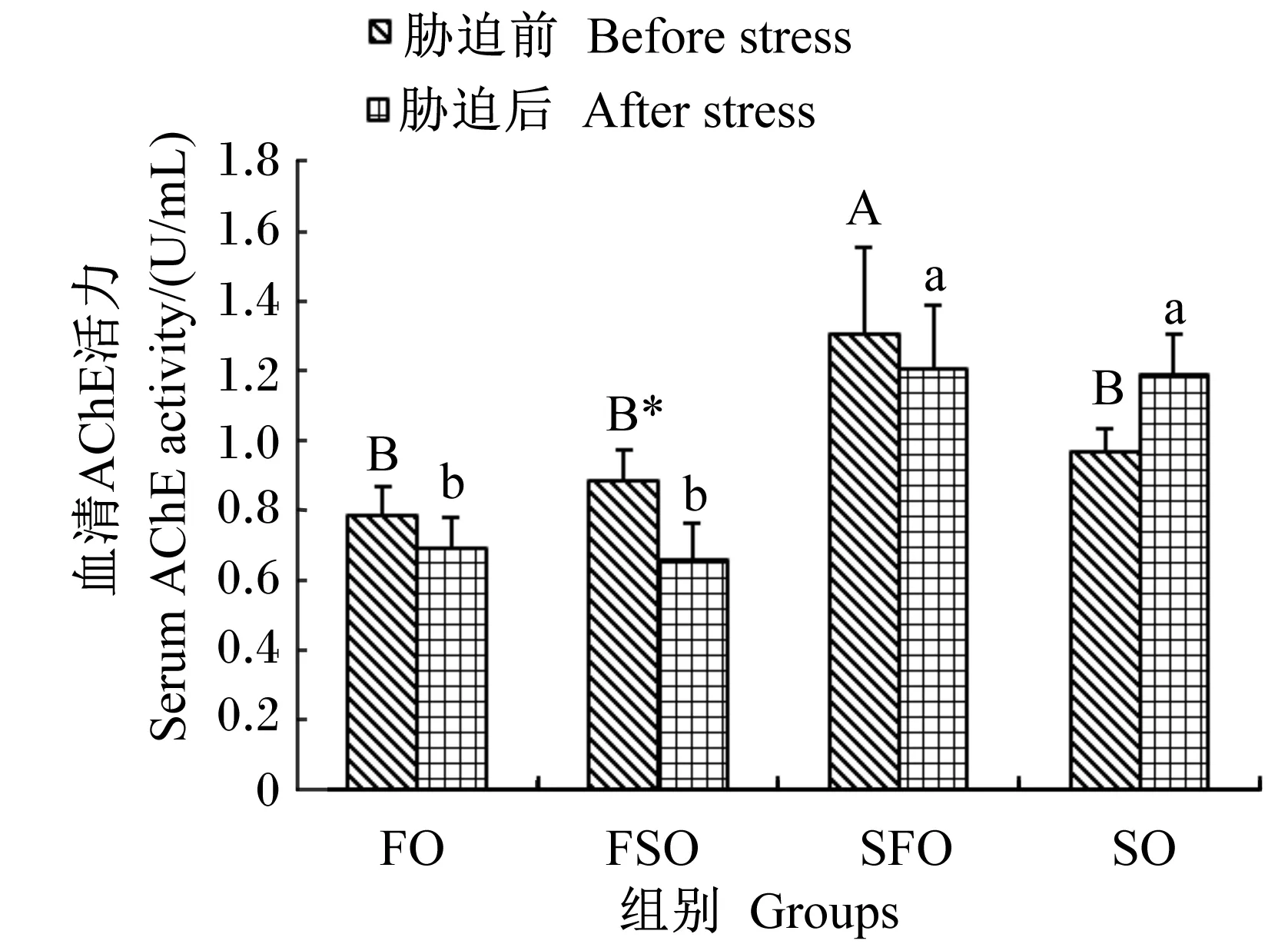
图4 运输胁迫对银鲳血清AChE活力的影响
2.5 银鲳血清、肝脏和肌肉SOD活力
4 h运输胁迫前后各组银鲳血清SOD活力变化情况如图6所示。胁迫前SO组血清SOD活力显著低于其他组(P<0.05)。4 h运输胁迫后,各组血清SOD活力都出现显著增强(P<0.05),FSO组显著高于FO和SO组(P<0.05)。血清SOD活力最高值出现在胁迫后FSO组,为(78.1±5.7) U/mL,最低值出现在胁迫前SO组,为(29.8±6.6) U/mL。

图5 运输胁迫对银鲳脑部AChE活力的影响
4 h运输胁迫前后各组银鲳肝脏和肌肉SOD活力变化情况如图7所示。胁迫前SFO组肌肉SOD活力显著高于FO和SO组(P<0.05)。4 h运输胁迫后,FO、FSO和SFO组肌肉SOD活力出现了下降,而SO组则有所上升,但变化均不显著(P>0.05);SFO和SO组显著高于FO和FSO组(P<0.05)。肌肉SOD活力最高值出现在胁迫前SFO组,为(27.1±6.6) U/mg prot,最低值出现在胁迫前SO组,为(14.7±4.6) U/mg prot。胁迫前FO组肝脏SOD活力显著高于其他组(P<0.05),而FSO组显著低于其他组(P<0.05)。4 h运输胁迫后,除SFO组肝脏SOD活力有所上升外,其他组均显著下降(P<0.05);各组间差异不显著(P>0.05)。肝脏SOD活力最高值出现在胁迫前FO组,为(166.1±24.2) U/mg prot,最低值出现在胁迫前SFO组,为(52.4±4.8) U/mg prot。
2.6 银鲳血清、肝脏和肌肉CAT活力
4 h运输胁迫前后各组银鲳血清CAT活力变化情况如图8所示。胁迫前SFO组血清CAT活力显著高于其他组(P<0.05)。4 h运输胁迫后,各组CAT活力都有所增加,其中SO组变化显著(P<0.05);各组间差异不显著(P>0.05)。血清CAT活力最高值出现在胁迫后SO组,为(1.93±0.19) U/mL,最低值出现在胁迫前FSO组,为(1.28±0.09) U/mL。
4 h运输胁迫前后各组银鲳肝脏和肌肉CAT活力变化情况如图9所示。胁迫前SFO组肌肉CAT活力显著高于其他组(P<0.05)。4 h运输胁迫后,除SFO组肌肉CAT活力略有下降外,其他组都出现了增强,其中SO组变化显著(P<0.05);SO组显著高于FO和FSO组(P<0.05)。肌肉CAT活力最高值出现在胁迫后SO组,为(0.97±0.18) U/mg prot,最低值出现在胁迫前SO组,为(0.45±0.08) U/mg prot。胁迫前FO组肝脏CAT活力显著高于其他组(P<0.05)。4 h运输胁迫后,FO和FSO组肝脏CAT活力出现下降,SFO和SO组则出现上升,其中SO组变化显著(P<0.05);FSO组显著低于FO和SO组(P<0.05)。肝脏CAT活力最高值出现在胁迫后SO组,为(1.73±0.24) U/mg prot,最低值出现在胁迫后SO组,为(0.40±0.09) U/mg prot。

图6 运输胁迫对银鲳血清SOD活力的影响
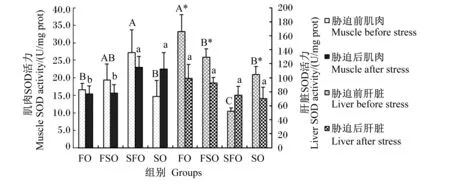
图7 运输胁迫对银鲳肌肉和肝脏SOD活力的影响
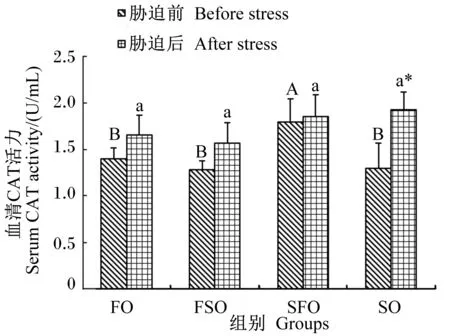
图8 运输胁迫对银鲳血清CAT活力的影响
2.7 油脂替代与运输胁迫的交互作用
油脂替代与运输胁迫对各指标的交互作用如表3所示。油脂替代、运输胁迫以及两者交互作用对肝脏SOD和肌肉、肝脏CAT活力有显著影响(P<0.05)。油脂替代和运输胁迫对血清皮质醇、乳酸浓度,SOD、CAT活力以及脑部AChE活力都有显著影响(P<0.05),但两者交互作用对上述指标的影响不显著(P>0.05)。油脂替代对血清AChE、肌肉SOD活力的影响显著(P<0.05),运输胁迫对血清葡萄糖浓度的影响显著(P<0.05)。
3 讨 论
鱼体体质的差异会影响其在运输过程中的应激程度以及运输后的成活率。运输期间的水质变化如溶氧浓度降低、氨氮浓度增高、pH变化,会使鱼体代谢需氧量和体表面黏液分泌量增加,也会对鱼机体和器官造成氧化压力,影响基因的表达和酶的活力[15-16]。另外,运输后银鲳存活个体经常出现头部、鳃部、鳍条和眼睛炎症,也常有打转、打漂等运动失调的状况存在。运输后恢复情况,不同银鲳个体也存在较大差异,有些个体会留下终生创伤,如失明、鳍条缺损等。本试验中,4 h运输胁迫后FO组死亡2条,FSO组和SFO组死亡各1条,SO组死亡3条,各组运输死亡率差别不大。

图9 运输胁迫对银鲳肌肉和肝脏CAT活力的影响
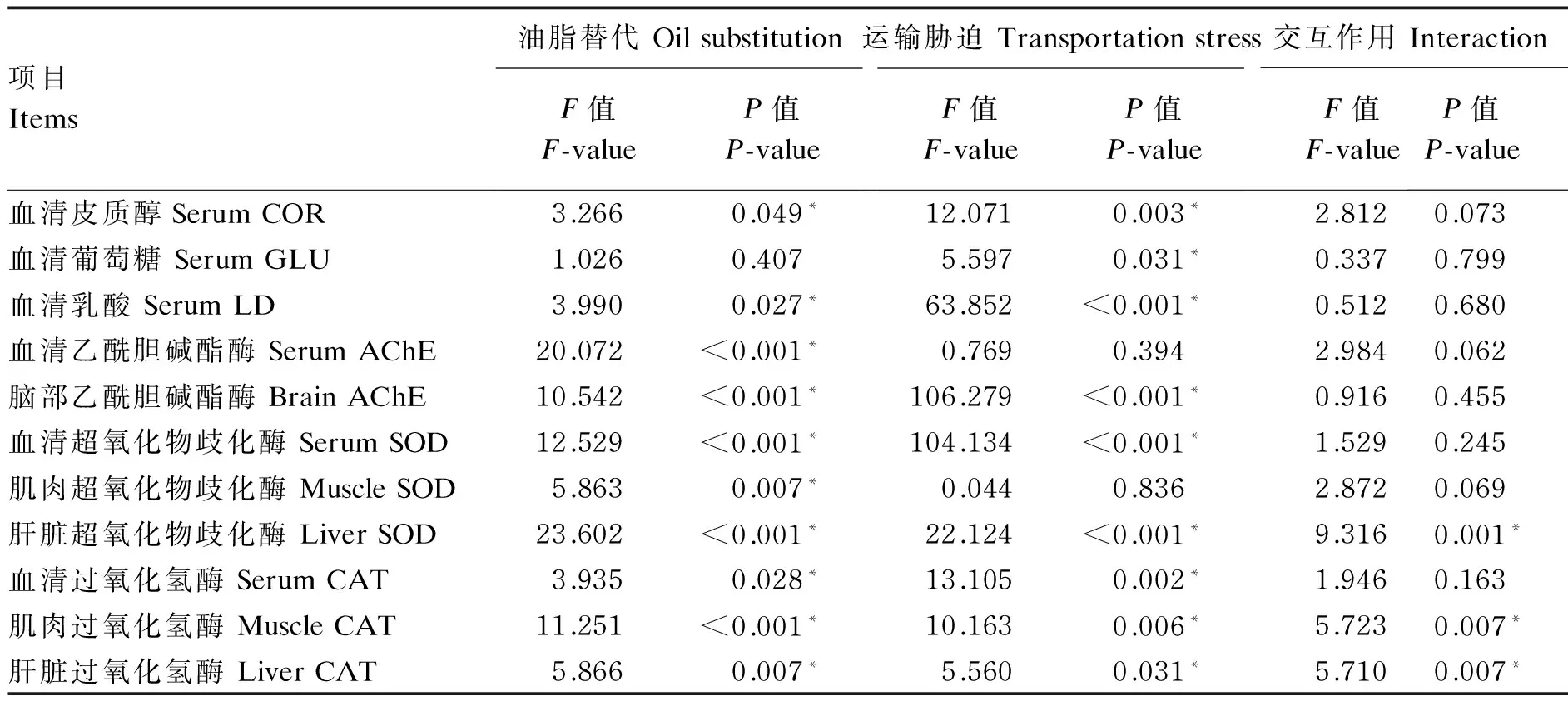
项目Items油脂替代OilsubstitutionF值F-valueP值P-value运输胁迫TransportationstressF值F-valueP值P-value交互作用InteractionF值F-valueP值P-value血清皮质醇SerumCOR3.2660.049*12.0710.003*2.8120.073血清葡萄糖SerumGLU1.0260.4075.5970.031*0.3370.799血清乳酸SerumLD3.9900.027*63.852<0.001*0.5120.680血清乙酰胆碱酯酶SerumAChE20.072<0.001*0.7690.3942.9840.062脑部乙酰胆碱酯酶BrainAChE10.542<0.001*106.279<0.001*0.9160.455血清超氧化物歧化酶SerumSOD12.529<0.001*104.134<0.001*1.5290.245肌肉超氧化物歧化酶MuscleSOD5.8630.007*0.0440.8362.8720.069肝脏超氧化物歧化酶LiverSOD23.602<0.001*22.124<0.001*9.3160.001*血清过氧化氢酶SerumCAT3.9350.028*13.1050.002*1.9460.163肌肉过氧化氢酶MuscleCAT11.251<0.001*10.1630.006*5.7230.007*肝脏过氧化氢酶LiverCAT5.8660.007*5.5600.031*5.7100.007*
*表示影响显著。
* indicated significant effect.
3.1 运输胁迫对各组银鲳应激指标的影响
鱼类受外界胁迫刺激后,其下丘脑-垂体-肾间组织轴(HPI)会迅速释放促肾上腺皮质激素(ACTH),以促进头肾细胞皮质醇激素的合成与释放[17]。杜浩等[18]研究得出,血清皮质醇浓度的增加会诱发鱼体代谢速率加快,各组织对葡萄糖的利用率降低,并导致抗病、抗氧化及耐低氧能力下降。
在运输胁迫后,鱼类体内皮质醇浓度普遍会显著上升,例如:虹鳟(Oncorhynchusmykiss)[19]、大黄鱼(Larimichthyscrocea)[20]、革胡子鲶(Clariasgariepinus)[21]、欧洲鳗鲡(Anguillaanguilla)[22]和维多利亚野鲮(Labeovictorianus)[23]都在运输不同时间后出现血清皮质醇浓度显著上升的情况。而有些鱼类反应较强烈,在2 h运输后,长江刀鲚(Coilianasus)血清皮质醇浓度升高2.5倍[24],而美洲鲥(Alosasapidissima)血清皮质醇浓度升高达20倍[17],翘嘴鲌(Culteralburnus)全鱼皮质醇浓度升高2倍[25]。
葡萄糖作为机体的主要功能物质,鱼类血清葡萄糖浓度会随应激程度的不同而发生改变。Iversen等[26]研究表明,应激反应可导致鱼类血清葡萄糖浓度明显升高,出现高血糖症,但维持高血清葡萄糖浓度有助于保障鱼体经受应激胁迫时提供能量供给。乳酸主要是肌肉在供氧不足的情况下通过糖酵解产生的,水体溶氧浓度低、血液循环缓慢以及剧烈的物理运动都可导致乳酸浓度升高。
运输胁迫后,美洲鲥[17]、虹鳟[19]血清葡萄糖浓度显著升高,大黄鱼全鱼乳酸浓度显著增加[20],而刀鲚血清葡萄糖浓度在2 h运输后升高2倍[24]。维多利亚野鲮在淡水、低盐度(0~0.5)、高盐度(8~10)运输环境下血清葡萄糖浓度均显著上升[23]。运输胁迫后,欧洲鳗鲡血清葡萄糖浓度略有上升,而乳酸浓度则显著下降,据Boerrigter等[22]解释,乳酸转化为丙酮酸可提供能量,并可在鳃、肾脏和肝脏中作为能量来源。
彭士明等[27]对银鲳运输的相关研究(运输时间与密度以及饲料维生素C水平的关系)显示:4 h运输胁迫后,银鲳血清皮质醇、葡萄糖和乳酸浓度升高最为显著,且高密度组浓度最高,而饲料添加维生素C后,上述3各指标的上升幅度显著小于对照组[28]。本试验中,4 h运输胁迫后各组血清皮质醇浓度都有所增加,与之前其他鱼类运输胁迫的研究结果相似,其中SO组变化显著,升高了1.89倍,说明SO组的应激反应比较剧烈,而SFO组变化程度最小,应激反应相对较弱;而各组血清葡萄糖浓度都略有增加,其中SFO组增加最少。从双因素方差分析结果来看,运输胁迫对血清皮质醇、葡萄糖和乳酸浓度都有显著影响,而油脂替代仅对血清皮质醇和乳酸浓度有显著影响,可以推测血清葡萄糖浓度的升高是由于运输胁迫所造成的,而油脂替代会对鱼体皮质醇的调节以及乳酸代谢产生影响,从而造成应激性能的差异。其中血清,乳酸浓度的升高在3个指标中表现最为显著,FO组升高2.06倍、FSO组升高1.79倍、SFO组升高1.76、SO组升高2.11倍,这可能是由于银鲳在运输过程中出现了过度兴奋和剧烈的物理运动,或是有氧代谢失调导致。
植物油替代鱼油会对鱼类的消化道产生不良影响,如肠壁变薄、黏膜褶皱变少,最终会影响脂肪酸的吸收,从而影响鱼类抗应激能力[29]。本试验饲料的高不饱和脂肪酸(HUFA)组成中,虽然豆油替代鱼油后n-3/n-6 PUFA逐渐下降,但花生四烯酸(ARA)和二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)含量也是随之逐渐下降,而亚麻酸和亚油酸含量则出现上升,这种组分的变化应当对海水鱼类银鲳的脂类消化吸收造成了影响。从血清葡萄糖和乳酸浓度的变化看,SFO和FSO组对运输的应激程度较低,可能是幼鱼饲料中鱼粉含量较高,且鱼油中的ARA、EPA和DHA基本能满足其营养需求,提高亚麻酸和亚油酸含量反而有助于抗应激。
AChE主要分布于神经组织、红细胞和肌肉中,作为神经递质,AChE的活力变化会对鱼类运动和协调能力产生较大影响,并进一步作用于能量合成和代谢通路[30-31]。本试验中,各组银鲳脑部AChE活力都出现显著减弱,而SFO组在胁迫前后的各组中均有最高活力,说明银鲳在运输时都处于兴奋的状态,SFO组的兴奋程度在各组中相对较低,血清AChE活力则是FSO组下降程度最显著,可推测FSO组兴奋程度最高。双因素方差分析显示油脂替代对血清和脑部AChE活力都有显著影响,说明脂肪酸的组成例如EPA、DHA含量对鱼类脑部敏感性会产生一定影响。
3.2 运输胁迫对各组银鲳抗氧化性能的影响
鱼类抗氧化防御系统分为酶促与非酶促两大部分[32]。SOD和CAT是2个重要的抗氧化酶,SOD与CAT能有效清除体内的超氧阴离子自由基(O2-·)、游离氧(O)、羟自由基(·OH)和过氧化氢(H2O2)等活性氧物质[33-34]。而LC-PUFA又是非酶促系统重要的抗氧化活性物质。
抗氧化功能是鱼类抗应激能力的重要组成部分,研究显示运输胁迫对鱼类抗氧化功能有显著影响。例如,运输胁迫后,日本黄姑鱼(Nibeajaponica)肝脏SOD和CAT活力显著升高[35];刀鲚肝脏CAT活力显著降低[36];红鳍扯旗鱼(Hyphessobryconcallistus)肝脏SOD活力和总抗氧化能力增强[13];银鲶(Rhamdiaquelen)肝脏CAT活力显著下降,而SOD活力变化不显著[15]。
本试验中,4 h运输胁迫后,各组血清SOD活力均显著增强,其中SO组上升幅度最大,上升1.91倍,虽然血清CAT活力各组都有所增强,但只有SO组变化显著。肝脏和肌肉CAT活力仅SO组显著增强。4 h运输胁迫后,SFO组肝脏SOD和CAT活力变化显示其对应激的反应较迅速。SO组肝脏CAT和SOD活力变化极为显著,说明SO组的抗氧化反应十分剧烈。
肝脏是鱼类对脂类和有害物质吸收、代谢的主要器官,应激会影响肝脏的吸收和转运功能[37]。从双因素方差分析看,运输胁迫、油脂替代以及两者交互作用对肝脏SOD和CAT活力都有显著影响。饲料中n-3 LC-PUFA含量过高,导致在体内大量聚集,必然会代谢更多脂类氧化副产物,需要肝脏提高抗氧功能予以消除,同时消耗更多能量与营养储备以维持氧化平衡。作为海水鱼类,银鲳对n-3 LC-PUFA的需求量较高,其含量过低会抑制抗氧化酶的活力,从而影响机体功能。运输胁迫前FO组肝脏SOD和CAT活力均最高,说明其体内氧化和抗氧化的平衡值较高,而4 h运输胁迫后FO组肝脏SOD活力与其他组差异不显著,CAT活力与SO组类似,可能是原来运用维持平衡的抗氧化酶被氧化应激所消耗,说明饲料n-3 LC-PUFA含量偏高同样不利于银鲳机体健康。
本试验中,各组银鲳终末体重如下:FO组,(37.8±3.8) g;FSO组,(39.9±4.0) g;SFO组,(34.6±3.7) g;SO组,(26.6±3.0) g。从上面数据可知SO组体重增长明显低于其他组,可以看出豆油过多替代鱼油会对银鲳生长造成负面影响。
4 结 论
虽然4 h运输胁迫后各组死亡率差别不大,但结合应激和抗氧化指标,发现SO组银鲳在运输后机体健康情况较差,应激反应较为剧烈,说明投喂过量添加大豆油的饲料不利于银鲳的机体健康和长途运输,而在保持鱼油含量的前提下适当添加大豆油的效果较好。
[1] 刘静,李春生,李显森.中国鲳属鱼类的分类研究[J].海洋科学集刊,2002(44):240-252.
[2] 孙鹏飞,戴芳群,陈云龙,等.长江口及其邻近海域渔业资源结构的季节变化[J].渔业科学进展,2015,36(6):8-16.
[3] 施兆鸿,彭士明,王建钢,等.人工养殖银鲳子代的胚胎发育及仔稚幼鱼形态观察[J].中国水产科学,2011,18(2):267-274.
[4] 彭士明,施兆鸿,孙鹏,等.养殖密度对银鲳幼鱼生长及组织生化指标的影响[J].生态学杂志,2010,29(7):1371-1376.
[5] XIE D,WANG S,YOU C,et al.Characteristics of LC-PUFA biosynthesis in marine herbivorous teleostSiganuscanaliculatusunder different ambient salinities[J].Aquaculture Nutrition,2015,21(5):541-551.
[6] TURCHINI G M,TORSTENSEN B E,NG W K.Fish oil replacement in finfish nutrition[J].Reviews in Aquaculture,2009,1(1):10-57.
[7] 蒋湘辉,骆小年,金广海,等.不同蛋白质和脂肪水平饲料对拉氏鱼岁幼鱼生长、体成分和免疫力的影响[J].动物营养学报,2016,28(3):864-871.
[8] VILLASANTE A,PATRO B,CHEW B,et al.Dietary intake of purple corn extract reduces fat body content and improves antioxidant capacity and n-3 polyunsaturated fatty acid profile in plasma of rainbow trout,Oncorhynchusmykiss[J].Journal of the World Aquaculture Society,2015,46(4):381-394.
[9] 田晶晶,雷彩霞,吉红.饲料亚油酸/亚麻酸比率对松浦镜鲤生长和健康状况的影响[J].淡水渔业,2015,45(5):76-82.
[10] URBINATI E C,ABREU J S D,CAMARGO A C D S,et al.Loading and transport stress of juvenile matrinxã (Bryconcephalus,Characidae) at various densities[J].Aquaculture,2004,229(1/2/3/4):389-400.
[11] 王文博,李爱华.环境胁迫对鱼类免疫系统影响的研究概况[J].水产学报,2002,26(4):368-374.
[12] KING H R.Fish transport in the aquaculture sector:an overview of the road transport of Atlantic salmon in Tasmania[J].Journal of Veterinary Behavior,2009,4(4):163-168.
[13] PAN C H,CHIEN Y H,WANG Y J.The antioxidant capacity response to hypoxia stress during transportation of characins (HyphessobryconcallistusBoulenger) fed diets supplemented with carotenoids[J].Aquaculture Research,2010,41(7):973-981.
[14] PARODI T V,CUNHA M A,BECKER A G,et al.Anesthetic activity of the essential oil of Aloysia triphylla and effectiveness in reducing stress during transport of albino and gray strains of silver catfish,Rhamdiaquelen[J].Fish Physiology and Biochemistry,2014,40(2):323-334.
[15] AZAMBUJA C R,MATTIAZZI J,RIFFEL A P,et al.Effect of the essential oil of Lippia alba on oxidative stress parameters in silver catfish (Rhamdiaquelen) subjected to transport[J].Aquaculture,2011,319(1/2):156-161.
[16] DHANASIRI A K S,FERNANDES J M O,KIRON V.Glutamine synthetase activity and the expression of threeglulparalogues in zebrafish during transport[J].Comparative Biochemistry and Physiology Part B,2012,163(3/4):274-284.
[17] 杜浩,危起伟,甘芳,等.苯唑卡因对美洲鲥运输应激的缓解作用研究[J].中国水产科学,2006,13(5):787-793.
[18] 杜浩,危起伟,甘芳,等.美洲鲥应激后皮质醇激素和血液生化指标的变化[J].动物学杂志,2006,41(3):80-84.
[19] TACCHI L,LOWREY L,MUSHARRAFIEH R,et al.Effects of transportation stress and addition of salt to transport water on the skin mucosal homeostasis of rainbow trout (Oncorhynchusmykiss)[J].Aquaculture,2015,435:120-127.
[20] 张伟,王有基,李伟明,等.运输密度和盐度对大黄鱼幼鱼皮质醇、糖元及乳酸含量的影响[J].水产学报,2014,38(7):973-980.
[21] MANUEL R,BOERRIGTER J,ROQUES J,et al.Stress in African catfish (Clariasgariepinus) following overland transportation[J].Fish Physiology and Biochemistry,2014,40(1):33-44.
[22] BOERRIGTER J G J,MANUEL R,VAN DEN BOS R,et al.Recovery from transportation by road of farmed European eel (Anguillaanguilla)[J].Aquaculture Research,2015,46(5):1248-1260.
[23] OYOO-OKOTH E,CHEROP L,NGUGI C C,et al.Survival and physiological response ofLabeovictorianus(Pisces:Cyprinidae,Boulenger 1901) juveniles to transport stress under a salinity gradient[J].Aquaculture,2011,319(1/2):226-231.
[24] 徐钢春,杜富宽,聂志娟,等.10‰盐度对长江刀鲚幼鱼装载和运输胁迫中应激指标的影响[J].水生生物学报,2015,39(1):66-72.
[25] 胡培培,刘汝鹏,赵忠波,等.运输时间和密度对翘嘴鲌皮质醇、耗氧率及氧气袋内水质的影响[J].水生生物学报,2014,38(6):1190-1194.
[26] IVERSEN M,FINSTAD B,MCKINLEY R S,et al.Stress responses in Atlantic salmon (SalmosalarL.) smolts during commercial well boat transports,and effects on survival after transfer to sea[J].Aquaculture,2005,243(1/2/3/4):373-382.
[27] 彭士明,施兆鸿,李杰,等.运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响[J].水产学报,2011,35(6):831-837.
[28] PENG S M,SHI Z H,FEI Y,et al.Effect of high-dose vitamin C supplementation on growth,tissue ascorbic acid concentrations and physiological response to transportation stress in juvenile silver pomfret,Pampusargenteus[J].Journal of Applied Ichthyology,2013,29(6):1337-1341.
[29] MOLDAL T,LØKKA G,WIIK-NIELSEN J,et al.Substitution of dietary fish oil with plant oils is associated with shortened mid intestinal folds in Atlantic salmon (Salmosalar)[J].BMC Veterinary Research,2014,10:60.
[30] BECKER A G,PARODI T V,GONÇALVES J F,et al.Ectonucleotidase and acetylcholinesterase activities in silver catfish (Rhamdiaquelen) exposed to different salinities[J].Biochemical Systematics and Ecology,2013,46:44-49.
[31] ASSIS C R D D,LINHARES A G,OLIVEIRA V M,et al.Characterization of catalytic efficiency parameters of brain cholinesterases in tropical fish[J].Fish Physiology and Biochemistry,2014,40(6):1659-1668.
[33] 曾本和,廖增艳,吴双,等.饲料脂肪水平对大鳞副泥鳅幼鱼生长性能、消化酶活性及抗氧化能力的影响[J].动物营养学报,2016,28(4):1105-1113.
[34] KANAK E G,DOGAN Z,EROGLU A,et al.Effects of fish size on the response of antioxidant systems ofOreochromisniloticusfollowing metal exposures[J].Fish Physiology and Biochemistry,2014,40(4):1083-1091.
[35] 孙鹏,柴学军,尹飞,等.运输胁迫下日本黄姑鱼肝脏抗氧化系统的响应[J].海洋渔业,2014,36(5):469-474.
[36] 高金伟,杜富宽,顾若波,等.运输应激对刀鲚生理生化指标和HPI轴基因表达影响及甘草甜素的作用[J].上海海洋大学学报,2015,24(6):817-825.
[37] MOZANZADEH M T,MARAMMAZI J G,YAVARI V,et al.Dietary n-3 LC-PUFA requirements in silvery-black porgy juveniles (Sparidentexhasta)[J].Aquaculture,2015,448:151-161.
*Corresponding author, associate professor, E-mail: shiming.peng@163.com
(责任编辑 菅景颖)
Substitution of Dietary Fish Oil with Soybean Oil Influences Stress Indexes and Tissue Antioxidant Function of Silver Pomfret (Pampus argenteus) before and after Transportation
ZHANG Chenjie GAO Quanxin PENG Shiming*SHI Zhaohong WANG Jiangang
(EastChinaSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Shanghai200090,China)
Through detecting the changes of serum cortisol, glucose, lactate concentrations and tissue antioxidant indexes, the influences of substitution of dietary fish oil with soybean oil on stress indexes and tissue antioxidant function of silver pomfret (Pampusargenteus) before and after Transportation were studied. Four experimental diets were designed, which used 100% fish oil (FO group), 70% fish oil+30% soybean oil (FSO group), 30% fish oil+70% soybean oil (SFO group) and 100% soybean oil (SO) as the fat source, respectively. The silver pomfret with the average body weight of (17.2±6.7) g had been fed with these experimental diets for 60 days, and then they were being transported for 4 h. Each diet fed 3 tanks (replicates) with 50 fish per tank. The results showed as follows: after 4 h transportation stress, serum cortisol concentration of each group was increased, and the change of SO group was significant that up-regulated to 1.89 folds (P<0.05), but the change of SFO group was lighter than other groups; serum glucose concentration of each group increased slightly, the change of each group was not significant (P>0.05), and the SFO group was the least one; then, serum lactate concentration of each group increased significantly (P<0.05), especially SO group. Brain acetyl-cholinesterase (AChE) activity of each group decreased significantly, and SFO was the highest group both before and after transportation; serum superoxide dismutase (SOD) activity of every group increased significantly (P<0.05), especially SO group; serum catalase (CAT) activity increased in all groups, but only SO group increased significantly (P<0.05); CAT activity in liver and muscle of SO group increased significantly (P<0.05), and the changes of other groups were not significant (P>0.05); serum SOD and CAT activities of SO group increased significantly (P<0.05). The results indicate that the health of silver pomfret in group SO is worse than other groups after transporting, and its stress response is more significant. It is suggested that the substitution of dietary fish oil with too much soybean oil is disadvantageous to transportation and health of silver pomfret. And it is important to keep the proper proportion of fish oil and soybean oil in the diet.[ChineseJournalofAnimalNutrition, 2017, 29(1):354-364]
silver pomfret; transportation; fatty acid; stress; antioxidant function
10.3969/j.issn.1006-267x.2017.01.041
2016-07-15
上海市科技兴农重点攻关项目(沪农科攻字2013-2-1);中央级公益性科研院所基本科研业务费(东2014Z02)
张晨捷(1989—),男,上海人,研究实习员,硕士,从事海水鱼类生理、繁殖研究。E-mail: zhangchenjie1989@sina.com
*通信作者:彭士明,副研究员,硕士生导师,E-mail: shiming.peng@163.com
S963
A
1006-267X(2017)01-0354-11

