水温和饥饿对鮸鱼肝脏抗氧化酶的影响
吕小康,刘 峰,楼 宝,刘阳阳,徐冬冬,陈睿毅,詹 炜,王立改,毛国民,马 涛
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316021)
水温和饥饿对鮸鱼肝脏抗氧化酶的影响
吕小康,刘 峰,楼 宝,刘阳阳,徐冬冬,陈睿毅,詹 炜,王立改,毛国民,马 涛
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316021)
为了探讨不同水温和饥饿条件下鮸鱼抗氧化酶的变化规律,采用实验生态法分析了实验条件下鮸鱼(体质量234.46±52.85 g)肝脏中超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力及其与体质量的相关分析。结果表明:饥饿导致实验鱼体质量下降,其中水温越高体质量下降越明显:30℃组下降(29.44±7.42)g,显著大于22℃组(9.06±1.47)g和13℃组(4.23±0.93)g。相同水温条件下,随着饥饿时间的延长,鮸鱼肝脏中SOD和CAT活力均出现明显变化,并且不同水温条件下变化各不相同:13℃组中,SOD和CAT活力均呈现先上升后下降的走势,在饥饿2 d时酶活力达到最高值;22℃组中,SOD和CAT从始至终均呈现逐渐下降的趋势;而在30℃高温组中,SOD与CAT活力变化趋势不完全一致,SOD活力变化较小,呈现轻微的先上升后下降趋势,同样是饥饿2 d时达到最大值,CAT活力总体表现为下降的趋势。同一饥饿时长不同温度处理组中,实验鱼肝脏中SOD和CAT活力同样存在显著差异(P<0.05):除了13℃组在鱼体饥饿2 d时CAT活力0.044±0.006 U/mgprot高于22℃组0.038±0.006 U/mgprot之外,SOD和CAT活力均是22℃组最高,30℃的高温组最低。本研究结果为鮸鱼的高效健康养殖提供技术参考。
鮸鱼;水温;饥饿胁迫;抗氧化酶;相关性分析
鮸鱼Miichthys miiuy属于鲈形目、石首鱼科,又称米鱼,因其鲜美的肉质和丰富的营养而深受大众喜爱。由于其生长迅速、自然抗逆性强、病害少、市场潜力巨大等一系列优点,逐渐成为人工养殖的优良品种[1]。在养殖过程中,鱼类常会因为饲养密度过大、投放饲料不均匀、投喂不及时、环境改变、季节变化等原因导致短期饥饿胁迫现象存在[2]。在饥饿胁迫下,鱼类的生理生化代谢会发生改变,降低代谢,来适应饥饿胁迫[3]。目前已有许多关于鱼类饥饿胁迫研究的报道,如柳敏海等[4]测定了短期饥饿胁迫对鮸鱼生化组成、脂肪酸和氨基酸组成的影响;谷江稳[5]对银鲳Pampus argenteus幼鱼在饥饿胁迫下的鱼体成分及消化系统组织学进行了系统研究。饥饿胁迫将会引起鱼体生理生化指标发生变化。苏慧[6]研究发现卵形鲳鲹Trachinotus ovatus幼鱼在饥饿胁迫条件下生理生化指标发生了明显变化。
此外,养殖水温是水生动物生存所需的重要非生物环境因素之一,养殖温度的变化将会导致鱼类生化反应过程、代谢能力发生变化[7],通常,温度升高能提高鱼类代谢速率,但温度过高时却能导致鱼类的死亡[8]。报道指出,温度胁迫会导致多种水生生物的超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalane,CAT)等抗氧化酶活性发生变化[9-11]。上述报道均是从饥饿或者水温单方面对鱼类生理生化指标影响进行探讨,关于温度和饥饿对鮸鱼抗氧化酶活力协同作用的研究未见报道。为了探讨饥饿时间和水温对鮸鱼生理生化指标的影响,本实验测定了不同水温条件、不同饥饿时间下鮸鱼肝脏组织中的SOD和CAT活力,探讨鮸鱼体内抗氧化体系在不同饥饿时间、温度条件下的变化规律,为进行高效、科学的鮸鱼人工养殖提供基础参考资料。
1 材料与方法
1.1 实验材料
实验在2015年12月底进行,实验鱼取自浙江舟山沿海网箱养殖的鮸鱼群体,选取规格相近、体表无伤、体格健壮的鮸鱼共计135尾,体质量均值(234.46±52.85)g,实验鱼随机分为3组,每组45尾,设3个平行,实验桶容积0.3 m3,每个实验桶中放养实验鱼15尾。实验所用海水为经高位池沉淀和砂滤池过滤处理之后的海水,海水盐度为26~27。
1.2 实验方法
实验分为3个温度组,温度分别为13℃、22℃、30℃。开始时的水温为13℃左右,因此,第1个处理组通过加热棒和温控仪使水温恒定在13℃左右,另外两个处理组通过加热棒进行升温,升温方式为每24 h升温1℃[12],达到实验设定温度之后,暂养7 d,每天早晚2次投喂人工配合饲料,颗粒直径5 mm左右,及时清除残饵和粪便。实验开始后则停止投喂饲料,即对实验鱼进行饥饿处理,注意观察实验状态,分别在饥饿0 d、1 d、2 d、3 d、4 d时对实验鱼进行取样。
实验水温的调控:通过加热棒及温控仪进行水温控制。其中,加热棒型号为WN-B1000 W,功率1 000 W;温控仪型号为WK-SM3。加热过程中,每个实验桶缓慢常流水,水流速度大约为30 L/h,确保加热升温速度快于常流水导致的降温速度,从而保证水温基本恒定。调节气阀确保水体含氧量在5.5 mg/mL以上。
1.3 样品制备与测定
在各温度处理条件下,每天上午对饥饿的实验组进行取样,每个实验组取9尾,每个平行3尾。首先对取样的实验鱼进行体质量测量,然后用纯水冲洗实验鱼体表2次,将实验鱼移至冰盘冰冻处死,冰盘上快速解剖取肝脏,用预冷鱼用生理盐水(1.2%)冲洗肝脏组织,经吸水纸吸干后盛装于2 mL离心管中,-80℃超低温保存,用于酶活力指标的测定。超氧化物歧化酶、过氧化氢酶的测定均使用南京建成生物工程研究所的试剂盒完成。
1.4 数据采集及统计分析
测量实验鱼初始体质量,采用电子天平,精确到0.01 g。为了避免称量过程中对实验鱼造成机械损伤、减少鱼体带水量导致的误差,本实验采取水中称量法,先在电子天平放置装有海水的器皿置零之后将实验鱼放入器皿中,逐一记录电子天平读数,计算增加的质量,即可获得每尾实验鱼的体质量。使用SPSS19.0软件对实验鱼肝脏抗氧化酶活力进行单因子方差分析(One-way ANOVA)并进行差异显著性检验。
2 结果
2.1 实验前后实验鱼体质量分析
对实验前后实验鱼体质量进行统计汇总,并用单因素方差分析和Duncans多重比较的方法对不同温度组实验前后体质量差值的差异性进行统计分析,用标记字母法表示结果(表1)。结果表明,30℃组实验鱼体质量降低值(29.44±7.42)g显著大于22℃组(9.06±1.47)g和13℃组(4.23±0.93)g,说明温度越高,实验鱼的活动能力较强,消耗能量较多,从而导致自身能量大量消耗,而低温条件下,鱼体运动及代谢能力较弱,减少了能量损耗,所以体质量减轻较小。
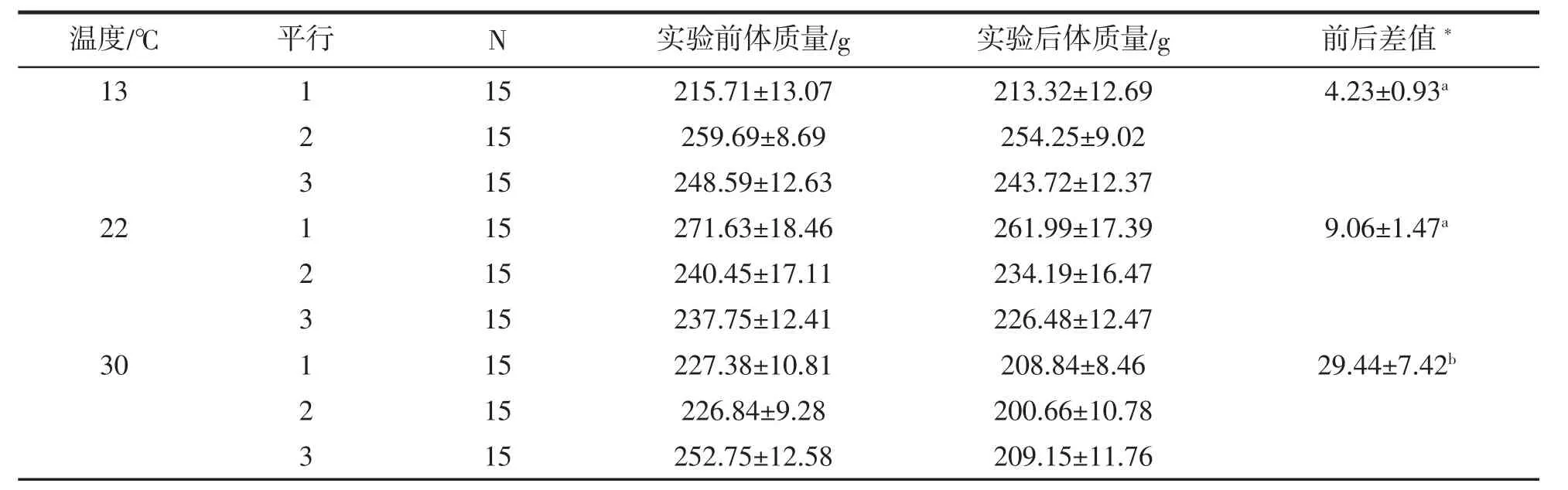
表1 实验前后实验鱼体质量比较分析Tab.1 Comparison of the fish body weight before and after the experiment
2.2 肝脏中SOD活力的变化
对肝脏中SOD活力进行统计分析,结果如图1。从图1中可以看出,相同饥饿时长不同温度处理组中,实验鱼肝脏中SOD活性存在显著差异(P<0.05),同一饥饿时长条件下,肝脏中SOD活力均是22℃的常温组最高,13℃的低温组次之,30℃的高温组最低;在同一温度组中,随着饥饿时间的延长,鮸鱼肝脏中SOD活性出现较为明显变化,13℃组中,SOD活力呈现先上升后下降的走势,在饥饿2 d时的活力最高,为259.838±28.230 U/mgprot;在22℃组中,SOD活力呈现逐渐降低的趋势,实验开始时的SOD活力最高,为439.157± 14.376 U/mgprot;而在30℃高温组中,SOD活力变化较小,呈现轻微的先上升后下降趋势,同样是饥饿2 d时的SOD活力最高,为156.676±9.579 U/mgprot。以饥饿时长为X轴,以肝脏中的SOD活力为Y轴,进行二次项回归分析,获得3个温度条件下的回归方程的决定系数R2值分别为0.999、0.984和0.925。
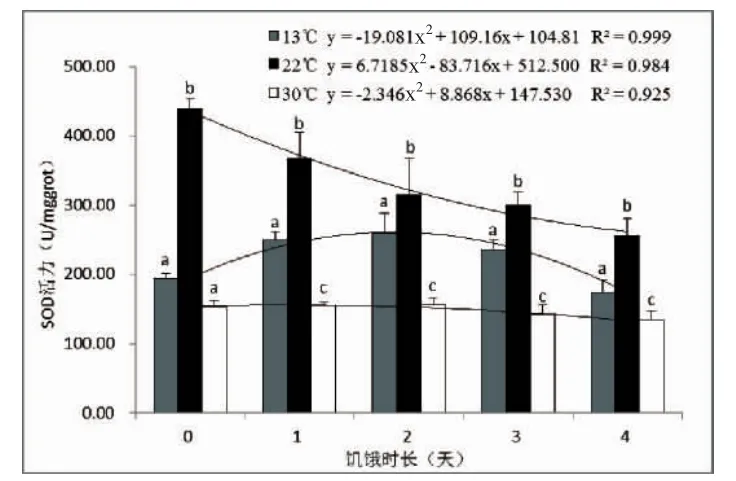
图1 水温和饥饿胁迫对肝脏中抗氧化酶SOD活力的影响Fig.1 Effects of water temperature and starvation stress on SOD activities in liver of M.miiuy
2.3 肝脏中CAT活力的变化
对肝脏中CAT活力进行统计分析,结果如图2。从图2可以得知,相同饥饿时长不同温度处理组中,实验鱼肝脏中CAT活力存在显著差异(P<0.05),实验开始时,是22℃组肝脏CAT活力最高,13℃的低温组CAT活力次之,而30℃高温组CAT活力最低。随着饥饿时长增大,13℃组CAT活力逐渐增加,饥饿超过2 d后该酶活力开始逐渐下降,此时CAT活力为0.044±0.006 U/mgprot。22℃组中,CAT活力逐渐下降,其活力在饥饿2 d时0.038± 0.006 U/mgprot开始低于13℃组CAT活力;30℃组CAT活力总体上呈现为逐渐下降的走势,并且始终低于其他两个温度组。同样,以饥饿时长为X轴,以肝脏中的CAT活力为Y轴,进行二次项回归分析,获得3个温度条件下的回归方程的决定系数R2值分别为0.699、0.921和0.832。
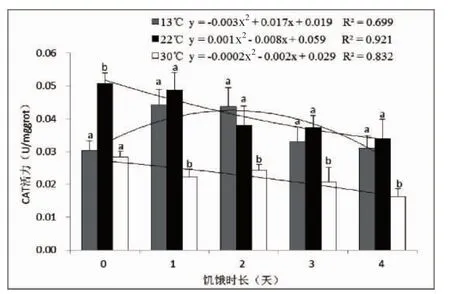
图2 水温和饥饿胁迫对肝脏中抗氧化酶CAT活力的影响Fig.2 Effects of water temperature and starvation stress on CAT activities in liver of M.miiuy
比较肝脏SOD和CAT活力的回归方程R2值可以发现,SOD活力的拟合效果要优于CAT。另外,在SOD中,13℃时的数值拟合的回归方程最好;而在CAT中,22℃时的最优。
2.4 实验鱼体质量与酶活性相关性分析
为了研究不同水温条件下,鮸鱼肝脏抗氧化酶活力与体质量之间的关联性,通过相关性分析对其进行研究,结果见表2。由表2可知,在水温22℃和30℃条件下,鮸鱼肝脏中SOD活力与CAT活力呈现显著相关关系(P<0.05)。3个温度水平中,SOD活力与体质量呈现正相关关系,而CAT活力与体质量呈现负相关关系。
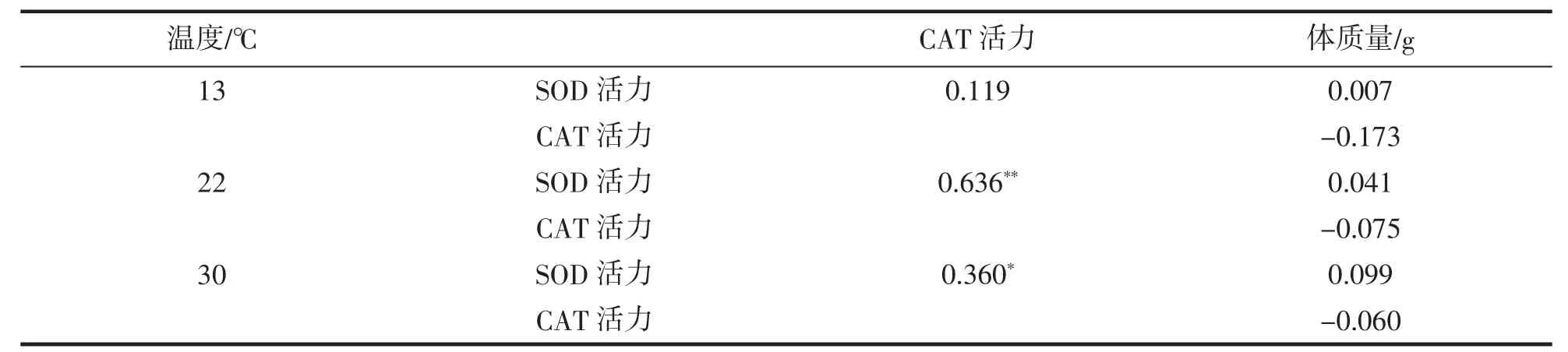
表2 不同温度条件下酶活力与体质量的相关性分析Tab.2 Correlation analysis of enzyme activities and body weight of M.miiuyunder different temperature
同样,使用相关性分析方法研究不同饥饿时长条件下抗氧化酶与体质量之间的关联性,结果见表3。由表3可以看出,各个饥饿时长取样测定的SOD活力都与CAT活力呈现显著相关关系(P<0.05);两种抗氧化酶活力与体质量之间相关性不显著(P>0.05)。

表3 饥饿胁迫酶活力与体质量的相关性分析Tab.3 Correlation analysis of enzyme activities and body weight of M.miiuyunder starvation stress
3 讨论
3.1 饥饿对体质量的影响
本次研究发现,鮸鱼经过饥饿处理之后体质量较实验前均有一定的降低,研究结果与尼罗罗非鱼Oreochromis niloticus[13]、草鱼Ctenopharyngodon idellus[14]及太平洋鲑Oncorhynchus spp.[15]等报道的结果相似。主要原因饥饿或食物不足时,动物体消耗自身贮存的能量以维持生命活动,饥饿时能较好地利用糖类作为能源物质[16]以及优先利用脂肪再利用蛋白质作为代谢能源,从而导致自身体质量降低[17-19];但也有研究者发现有南方鲇饥饿后的蛋白质含量无明显变化[20]。本次研究不同温度处理组之间鮸鱼体质量降低量有一定的差别,其中高温组(30℃)体质量下降显著高于22℃组和13℃组,推测在高温条件下,鱼体的能量代谢加快,消耗能量增加,需要大量利用机体内能源物质,从而出现体质量降低量要明显高于其他两个温度组。
3.2 温度和饥饿胁迫对鮸鱼肝脏SOD和CAT的影响
水生动物在遭受外界环境胁迫时,机体内抗氧化酶的活力会发生一定的变化,以避免机体受到自由基的伤害[21]。本研究中,在温度和饥饿的胁迫下,鮸鱼肝脏中的SOD和CAT活力均发生了一定的变化,在13℃的低温组中,鮸鱼肝脏中SOD和CAT活力均表现为先升高后下降的趋势。可能原因是,低温条件诱使鮸鱼新陈代谢加快以应对外界的低温环境,此过程引起抗氧化酶积极响应,表现为酶活力升高,但是随着饥饿时间的延长,机体内能源物质逐渐消耗,导致新陈代谢速度减慢,进而引起两种酶活力逐渐下降[22],同时,饥饿时间的延长,使得饥饿胁迫胁迫作用强度增加,已经超出鮸鱼的适应能力范围,鮸鱼抗氧化系统的功能无法正常发挥,也表现为两种酶活力的下降。在22℃组中,两种酶活力均表现为逐渐下降的趋势,导致此现象的可能原因是,此温度条件下鮸鱼代谢旺盛,对外界能源需求量大,此时遭受饥饿胁迫,外界能源供应不足,机体代谢速度迅速降低[23],进而表现出抗氧化酶活力逐渐下降的现象。在30℃的高温组中,抗氧化酶活力显著低于前两个温度处理组,可能原因是,高温胁迫会使生物体内的活性氧产物升高,生物体内的氧自由基不断积累,抗氧化酶的活力不足以抑制细胞内的氧化损伤,造成机体受到一定程度的损害,从而使体内的抗氧化酶活力降低[23]。
3.3 酶活力与体质量之间关联性
本次研究中,在水温22℃和30℃条件下,鮸鱼肝脏中SOD活力与CAT活力呈现显著相关关系(P< 0.05)。3个温度水平中,SOD活力与体质量呈现正相关关系,而CAT活力与体质量呈现负相关关系,但是相关性均不显著,因此两种抗氧化酶活力与体质量之间并未表现出显著的相关关系。各个饥饿时长取样测定的SOD活力都与CAT活力呈现显著相关关系(P<0.05),但是两种抗氧化酶活力同样与体质量之间相关性不显著(P>0.05)。出现上述现象可能原因是本次实验所取用的实验鱼个体之间差异较小,进行相关性分析时不能有效检验出体质量与酶活力变化是否具有显著的相关性,因此,鱼体体质量与抗氧化酶活力变化的相关性分析,需要基于不同大小规格的实验鱼进行深入探讨。
研究得知,低温条件下(本研究中为13℃)适当饥饿有利于提高鱼体免疫力,但是饥饿时间太久(本研究中为超过2 d以上),会对机体造成损伤,免疫力降低;适宜温度条件下进行饥饿将会降低鱼体免疫力,有爆发病害的危险。高温条件下养殖鮸鱼,将会导致鱼体损伤,免疫力降低,同样有爆发病害的危险,不利于鱼类养殖。
[1]孙庆海,陈诗凯.鮸鱼规模化繁育技术研究[J].浙江海洋学院学报:自然科学版,2003,22(3):273-276.
[2]刘 波,何庆国,唐永凯,等.饥饿胁迫对吉富罗非鱼生长及生理生化指标的影响[J].中国水产科学,2009,16(2):230-237.
[3]MCCUE M D.Starvation physiology:Reviewing the different strategies animals use to survive a common challenge[J].Comparative Biochemistry&Physiology Part A:Molecular&Integrative Physiology,2010,156(1):1-18.
[4]柳敏海,罗海忠,傅荣兵,等.短期饥饿胁迫对鮸鱼生化组成、脂肪酸和氨基酸组成的影响[J].水生生物学报,2009,33(2):230-235.
[5]谷江稳.饥饿胁迫对银鲳幼鱼体成分及消化系统组织学的影响[D].宁波:宁波大学,2012.
[6]苏 慧.饥饿胁迫对卵形鲳鲹幼鱼生理生化影响的初步研究[D].上海:上海海洋大学,2012.
[7]钱佳慧,栗志民,申玉春,等.温度和盐度对华贵栉孔扇贝抗氧化酶活性的联合效应研究[J].南方水产科学,2015,11(6):49-57.
[8]陈全震,曾江宁,高爱根,等.鱼类热忍耐温度研究进展[J].水产学报,2004,28(5):562-567.
[9]徐冬冬,楼 宝,詹 炜,等.高温胁迫对褐牙鲆生长及肝脏抗氧化酶活性的影响[J].水产学报,2010,34(7):1099-1105.
[10]LUSHCHAK V,BAGNYUKOVA T.Temperature increase results in oxidative stress in goldfish tissues.1.Indices of oxidative stress[J].Comparative Biochemistry&Physiology Part C:Toxicology&Pharmacology,2006,143(1):30-35.
[11]CHENMuyan,YANGHongsheng,DELAPORTE M,et al.Immune condition of Chlamys farreri,in response to acute temperature challenge[J].Aquaculture,2007,271(1/4):479-487.
[12]NDONG D,CHEN Yuyuan,LIN Yuhung,et al.The immune response of tilapia Oreochromis mossambicus,and its susceptibility to Streptococcus iniae,under stress in low and high temperatures[J].Fish&Shellfish Immunology,2007,22(6):686-694.
[13]田 娟,涂 玮,曾令兵,等.饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-I和胰岛素mRNA表达丰度的变化[J].水产学报,2012,36(6):900-907.
[14]朱站英,华雪铭,于 宁,等.草鱼蛋白质和脂肪代谢对饥饿胁迫的响应[J].水产学报,2012,36(5):756-763.
[15]陈 斌,冯 健,吴 彬,等.饥饿对太平洋鲑(Oncorhynchus spp.)鱼体脂肪与脂肪酸的影响[J].海洋与湖沼,2012,43(6): 1 247-1 253.
[16]沈文英,林浩然,张为民.饥饿和再投喂对草鱼鱼种生物化学组成的影响[J].动物学报,1999,45(4):404-412.
[17]姜志强,贾泽梅,韩延波.美国红鱼继饥饿后的补偿生长及其机制[J].水产学报,2002,26(1):67-72.
[18]郑曙明,王燕妮,聂迎霞,等.虎鲨饥饿后的补偿生长及淀粉酶活性研究[J].华中农业大学学报,2003,22(5):483-487.
[19]覃川杰,邵 婷,杨洁萍,等.饥饿胁迫对瓦氏黄颡鱼脂肪代谢的影响[J].水生生物学报,2015,39(1):58-65.
[20]邓 利,张 波,谢小军.南方鲇继饥饿后的恢复生长[J].水生生物学报,1999,23(2):167-173.
[21]蒋 玫,黄世林,伦凤霞,等.微小亚历山大藻对黑鲷仔鱼的抗氧化酶和ATPase的胁迫影响[J].海洋通报,2010,29(4): 427-431.
[22]郭 黎,马爱军,王新安,等.盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J].大连海洋大学学报,2012,27(5):422-428.
[23]MEHNER T,WIESER W.Energetics and metabolic correlates of starvation in juvenile perch(Perca fluviatilis)[J].Journal of Fish Biology,1994,45(2):325-333.
[24]DOWNS C A,FAUTH J E,WOODLEY C M.Assessing the Health of Grass Shrimp(Palaeomonetes pugio)Exposed to Natural and Anthropogenic Stressors:A Molecular Biomarker System[J].Marine Biotechnology,2001,3(4):380-397.
The Effects of Temperature and Starvation Stress on Liver Antioxidant Enzyme Activities of Miichthys miiuy
LÜ Xiao-kang,LIU Feng,LOU Bao,et al
(Marine and Fishery Research Institute of Zhejiang Ocean University,Marine Fisheries Research Institute of Zhejiang Province,Key Lab of Mariculture and Enhancement of Zhejiang Province,Zhoushan 316021,China)
In order to understand the change rule of liver antioxidant enzyme activities of Miichthys miiuy, the effects of temperature and starvation stress on liver antioxidant enzyme(Superoxide Dismutase,SOD,and Catalane,CAT)activities and the correlation of body weight and the antioxidant enzyme activities of M.miiuy (234.46±52.85 g)were investigated at 13,22,and 30℃.The result showed that the body weight of samples was decreased,in which most obvious is the 30℃group (29.44±7.42)g followed by the 22℃group (9.06± 1.47)g.The temperature and starvation significantly affected the activities of antioxidant enzymes of liver of M. miiuy.In the temperature of 13℃ group,the liver antioxidant enzyme activities of M.miiuy increased andthen declined with starvation time prolonged ranged from 0 to 4 days;in the 22℃group,as the starvation time prolonged,both the SOD and CAT activities constantly decreased.Nevertheless,in the high temperature of 30℃group,the change trends of the SOD and CAT activities were not completely similar,in which the SOD activities increased and then declined,while the CAT activities roughly showed a decreasing trend.For the same starvation time,both the SOD and CAT activities of the 22℃ group were the highest,and the 30℃ group were the lowest,except the CAT activity under stop feeding for 2 days in 13℃group 0.044±0.006 U/mgprot was higher than that of 22℃group 0.038±0.006 U/mgprot.Those research results would be good references for healthy culture of M.miiuy.
Miichthys miiuy;water temperature;starvation stress;antioxidant enzyme;correlation analysis
S917
A
1008-830X(2016)05-0384-06
2016-05-17
农业部公益性行业(农业)科研专项(201203065-07)
吕小康(1994-),男,浙江嵊州人,硕士研究生,研究方向:水产动物遗传育种.E-mail:lengfeng0210@126.com
楼宝.E-mail:loubao6577@163.com

