H7亚型禽流感病毒HA基因的原核表达及表达产物的反应原性分析
董斌+陈海超 杨伦 耿文学 熊晓妍 孙兴臣+李敏婕+陈闻+蒋家森
摘要:为构建新型H7亚型禽流感HA基因的原核表达载体,并在大肠杆菌中进行表达。从NCBI数据库下载H7亚型禽流感HA全基因序列,合成HA基因;定向克隆到原核表达载体pET-32a(+)的多克隆位点中,构建重组原核表达质粒pET-32a(+)-HA;转化入大肠杆菌BL21(DE3)中经IPTG诱导表达,表达产物经SDS-PAGE和Western-blot法鉴定。结果显示,重组质粒经双酶切及基因测序鉴定构建正确;重组的HA融合蛋白约为84 ku,大小与预期融合蛋白大小一致;重组HA融合蛋白可以与His标签单克隆抗体特异性结合,与H7阳性血清有较强的反应原性。成功构建了HA基因原核表达载体,并在大肠杆菌BL21(DE3)中获得重组HA融合蛋白表达。
关键词:H7N9禽流感病毒;HA基因;pET32a(+);原核表达;反应原性分析
中图分类号: S852.65文献标志码: A
文章编号:1002-1302(2016)10-0049-04
收稿日期:2015-09-01
基金项目:江苏省句容市科委项目(编号:NY2013029);江苏省镇江市农业科技支撑项目(编号:SBK2014022021);南京农业大学教改项目(编号:2013Y021);南京农业大学动物医学院教育教学改革研究项目;江苏高校优势学科建设工程资助项目。
作者简介:董斌(1990—),男,黑龙江哈尔滨人,硕士研究生,研究方向为预防兽医学。E-mail:1135220155@qq.com。
通信作者:许家荣,教授,硕士生导师,主要从事学兽医流行病学研究、畜禽传染病防治、生物制品研制。E-mail:xjr@njau.edu.cn。[HJ]
[ZK)]
H7N9型禽流感病毒感染人事件于2013年3月底在华东地区(上海和安徽2地)率先发生,感染以迅速进展的肺炎、呼吸衰竭、急性呼吸窘迫综合征(ARDS)和致死性转归为特点[1]。目前,已经在鸡、鸽子中检测到H7N9型禽流感病毒,但这些家禽不表现明显的临床症状。陈化兰团队在《科学通报》的最新研究显示,近期在我国导致人感染的新型H7N9流感病毒与同一时期存在于活禽市场上的H7N9流感病毒高度同源;该新型H7N9流感病毒是不同来源病毒的重组病毒,它的6个内部基因来源于H9N2禽流感病毒,HA基因来源于浙江鸭H7N3,NA基因来自韩国野生鸟类携带的H7N9;H7N9病毒的受体结合位点获得了部分人流感病毒特征的突变,病毒再感染人后获得了关键氨基酸位点的适应性突变,这可能与该病毒对人的感染和致死能力有关[2]。尚未证实此类病毒是否具有人传染人的特性,但已有家族式感染的报道[3],到目前已有数名患者抢救无效死亡。
禽流感病毒在生物分类学上属正黏病毒科(Orthomyxoviridae)A型流感病毒属(Influenzavirus A)[4-5]。A型流感病毒基因组为8个节段的单股负链RNA,编码11种功能蛋白。病毒基因组分节段的特性使流感病毒容易发生基因重排。A型流感病毒呈多形性,多为球形,然而新分离的主要为丝状。病毒直径80~120 nm。病毒粒子结构的最外层为来自于宿主细胞的双层类脂囊膜。囊膜上有3种蛋白突起(又称纤突):血凝素(hemagglutinin,HA)、神经氨酸酶(neuraminidase,NA)和基质蛋白2(matrixprotein,M2),这3种突起均以疏水性氨基酸锚定在类脂膜上。中间层为基质蛋白1(M1)。最里层是呈螺旋型对称的核衣壳,含有核蛋白(neucleoprotein,NP)、3种多聚蛋白酶和病毒基因组RNA[6]。迄今为止,已知A型流感病毒的HA有16个亚型(H1-H16)[7],NA有9个亚型(N1-N10),HA和NA之间的不同组合使A型流感病毒有许多亚型(如H1N1、H3N2、H5N1、H9N2等),各亚型之间无交互免疫力。其中高致病性的主要有H7和H5亚型。在A型流感病毒的8个RNA节段中,节段4编码血凝素HA。HA属于Ⅰ型膜糖蛋白,是流感病毒最重要的表面蛋白。新合成的HA在粗面内质网中进行糖基化,并在通过内质网时切除氨基端含14~18个氨基酸的信号肽。HA以同源三聚体的形式突出在囊膜表面,呈棒状,由球形的头部和颈部组成,其中球部在HA1亚单位内,包括受体结合位点和大部分的抗原位点;颈部由全部HA2和部分HA1亚单位组成。HA 是流感病毒的主要表面抗原,能诱导机体产生保护性中和抗体[8-11]。流感病毒感染后产生能针对病毒HA、NA、M和NP蛋白的抗体,但只有针对HA顶部球形区的抗体能阻止病毒吸附到宿主细胞受体上[12],从而中和病毒的感染力。这些抗体可以通过病毒中和试验或HI试验测定。
检测鸡血清样品中H7亚型抗体能有助于了解鸡群的感染情况,检测抗体可以用中和试验或血凝抑制(HI)试验来进行,但操作过程时间较长,影响因素多且比较繁琐,所以建立1种快速、易标准化、能同时检测大量样品的检测方法尤为迫切,例如胶体金、间接ELISA等。本次试验只进行到HA基因的原核表达以及反应原性的鉴定,检测方法的建立有待后续研究。
1材料与方法
1.1材料
1.1.1质粒、细胞从NCBI下载此次疫情GenBank最早发布的A/Hangzhou/1/2013(H7N9)株HA全基因序列,Gen-Bank登录号为KC853766。自行设计优化,由上海捷瑞生物技术公司合成HA基因,并将其插入质粒pET-32a(+)中,构建pET-32a(+)-HA重组质粒。实验室常备大肠杆菌BL21。
1.1.2主要材料限制性内切酶BamHⅠ和XhoⅠ、10 000 bp DNA Marker、小鼠抗6× His组氨酸单克隆抗体(mAb)、辣根过氧化物酶标记的羊抗鸡IgY均购自大连宝生物工程有限公司。商品化的丽春红染色液,增强型ECL发光液,NC膜,滤纸购自北京中杉金桥生物技术有限公司。H7阳性血清来自哈尔滨兽医研究所。
1.2方法
1.2.1HA基因序列及生物信息学分析利用DNAstar中Protean进行抗原表位分析。
1.2.2重组质粒的鉴定对上海捷瑞生物有限公司合成的重组质粒pET-32(+)-HA进行双酶切鉴定。以该合成重组质粒为模板。20 μL酶切体系:质粒8 μL(100 ng/μL),10×酶切buffer 2 μL,BamHⅠ 1 μL,XhoⅠ 1 μL,加ddH2O至 20 μL,37 ℃酶切1 h。重组质粒阳转的单菌落菌液送南京金斯瑞生物科技有限公司测序。
1.2.3感受态BL21制备在LB平板上挑取大肠杆菌BL21单个菌落接种于3.0 mL LB液体培养基中 200 r/min过夜振荡培养。次日按20 μL菌液接种至3 mL新的LB培养基中 200 r/min 振荡培养3~4 h至D600 nm=0.4,将细菌移至 1.5 mL 的灭菌离心管中,离心去上液。先加200 μL CaCl2重悬菌体,再加800 μL CaCl2(冰上进行),冰浴30 min,然后 4 ℃ 12 000 r/min 离心1 min,取上液最后用100 μL CaCl2重悬细菌,即为新鲜制备的感受态BL21。
1.2.4质粒转化感受态大肠杆菌BL21取pET32a(+)-HA重组质粒,pET32a空载体各1 μL,分别加入到新鲜制备的大肠杆菌BL21感受态细胞中,轻轻混匀,冰浴30 min,然后置于42 ℃水浴中热休克90 s,迅速置于冰中冷却5 min,加入 800 μL LB培养基,37 ℃ 180 r/min振荡培养45 min,取 100 μL 凃布于带有氨苄抗性的平板上,37 ℃培养8 h。
1.2.5重组表达菌的IPTG诱导表达[JP2]将DNA测序正确的重组质粒转化至E.coli BL21(DE3)中,同时另取空载体pET-32(+)化至E.coli BL21(DE3)作对照,涂布于LB(Amp+)培养基平板,挑取单克隆菌落接种于3 mL LB(Amp+),37 ℃ 200 r/min振荡培养6~8 h,取菌20 μL至4 mL LB(Amp+)液体培养基中,37 ℃ 200 r/min振荡培养基至D600 nm为0.8,取1 mL样品于无菌1.5 mL EP管中作为诱导前对照,向上述菌液中加入终浓度为1 mol/L的IPTG进行重组蛋白的诱导表达,并对诱导时间及温度进行优化筛选。超声裂菌器裂菌。
1.2.6SDS-PAGE分析表达产物表达产物加5×SDS蛋白上样缓冲液煮沸处理后,进行SDS-PAGE分析,选用5%浓缩胶、10%分离胶,浓缩胶80 V恒定电压,分离胶120 V恒定电压,考马斯亮蓝染色,脱色液脱色,鉴定分析融合蛋白的诱导表达。
1.2.7重组蛋白的Western-Blot鉴定表达产物经SDS-PAGE分离后,转印至NC膜上,5%脱脂奶粉封闭3 h,1 ∶[KG-*3]20 000 稀释小鼠抗6×His mAb室温3 h,4 ℃过夜,PBST洗膜3次,1 ∶[KG-*3]3 000稀释的辣根过氧化物酶标记的羊抗鼠IgG室温孵育3 h,PBST洗膜3次,增强型ECL发光液显影。以重组蛋白为抗原,以商品化H7阳性血清(哈尔滨兽医研究所)为一抗,辣根过氧化物酶标记的羊抗鸡IgG为二抗,增强型ECL发光液为显色液,以此来证明该蛋白的反应原性。
1.2.8曝光将涂布发光液的NC膜置于暗室进行曝光,将胶片置于显色液中显色,水中洗去显色液,再置于定影液中定影,待胶片透明定影结束,观察结果。
2结果与分析
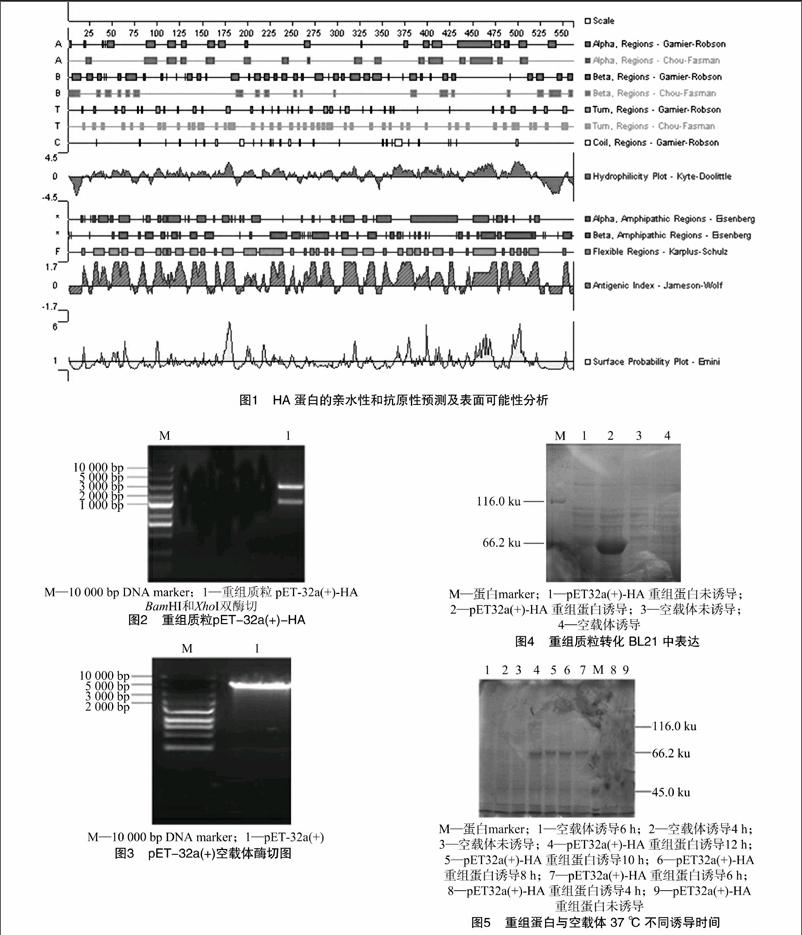
2.1HA蛋白的亲水性和抗原性预测及表面可能性分析[HT]
利用DNAStar中Protean软件分析结果(图1)显示,HA蛋白的二级结构以α螺旋和β螺旋为主,对其抗原性及表面可能性的分析结果显示,该蛋白抗原可能位点丰富,具有良好的亲水性和疏水性。
2.2重组质粒酶切鉴定
重组质粒pET-32a(+)-HA经BamHⅠ和XhoⅠ双酶切,可获得大小5 900 bp的载体片段和1 609 bp的基因片段,该片段大小与HA基因片段大小相符(图2)。以空载体酶切图(图3)作为对照,双酶切鉴定正确。DNA测序结果正确。
2.3重组质粒表达分析
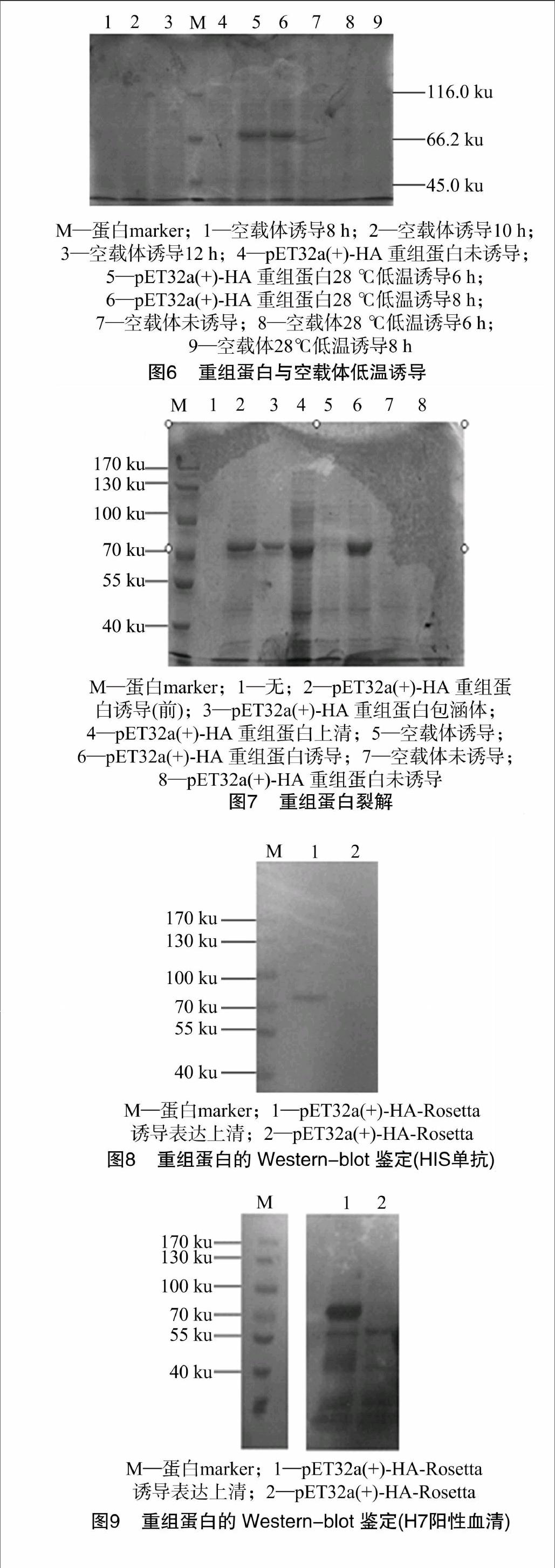
[JP2]HA蛋白约59 ku, 对含有重组表达质粒pET-32a(+)-HA的重组大肠杆菌BL21利用IPTG诱导表达,表达出HA-His融合蛋白,融合蛋白含有25 ku的His标签蛋白(图4);对蛋白表达条件优化后表明,HA-His蛋白在28 ℃下1.0 mol/L IPTG[CM(19]诱导8[KG*3]h表达量最大,融合蛋白大小约为[CM)][FL)]
84 ku (图5、图6);重组表达蛋白在包涵体和上清中都存在,在上清中表达量较高(图7)。
2.4重组融合蛋白Western-Blot 鉴定
分别采用His标签抗体和H7阳性血清对HA-His融合蛋白进行检测,结果如图8、图9所示,同种抗体均能在分量约为84 ku处检测到特异性条带,说明融合蛋白能够特异性表达,与预期结果一致。
3讨论
[CM(24]本研究通过原核表达系统表达H7亚型禽流感病毒的HA抗原,从上述SDS-PAGE、Western blot的检测结果可以得知,HA蛋白获得表达并与H7阳性血清产生良好的反应原性,重组蛋白在包涵体和上清中都存在,且上清中较多。总结本次试验,HA蛋白的二级结构以α螺旋和β螺旋为主,对其抗原性及表面可能性的分析结果显示,该蛋白抗原可能位点丰[CM(25]富,该蛋白具有良好的亲水性和疏水性。根据目的基因序列预测蛋白的大小应该为84 ku,在SDS-PAGE鉴定中显示目的蛋白条带出现在66.2~116 ku,符合预测结果,且发现低温诱导表达量大于37 ℃诱导表达量,在低温诱导时,诱导6 h与 8 h 表达量变化不大,在37 ℃诱导时,诱导4、6、8 h,表达量有明显梯度增加,时间再延长表达量变化不大。分别采用His标签抗体和H7阳性血清对HA-His融合蛋白进行检测,同种抗体均能在分子量约为84 ku处检测到特异性条带,说明融合蛋白能够特异性表达,并与H7阳性血清产生良好反应性。本研究只进行到HA基因的原核表达以及反应原性的鉴定,建立1种快速、易标准化、能同时检测大量样品的检测方法有待后续研究。
参考文献:
[1]Gao R,Cao B,Hu Y,et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. The New England Journal of Medicine,2013,368(20):1888-1897.
[2]Shi J Z,Deng G H,Liu P H,et al. Isolation and characterization of H7N9 viruses from live poultry markets—Implication of the source of current H7N9 infection in humans[J]. Chinese Science Bulletin,2013,58(16):1857-1863.
[3]Li Q,Zhou L,Zhou M,et al. Preliminary report:epidemiology of the avian influenza A (H7N9) outbreak in China[J]. New England Journal of Medicine,2013,370(6):1668-1677.
[4]黄欣梅,李银,刘宇卓,等. 华东地区H9N2亚型禽流感病毒基因的遗传演化分析[J]. 江苏农业学报,2015,31(2):382-388.
[5]唐应华,陆吉虎,吴培培,等. 免疫增强剂对禽流感疫苗免疫持续期、安全性和鸡淋巴细胞转化的影响[J]. 江苏农业学报,2014,30(4):821-825.
[6]陆承平. 兽医微生物学[M]. 北京:中国农业出版社,2007.
[7]Fouchier R M,Munster V,Wallensten A,et al. Characterization of a novel influenza A virus hemagglutinin subtype(H16)obtained from black-headed gulls[J]. Journal of Virology,2005,79(5):2814-2822.
[8]Caton A J,Brownlee G G,Yewdell J W,et al. The antigenic structure of the influenza virus A/PR/8/34 hemagglutinin (H1 subtype)[J]. Cell,1982,31(2 Pt 1):417-427.
[9]Wiley D C,Wilson I A,Skehel J J. Structural identification of the antibody-binding sites of Hong Kong influenza haemagglutinin and their involvement in antigenic variation[J]. Nature,1981,289(5796):373-378.[ZK)]
[10]Winter G,Fields S,Brownlee G G. Nucleotide sequence of the haemagglutinin gene of a human influenza virus H1 subtype[J]. Nature,1981,292(5818):72-75.
[11]Raymond F L,Caton A J,Cox N J,et al. The antigenicity and evolution of influenza H1 haemagglutinin,from 1950—1957 and 1977—1983:two pathways from one gene[J]. Virology,1986,148(2):275-287.
[12]Wiley D C,Skehel J J. The structure and function of the hemagglutinin membrane glycoprotein of influenza virus[J]. Annual Review of Biochemistry,1987,56(1):365-394.

