盐单胞菌Fosmid文库构建及群体感应淬灭酶的筛选
薛鹏飞++柳鹏福++史吉平++李丽霞

doi:10.15889/j.issn.1002-1302.2016.10.020
摘要:通过构建盐单胞菌Fosmid基因组文库,以求筛选到群体感应淬灭酶(AHL降解酶)。采用改良的SDS-CTAB法提取1株盐单胞菌基因组DNA,经平末端连接、包装和转染后,成功构建盐单胞菌Fosmid基因组文库。该文库库容1 700个克隆,平均插入片段约35 kb,共包含约60 Mb的DNA容量,覆盖该菌基因组10倍以上。然后以加 X-gal的MM基本培养基筛选AHL降解酶阳性克隆,对文库进行功能驱动的蓝白斑筛选。通过初筛,筛选到3个Fosmid阳性克隆,证实了所构建的Fosmid基因组文库能够应用于AHL降解酶的活性筛选。同时该Fosmid文库亦可进一步用于其他功能基因的开发。
关键词:盐单胞菌;Fosmid基因组文库;蓝白斑筛选;群体感应淬灭酶
中图分类号: Q785文献标志码: A文章编号:1002-1302(2016)10-0088-04
收稿日期:2015-10-11
基金项目:国家自然科学基金(编号:41306142)。
作者简介:薛鹏飞(1991—),男,河北南和人,硕士研究生,从事海洋环境中群体感应淬灭酶资源发掘及酶学性质相关研究。E-mail:xpflying@yeah.net。
通信作者:李丽霞,副教授,主要从事植物逆境生理与分子生物学、植物蛋白质组学和海洋藻类生态毒理学等研究。植物的细菌性病害是威胁农业生产的主要自然灾害之一。病害的发生往往造成作物大面积减产,并在农产品贮藏、加工、运输过程中进一步造成更大危害,带来巨大损失。目前主要采用化学药物来防治细菌性病害。这些化学药物的使用显著减轻了病害的危害程度,减少了经济损失,但也带来了环境污染、细菌耐药性增加及化学药物残留等诸多问题。近年来,随着对环保意识的提高,人们越来越崇尚自然健康的生活方式,对植物病害的防治也提出了更高的要求,生物防治日益受到重视。
很多植物病原菌的致病性受一种被称为群体感应(quorum sensing,QS)系统的机制调控 [1]。很多病原菌的致病能力受群体感应系统调控[2-4],也能被群体淬灭(quorum quenching,QQ)机制干扰和减弱。以细菌群体感应系统为靶标的群体淬灭已被证明是防治这一类细菌性病害的有效策略。具有群体淬灭功能的信号分子降解酶能水解信号分子,进而干扰致病基因的表达,起到防治病害的作用[5]。2000年,Dong等筛选到1株能特异性降解AHL类信号分子的芽孢杆菌(Bacillus sp.)240B1,并从中分离到aiiA基因,将其转入致病菌胡萝卜软腐欧文氏菌(Erwinia carotovora)SCG1后,显著减少了后者AHL类信号分子的产生,降低了其对马铃薯、胡萝卜等的致病性。将该基因转入烟草、马铃薯后,这些植物对胡萝卜软腐欧文氏菌SCG1导致的软腐病抗性大大增强[6]。从第1个内酯酶AiiA被发现至今,已有约20种内酯酶基因得到了克隆与鉴定。筛选有实际应用价值的高活性信号降解酶是目前生物防治领域的研究热点之一。
目前,稳定的大片段基因组文库可以作为研究基因组学及功能基因的重要材料[7]。Fosmid 载体是现在流行的用于替代Cosmid载体构建大片段文库的新载体。与BAC文库构建相比,Fosmid文库的构建更简单、快速,可利用其进行全基因组物理图谱构建、研究基因功能和表达调控、重要性状基因的图位克隆和基因结构及功能分析等。Fosmid文库中重组载体在宿主菌中以单拷贝形式存在,稳定性好,需要时可诱导达到高拷贝;且其随机性好,保证了每段DNA在文库中出现的频率均等。近年来,Fosmid文库已被广泛应用于基因图位克隆、物理图谱的构建、比较基因组及功能基因的筛选与研究。
本实验室分离了大量细菌,并从中筛选出一系列具有信号分子降解活性的细菌,鉴定后发现其中有1株盐单胞菌1A01339(Halomonas salaria)首次被发现具有信号降解的活性。本研究对该菌株构建合格的Fosmid基因组文库。利用实验室构建的高通量筛选平台,通过功能驱动的蓝白斑筛选得到Fosmid阳性克隆,以期为后续分离纯化该群体感应淬灭酶及深入研究其酶学性质和催化机制奠定基础。同时该文库可用于其他功能基因的开发与研究。
1材料与方法
1.1材料
1.1.1菌株来源盐单胞菌1A01339(Halomonas salaria)购自于中国海洋微生物菌种保藏管理中心,经鉴定具有群体感应淬灭活性;根癌农杆菌NTI(traR;tra::lacZ749)由本实验室保存。
1.1.2主要试剂和仪器溶菌酶、蛋白酶K、Not Ⅰ购自Thermo Scientific公司;λ/Hind Ⅲ Digest DNA Marker低熔点琼脂糖酶β-Agarase购自于TaKaRa公司;文库构建试剂盒Copy Control Fosmid Library Production Kit、大肠杆菌EPI300-T1购自Epicentre公司;小剂量质粒提取试剂盒购自于Axygen公司;X-gal、IPTG、OOHL(3-oxo-C8-HSL)购自Sigma公司;核酸电泳仪、紫外凝胶成像分析系统(Bio-RAD);各型规格移液器、小型离心机(Eppenendorf);恒温培养箱 (上海智城分析仪器);纯水制备系统(Milipore)。
1.1.3主要培养基高盐LB培养基:含3%质量浓度NaCl的LB培养基;筛选培养基:加有20 mg/mL X-gal的1.5%质量浓度琼脂固体MM基本培养基,所用抗生素终浓度为卡那霉素50 μg/mL。
1.2盐单胞菌Fosmid文库的构建及鉴定
1.2.1盐单胞菌基因组DNA的提取(改良SDS-CTAB法)为了能顺利获得较为完整的盐单胞菌基因组,本研究采用改良的SDS-CTAB法提取。具体操作步骤如下:挑取盐单胞菌1A01339接种于50 mL高盐LB液体培养基中,37 ℃过夜振荡培养;取1.5 mL上述菌液于2 mL离心管中,8 000 r/min离心3 min,弃去上清;菌体洗涤2次,5 000 r/min离心5 min,弃去上清;加入564 μL的TE重置悬浮,然后加入约10 μg溶菌酶,轻轻混匀,37 ℃温育1 h;再加入50 μL 10% SDS和 3 μL 蛋白酶K(10 mg/mL),轻轻混匀,37 ℃温育2 h;加入100 μL 5 mol/L NaCl,混合均匀,65 ℃反应2 min;加入80 μL CTAB-NaCl,混合均匀,65 ℃反应10 min;加入等体积的氯仿-异戊醇(24 ∶1),振荡均匀,9 000 r/min离心10 min;上清移至另一离心管中加入等体积的酚-氯仿-异戊醇(25 ∶24 ∶1),轻轻混匀,10 000 r/min离心10 min;上清移至另一离心管加入0.6倍体积异丙醇(贴壁加入),轻轻颠倒混匀,静置10 min,9 000 r/min 离心5 min;弃上清,用70%乙醇洗涤2次,10 000 r/min 离心5 min;离心管倒立于铺开的纸巾上,数分钟后,直立离心管,干燥DNA;干燥DNA溶于 50 μL TE中。-20 ℃保存。
1.2.2基因组Fosmid文库的构建研究依照Copy Control Fosmid Library Production Kit说明构建Fosmid文库。因为构建Fosmid基因组文库所需要的最合适的DNA大小范围为 30~40 kb,所以需将将大片段的高质量基因组DNA随机剪切成大小均匀的片段(控制在25~40 kb之间)。为保证对基因组DNA处理的随机性,本研究未使用限制性内切酶进行处理。采用200 μL小孔径Tip反复吹吸50、100、150、200、250次,通过调整吹吸次数来获得最合适的DNA片段。电压 30~35 V电泳过夜,检测随机剪切程度,切下30~40 kb相应区间片段,用低熔点琼脂糖酶 β-Agarase对DNA片段进行消化回收。利用End-Repair Enzyme将DNA片段进行平末端处理和5′磷酸化修饰。利用连接酶Fast-Link DNA Ligase将获得的DNA片段连接于Fosmid黏粒载体上。连接液用噬菌体蛋白λ Packaging Extracts包装,加入氯仿轻柔混匀,包装液经梯度稀释后侵染宿主EPI300-T1感受态细胞,确定合适的稀释比例。以经过适当稀释的包装液侵染宿主EPI300-T1感受态细胞,37 ℃孵育1 h。最后将包装完成的菌液涂布于含12.5 μg/ mL氯霉素的LB琼脂平板培养基上37 ℃培养过夜,构建成Fosmid基因组文库。
1.2.3文库重组克隆子的鉴定插入片段大小鉴定:在平板上随机挑取14个克隆子培养并根据Fosmid文库构建说明加入多拷贝诱导液对其进行诱导培养,使其获得高拷贝数质粒。采用Axygen质粒提取试剂盒提取质粒,Not Ⅰ酶切,如上条件进行低电压普通电泳,检测插入片段的大小分布情况,鉴定Fosmid文库质量。克隆稳定性检测:随机挑取5个克隆,分别接种于3 mL含氯霉素的LB液体培养基中继代培养5 d,分别提取第50代(培养3 d)和第100代(培养5 d)菌液中的质粒,Not Ⅰ酶切后,电泳检测。
1.2.4Fosmid文库保存(1)短期保存:Fosmid文库克隆在平板上培养后可暂时保存1~2个月。(2)长期保存:用无菌牙签挑取转化平板上的单菌落于96孔培养板中,每个菌落1个孔格,每孔加入含氯霉素的 12.5 mg/L 液体培养基,用封口膜密封,37 ℃恒温箱箱中培养过夜。加入终浓度为10%的甘油,保存于-80 ℃。
1.3群体感应淬灭酶阳性克隆的筛选
本研究采用根癌农杆菌NTI(traR,tra::lacZ749)对文库进行筛选。将文库单克隆接种于96孔培养板中,37 ℃培养过夜。再加至终浓度为0.1 mmol/L的IPTG,30 ℃进行诱导培养。取诱导培养5 h菌液与等体积2 μmol/L OOHL(3-oxo-C8-HSL)混合并反应2 h作为待测样品(本研究以OOHL作为AHL分子标准品进行检测)。以加有X-gal的MM琼脂固体培养基为生测培养基,用无菌小刀将培养基琼脂切成间隔的细条状,在细条的上端加入待测的样品,在样品的下面连续点接农杆菌NTI,28 ℃培养24 h后观察并记录试验结果。当样品中存在AHL分子时,随着分子在培养基内不断向下扩散,激活生测菌株中lacZ基因的表达,可使菌落呈现蓝色; AHL分子浓度越大,扩散距离越远,就有越多的指示菌变蓝。通过观察变蓝的数量就可判断AHL分子的浓度。本研究分别以OOHL分子与无菌水作为阳性对照与阴性对照,通过指示菌变色程度筛选阳性克隆。
2结果与分析
2.1盐单胞菌基因组DNA的提取
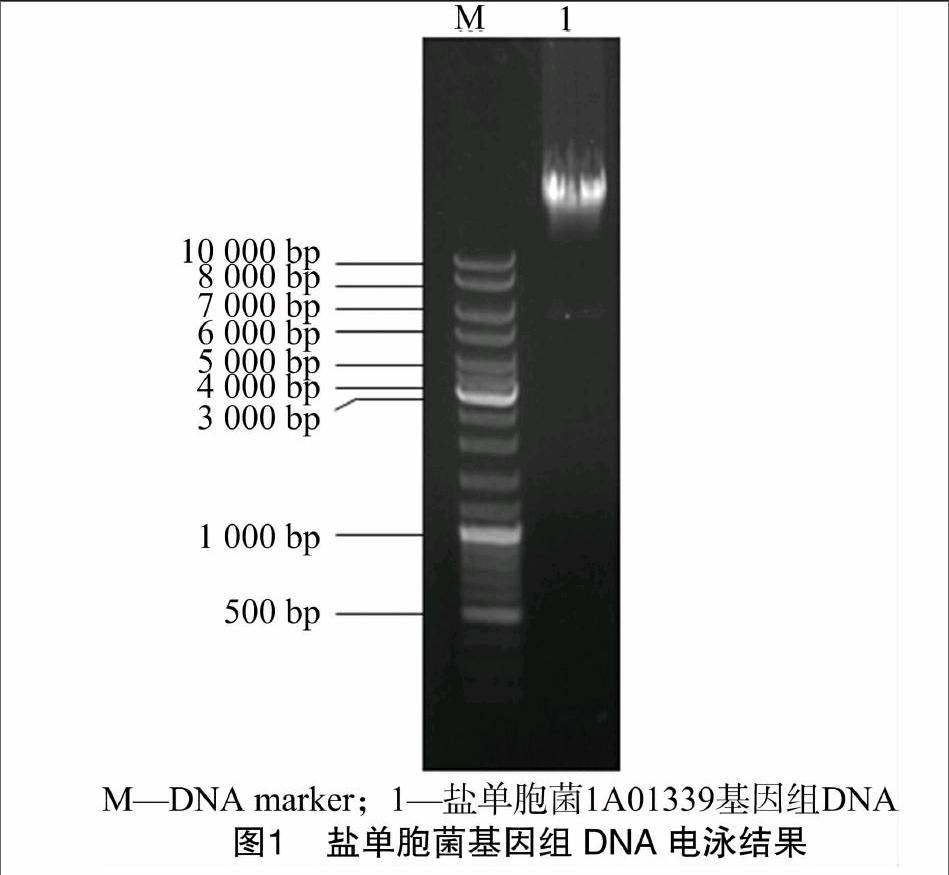
本研究中盐单胞菌1A01339基因组DNA提取采用改良的CTAB-NaCl法提取后进行琼脂糖凝胶电泳,结果见图1。高质量的基因组DNA为后续构建Fosmid文库提供良好的样品。
2.2Fosmid文库构建质量鉴定与评价
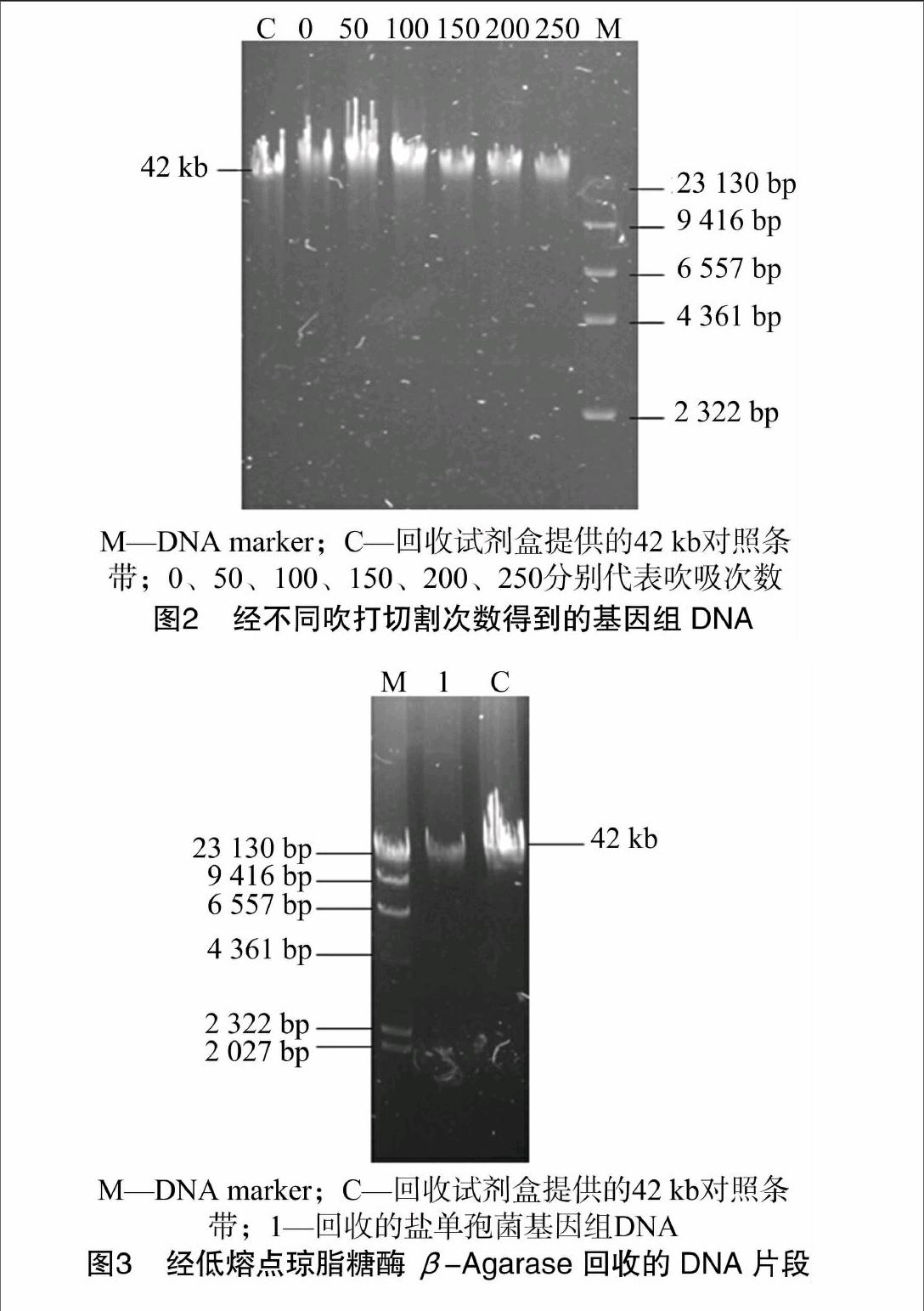
由于构建Fosmid文库需要将大片段的高质量基因组DNA剪切成大小均匀的片段(30~40 kb),而本试验提取的盐单胞菌基因组DNA片段完整,因此要对DNA进行剪切。电压30~35 V电泳过夜,电泳检测结果见图2,可确定经250次剪切效果最佳。故以经250次剪切的基因组DNA为材料,采用低熔点琼脂糖酶β-Agarase对DNA片段进行消化回收。经电泳检测(图3),发现回收片段介于23~42 kb之间,符合建库要求,可以用于构建Fosmid文库。
本试验共获得约1 700个克隆。随机挑取14个克隆分析插入片段的大小。Not Ⅰ酶切片段进行低电压普通琼脂糖凝胶电泳。从图4可以看到,14个阳性菌落的酶切产物中均有1条同样大小的条带,此条带极为pCC1FOS载体(8.1 kb)。克隆子中插入最长片段约为42 kb,最短片段约为25 kb;将所有片段进行统计得到插入片段平均长度为35 kb,插入率为100%。克隆片段总库容达到60 Mb,假设该盐单胞菌基因组以4.5 Mb为计,则整个文库包含的DNA量超过该菌基因组的10倍,且克隆质粒酶切带型多态性较强,说明了文库克隆的随机性大。
通过克隆的稳定性检测发现第100代酶切图谱与第0代无任何明显差异,未发现插入片段的丢失或重排,说明所构建的Fosmid文库是稳定的。高质量的Fosmid文库提供了后续功能筛选阳性克隆的基础。
2.3群体感应淬灭酶阳性克隆筛选
研究表明,对基因文库进行活性筛选要比序列筛选容易获得更新型的基因[7]。因此,从Fosmid文库中挑取克隆子,利用功能驱动的蓝白斑筛选AHL降解酶,并以此验证活性筛选Fosmid文库中生物催化剂的可行性。
常规研究多采用以β-葡萄糖苷酶为报告系统的基因重组菌株根癌农杆菌NTI(traR,tra::lacZ749)筛选产AHL降解酶的菌株,其原理为:根癌农杆菌NTI中含有编码受体蛋白TraR的traR基因和由tra启动子控制表达的β-半乳糖甘酶基因tra::lacZ749,同时自身缺失traI基因,不能合成AHL信号分子。当外源的AHL信号分子被加入时,traR基因表达的蛋白TraR 与AHL分子结合后可激活lacZ基因的表达,产生β-半乳糖甘酶从而使加有X-gal的平板培养基显蓝色。通过前期筛选工作,已确定该株盐单胞菌1A01339具有群体感应淬灭活性(图5)。
本研究对构建的Fosmid文库进行高通量活性初筛,共获得3个有活性的阳性克隆:10B4、11G10和23A3(图6)。经后续验证,这些Fosmid克隆均具有AHL降解酶活性,可为分离鉴定该菌株的群体感应淬灭酶开展后续研究。
3讨论
基因组文库是上世纪70年代末发展起来的一种研究基因组特性、分离新基因的技术手段,它包含了基因组的全套遗传信息,人们可用相应的基因探针从文库中调取出任一特定的基因片段加以研究。通过构建基因组文库,再结合功能性筛选的方法,大量基因信息被发现。目前大部分研究倾向于
构建小片段质粒文库,但与小片段文库相比,大片段文库如Fosmid文库有明显的优点,因其插入片段长度较长(30~ 40 kb),单个克隆可涵盖完整代谢途径的多基因簇,可能更有利于基因及其周围信息的发现,因而广泛应用于对生物活性物质功能性筛选的研究中[9],但用该方法筛选AHL降解酶基因的报道尚少见。因而,考虑到Fosmid文库片段长度和容量上的优势,应用Fosmid文库的方法可能利于群体感应淬灭酶的筛选和鉴定。
2000年,Dong等鉴定了2类分解AHL群体感应信号的水解酶——AHL内酯酶和酰胺酶,并发现将该类基因转入植物病原菌胡萝卜软腐欧文氏菌后,减弱了各种试验植物软腐病的症状,从而首次提出群体淬灭生物防治的新概念[6]。这些研究的主要成果发表在《Nature》和《PNAS》等权威学术刊物上,开辟了群体淬灭这一新的研究领域[10-12]。自此以后,世界各国很多学者都开展了筛选分离AHL信号分子降解酶的工作,并发现了一系列AHL降解酶[13]。
本研究通过Fosmid文库构建并成功筛选到具有群体感应淬灭活性的阳性克隆。利用改良的SDS-CTAB法提取1株盐单胞菌基因组DNA,并采用Epicentre公司的文库构建试剂盒成功构建了盐单胞菌高质量的Fosmid基因组文库,并通过功能驱动的蓝白斑筛选群体感应淬灭酶,最后成功获得3个Fosmid阳性克隆子。表明构建的Fosmid文库能够用于AHL降解酶的活性筛选,为后续开展分离鉴定该菌株的群体感应淬灭酶奠定了基础。同时所构建的盐单胞菌Fosmid文库亦可进一步用于其他功能基因的开发。
参考文献:
[1]Fuqua W C,Winans SC,Greenberg E P. Quorum sensing in bacteria:the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. J Bacteriol,1994,176(2):269-275.
[2]Miller M B,Bonnie B L. Quorum sensing in bacteria[J]. Annu Rev Microbiol,2001,55:165-199.
[3]Minna P,Diana F,Rillkka H,et al. A small diffusible signal molecule is responsible for the global control of virulence and exoenzyme production in the plant pathogen Erwinia carotovora[J]. Embo Journal,1993,12(6):2467-2476.
[4]Ravi K,Sanjay C,Kusum H. Quorum sensing is necessary for the virulence of Pseudomonas aeruginosa during urinary tract infection[J]. Kidney Int,2009,76(3):286-292.
[5]Dong Y H,Zhang L H.Quorum sensing and quorum-quenching enzymes[J]. J Microbiol,2005,43(1):101-109.
[6]Dong Y H,Xu J L,Li X Z,et al. AiiA,an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora[J]. PNAS,2000,97(7):3526-3531.
[7]李丽娟,蔡晶,张石来,等. 长雄野生稻(Oryza longistaminata)全基因组Fosmid文库构建[J]. 分子植物育种,2012,10(4):457-461.
[8]Schmeisser C,Steele H,Streit W R. Metagenomics,biotechnology with non-culturable microbes [J]. Applied Microbiology & Biotechnology,2007,75(5):955-962.
[9]赵志祥,芦小飞,陈国华,等. 温室黄瓜根结线虫发生地土壤微生物宏基因组文库的构建及其一个杀线虫蛋白酶基因的筛选[J]. 微生物学报,2010,50(8):1072-1079.
[10]Dong Y H,Wang L H,Xu J L,et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase [J]. Nature,2001,411(6839):813-817.
[11]Lin Y H,Xu J L,Wang L H,et al. Acyl-homoserine lactone acylase from Ralstonia strain XJ12B represents a novel and potent class of quorum-quenching enzymes[J]. Mol Microbiol,2003,47(3):849-860.
[12]Zhang L H,Dong Y H. Quorum sensing and signal interference:diverse implications [J]. Mol Microbiol,2004,53(6):1563-1571.
[13]Czajkowski R,Jafra S. Quenching of acyl-homoserine lactone-dependent quorum sensing by enzymatic disruption of signal molecules[J]. Acta Biochim Pol,2009,56(1):1-16.龚瑞玥,方春林,万正义,等. 基于SRAP分子标记的黄颡鱼属遗传多样性分析[J]. 江苏农业科学,2016,44(10):92-95.

