洋葱不同组织RNA提取方法比较分析
张仕林++许玉超++帅强++邓鹏+++王建军
doi:10.15889/j.issn.1002-1302.2016.10.022
摘要:探讨洋葱不同组织总RNA提取的最优方法,以期为今后开展洋葱的分子生物学研究奠定基础。以洋葱品种W470发育旺盛时期的叶片、根、鳞茎为材料,比较TaKaRa试剂盒法、TIANGEN试剂盒法、TRIzol法、pBIOZOL法等4种RNA提取方法提取洋葱RNA的效果。凝胶电泳结果显示,除了TIANGEN试剂盒法不能提取洋葱根的总RNA,其他方法在洋葱不同组织中均可提取到不同质量的RNA。对不同方法提取洋葱RNA浓度、纯度进行检测发现,TaKaRa试剂盒法提取洋葱叶片的总RNA浓度为342.31 μg/g,pBiozol法提取洋葱鳞茎、根的总RNA浓度分别为 1 119.39、171.85 μg/mL。经RT-PCR验证,TaKaRa试剂盒法提取的洋葱叶片总RNA、pBIozol法提取洋葱鳞茎、根的总RNA均成功扩出洋葱β-actin基因片段。由结果可知,TaKaRa试剂盒适合提取洋葱叶片的总RNA,pBIOZOL法适合提取洋葱鳞茎、根的总RNA且质量能够满足后续试验要求。
关键词:洋葱;总RNA;RNA提取;RT-PCR
中图分类号:S633.201 文献标志码:A文章编号:1002-1302(2016)10-0095-03
收稿日期:2015-09-11
基金项目:国家公益性行业(农业)科研专项(编号:200903018)。
作者简介:张仕林(1989—),男,四川广元人,硕士研究生,研究方向为洋葱遗传育种与分子生物学。E-mail:709744424@qq.com。
通信作者:王建军,硕士,副教授,主要从事洋葱遗传育种研究。E-mail:wangjianjun@njau.edu.cn。洋葱(Allium cepa L.)为百合科葱属2年生蔬菜,在我国已广泛栽培,并作为主要的出口蔬菜品种之一[1]。洋葱不仅可以作为蔬菜和调味品,而且因其糖类、硫化物含量丰富,从而具有降“三高”、降低和预防血栓形成风险以及预防心肌梗塞等功效。此外,洋葱还含有特殊的营养物质槲皮素,能抑制癌细胞活性、阻止癌细胞生长、预防癌症[2]。
RNA是一种重要的遗传信息分子,提取高质量RNA是进行定量PCR、RT-PCR、 Northern杂交和cDNA文库构建等相关研究的前提条件[3-5]。目前有许多提取植物RNA的方法,例如CTAB法、SDS法、Trizol法等,但针对洋葱不同组织的RNA提取研究却鲜有报道。黄钰等对分蘖洋葱叶片RNA提取方法进行比较和分析[3,6]。由于洋葱各种组织,尤其是叶片、鳞茎中含有丰富的多糖等次生代谢物,而且多糖会抑制酶的活性[7],导致洋葱高质量RNA的提取受到制约。此外,由于洋葱不同组织内含物成分不尽相同,在具体操作过程中对RNA提取方法的要求也不一样。本试验通过对TaKaRa试剂盒法、TIANGEN试剂盒法、Trizol法以及pBIOZOL法等4种RNA提取方法的比较研究,建立1套适于洋葱根、鳞茎、叶片材料的RNA提取方法,对于下一步开展洋葱相关功能基因组学和分子生物学研究具有一定意义,同时也为从葱属植物中提取高质量的RNA提供参考。
1材料与方法
1.1试验材料
于2015年3月25日选取洋葱品种W470新鲜幼嫩的根、鳞茎、叶片,用蒸馏水冲洗干净后,用液氮速冻后带回实验室保存在-70 ℃冰箱,备用。试验材料由南京农业大学洋葱课题组提供,样本取自南京农业大学江浦园艺站。
主要试剂:TaKaRa试剂盒、反转录试剂盒,宝生物工程(大连)有限公司;TIANGEN试剂盒,Tiangen Biotech公司;TRIzol试剂盒,Invitrogen公司;pBIOZOL试剂盒,Solarbio公司。试验所用引物由南京金斯瑞生物科技有限公司合成,其他生化试剂均为进口及国产分析纯产品。
1.2RNA提取方法
试验所需塑料制品如Eppendorf管、吸头、PCR管等均于37 ℃用0.1%DEPC水处理24 h后,于121 ℃高压蒸汽灭菌20 min,80 ℃烘干后备用。玻璃器皿、研钵于200 ℃干热灭菌2 h。每种洋葱组织均使用以下4种方法提取总RNA,并做3次重复。
1.2.1TaKaRa试剂盒法称取50 mg洋葱组织,参照 TaKaRa 试剂盒使用手册中提取富含多糖类组织的方法提取RNA。
1.2.2TIANGEN试剂盒法称取100 mg洋葱组织,参照TIANGEN试剂盒使用手册中提取富含多糖类组织的方法提取RNA。
1.2.3TRIzol法称取各洋葱组织100 mg,经液氮研磨后,参照试剂盒说明的方法提取并增加2次三氯甲烷-异戊醇(体积比24 ∶1)抽提,以去除蛋白质、多糖、多酚等大分子物质;用异丙醇沉淀RNA,于-20 ℃沉淀60 min。
1.2.4pBIOZOL法具体方法如下:称取100 mg洋葱组织,液氮下迅速将其研磨成粉末,将粉末转入1.5 mL离心管中,加1.3 mL裂解液,短暂漩涡混匀,至样品完全重悬,室温放置5 min(可将离心管水平放置,以增大裂解液与细胞接触的表面积,有助于细胞破壁)。室温下于12 000 g离心10 min,转移上层液体至新的1.5 mL离心管中,加入100 μL 5 mol/L NaCl,混匀后加入300 μL三氯甲烷,剧烈振荡以充分混匀,4 ℃、12 000 g离心10 min,上层液全部转入1.5 mL离心管中,用水饱和酚-三氯甲烷(体积比5 ∶1)、三氯甲烷-异戊醇(体积比24 ∶1)分别抽提1次,直至中间层较干净,加入 2/3 体积异丙醇、1/3体积高盐溶液,颠倒混匀,-20 ℃放置 1 h。4 ℃、12 000 g离心10 min,弃上清,加入1.0 mL 75%乙醇,静置3 min,其间颠倒洗涤,4 ℃、12 000 g离心3 min,弃掉液体,吸干残留的乙醇,将沉淀置于超净工作台上吹干,用 30 μL RNase-free 水溶解RNA沉淀。
1.3总RNA的完整性及质量检测
取4 μL RNA样品在1.2%琼脂糖凝胶上进行电泳检测,120 V 稳压,待溴酚蓝到达胶面1/2位置时,用紫外凝胶呈像系统拍照记录。
采用Eppendorf核酸蛋白测定仪对纯化好的RNA样品进行浓度及吸光度测定,分别记录D260 nm/D280 nm值、RNA浓度,并计算RNA产率。RNA产率(μg/g)=RNA浓度(μg/mL)×体积(mL)/样品质量(g)[8]。
1.4RT-PCR检测
取1 μg RNA用于反转录,具体方法参照TaKaRa Primer ScriptTM First Stand cDNA Synthesis Kit反转录说明书进行。以洋葱β-actin基因(引物为5′-ACACGGCCTGGATAGCAACAT-3′、5′-AGAGCAGTATTCCCAAGCATT-3′)为内参基因[8]。PCR扩增反应体系 (10 μL):5 μL Premix Taq酶(TaKaRa),各0.5 μL 10 μmol/L上、下游引物,0.5 μL 10 ng/μL cDNA,3.5μL ddH2O。PCR反应热循环程序:95 ℃ 4 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,35次循环;72 ℃ 10 min;4 ℃条件保存。PCR产物在1.5%琼脂糖凝胶上进行电泳检测,预期扩增产物大小为337 bp。
2结果与分析
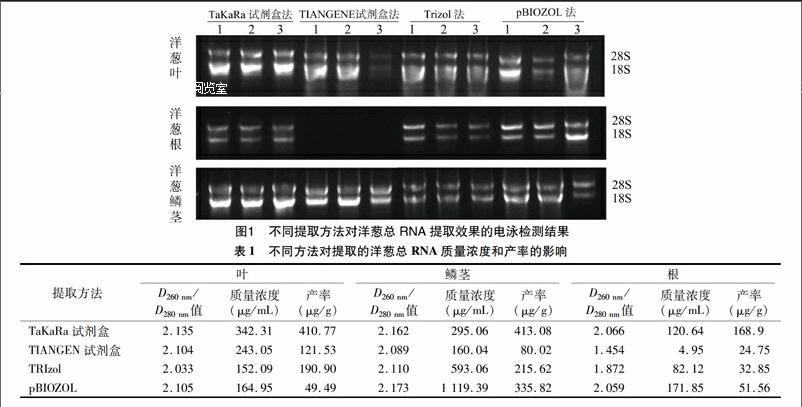
2.1不同方法提取的洋葱RNA的凝胶电泳分析
以洋葱根、鳞茎、叶片为试验材料提取总RNA,由图1可见,经琼脂糖凝胶电泳检测,除了TIANGEN试剂盒不能提取洋葱根的总RNA,其他方法在洋葱不同组织处均可提取到不同质量的RNA。对于洋葱叶来说,用TIANGEN试剂盒法、Trizol 法、pBIOZOL法所提取的RNA在28S rRNA、18S rRNA条带处较暗,2条条带的亮度相当,且有拖尾,说明RNA有降解,存在蛋白质、多糖等杂质污染;TaKaRa试剂盒所提总RNA较完整,且条带清晰。对于洋葱根来说,TRIzol法、TaKaRa试剂盒法所提取的RNA在28S rRNA、18S rRNA条带处较暗,pBIOZOL法所提总RNA较完整,且条带清晰。对于洋葱鳞茎来说,TaKaRa试剂盒与TIANGEN试剂盒所提取的RNA18S rRNA比28S rRNA更亮,说明提取过程中发生降解和多糖污染;Trizol法条带弱,浓度低;pBIOZOL法无拖尾现象,RNA完整性好,纯度高。通过对比得出,TaKaRa试剂盒法适合洋葱叶片,pBIOZOL法适合洋葱鳞茎和根总RNA的提取。
2.2不同方法提取洋葱RNA质量浓度和纯度的检测
由表1可知,用TaKaRa试剂盒提取的洋葱叶、鳞茎、根总RNA质量浓度分别为342.31、295.06、120.64 μg/mL,D260 nm/D280 nm值均较大,表明有一定程度降解。TIANGEN试剂盒法提取的洋葱叶、鳞茎、根总RNA质量浓度分别为24305、160.04、4.95 μg/mL,其中由于鳞茎、根总RNA的浓度太低,不能用于后续试验。在所有提取洋葱叶组织总RNA的方法中,TaKaRa试剂盒法最高,为 342.31 μg/mL。pBIOZOL法提取洋葱鳞茎、根组织总RNA的质量浓度分别为 1 119.39、171.85 μg/mL。纯度高、完整性好的RNA是进行后续分子生物分析的基础[9]。通过对各种参数进行比较后表明,TaKaRa试剂盒最适合提取洋葱叶片总RNA;pBIOZOL法适合提取洋葱鳞茎、根的总RNA。
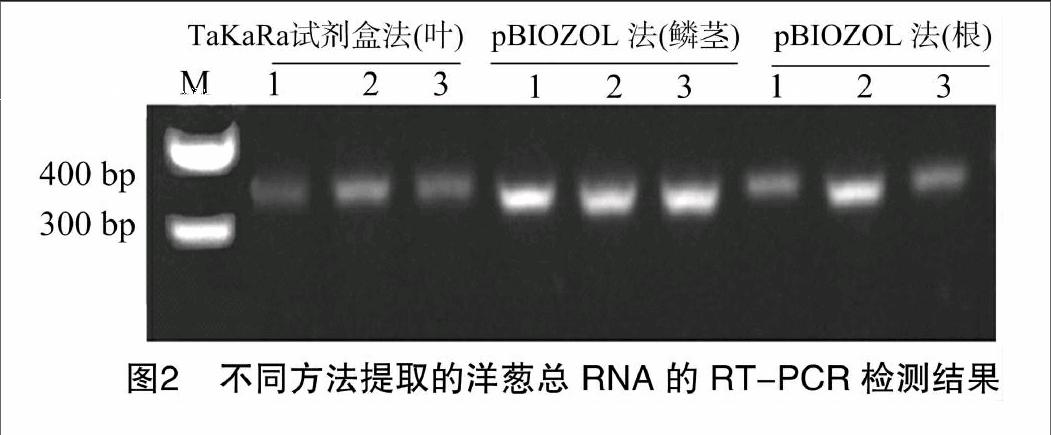
2.3RT-PCR检测mRNA的质量
将TaKaRa试剂盒提取的洋葱叶组织RNA、pBIOZOL法提取的洋葱鳞茎和根总RNA经反转录后,进行RT-PCR,以验证所提RNA能否满足后续试验要求。PCR产物电泳结果表明,2种提取方法对于洋葱不同组织提取的RNA能够满足后续分子试验对样品品质的需求详见图2。
3讨论与结论
不同的植物RNA提取方法各有优缺点,同一种提取方法在不同植物或同种植物不同组织上的可利用性也有差异[10]。传统提取RNA的方法有CATB法、SDS法等,这些方法对微生物和动物组织的RNA提取效果良好,但是操作较为繁琐且耗时长,同时对含有多糖类、酚类物质的高等植物效果不明显,因此本研究未予以考虑。洋葱各种组织,尤其是叶片、鳞茎中含有丰富的多糖及各类次生代谢物,由于相似的理化性质,很难将多糖与RNA分开,导致RNA质量差、易降解,最终会使反转录PCR反应受到抑制[11-12]。因此,去除多糖、次生代谢物质对于洋葱总RNA提取至关重要。
本研究采用4种方法提取洋葱不同组织的总RNA,结果表明:这4种RNA提取方法对仪器设备的要求相同,均较为简便,用时都约为2 h。在4种提取方法中,就提取同样量 RNA 而言,TaKaRa试剂盒提取法最昂贵,其次是TIANGEN试剂盒法,而TRIzol、pBIOZOL法则较为低廉。采用TaKaRa试剂盒能够快速高效地提取洋葱叶片的总RNA,RNA回收效率高;pBIOZOL法适合提取洋葱鳞茎和根的总RNA,并且RNA纯度较高,能有效去组织中的多糖。RT-PCR检测结果表明,经试验筛选得到的最优方法所提取的洋葱各组织总RNA完全能够满足后续试验要求。本研究在结合相关研究的基础上,筛选出适合洋葱叶片、鳞茎和根总RNA提取的最佳方法,为后续的分子生物学研究提供了方法借鉴,同时也为葱属其他植物提取RNA提供了一定参考。
参考文献:
[1]陈沁滨,王建军,薛萍,等. 洋葱种质资源与遗传育种研究进展[J]. 中国蔬菜,2008(1):37-42.
[2]翟亚辉,马蓉丽,成妍,等. 37份洋葱遗传多样性的RAPD和SSR分析[J]. 华北农学报,2013,28(6):115-120.
[3]黄钰,李旭双,陈典,等. 分蘖洋葱叶片 RNA提取方法的比较和分析[J]. 北方园艺,2011(14):111-113.
[4]张彦苹,王晨,于华平,等. 适于葡萄不同组织 RNA 提取方法的筛选[J]. 西北农业学报,2010,19(11):135-140.
[5]Wang Y C,Guo B H,Zhang F,et al. Molecular cloning and functional analysis of genes encoding 3-hydroxy-3-methylglutaryl coenzyme a reductase from hazel (Corylus avellana L. Gasaway). [J]. Journal of Biological Chemistry and Molecular Biology,2007,40(6):861-869.
[6]史公军,侯喜林,易金鑫. 白菜花药组织总 RNA 提取方法比较及其分析[J]. 西北农业学报,2004,13(3):97-99.
[7]张琰,安龙杰,史宝胜,等. 血红鸡爪槭叶片总RNA提取方法的比较研究[J]. 中国农学通报,2011,27(2):7-11.
[8]梁毅,刘小义,张洪伟,等. 洋葱花青素合成相关基因(AcPAL1)的克隆和表达分析[J]. 农业生物技术学报,2014,22(1):47-54.
[9]郝福玲,刘雅莉,王跃进.百合花瓣总 RNA 提取方法的研究[J]. 西北植物学报,2005,25(6):1143-1147.
[10]张今今,王跃进,王西平. 葡萄总RNA提取方法的研究[J]. 果树学报,2003,20(3):178-181.
[11]Su X,Gibor A. A method for RNA isolation from marine macroalgae[J]. Analytical Biochemistry,1988,174(2):650-657.
[12]Wang C S,Vodkinl O. Extraction of RNA from tissues containing high levels of procyanidins that bind RNA[J]. Plant Molecular Biology Reporter,1994,12(2):132-145.康俊. 紫杉醇关键酶基因TwDBAT在平菇中的遗传转化及表达[J]. 江苏农业科学,2016,44(10):98-103.

