不同地理种源丹参组培快繁及再生苗性状差异比较
兰英++柳敏++严铸云++谢惠庆++沈晓凤++张礼++林婵春


doi:10.15889/j.issn.1002-1302.2016.10.024
摘要:建立不同地理种源丹参(四川、山东、河南)组织培养条件,比较其组培苗及大田栽种后植株间的生物学性状差异。以不同地理种源盆栽丹参茎尖嫩叶为外植体,经70%的乙醇处理10 s后,再用2%的NaClO溶液灭菌20 min效果较好,污染率仅为5%。叶片愈伤组织的诱导及继代增殖最适培养基为MS+2.0 mg/L 6-BA+1.0 mg/L NAA,出愈率达到96.7%;芽分化的最佳激素条件为1.0 mg/L 6-BA+0.1 mg/L NAA;幼苗生根的适宜培养基为1/2MS+0.2 mg/L NAA+0.5 mg/L IBA,生根率为94%。结果显示不同地理种源丹参组培苗及大田栽培后植株间根部特征、株高、叶形及开花与否均有较大差异。这为进一步探索3个种源丹参根系分泌物的差异及其与品质形成的关系提供了依据。
关键词:丹参;组培快繁;植株再生;生物学性状
中图分类号: S567.5+30.43文献标志码: A文章编号:1002-1302(2016)10-0103-05
收稿日期:2015-08-13
基金项目:国家自然科学基金(编号:81173493)。
作者简介:兰英,女,重庆人,硕士研究生,主要从事中药资源与开发利用研究。E-mail:961269730@qq.com。
通信作者:严铸云,教授,博士生导师,主要从事道地药材品质形成与调控研究。E-mail:cdtcmyan@126.com。丹参为唇形科鼠尾草属植物丹参(Salvia miltiorrhiza Bge.)的干燥根及根茎,具有活血化瘀、消肿止痛、养血安神的功能,是常用的重要中药[1];广泛分布于四川、河南、山东、安徽、陕西等省区,具有较强的土壤适应性[2]。前期研究结果表明,不同产地丹参栽培中普遍存在连作障碍及病毒积累等问题,而其有效成分含量差异明显,这与其遗传特性有关[3-4]。本试验以3个不同地理种源的丹参植株为材料,利用组织培养具备繁殖速度快、脱除病毒且保证植株遗传稳定性等优势,建立山东临朐、河南方城、四川中江3个种源丹参的组培快繁体系,实现对3种不同丹参组培苗的快速繁殖,并将试管苗移栽于四川中江进行大田培育,比较其生物学性状的差异,为后期探索不同丹参遗传特性与其药材品质形成的关系提供依据。
1材料与方法
1.1试验材料
丹参种源于2012年12月分别采自四川省中江县石泉乡、山东省临朐县吕匣镇、河南省方城县拐河镇3个不同产区,根段繁殖,翌年开花后,经鉴定均为唇形科植物丹参(Salvia miltiorrhiza Bge.)。
1.2仪器与试剂
仪器:SW-CJ-1F 超净工作台(江苏苏净集团有限公司),JA5003电子天平(上海良平仪器仪表有限公司),MLS-3020自动高压灭菌锅(日本三洋公司),PHS-3C+ 酸度计(成都世纪方舟科技有限公司),MLR-350HT组培箱(日本三洋公司)。
试剂:MS培养基(杭州临安木木生物技术有限公司,批号20120701),6-BA(济南昊天科技发展有限公司,批号20110603),NAA(济南昊天科技发展有限公司,批号20110607),2,4-D(济南昊天科技发展有限公司,批号20101107),维生素B1(成都市科龙化工试剂厂 批号20111023),蔗糖(成都市科龙化工试剂厂,批号20090610),琼脂粉(成都市科龙化工试剂厂,批号20111001),蒸馏水。
1.3试验方法
1.3.1无菌外植体的获得取样前将丹参植株移至室内培养1周后,采取植株茎尖1~2片新叶,用无菌纱布包裹置于自来水下冲洗1 h。将冲好的嫩叶用无菌水洗涤5次后置于超净工作台中,先后用70%的乙醇和2%的NaClO溶液进行不同时间的灭菌处理,期间不断搅拌使叶片与消毒液充分接触[5-6]。最后用无菌水冲洗4次后切块接种于培养基上。1周后统计其灭菌后的生长状况及污染率,筛选出最佳的灭菌时间组合。污染率=污染数/接种数×100%[7]。
1.3.2丹参愈伤组织的诱导及增殖培养将灭菌好的嫩叶剪成约0.5 cm×0.5 cm的小块,并用解剖刀轻轻将其表面划伤,背接(背面向上)于附加不同浓度生长素(NAA、2,4-D)和细胞分裂素(6-BA)配比的MS培养基上(含蔗糖3%、琼脂0.7%,pH 5.8~6.0,121 ℃、1.1 kg/cm2条件下灭菌 15 min)。每种处理培养10瓶,每瓶接种3块,培养5 d后将无菌的组织块接入新的培养基上培养。于(25±2) ℃下黑暗培养,每隔5 d对其生长状况进行观察,20 d后统计诱导出愈伤组织的外植体数并计算诱导率,同时记录愈伤组织的颜色、质地和生长情况。愈伤组织诱导率按出愈率计算,公式如下[7]:
出愈率=[无污染愈伤组织数/(总接种数-污染数)]×100%。
将上述已分化愈伤组织分割成大小约0.5 cm×0.5 cm的小块后,转移到与诱导愈伤相同激素比例的增殖培养基中,于(25±2) ℃黑暗条件下继代培养。
1.3.3丛生芽的诱导将愈伤组织分割成大小约0.5 cm×0.5 cm 的小块后,转移到附加不同浓度生长素(NAA)和细胞分裂素(6-BA)的MS增殖培养基中(培养基组成同“1.2.2”节)。温度(25±2) ℃、光照度2 000~3 000 lx、光照时间 11 h/d 条件下培养,20 d后记录丛生芽生长状态。
1.3.4根的发生取增殖培养中生长的丹参无根苗茎尖端2~3 cm,同时将未分化成苗的芽丛分割成单芽,接种到附加不同浓度的NAA 和IBA的1/2MS生根培养基中(含蔗糖 1.5%、琼脂0.8%,pH 5.8~6.0,121 ℃、1.1 kg/cm2条件下灭菌15 min)。以不添加任何激素的1/2MS为对照培养基。培养条件同上述处理。统计各种激素条件下2种材料的最早生根时间,并在培养25 d后统计其生根率并记录生长状况。生根率计算公式如下:
生根率=[形成根的苗数/(接种数-污染数)]×100%。
将采自同一植株的河南方城和四川中江丹参外植体按最佳灭菌条件灭菌后,接种于山东临朐丹参组培中各阶段优化的最佳培养基上,于同样条件下进行培养,以期获得3个不同地理种源的丹参无菌组培苗,比较其性状的差异。至根长至5~8 cm时取出组培苗,洗净根部培养基后,移栽于含灭菌基质(腐殖土 ∶珍珠岩比例为3 ∶1)的育苗杯中室内光照炼苗。成活后移栽到四川省中江县石泉乡进行大田栽培,不同种源丹参以相同方式管理。于栽种1个月后统计其幼苗存活率,并分别补苗以保证各种源丹参幼苗35株以上。定期观察不同地理种源丹参大田栽培的植株生物学性状差异。
2结果与分析
2.1丹参外植体的最佳灭菌条件
取同一丹参植株切根繁殖的丹参苗茎尖嫩叶为组培外植体,按“1.3.1”节的步骤进行不同灭菌时间的处理后接种于不含激素的MS培养基上(同“1.3.2”节)。其灭菌情况及丹参叶片生长状态见表1。
盆栽丹参茎尖嫩叶因暴露于空气中易被微生物污染,在置入培养基之前必须经过表面灭菌,但不同灭菌剂、灭菌浓度及灭菌时间的灭菌效果不一样,且表面灭菌剂对植物组织会有一定的伤害作用。文献报道多以氯化汞作为灭菌剂[8-9],考虑到氯化汞虽具有较好的灭菌效果,但毒性较大,易损伤外植体,且灭菌后难以除去,因此本试验中以70%的乙醇溶液和2% NaClO组合灭菌。从表1可以看出,先用70%的乙醇处理10 s后再用2%的NaClO溶液灭菌20 min效果最好,污染率仅为5%。其他灭菌时间均不理想。
2.2外源激素对愈伤组织形成的诱导
将灭菌好的组织块分别接种到6-BA、NAA、2,4-D不同浓度组合的培养基上,25 d后统计愈伤组织诱导率,结果见表2。
从表2可见,不同外源激素和相同外源激素的不同比例处理时,外植体的生长情况有较大差异,当用6-BA单因素处理时,随着浓度的增加,外植体增长较快且芽的分化率较高,同时有的叶片在接触培养基的部位可不经过明显的愈伤组织阶段而直接分化出芽,表明细胞分裂素可明显促进芽的分化及生长。将6-BA与NAA配合使用,在适宜浓度下培养7 d左右,可见叶片皱缩增大,中部隆起,叶缘及切口处开始膨大,叶片颜色变浅,外植体进入脱分化阶段(图1-A)。至15 d时,整个叶片呈黄白色,切口处形成无固定形态的细胞团,并有少量不定芽形成(图1-B)。30 d时叶片基本完全脱分化形成愈伤组织,具少数丛生芽(图1-C)。最佳的激素组合是2.0 mg/L 6-BA+1.0 mg/L NAA,出愈率达到967%。生长素浓度过低时叶片脱分化较缓慢, 可见生长素在叶片脱分化过程中起着至关重要的作用。这可能与生长素可启动细胞中DNA的转录与翻译,活化细胞代谢,启动细胞分裂有关。6-BA与2,4-D搭配使用,外植体未明显长大且形成少量愈伤组织,培养过程中逐渐褐化、死亡。这可能是因为2,4-D诱导愈伤组织中的多酚氧化酶活性升高,或是对外植体的毒害作用导致其褐化[10]。
2.3外源激素对芽分化的诱导
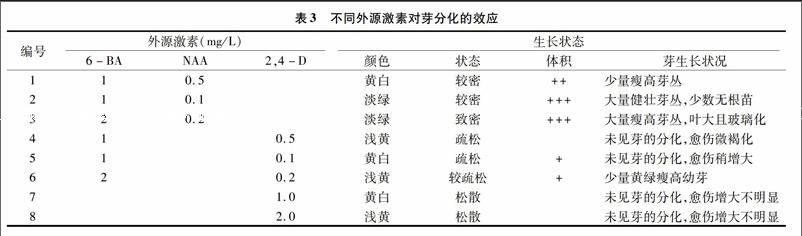
愈伤组织分割成约0.5×0.5 cm2的小块后,转移到 6-BA、NAA和2,4-D不同组合的培养基上继续培养,20 d后观察组织块的生长状态,结果见表3。
从表3可见,6-BA与NAA组合应用时,可促进愈伤组织的生长,且当6-BA与NAA浓度比值较大时可明显地诱导愈伤组织分化产生丛生芽,甚至长成无根幼苗,这与Skoog提出的细胞分裂素和生长素比例较高时利于芽生长,而比值较低时有利于根的分化相一致。但1 mg/L 6-BA+0.1 mg/L NAA与2 mg/L 6-BA+0.2 mg/L NAA组合试验中发现,高浓度诱导的丛生芽分化较快,玻璃化严重而变脆,芽丛叶片大而密集,生根培养难以成活。且激素用量较大会增大植株的变异概率,不利于保持试管苗的遗传稳定性[11]。而低浓度组合诱导丛生芽生长正常,且有少数无根苗(图1-D)。相同比例的6-BA和2,4-D搭配后加入到增殖培养基中,未见芽的分化,愈伤组织增大不明显,但愈伤组织呈疏松的黄白色。可见,2,4-D并不能诱导愈伤组织分化出芽丛,甚至抑制了6-BA的诱导效果,但明显地改善了其生长状态,这有利于在悬浮培养时得到均一分散的细胞悬浮液。因此在丛生芽的诱导时,以1.0 mg/L 6-BA与0.1 mg/L NAA配合使用效果更佳,这与李明军等报道的裕丹参愈伤组织诱导最佳激素比相同[12]。而当需要将培养的愈伤组织进行细胞悬浮培养时,可考虑将生长良好的愈伤组织块接种于含1.0 mg/L 6-BA和0.1 mg/L 2,4-D的培养基上预培养一段时间,待愈伤组织呈疏松易分散状态时再进行悬浮培养,可获得较好的效果。
2.4外源激素对根发生的影响
将2~3 cm的无根苗茎尖及幼芽分别接种于NAA与IBA不同组合的培养基上诱导生根,总共设计5组激素组合,观察不同激素条件下最早的生根时间、生根率及根和幼苗的生长情况,结果见表4。
将芽和无根苗接种到同样的培养基上诱导生根时,大多幼芽均基部褐化死亡,而无根幼苗的茎尖多数能产生根,说明丹参无根苗比幼芽更容易生根。这可能是由于幼芽分化程度相对较低,其内源激素水平及对外界环境的适应力较差,使其不能正常分化产生根,而丹参苗具有完整的顶芽、叶片,有较强的适应能力,能合成自身所需的生长素,从而促进茎的基部生根。因此,在生根培养时以无根苗的茎尖扦插可提高成活率。当以NAA和IBA配合使用诱导生根时,比值较高时则会诱导产生不正常幼根,表面微褐化,极易脱落,最早生根时间较长,且移栽成活率低;比值较低时则可诱导产生较多幼根,其中最佳组合为0.2 mg/L NAA+0.5 mg/L IBA,最早生根,且生根率达 94%(图1-E)。而当单独使用 0.5 mg/L IBA时,虽诱导生根较快,但苗瘦高,移栽时易受损伤而难以成活。试验中未添加激素的空白组也能诱导无根苗生根,但较为缓慢, 生根率较低,这可能是其内源激素促进其自发生根,与蔡朝晖等的试验现象相同[13]。
2.5不同种源丹参组培苗的性状比较
3个不同种源的丹参外植体均能适应优选的最佳组培条件,实现丹参无菌组培苗的快速繁殖,但不同种源丹参组培苗性状及移栽成活率有所不同(表5)。于四川省中江县石泉乡大田栽培后,不同种源丹参植株生物学性状差异较大(表6、图2、图3)。
虽然3个不同种源丹参的遗传特性有所不同,但试验中筛选的最佳组培条件成功应用于3种丹参的组培快繁,说明所获得的最佳激素比例具较广适用性,可用于丹参无菌组培苗的大量繁育。但经四川中江大田栽培存活率均较低,可能与丹参组培苗过于幼小及一直处于室内环境炼苗有关,建议后期大田移栽前进行室外炼苗以增强组培苗的适应能力。河南方城丹参组培苗存活率最高(64.7%),其次是四川中江组培苗(42.2%),山东临朐组培苗最低(37.5%)。这与不同种源丹参组培苗的性状也有关,四川中江丹参组培苗虽较瘦高,但根多,且其外植体本身来源于当地栽培的丹参植株,因此移栽后仍具较强的适应性,苗成活率较高;河南方城丹参组培苗根多且较粗,茎较粗壮,适应性强,成活率高;而山东临朐丹参组培苗根少,成活率最低。开花期,发现山东与河南丹参第一年均不开花,这与当地丹参栽培情况相同,而于药植园进行多年栽培发现,山东、河南丹参第二年均开花,可能与其“生理记忆”相关。收获期,山东临朐丹参根结线虫病极严重,呈红色,而河南临朐和四川中江丹参均无根结线虫病发生,但根呈浅红色,部分呈红白相间。其根颜色的变化和发病情况是否与药材有效成分含量及植株本身的抗病性有关,还有待进一步研究。
3讨论
植物组织培养中影响因素很多,有物种的遗传特性及生理状态,植株的基因型及所处的发育阶段等内在因素,也包括激素、碳源、氮源、诱导因子等化学因素及光照、湿度、温度等物理因素,还有共生菌等生物因素,均会影响植物组织培养的难易程度[14-17]。无菌外植体的获得是建立无菌体系的关键,外源激素是诱导外植体分化的重要因素[11]。因此,本试验着重对其灭菌条件及组培各阶段的最佳激素组合进行优化,并以不同地理种源的同一丹参植株为材料,以避免不同植株间的遗传变异,同时获得适应3个不同种源丹参组培快繁的最佳培养条件,实现丹参组培苗的快速繁殖。
不同丹参的差异性比较多见于不同种质间[18],或者与人工诱导多倍体植株间的对比[19],而不同地理种源丹参组培苗大田栽培过程中的生物学性状差异未见报道。研究发现,不同产地的野生丹参,其生物学性状并不完全一致,如辽宁丹参复叶为3出,少数5出,花冠深蓝紫色,冠幅平均34.6 cm;陕西商洛丹参复叶变化较大,为3~7出,花冠蓝紫色,冠幅478 cm[18]。同一野生丹参与其组培再生苗相比,其株高、冠幅、叶片等均有较大差异,有些变异甚至超出生态型的变异范围[20]。可见,产地不同、生长环境不同均会造成物种部分生物学性状变异。本研究同样发现不同地理种源丹参组培苗间及大田栽培植株间均有一定差异,这些差异是否稳定传递,并与其丹参药材的产量及有效成分的积累有关,还需进一步观察研究。
参考文献:
[1]国家药典委员会. 中华人民共和国药典:一部[M]. 北京:中国中医药出版社,2015.
[2]彭成. 中华道地药材[M]. 北京:中国中医药出版社,2011:892-893.
[3]杨新杰,万德光,林贵兵,等. 丹参脂溶性成分的地域分布特点分析[J]. 中草药,2010,41(5):809-813.
[4]杨新杰,万德光,刘敏,等. 丹参水溶性成分的地域分布特点分析[J]. 天然药物研究与利用,2011,23(4):684-688.
[5]杜雪玲,张振霞,余如刚,等. 植物组织培养中的污染成因及其预防[J]. 草业科学,2005,22(1):24-27.
[6]周建国,刘珊珊,毛志远,等. 丹参组织培养技术的初步研究[J]. 食品与药品,2015,17(2):93-95.
[7]蔡月琴,陆銮眉,黄志丹,等. 火焰树的组织培养与快速繁殖[J]. 植物生理学报,2015,51(5):709-714.
[8]刘学安. 丹参组织培养技术研究及组培苗生产试验[D]. 四川农业大学,2004:1-28.
[9]柳福智,董娟娥,梁宗锁. 不同生长调节物质对丹参愈伤组织的诱导效应[J]. 中国农学通报,2005,21(11):202-204.
[10]胡彦,赵艳. 植物组织培养技术的应用以及在培养过程中存在的问题[J]. 陕西师范大学学报:自然科学版,2004,32(增刊1):130-134.
[11]潘瑞炽. 植物生理学[M]. 高等教育出版社,1995.
[12]李明军,刘杰,周娜,等. 裕丹参愈伤组织诱导、继代及植株再生的研究[J]. 中草药,2008,39(7):1078-1081.
[13]蔡朝晖,高山林,徐德然. 丹参组织培养快速繁殖技术的研究[J]. 中国药科大学学报,1991,22(2):65-68.
[14]王兴翠,曹逼力. 光质对生姜试管苗生长及微型姜诱导的影响[J]. 江苏农业科学,2015,43(7):142-146
[15]张丽珍,杨冬业,袁盼盼. 红果萝荚木植物组织培养及快速繁殖[J]. 江苏农业科学,2015,43(6):44-46.
[16]黎海利,谭飞理,刘锴栋,等. 聚花过路黄的组织培养和快速繁殖[J]. 江苏农业科学,2015,43(6):51-53.
[17]苏江,韦剑锋,岑忠用,等. 水晶布兰卡百合花器官的组织培养[J]. 江苏农业科学,2015,43(6):56-58.
[18]舒志明,梁宗锁,孙群,等. 不同丹参种质生物学性状比较与评价[J]. 西安文理学院学报:自然科学版,2007,10(2):24-29.
[19]高山林,朱丹妮,蔡朝晖,等. 丹参多倍体性状和药材质量的关系[J]. 植物资源与环境,1996,5(2):1-4.
[20]赵东利,王术烽,关玉伟,等. 丹参组织培养再生苗性状变异[J]. 北京农学院学报,2012,27(3):7-9. 李敏,马祥建,李玉娟,等. 耐盐柳树抗虫基因Cry3A重组表达载体的构建[J]. 江苏农业科学,2016,44(10):108-109.

