达氟沙星完全抗原的制备与鉴定
王娅丹++杨雅梅++强敏++朱新生++王云

doi:10.15889/j.issn.1002-1302.2016.10.103
摘要:通过N-羟基琥珀酰亚胺(NHS)法,将半抗原达氟沙星(danofloxacin,DAN)与载体蛋白牛血清白蛋白(BSA)偶联,制备完全抗原DAN-BSA。对所制备的完全抗原通过FT-IR光谱、紫外光谱和SDS-PAGE进行分析确证,并通过测定免疫血清的效价和IC50对其免疫原性进行检测。结果表明,DAN-BSA的FT-IR光谱较BSA和DAN均有变化;紫外光谱扫描中,DAN-BSA的最大吸收波长较BSA和DAN有所偏移;SDS-PAGE电泳中DAN-BSA的条带较BSA条带上移,说明DAN-BSA的分子量大于BSA;免疫原性检测中,血清的效价达到256 000,IC50值为 28.84 μg/L,说明所制备的完全抗原具有免疫原性。综上可知,完全抗原DAN-BSA成功合成,可以用来免疫动物制备抗体,这为后续免疫学检测方法的建立奠定了良好的基础。
关键词:达氟沙星;完全抗原;N-羟基琥珀酰亚胺法;免疫原性
中图分类号: Q812文献标志码: A文章编号:1002-1302(2016)10-0354-03
收稿日期:2016-03-07
基金项目:国家科技支撑计划(编号:2015BAK45B01);江苏省镇江市农业科技支撑计划(编号:NY2014024);江苏省普通高校研究生科研实践计划(编号:SJLX_0483)。
作者简介:王娅丹(1990—),女,河南平顶山人,硕士,主要从事食品安全研究。E-mail:w_yadan@163.com。
通信作者:王云,博士,教授,从事食品生物技术研究。E-mail:wangy1974@ujs.edu.cn。达氟沙星(danofloxacin,简称DAN)是一种氟喹诺酮类抗菌药物(图1),具有抗菌谱广、杀菌作用强、与其他抗菌药物无交叉耐药性等优点,因而被广泛用于动物疫病的预防和治疗[1];但是,达氟沙星会在动物组织中累积,通过食物链进入人体,进而威胁人体健康。已有研究表明达氟沙星会损伤人体器官,使人体免疫力下降,并且具有潜在的致癌性[2]。FAO /WHO 食品添加剂联合专家委员会( JCEFA)、欧盟及我国都制定了达氟沙星在肉制品中严格的残留限量。由于达氟沙星在畜牧业中的加量使用和滥用现象普遍存在,因而需要建立一种针对达氟沙星的快速筛查技术。
目前,农兽药残留检测以仪器分析法为主,如高效液相色谱法、气相色谱-质谱法、高效液相色谱-质谱法、毛细管电泳法、高效薄层色谱法等[3-5]。仪器分析方法检测准确,但是样品前处理复杂,仪器设备价格昂贵,需要专业的实验室和操作人员,这些缺点限制了仪器分析法在大规模快速筛查中的应用。免疫学检测是基于抗原和抗体的特异性结合反应建立起来的一种快速分析方法,具有快速、简便、特异性高等优点,适合大量样品的快速筛查和现场检测[6]。免疫学检测方法主要包括酶联免疫法(ELISA)、胶体金试纸条、免疫亲和柱等方法[7]。
免疫学检测的关键是获得对应的抗体。达氟沙星属于小分子化合物,本身不具有免疫原性,必须先和载体蛋白偶联获得完全抗原,再进行动物免疫制备抗体。本试验通过NHS法合成了达氟沙星的完全抗原,免疫动物制备获得了相应的多抗,为达氟沙星的免疫学快速检测奠定基础。
1材料与方法
1.1试剂
达氟沙星,购自上海圣克鲁斯生物技术公司;N-羟基琥珀酰亚胺(NHS)、1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐(EDAC)、二甲基甲酰胺(DMF)、牛血清白蛋白(BSA)、卵清蛋白(OVA)、弗氏佐剂均购自Sigma公司;HRP-山羊抗兔IgG购自上海生工生物工程公司;其他所涉及的试剂均为国产分析纯,购自上海国药集团化学试剂有限公司。
1.2试验动物
新西兰纯系大白兔,雄性,体质量1.5~2 kg,购自江苏大学动物中心。
1.3DAN完全抗原的制备
采用N-羟基琥珀酰亚胺法(NHS法)制备完全抗原[8]。称取20 mg DAN、12.5 mg EDAC、10 mg NHS,充分溶解于 1 mL DMF中,并将其滴加到含有25 mg BSA的PBS(0.01 mmol/L,pH值7.4)溶液中,室温搅拌3 h;将上述反应好的溶液装入透析袋中,对PBS溶液4 ℃条件下透析3 d后,4 000 r/min离心20 min,收集上清液,冷冻干燥后,分装保存。用 OVA代替BSA,制备包被原(DAN-OVA)。
1.4完全抗原DAN-BSA的FT-IR光谱扫描鉴定
取1 mg冻干的完全抗原DAN-BSA、BSA和DAN分别与KBr研磨压片,进行FT-IR扫描分析。
1.5完全抗原DAN-BSA的紫外光谱扫描鉴定
在200~400 nm波长范围内分别对完全抗原DAN-BSA、载体蛋白BSA和达氟沙星进行紫外扫描分析,以PBS溶液为空白对照。
1.6完全抗原DAN-BSA的SDS-PAGE电泳鉴定
SDS-PAGE电泳鉴定参照文献[9]进行,浓缩胶和分离胶浓度分别为5%和12%。
1.7完全抗原DAN-BSA的免疫原性鉴定
1.7.1动物免疫完全抗原用生理盐水配成1 g /L的溶液。首次免疫0.4 mg/只,用弗氏完全佐剂将完全抗原乳化后,采用背部皮下多点注射方式;加强免疫使用不完全佐剂进行抗原乳化。三免后第7天,耳缘静脉取血,测定其效价和IC50值。
1.7.2免疫血清效价的测定采用间接ELISA法测定血清的效价,具体步骤如下:用DAN-OVA作为包被原,100 μL/孔,4 ℃包被过夜,PBST洗板3次;用含有0.2%明胶的PBS溶液作为封闭液,200 μL/孔,37 ℃封闭2 h,PBST洗板3次;用含有质量浓度0.1%明胶的PBST溶液作为抗体稀释液,将免疫血清在稀释2 000倍的基础上做2倍倍比稀释,100 μL/孔,37 ℃温育1 h;将HRP-山羊抗兔IgG稀释3 000倍作为酶标二抗,100 μL/孔,37℃温育1 h;加入TMB显色液,100 μL/孔,37 ℃温育15 min;加入终止液,50 μL/孔,终止反应后,用酶标仪测定450 nm下的吸光度(D450 nm)。
1.7.3免疫血清IC50值的测定采用间接竞争ELISA法测定免疫血清的IC50值。将酶标板包被封闭后,每孔加入50 μL不同浓度的达氟沙星标准品溶液,再加入50 μL合适稀释倍数的免疫血清,其他步骤同效价测定。
2结果与分析
2.1完全抗原DAN-BSA的红外图谱
如图2所示,在1 700~1 600 cm-1处三者的吸收峰强度有很大不同,这是因为羧基极性强,在1 850~1 600 cm-1之间会出现非常强的吸收峰。达氟沙星有羧基,此处的吸收峰强度最大,完全抗原此处吸收峰强度变弱,说明达氟沙星和载体蛋白发生酰胺反应。达氟沙星相对分子质量远远小于载体蛋白BSA,其结构信息容易被掩埋在载体蛋白的结构信息中[10],但图谱显示两者的指纹区(1 300~670 cm-1)差别很大,指纹区对分子结构的微小变化表现很敏感,这里通过羧基吸收峰和指纹区的差别初步判定DAN和BSA发生反应合成完全抗原DAN-BSA。
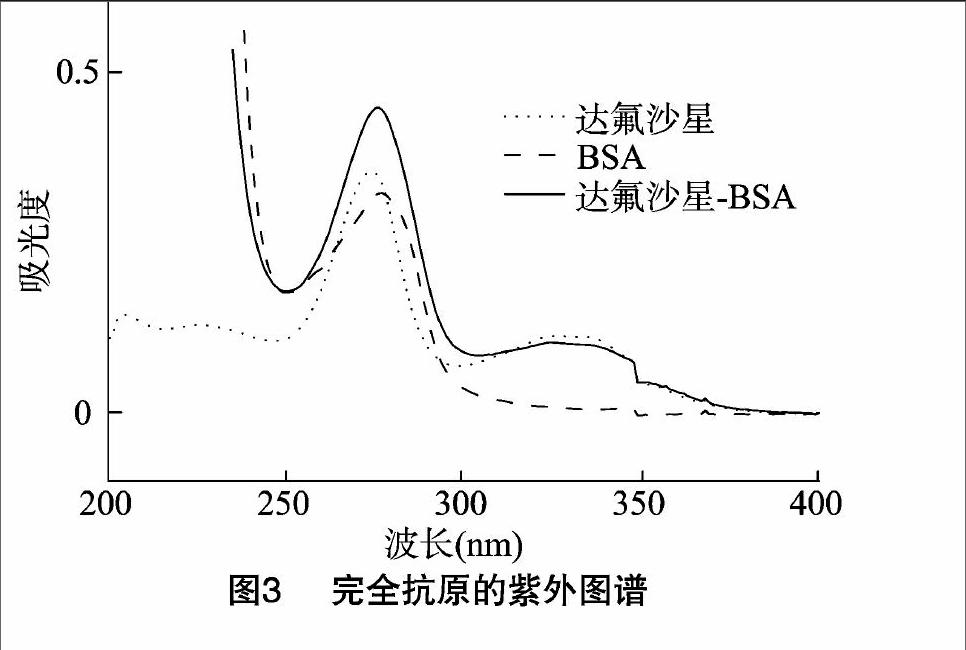
2.2完全抗原DAN-BSA的紫外图谱
图3的紫外扫描图谱表明,载体蛋白BSA在277 nm处有特征吸收峰,DAN在274 nm和326 nm处有2个特征吸收峰,完全抗原DAN-BSA在276 nm和325 nm处有2个特征吸收峰。紫外吸收具有加合性,完全抗原DAN-BSA的紫外图谱保留了BSA在277 nm处的紫外特征吸收峰,也有DAN在326 nm处的特征吸收峰,但又有所迁移,说明BSA和DAN发生反应,另外透析过程中未反应的半抗原DAN已经除去,完全抗原在326 nm处仍有半抗原DAN的特征吸收峰并有所迁移,充分说明完全抗原的成功合成。
2.3完全抗原DAN-BSA的SDS-PAGE鉴定
凝胶电泳分析中样品的迁移率只与分子质量有关,图4显示偶联后产物DAN-BSA的相对分子质量大于BSA,并且条带清晰,纯度比较高,进一步说明完全抗原偶联成功。
2.4完全抗原的免疫原性鉴定
2.4.1免疫血清的效价免疫血清的效价是指将免疫血清做倍比稀释后与对应的配体相作用,出现反应的最大稀释倍数,一般以阳性血清与阴性血清比值大于2.1倍时的稀释倍数作为血清的效价。由图5可以看出,随着稀释倍数的增加,阴性血清的D值无显著变化,阳性血清的D值随着稀释倍数的增加而降低,ELISA测定的免疫血清的效价达到256 000。
2.4.2免疫血清的IC50值免疫血清的间接竞争ELISA曲线如图6所示,根据拟合结果,得出3次免疫后免疫血清的IC50值为28.84 μg/L,最低检测限IC15值为0.18 μg/L。所制备的完全抗原DAN-BSA具有免疫原性,可以制备针对DAN的特异性抗体。免疫血清的抑制性可以通过加强免疫和抗体纯化进一步提高。
3结论
本试验以BSA、OVA作为载体蛋白,采用NHS法,将DAN进行活化,生成中间产物,再与载体蛋白通过酰胺反应生成完全抗原,这样可以防止载体蛋白对半抗原的包埋,使抗原决定簇完全外露,增加所产生抗体的特异性。
完全抗原的鉴定中,FT-IR图谱、紫外图谱和SDS-PAGE这3种方法检测表明偶联成功。虽然物理及化学方法的检验是必要的,但只有特异抗体的出现才是对完全抗原及其合成步骤的最好检验[11],本试验所获免疫血清效价高、具有抑制性,可以通过加强免疫及纯化进一步提高。
综合完全抗原的鉴定,DAN-BSA偶联成功并且具有良好的免疫原性,可以用来免疫动物进行DAN抗体的制备,为后续ELISA检测、免疫亲和柱和胶体金试纸条等免疫学检测产品的制备奠定良好的基础。
参考文献:
[1]刘芳萍,李昌文,佟恒敏. 兽用氟喹诺酮类抗菌剂单诺沙星的研究进展[J]. 黑龙江畜牧兽医,2002(5):50-51.
[2]杜付彬,谭建华. 动物性食品中氟喹诺酮类药物残留检测研究进展[J]. 动物医学进展,2006,27(12):39-43.
[3]Zeng Z L,Dong A G,Yang G X,et al. Simultaneous determination of nine fluoroquinolones in egg white and egg yolk by liquid chromatography with fluorescence detection[J]. Journal of Chromatography B,2005,821(2):202-209.
[4]Toussaint B,Chedin M,Bordin G,et al. Determination of (fluoro)quinolone antibiotic residues in pig kidney using liquid chromatography-tandem mass spectrometry.Ⅰ. Laboratory-validated method[J]. Journal of Chromatography A,2005,1088(1/2):32-39.
[5]van Vyncht G,Janosi A,Bordin G,et al. Multiresidue determination of(fluoro)quinolone antibiotics in swine kidney using liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A,2002,952(1/2):121-129.
[6]Turner N W,Subrahmanyam S,Piletsky S A. Analytical methods for determination of mycotoxins:a review[J]. Analytica Chimica Acta,2009,632(2):168-180.
[7]Kppen R,Koch M,Siegel D,et al. Determination of mycotoxins in foods:current state of analytical methods and limitations[J]. Applied Microbiology and Biotechnology,2010,86(6):1595-1612.
[8]Hiroo W,Atsuko S,Yasumasa K,et al. Monolonal-based enzyme-linked immunosorbent assay and immunochromatographic assay for enrofloxacin in biological matrices[J]. Analyst,2002,127(1):98-103.
[9]陆建. 蛋白质纯化技术及应用[M]. 北京:化学工业出版社,2005:183.
[10]李伟岭,岳永波,李金明,等. 沃尼妙林人工抗原的合成与鉴定[J]. 中国兽医杂志,2012,48(2):78-80.
[11]罗芳琴,金邦荃,侯翔,等. 环丙氨嗪人工抗原的合成与鉴定[J]. 江苏农业科学,2009(4):343-345.

