酶预处理对漂白麦草纤维孔隙结构的影响
陈家杰,李新平∗,陈帅,王志杰,陈立红2
(1.陕西科技大学 轻工科学与工程学院,陕西省造纸技术及特种纸品开发重点实验室,陕西西安 710021;2.陕西科技大学化学与化工学院,陕西 西安 710021)
酶预处理对漂白麦草纤维孔隙结构的影响
陈家杰1,李新平1∗,陈帅1,王志杰1,陈立红2
(1.陕西科技大学 轻工科学与工程学院,陕西省造纸技术及特种纸品开发重点实验室,陕西西安 710021;2.陕西科技大学化学与化工学院,陕西 西安 710021)
为了探究纤维孔隙结构对微纤化纤维素制备过程中机械解离能耗的影响,采用低温氮吸附法分析了不同酶用量对复合纤维素酶预处理漂白麦草纤维孔隙结构的影响。结果表明:随着酶用量的增加,纤维BET比表面积和总孔容均呈现先降低后增加,再降低再增加的“W”型变化。通过分析筛分后纤维各组分孔隙结构的变化,发现纤维细胞壁上的孔隙相对集中在细小纤维组分上,当酶用量较低时,细小纤维含量下降是造成纤维BET比表面积和总孔容减小的主要因素,当酶用量较高时,纤维细胞壁孔隙间转化程度明显增加,孔隙结构的变化是影响纤维BET比表面积的主要因素。
漂白麦草纤维;复合纤维素酶;孔隙结构
从天然纤维素中制备出来的微纤化纤维素(MFC)是一种新型的纳米级纤维素功能材料,因纤维直径达到纳米水平,与传统纤维素相比,具有强度高、质量轻、机械性能良好的优点,且其亲水性、杨氏模量和透明度等性能也都有很大的提高,使其具有更广阔的应用范围,现在已经被广泛应用于纳米器件、包装材料、食品添加剂、太阳能电池和纳米纸等领域[1-2]。目前,国内外相关学者和专家对MFC的制备和应用展开了大量的研究,其中,酶预处理结合机械法是一种最绿色环保的制备方法。相比发达国家,我国对这方面的研究起步较晚,且研究范围较窄[3],对酶预处理过程中纤维细胞壁孔隙结构的变化规律研究并不多,但纤维孔隙结构对纤维的聚合能力、润胀性能等有着很大的影响,进而制约着MFC制备过程中机械解离的难易程度,具有非常重要的研究价值[4]。Fahlén等[5]的研究结果证实,植物纤维细胞壁上分布着大量不规则的孔隙,在酶预处理纤维的过程中,酶不仅会作用于纤维表面,而且也可以通过细胞壁的孔隙渗透至细胞壁内部,作用于次生壁中层(S2)或内层(S3),使细胞壁内部的聚糖组分发生水解,改变细胞壁内部结构和性能,从而必将对MFC制备时的机械解离能耗和MFC质量产生重要影响。Park等[6]的研究结果表明,用纤维素酶预处理纤维可以改变纤维的表面状况和细胞壁孔隙结构,从而使纤维性能得到改善。于红等[7]的研究结果表明,大量菌丝不仅可以附着在麦草外表面,在麦草表面迅速扩散,还能进入细胞壁,在胞腔内生长,在细胞壁上形成孔洞和凹坑;菌丝分泌的酶也可以对细胞壁进行降解,使得细胞壁变薄,从而有助于改善后续化学处理的效果。因此,掌握酶预处理过程中纤维孔隙结构的变化规律对制备MFC及降低机械解离能耗是至关重要的。低温氮吸附法是测定纤维孔隙结构的常用办法[8-9]。本研究采用低温氮吸附法测定不同酶用量预处理前后漂白麦草纤维孔隙结构的变化情况,分析酶预处理对纤维细胞壁孔隙结构的影响,为酶预处理技术在辅助制备MFC及降低机械解离能耗方面的应用提供理论指导。
1 实验
1.1 原料、试剂及仪器
漂白麦草纤维,取自国内某造纸厂。
复合纤维素酶,商品名Celluclast 1.5 L,购自Sigma公司,在pH值4.8、温度50℃的条件下按照IUPAC标准[10]测得滤纸酶活为86.2FPU/mL;柠檬酸、3,5-二硝基水杨酸(DNS)等均为分析纯。
法国Techpap MorFi Compact型纤维形态分析仪;美国IMC MT2110-086 CF型动态滤水性测定仪(DDJ);日本理学D/max2200PC型X射线衍射仪(XRD);美国Gemini_VII_2390型全自动快速比表面积与孔隙度分析仪。
1.2 酶预处理纤维
将6组称好的漂白麦草纤维置于锥形瓶中,用浓度0.05mol/L、pH值4.8的柠檬酸钠缓冲溶液配制成质量分数为3%的纤维悬浮液,浸泡润胀12 h后,分别加入酶用量为0.5、2、5、10、15、30FPU/g的复合纤维素酶液,在温度为50℃的恒温振荡水浴中水解2h。待反应结束立即煮沸灭活5min,用蒸馏水充分洗涤,布氏漏斗抽滤,收集纤维平衡水分,备用。对照实验为不加酶液,其他反应条件不变。
1.3 纤维浆料的筛分
采用动态滤水性测定仪(DDJ)进行纤维分级,所用筛网孔径为0.075mm,浆料质量分数为0.5%,搅拌速度为1200 r/min,搅拌至滤液澄清,收集滤液中的细小纤维组分(P200)和留在筛网上的纤维组分(R200),平衡水分,备用。对照实验中的纤维浆料筛分相同,分别记为P0200和R0200。
1.4 分析测定
1.4.1 细小纤维含量测定 取30mg绝干纤维样品经标准浆料疏解机疏解,然后将溶液稀释到1000mL,用纤维质量分析仪测定细小纤维含量。
1.4.2 结晶度测定 称取0.20~0.25 g干燥后的纤维粉末样品进行压片处理,压好的片用X射线衍射仪进行测定[11],测试条件为Ni滤波、Cu靶Kα射线、管压40kV、管流40mA、扫描速度4(°)/min,从5°扫描到60°。
1.4.3 低温氮吸附法分析 采用全自动快速比表面积与孔隙度分析仪对漂白麦草纤维孔隙结构进行测定。仪器的主要技术指标:比表面积测量范围为0.000 1m2/g~无上限,孔径范围为0.35~500 nm,借助于气体吸附原理(典型气体为氮气)进行等温吸附分析。操作过程:采用高纯N2作为吸附质,相对压力p/p°(p为吸附压力,p°为液氮温度下氮气的饱和蒸汽压)范围为0.010~0.990。将纤维样品冷冻干燥,在80℃的温度下使用氮气吹扫纤维表面1.5 h,除去以物理形式黏附在纤维孔隙表面的气体及其他吸附杂质,待样品自然冷却至室温后称重,装入样品分析管中,在77.4K的液氮冷阱环境下进行吸附测定。该仪器自带的软件通过计算可以直接输出纤维BET比表面积[12]、总孔容及孔径分布等孔隙结构参数。
2 结果与讨论
2.1 原料漂白麦草纤维的孔隙结构特征
麦草纤维的组成比较复杂,除了有长短不同、形态迥异的纤维外,还有很多非纤维状的杂细胞[13],在酶预处理纤维的过程中,各组分和酶之间的吸附和水解作用程度不同,因此研究原料中各组分纤维细胞壁的孔隙结构特征是非常必要的。原料漂白麦草纤维各组分的孔径分布曲线如图1所示。由图1可知,漂白麦草纤维细胞壁孔径分布比较复杂,平均孔径在15~20 nm处具有一个明显的峰值,说明样品具有少量的微孔、分布较宽的中孔和一定量的大孔。比较图中3条曲线得出,R0200组分细胞壁上的孔隙比较少,相对集中在细小纤维(P0200)组分上,这是因为麦草中细小纤维含有大量的杂细胞如薄壁细胞等,这些细胞腔大壁薄,长度短,结晶程度低,戊糖和木糖的相对含量较高[13],在制浆和漂白等过程中,植物纤维细胞壁中的木质素和半纤维素大量降解、溶出导致纤维结构变得更加疏松,产生大量的空隙或孔洞,从而存在较多的孔隙,而R0200组分结晶度高,结构比较致密,纤维细胞壁的孔隙相对比较少。
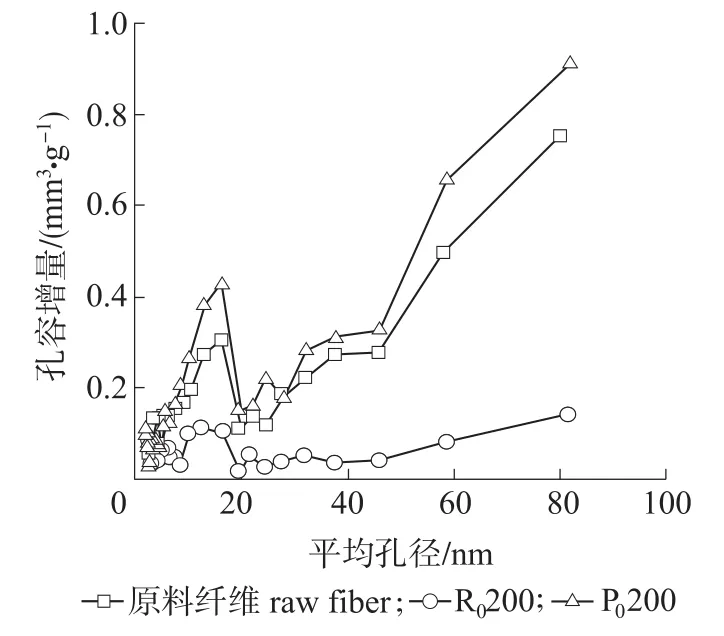
图1 漂白麦草纤维各组分的孔径分布曲线Fig.1 Pore size distribution curves of bleached wheat straw fiber com ponents
2.2 酶预处理对漂白麦草纤维孔隙结构的影响
2.2.1 不同酶用量对漂白麦草纤维孔隙结构的影响 植物纤维是一种具有多孔结构的天然高分子材料,其孔结构是和纤维性能密切相关的重要参数,会影响纤维的聚合能力和润胀性能等[14],因此本实验定量地研究了复合纤维素酶预处理对漂白麦草纤维孔隙结构的影响,结果如图2所示。
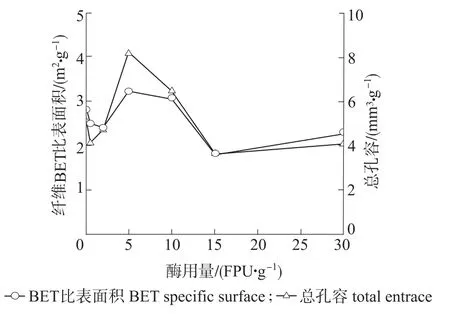
图2 复合纤维素酶预处理对漂白麦草纤维孔隙结构的影响Fig.2 Effects of compound cellulase pretreatment on the pore structure of bleached wheat straw fiber
由图2可知,通过低温氮吸附法测得的原漂白麦草纤维BET比表面积为2.88m2/g,总孔容为5.06mm3/g,这与吴微微等[8]和龚木荣等[15]的测试结果有所不同,原因是麦草纤维原料脱木质素程度不同。随着Celluclast 1.5 L酶用量的增加,纤维BET比表面积和总孔容均呈现先降低后增加,再降低再增加的“W”型变化;在酶用量为5FPU/g时,纤维BET比表面积达到最大值3.24m2/g,总孔容达到最大值8.25mm3/g;在酶用量为15FPU/g时,纤维BET比表面积达到最小值1.79m2/g,总孔容达到最小值3.59mm3/g,与原料初始值相比,纤维BET比表面积和总孔容是减小的。由上述分析可知,当酶用量较低时,由于原料中含有杂细胞的细小纤维比表面积大且孔隙较多,很容易被酶溶解造成纤维BET比表面积和总孔容减小[16];当增加酶用量时,陈帅等[17]的研究结果表明酶解作用会使纤维表面发生“腐蚀”、“剥皮”、“切断”等变化,纤维细纤化程度提高,细小纤维含量增加,但是纤维BET比表面积和总孔容却呈现波动的“W”型变化,这可能是因为随着酶用量的增加,纤维表面结晶区和无定形区受到不同程度的水解,且纤维素酶对植物纤维细胞壁表面及内部不同区域的水解速度不一致[18],在一定水解时间内,不同酶用量作用会使纤维细胞壁发生不同程度的改变,产生新孔隙或者破坏孔隙这2方面的共同作用使纤维BET比表面积和总孔容表现出波动的“W”型变化。综合考虑,以下分析选择具有代表性的低酶用量0.5FPU/g和高酶用量15FPU/g预处理的漂白麦草纤维。
2.2.2 酶预处理对浆料中细小纤维含量和结晶度的影响 酶预处理对漂白麦草纤维中细小纤维含量和结晶度的影响如表1所示。由表1可见,随着酶用量的增加,细小纤维含量先降低后增加,结晶度增加,这是因为在酶预处理过程中,浆料中原有的细小纤维与酶之间的吸附和水解作用都较强,随着水解的进行,有部分细小纤维被溶解,同时也有部分细小纤维是在水解过程中纤维尺寸变小形成的,生成细小纤维的速率大于溶解速率,这部分新形成的细小纤维与浆料中原有的细小纤维相比,结构紧密,结晶程度高。
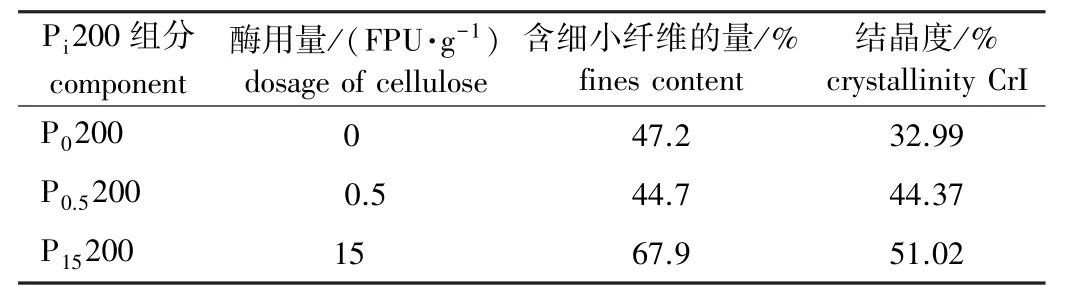
表1 酶预处理对漂白麦草中含细小纤维的量和结晶度的影响Table 1 Effects of enzymatic pretreatment on fines content and crystallinity of the bleached wheat straw
2.2.3 酶预处理对浆料中各组分BET比表面积和总孔容的影响 将酶预处理后的漂白麦草纤维经过DDJ处理得到2种筛分组分,然后采用低温氮吸附法研究不同酶用量预处理对漂白麦草纤维各组分BET比表面积和总孔容的影响,结果如表2所示。
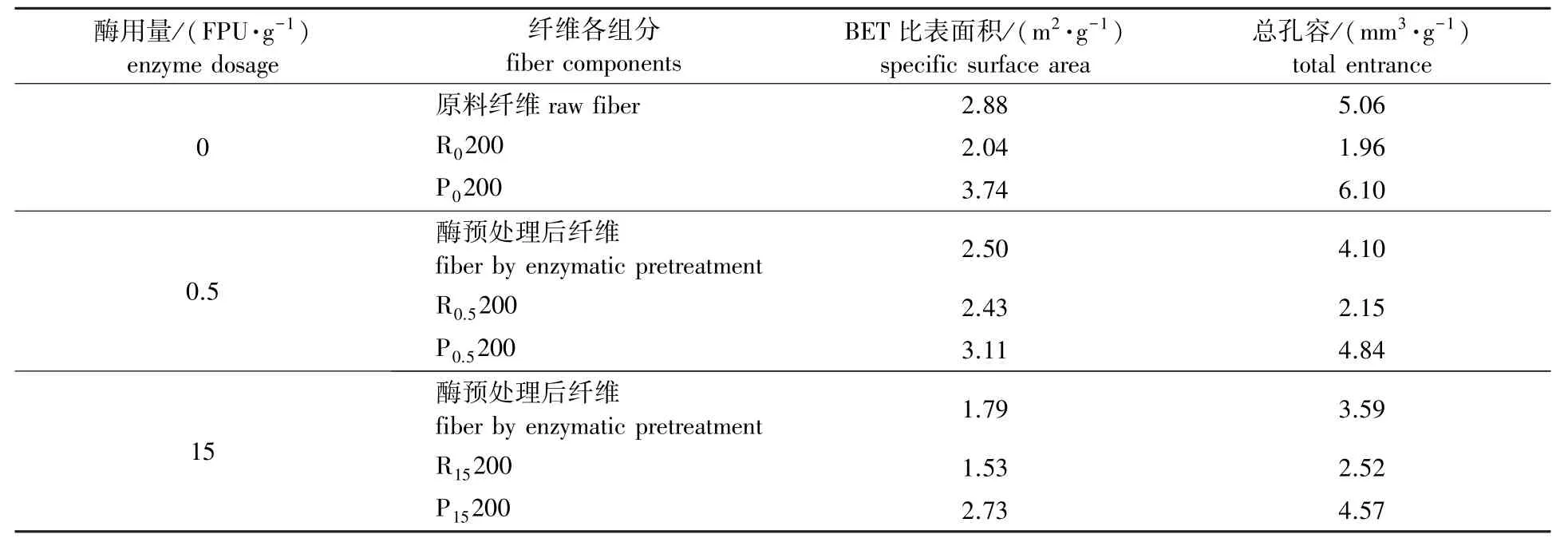
表2 酶预处理对漂白麦草纤维各组分BET比表面积和总孔容的影响Table 2 Effects of enzymatic pretreatment on the BET specific surface area and total entrance of bleached wheat straw fiber components
由表2可见,经过酶用量0.5FPU/g处理后,原料纤维和酶预处理后纤维中P200组分的BET比表面积和总孔容减小,而R200组分的BET比表面积和总孔容却是增加的,同时P200组分含量有所下降(如表1所示),从而分析出当酶用量较低时,细小纤维含量下降是造成纤维BET比表面积和总孔容减小的主要因素。经过酶用量15 FPU/g处理后,与较低酶用量处理相比,P200组分含量增加,生成细小纤维的速率大于溶解速率,新形成的细小纤维一部分是由纤维被切断,纤维尺寸变小形成的,还有一部分是从纤维表面剥离下来得到的[15],这部分细小纤维结晶度高,结构致密,细胞壁上孔隙少,使得P200组分的BET比表面积和总孔容减小,而R200组分的BET比表面积减小和总孔容增大可以由图3分析得到。
由图3可知,3种曲线的变化趋势相同,只是增量程度不同。在平均孔径小于8 nm时,R0200组分的孔径分布曲线基本在R0.5200和R15200曲线之间,在平均孔径大于8 nm时,R0200组分的孔径分布曲线基本在R0.5200和R15200曲线的下方。这说明当较低酶用量处理时,纤维细胞壁上小于8 nm的微小孔隙增加,较大孔隙也稍微增加,这是因为酶不仅水解部分细小纤维,而且还作用于R200组分表面疏松无序的无定形区域,细胞壁变薄,使纤维表面区域呈现清晰的微细纤维纹路,部分起初存在的纤丝状连接断开,形成最终的裂缝状孔隙[19-20],使纤维细胞壁上微小孔隙增加,而微小孔隙对纤维比表面积具有较大的影响,微小孔隙越多,比表面积越大[21],因此纤维比表面积增大,总孔容稍微增加;当较高酶用量处理时,纤维细胞壁微小孔隙减小,较大孔隙大量增加,这是因为随着酶处理程度的提高,酶不仅可以渗透至纤维细胞壁内部使孔隙扩大,而且纤维表面微小孔隙能够被连通转化为较大孔隙[22],从而使R15200组分纤维比表面积减小,总孔容增加。可见,当酶用量较高时,纤维细胞壁孔隙间的转化程度明显增加,孔隙结构的变化是影响纤维BET比表面积的主要因素。
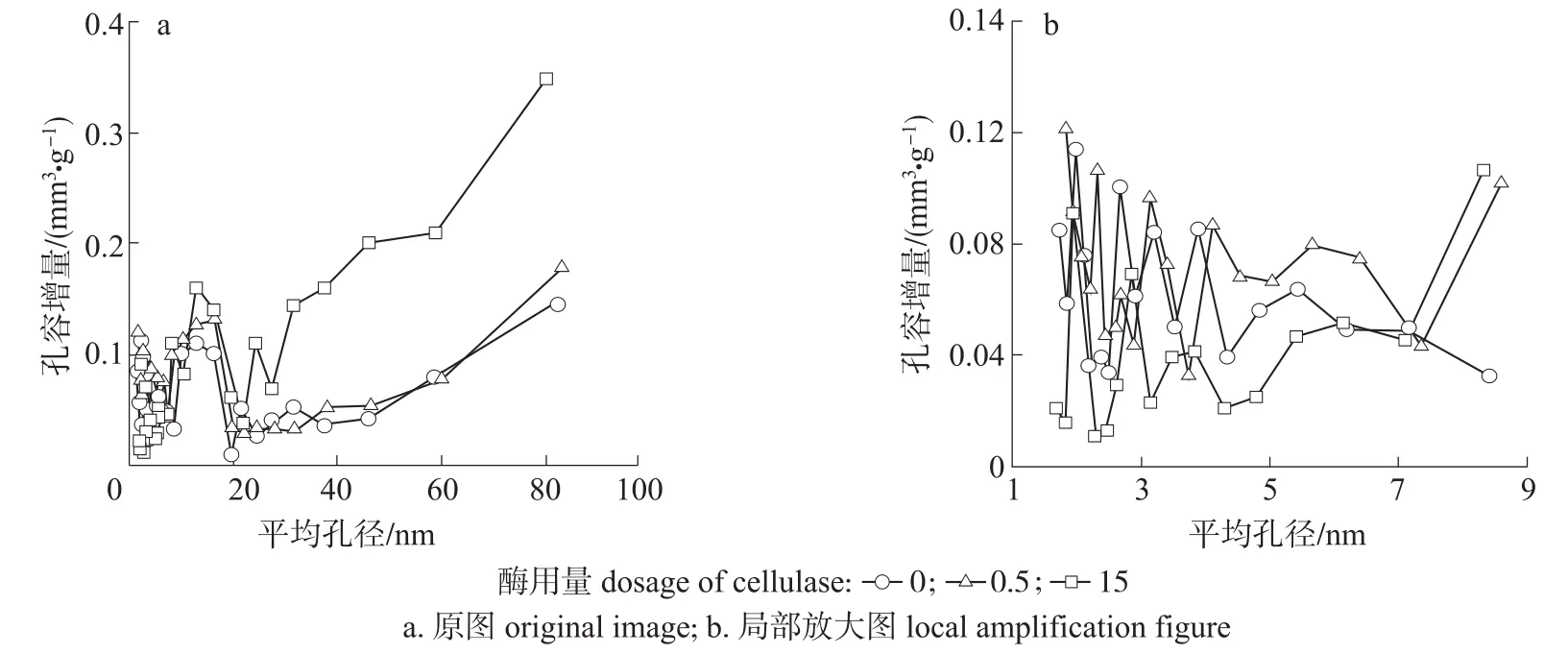
图3 不同酶用量预处理对漂白麦草纤维中R200组分孔径分布的影响Fig.3 Effect of enzymatic pretreatment on the pore size distribution of R200 component of bleached wheat straw fiber
3 结论
3.1 漂白麦草纤维细胞壁孔径分布比较复杂,平均孔径在15~20 nm处具有一个明显的峰值,并且纤维细胞壁上的孔隙相对集中在细小纤维组分上。
3.2 随着酶用量的增加,纤维BET比表面积和总孔容均呈现先降低后增加,再降低再增加的“W”型变化,与原料初始值相比,在高酶用量时,纤维BET比表面积和总孔容是减小的。
3.3 通过分析筛分后纤维各组分孔隙结构的变化,发现当酶用量较低时,细小纤维含量下降是造成纤维BET比表面积和总孔容减小的主要因素,当酶用量较高时,纤维细胞壁孔隙间的转化程度明显增加,孔隙结构的变化是影响纤维BET比表面积的主要因素。
[1]卿彦,蔡智勇,吴义强,等.纤维素纳米纤丝研究进展[J].林业科学,2012,48(7):145-152.
[2]李金玲,陈广祥,叶代勇.纳米纤维素晶须的制备及应用的研究进展[J].林产化学与工业,2010,30(2):121-125.
[3]江泽慧,王汉坤,余雁,等.植物源微纤化纤维素的制备及性能研究进展[J].世界林业研究,2012,25(2):46-50.
[4]GILBERTO S,SANDRA T L,JULIEN B,et al.Morphological investigation of nanoparticles obtained from combined mechanical shearing,and enzymatic and acid hydrolysis of sisal fibers[J].Cellulose,2010,17(6):1147-1158.
[5]FAHLÉN J,SALMÉN L.Ultrastructural changes in a holocellulose pulp revealed by enzymes,thermoporosimetry and atomic forcemicroscopy [J].Holzforschung,2005,59(6):589-597.
[6]PARK S,VENDITTIR A,ABRECHT D G,et al.Surface and pore structuremodification of cellulose fibers through cellulose treatment[J]. Journal of Applied Polymer Science,2007,103(6):3833-3839.
[7]于红,秦梦华,卢雪梅,等.微生物预处理对麦草微观结构和化学成分的影响[J].中国造纸学报,2004,19(1):27-31.
[8]吴微微,万金泉,马邕文,等.麦草纤维孔隙结构在回用过程中的变化规律研究[J].林产化学与工业,2008,28(3):81-85.
[9]王哲,王喜明.木材多尺度孔隙结构及表征方法研究进展[J].林业科学,2014,50(10):123-133.
[10]GHOSE T K.Measurement of cellulose activity[J].Pure&Applied Chemistry,1987,59(2):257-268.
[11]SEGAL L,CREELY L,MARTIN A E.An empirical method for estimating the degree of crystallinity of native cellulose using X-ray diffractometer[J].Textile Research Journal,1959,29(6):786-794.
[12]刘培生.多孔材料比表面积和孔隙形貌的测定方法[J].稀有金属材料与工程,2006,35(S2):25-29.
[13]邝仕均,张皎.麦草浆不同筛分组分的特性[J].中国造纸,1987(1):4-11.
[14]ANDREASSON B.The porous structure of pulp fibers with different yields and its influence on paper strength[J].Cellulose,2003,10 (2):111-123.
[15]龚木荣,毕松林.纤维素酶改善漂白麦草浆滤水性能的作用机理[J].中国造纸,2005,24(3):3-6.
[16]管斌,隆言泉,谢来苏,等.复合纤维素酶对杨木SGW浆的游离度和纤维比表面积的影响[J].中国造纸学报,2000,15(1):1-6.
[17]陈帅,李新平,杜敏,等.复合纤维素酶预处理对漂白麦草纤维结构的影响[J].功能材料,2015,46(8):8090-8093.
[18]CLARKE K,LIX P,LIK C.Themechanism of fiber cutting during enzymatic hydrolysisofwood biomass[J].Biomassand Bioenergy,2011,35(9):3943-3950.
[19]YU H,LIU R G,SHEN DW,et al.Arrangement of cellulosemicrofibrils in the wheat straw cell wall[J].Carbohydrate Polymers,2008,72 (1):122-127.
[20]王玉秀,童国林,尤纪雪.相思木EMCC硫酸盐浆氧脱木质素前后酶处理的影响研究[J].林产化学与工业,2012,32(4):77-82.
[21]郑明飞,张爱清,杨天耀,等.石墨纤维的比表面积与孔隙结构的测定与分析[J].功能材料,2011,42(S4):717-720.
[22]CHEN YM,WANGY,WAN JQ,etal.Crystal and pore structure ofwheatstraw cellulose fiber during recycling[J].Cellulose,2010,17(2): 329-338.
Effect of Enzymatic Pretreatment on Pore Structure of Bleached Wheat Straw Fiber
CHEN Jiajie1,LIXinping1,CHEN Shuai1,WANG Zhijie1,CHEN Lihong2
(1.College of Science and Technology,Shaanxi University of Science&Technology,Shaanxi Province Key Laboratory of Papermaking Technology and Specialty Paper,Xi’an 710021,China;2.College of chemistry and chemical engineering,Shaanxi University of Science&Technology,Xi’an 710021,China)
In order to study the effect of fiber pore structure on the mechanical dissociation energy consumption during the preparation of microfibriled cellulose(MFC),low-temperature nitrogen adsorption method was used to analyze the effect of different dosages of compound cellulase pretreatment on the pore structure of bleached wheat straw fiber.The results showed that the BET specific surface and total entrance of fiber pore all had“W”type change of decreasing,increasing,then decreasing and increasing again with the increase of dosages of enzyme.By analyzing the changes of pore structure of fiber components after screening,itwas found that the pores in cellwall relatively concentrated in fiber fines.And thus themain decreasing factor of BET specific surface and total entrancewas the decline of fines content during the lower dosage ofenzyme.While the dosage of enzyme was higher,transformation of fiber pores was significantly intensified and the change of porosity in the fiber cell walls was consequently themain factor which influenced the fiber BET specific surface.
bleached wheat straw fiber;compound cellulase;pore structure
TQ35
:A
:1673-5854(2017)01-0027-06
10.3969/j.issn.1673-5854.2017.01.005
2016-07-22
国家自然科学基金资助项目(31370578);陕西省科技厅省级重点实验室项目(2011HBSZS014)
陈家杰(1990—),男,湖北襄阳人,硕士生,主要从事纤维素功能性材料方面的研究工作
∗通讯作者:李新平,教授,博士生导师,主要研究方向是纤维素功能性材料;E-mail:lixp@sust.edu.cn。

