大肠杆菌JH-B2产L-丙氨酸发酵工艺的研究
付 刚, 付相敏, 刘 枣, 王金华, 王永泽
(1 湖北工业大学生物工程与食品学院, 湖北 武汉 430068; 2 滨州市力之源生物科技有限公司,山东 滨州 256600)
大肠杆菌JH-B2产L-丙氨酸发酵工艺的研究
付 刚1,2, 付相敏1, 刘 枣1, 王金华1, 王永泽1
(1 湖北工业大学生物工程与食品学院, 湖北 武汉 430068; 2 滨州市力之源生物科技有限公司,山东 滨州 256600)
L-丙氨酸在医药和食品行业中有着非常广泛的应用,利用大肠杆菌生产L-丙氨酸具有生产周期短和营养要求低的特点。以一株经过基因改造的大肠杆菌JH-B2(ΔfrdBC,ΔadhE,Δpta,ΔldhA,ΔpflB∷alaD)作为发酵菌株,研究其以葡萄糖为碳源配以少量氮源(5g/L酵母粉)发酵产L-丙氨酸的条件,对比分批发酵和补料发酵的结果,并在50L的发酵罐中进行了发酵的放大。研究结果表明,优化后发酵条件为:转速300r/min,pH6.0,通气量0.6L/((min·L))。其中,pH为6.0接近于L-丙氨酸的等电点。在此条件下L-丙氨酸产量可达76.51g/L,比优化前提高12.5%;7-L发酵罐中补料发酵相比分批发酵产量提高了40%;在50L发酵罐中进行补料发酵,L-丙氨酸产量达到135.0g/L。
L-丙氨酸; 发酵; 大肠杆菌
L-丙氨酸是一种人体非必需氨基酸,但其在食品和医药等领域具有广泛的用途,可作为手术前后营养品[1],亦可作为合成蛋白质所需的原料[2]。除此之外,在工程塑料制造方面,L-丙氨酸也具备很大的商业价值,因此国内L-丙氨酸的市场价格较高,约为2.5万元/t。目前L-丙氨酸生产成本较高[3],其大规模应用受到一定的限制[4]。由于大肠杆菌具有生长快和营养要求低等特点,采用大肠杆菌生产L-丙氨酸,可在一定程度上降低L-丙氨酸生产成本。徐友强[5]等利用重组大肠杆菌,以富马酸为底物,采用生物转化的方法将其转化为L-丙氨酸,产量达到112.5g/L。此外,还可通过基因工程手段,将外源丙氨酸脱氢酶基因导入大肠杆菌,使大肠杆菌利用葡萄糖合成L-丙氨酸,并通过代谢途径的优化,使L-丙氨酸产量和光学纯度大大提高[6]。周丽[7]等利用重组大肠杆菌,以初始葡萄糖浓度30g/L作为碳源,经补料发酵工艺最终得到67.2g/LL-丙氨酸。
本文以一株经过前期基因工程改造的大肠杆菌JH-B2(ΔfrdBC,ΔadhE,Δpta,ΔldhA,ΔpflB∷alaD)作为发酵菌株。该菌株具有需要有机氮源更少、发酵速度快等优点。首先评估发酵转速、pH、通气量对L-丙氨酸发酵产量的影响。在此基础上,进一步研究分批发酵与补料发酵的区别,并在50L的发酵罐中进行了补料发酵的放大,以期为大规模发酵L-丙氨酸提供发酵参数和工艺条件。
1 材料与方法
1.1 菌株
大肠杆菌JH-B2(ΔfrdBC,ΔadhE,Δpta,ΔldhA,ΔpflB∷alaD),出发菌株为大肠杆菌EscherichiacoliW(ATCC 9637),经过基因工程手段构建而成,甘油管-20℃中保存。
1.2 培养基
活化培养基:七水硫酸镁 0.5 g/L,一水硫酸锰 0.05 g/L,磷酸二氢钾 1.5 g/L,磷酸氢二钾 3.6 g/L,NaCl 5 g/L,酵母粉 2 g/L,葡萄糖 20 g/L,琼脂 20 g/L。
摇瓶种子培养基:七水硫酸镁 0.5 g/L,一水硫酸锰 0.05 g/L,磷酸二氢钾 1.5,磷酸氢二钾 3.6 g/L,酵母粉 2 g/L,NaCl 5 g/L,葡萄糖 20 g/L。
发酵培养基:硫酸铵 30 g/L,七水硫酸镁 0.5 g/L,一水硫酸锰 0.05 g/L,磷酸二氢钾 1.5 g/L,磷酸氢二钾 3.6 g/L,酵母粉 1 g/L,NaCl 5 g/L,葡萄糖 120 g/L,聚醚消泡剂 1.0 g/L。
1.3 大肠杆菌JH-B2发酵产L-丙氨酸的条件
1.3.1 菌种活化及种子培养
菌种活化:用灭菌后的竹签从甘油管中蘸取菌液,划线至活化培养基中,置于恒温培养箱37℃培养24 h,连续活化2~3代。
摇瓶种子培养:从活化好的平板培养基上划取少量菌落,接入400 mL摇瓶种子培养基中,摇床37℃培养12 h。
1.3.2 培养条件的优化
1)转速的优化
将培养好的摇瓶种子培养液(菌液OD值为1.0~1.5,pH为5.0~5.5)以10%接种量接种至含有1800 mL培养基的发酵罐中,以7.47 mol/L氨水作为发酵中和剂,初始葡萄糖浓度80 g/L。设定pH值6.0,温度37℃,通气量0.6 L/(min·L),转速分别设置为100、200、300、400、500 r/min。
2)通气量的优化
将培养好的摇瓶种子培养液(OD为1.0~1.5,pH为5.0~5.5)以10%接种量接种至含有1800 mL培养基的发酵罐中,以7.47 mol/L氨水作为发酵中和剂,初始葡萄糖浓度140 g/L。设定pH值6.0,温度37℃,转速300 r/min,通气量分别设置为2、4、6、8、10 L/min。
3)pH的优化
将培养好的摇瓶种子培养液(OD为1.0~1.5,pH为5.0~5.5)以10%接种量接种至含有1800 mL培养基的发酵罐中,以7.47 mol/L氨水作为发酵中和剂,初始葡萄糖浓度140 g/L。设定温度37℃,转速300 r/min,通气量6 L/min,pH分别设置为0.2、0.4、0.6、0.8和1.0 L/(min·L)。
1.3.3 不同发酵方式的比较
1)分批发酵培养
将培养好的摇瓶种子培养液(OD为1.0~1.5,pH为5.0~5.5)以10%接种量接种至含有1800 mL培养基的发酵罐中,以7.47 mol/L氨水作为发酵中和剂,初始葡萄糖浓度140 g/L。设定pH值0.6 L/(min·L),温度37℃,转速300 r/min,通气量0.6 L/(min·L),发酵重复三次。
2)分批-补料发酵培养
将培养好的摇瓶种子培养液(OD为1.0~1.5,pH为5.0~5.5)以10%接种量接种至含有1800 mL培养基的发酵罐中,以7.47 mol/L氨水作为发酵中和剂,初始葡萄糖浓度80 g/L,发酵至24 h时,补充葡萄糖浓度至60 g/L。设定pH值6.0,温度37℃,转速300 r/min,通气量0.6 L/(min·L),发酵重复三次。
1.3.4 50 L发酵罐发酵L-丙氨酸 将培养好的摇瓶种子培养液(OD为1.0~1.5,pH为5.0~5.5)以10%接种量接种至含有27 L培养基的发酵罐中,以7.47 mol/L氨水作为发酵中和剂,初始葡萄糖浓度80 g/L,发酵至24 h时,补充葡萄糖浓度至于60 g/L。设定pH值6.0,温度37℃,转速300 r/min,通气量0.6 L/(min·L)。
1.3.5 发酵终点判断 通过检测残糖含量小于1 g/L时,确定发酵终点。发酵结束后,升温至60℃维持30 min。
1.4 分析检测方法
1.4.1 发酵液OD值检测方法 取1 mL样品稀释一定倍数,利用分光光度计在600 nm波长处检测吸光度,使显示值在0.2~0.8之间。
1.4.2 葡萄糖的检测方法 取适量样品10 000 r/min离心5 min,取上清液稀释100倍,利用生物传感仪(SBA-40D)测定葡萄糖含量。
1.4.3 L-丙氨酸检测方法 Waters e2695高效液相色谱,依力特C18色谱柱(4.6 mm×250 mm),流动相甲醇-磷酸氢二钠混合液(V(pH为6.5的0.05 mol/L磷酸氢二钠)∶V(甲醇)=1∶9),流速0.8 mL/min,柱温30℃,进样体积5 μL,检测波长215 nm。
2 结果与分析
2.1 搅拌转速的优化
设定pH值为6.0,温度37℃,通气量0.6 L/(min·L),转速分别设置为100、200、300、400、500 r/min来考察转速对发酵的影响。

图 1 搅拌转速对大肠杆菌发酵L-丙氨酸的影响
由图1可知,L-丙氨酸产量随发酵罐转速的提高而增加。当转速为300 r/min时,产量最大77.12 g/L;当转速大于300 r/min时,产量不再增加。结果表明,发酵转速是影响摇瓶供氧的重要因素,适当氧气量的供应可以促进辅酶I的高效回复利用和代谢的高效运行[3],这有利于丙氨酸的积累。
2.2 通气量的优化
设定pH值6.0,温度37℃,转速300 r/min,通气量分别设置为0.2、0.4、0.6、0.8和1.0 L/(min·L)来考察不同通气量对发酵的影响。
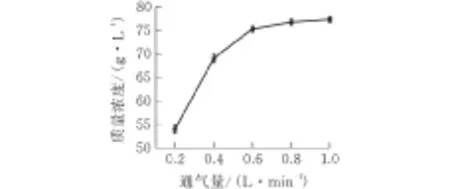
图 2 通气量对大肠杆菌发酵L-丙氨酸的影响
由图2可以看出,L-丙氨酸产量与通气量大小成正相关关系。当通气量小于0.6 L/(min·L)时,L-丙氨酸产量随通气量增大而增加;当通气量大于0.6 L/(min·L)时,L-丙氨酸产量增长缓慢。通气量直接关系到发酵液中溶氧值大小,但并非通气量越大越好。当通气量达到一定值时,产物产量不再明显提高,发酵能耗反而会进一步增加,而且通气量太大会使发酵液飞溅至管壁,容易造成染菌,通气量6 L/min为大肠杆菌工程菌发酵产L-丙氨酸的适宜条件。
2.3 pH的优化
设定温度37℃,转速300 r/min,通气量0.6 L/(min·L),pH分别设置为6.0、6.2、6.4、6.6、6.8和7.0来考察pH对发酵影响。

图 3 pH值对大肠杆菌发酵产L-丙氨酸的影响
由图3可知,发酵液pH值为6时,L-丙氨酸产量最高。这可能是由于L-丙氨酸等电点为6.02,因此在pH为6.0时L-丙氨酸溶解度最小,发酵液中L-丙氨酸浓度最小,对菌体反馈抑制作用最弱[8]。
2.4 7 L发酵罐分批发酵
设定pH值6.0,温度37℃,转速300 r/min,通气量0.6 L/(min·L)进行了分批发酵实验。
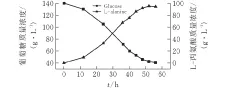
图 4 7 L发酵罐中利用大肠杆菌分批发酵产L-丙氨酸
由图4可知:0~12 h葡萄糖消耗较慢,产物增加较小,说明大肠杆菌基本还处于生长的延滞期;发酵12 h以后,耗糖速度和产酸速度明显提高,发酵进入了产酸旺盛阶段,整个发酵过程中产物的积累基本在这个阶段完成,最终L-丙氨酸积累量为95 g/L。
2.5 7 L发酵罐补料发酵
设定pH值6.0,温度37℃,转速300 r/min,通气量0.6 L/(min·L)进行补料发酵,初糖浓度为80 g/L,当发酵液中残糖低于1 g/L时,补料一次,使葡萄糖浓度达到60 g/L,继续发酵至残糖低于1 g/L,结束发酵(图5)。

图 5 7 L发酵罐中利用大肠杆菌补料发酵产L-丙氨酸
从图5可看出:0~8 h时耗糖速度和产物生成速度较慢;20 h后,耗糖速度和产物速度快速提高;当发酵至46 h 时L-丙氨酸积累量为133 g/L。
2.6 50 L发酵罐补料发酵
设定pH值6.0,温度37℃,转速300 r/min,通气量0.6 L/(min·L),在50 L发酵罐中进行了L-丙氨酸发酵。初糖浓度为80 g/L,当发酵液中残糖低于1 g/L时,补料一次,使葡萄糖浓度达到60 g/L,继续发酵至残糖低于1 g/L,结束发酵(图6)。

图 6 50 L发酵罐中利用大肠杆菌补料发酵产L-丙氨酸
由图6可知:0~4 h时产物积累量很少;发酵4 h以后进入产酸期,大量积累产物L-丙氨酸;40 h发酵就已结束。整个发酵过程生产强度3.38 g/(L·h),L-丙氨酸产量135 g/L。
2.7 不同发酵方式的比较
从表1中可以看出,不同发酵方式以及不同发酵规模对L-丙氨酸发酵都有一定影响。在7 L发酵罐中,补料发酵明显比分批发酵效果要好,前者转化率达95%,后者仅为68%;补料发酵最大生产强度和平均生产强度均高于分批发酵。一般来说,分批发酵初始葡萄糖浓度过高对菌体生长不利,延长了发酵周期,从本文研究结果也可看出,分批发酵发酵56 h后发酵液中还有40 g/L的葡萄糖残留。而分批-补料发酵初始葡萄糖浓度仅为80 g/L,发酵46 h基本无残糖,发酵转化率大于95%。

表1 不同发酵方式L-丙氨酸发酵的效果
补料发酵从工艺上讲,操作并不复杂,但其平均生产强度为2.90 g/(L·h),不但高于分批发酵,对其他形式工艺操作也具有一定优势,如文献[7]同样利用大肠杆菌,以葡萄糖作为碳源,发酵分好氧和厌氧两阶段进行发酵,其L-丙氨酸最终产量67.2 g/L,转化率67.2%,L-丙氨酸生产强度2.01 g/(L·h)。
从发酵规模来看,50 L发酵罐中的效果比7 L发酵罐中的发酵效果有一定提高,发酵产量可达135 g/L。50 L发酵罐中发酵L-丙氨酸时糖酸转化率97%,而7 L发酵罐中转化率仅仅为95%;前者最大生产强度和平均生产强度均高于后者,表明本文菌株在适应大规模发酵生产L-丙氨酸上具有很大的潜力。
3 结论
本文以一株经过基因工程改造的大肠杆菌JH-B2(ΔfrdBC,ΔadhE,Δpta,ΔpflB∷alaD,ΔldhA)作为发酵菌株,对L-丙氨酸发酵工艺条件进行了探索。1)转速小于300r/min范围内,随转速增大,L-丙氨酸产量随之增加;当通气量小于0.6L/(min·L)时,L-丙氨酸产量随通气量增大而增加;发酵液pH值为6时即在丙氨酸等电点附近时,L-丙氨酸产量最高。
2)对比了补料发酵和分批发酵产L-丙氨酸的发酵效果。结果表明,采用初糖80g/L补料60g/L的补料发酵方式,L-丙氨酸可达133.5g/L,比分批发酵(95g/L)产量高出40%,生产强度也有很大提高,达2.90g/(L·h)。
3)50L发酵罐中的效果比7L发酵罐中的发酵效果有一定提高。50L发酵罐中发酵L-丙氨酸时糖酸转化率97%,而7L发酵罐中转化率为95%;前者最大生产强度和平均生产强度均高于后者,表明菌株在适应大规模发酵生产上具有很大的潜力。
[1]HolsP,KleerebezemM,SchanckAN,etal.ConversionofLactococcuslactisfromhomolactictohomoalaninefermentationthroughmetabolicengineering.[J].NatureBiotechnology, 1999, 17(6):588-92.
[2]LeeM,SmithGM,EitemanMA,etal.Aerobicproductionofalanineby,EscherichiacoliaceFldhA,mutantsexpressingthe,BacillussphaericusalaD,gene[J].AppliedMicrobiology&Biotechnology, 2004, 65(1):56-60.
[3] 周丽, 邓璨, 崔文璟,等. 利用重组大肠杆菌发酵甘油合成L-丙氨酸[J]. 现代食品科技, 2016(6):163-169.
[4]DinariSMM.ProgressinSyntheticPolymersBasedonNaturalAminoAcids[J].JournalofMacromolecularSciencePartA, 2011,PartA(8):644-679.
[5] 徐友强, 马玉岳, 姚粟,等. 重组大肠杆菌转化富马酸生产L丙氨酸[J]. 生物加工过程, 2016, 14(2):7-11.
[6]SmithGM,LeeSA,ReillyKC,etal.Fed-batchtwo-phaseproductionofalaninebyametabolicallyengineeredEscherichiacoli[J].BiotechnologyLetters, 2006, 28(20):1695-700.
[7] 周丽, 邓璨, 崔文璟,等. 温度调节基因开关调控大肠杆菌发酵合成L-丙氨酸[J]. 微生物学通报, 2015, 42(11):2272-2281.
[8] 邓辉, 陈存武, 孙传伯,等. 大肠杆菌磷酸甘油酸脱氢酶突变体的构建及抗反馈抑制效应[J]. 生物工程学报, 2016, 32(4):468-477.
[责任编校: 张 众]
Research on L-alanine fermentation by Escherichia coli JH B2
FU Gang1,2, FU Xiangmin1, LIU Zao1, WANG Jinhua1, WANG Yongze1
(CollegeofBioengineeringandFoodScience,HubeiUniv.ofTech.,Wuhan430068China; 2BinzhouLIZHIYUANBiologicalTech.Co.Ltd.,Binzhou256600,China)
L-alanine has been widely used in the pharmaceutical and food industries. The production of L-alanine byEscherichiacolihasthecharacteristicsofshortfermentationtimeandminimalnutritionalrequirement.Inthisstudy,EscherichiacoliJH-B2 (ΔfrdBC,ΔadhE,Δpta,ΔldhA,ΔpflB∷alaD)wasevaluatedforfermentativeproductionofL-alanineusingbatchandfed-batchmodes.Theresultsachievedinbatchfermentationshowedthattheoptimizedfermentationconditionswereasfollows:rotationspeedof300r/min,controllingpHof6.0 (approximatelyequivalenttotheisoelectricpointofL-alanine),andaerationrateof0.6L/(min·L).Undertheseconditions,theL-alaninetiterreachedto76.51g/Linthebatchfermentation,whichwas12.5%higherthanthatproducedinpreviousfermentationwithoutoptimizedcondition.Furthermore,L-alaninetiterachievedinafed-batchmodewas40%higherthanobtainedinbatchmode.Ina50Lfermenterwithafed-batchmode,thetiterofL-alaninereached135.0g/L.
L-alanine;fermentation;Escherichia coli
2016-11-17
湖北省自然科学基金项目(2011CDB076;2011CDA008),湖北省教育厅项目(B20121402)
付 刚(1969-), 男, 山东滨州人,湖北工业大学硕士研究生,研究方向为生物化工
1003-4684(2017)01-0116-05
Q
A

