A型肉毒毒素对增生性瘢痕成纤维细胞的抑制作用及机制*
张 雪,兰 东,宁淑华,冉立伟,贾红侠,于思思,王晓军
(1.首都医科大学附属北京朝阳医院皮肤与医疗美容科,北京 100043;2.中国医学科学院北京协和医院美容外科,北京 100730)
A型肉毒毒素对增生性瘢痕成纤维细胞的抑制作用及机制*
张 雪1,兰 东1,宁淑华1,冉立伟1,贾红侠1,于思思1,王晓军2
(1.首都医科大学附属北京朝阳医院皮肤与医疗美容科,北京 100043;2.中国医学科学院北京协和医院美容外科,北京 100730)
目的 探讨A型肉毒毒素(BTXA)对增生性瘢痕成纤维细胞的抑制作用及机制。方法 0(对照组)、0.2、0.4、0.8 U/mL的BTXA作用于增生性瘢痕成纤维细胞48 h,噻唑蓝(MTT)法检测细胞活力,Hoechst染色检测细胞凋亡,流式细胞术检测细胞周期,免疫印迹法分析细胞周期蛋白D1(Cyclin D1)、增殖细胞核抗原(PCNA)、磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(AKT)通路的激活状况。结果 与对照组(0.75±0.07)比较,0.2、0.4、0.8 U/mL的BTXA(0.59±0.06、0.43±0.04、0.34±0.03)可明显降低增生性成纤维细胞活力;与对照组[(2.38±0.24)%]比较,可显著提高细胞凋亡率[(15.79±1.54)%、(27.32±2.69)%、(38.46±3.90)%];下调Cyclin D1及PCNA表达,降低PI3K表达及AKT磷酸化水平,并使细胞周期阻滞在G1期,差异均具有统计学意义(P<0.05)。结论 BTXA可通过阻断PI3K/AKT信号通路及细胞周期蛋白表达,进而抑制增生性细胞增殖。
肉毒毒素类;成纤维细胞;细胞周期;增生性瘢痕;磷脂酰肌醇3 激酶/蛋白激酶B信号通路
创面愈合的同时会导致瘢痕的产生,使患者在烧伤或者创面愈合时产生高低不平,形状不规则,局部潮红并伴有灼痛感及瘙痒感的增生性瘢痕。而且当增生性瘢痕发生在面部、关节、手时,会导致挛缩的产生,产生严重的功能障碍,影响美观,给患者带来巨大的生理心理负担,是整形科及烧伤科亟待解决的难题之一[1-2]。研究已显示,成纤维细胞在瘢痕形成过程中起重要作用,细胞数目的增加,凋亡的不足,进而大量分泌胶原,导致细胞外基质过度沉积,是增生性瘢痕形成的机制之一[3-4]。A型肉毒毒素(BTXA)是20世纪90年代初开始用于美容整形外科的一种生物制剂,临床上主要用于去除鱼尾纹、眉间纹、抬头纹等,或者用于面部轮廓的重塑,安全有效[5]。近些年临床及动物实验研究发现,BTAX对增生性瘢痕具有显著疗效[6-8]。此外国内外学者也发现,BTXA不仅能抑制胶原蛋白生成,还能显著抑制增生性瘢痕成纤维细胞增殖,但是具体作用机制未知。所以本研究将探讨BTXA对于增生性瘢痕成纤维细胞增殖的抑制作用及具体机制。
1 材料与方法
1.1 药品与试剂 BTXA购于兰州生物制品研究所。兔细胞周期蛋白D1(Cyclin D1)、增殖细胞核抗原(PCNA)、3-磷酸甘油醛脱氢酶(GADPH)抗体购自美国Epitmics公司;兔磷脂酰肌醇3激酶(PI3K)、蛋白激酶B(AKT)、p-AKT抗体购自美国Cell Signaling Technology公司;DMEM培养基、噻唑蓝(MTT)购自美国Gibco公司;Hoechst染色试剂盒,细胞周期检测试剂盒均购自碧云天生物技术有限公司。
1.2 仪器 ChemiDocTMXRS凝胶成像系统购自美国Bio-Rad公司;FACSAria®Fusion型流式细胞仪购自美国BD公司;电泳仪、转印电泳仪均购自北京六一仪器厂,TS100倒置显微镜购自日本Nikon公司。
1.3 瘢痕组织标本来源 10份标本取自首都医科大学附属北京朝阳医院同期住院并进行手术的临床烧伤患者所切除的瘢痕组织,患者男7例,女3例,年龄11~47岁,平均年龄29岁,病程3个月至2年。患者瘢痕组织红、痒、痛症状明显,说明瘢痕处于增生期,另外取材前所有患者皆无用药史,且知情并签署了同意书。
1.4 方法
1.4.1 增生性瘢痕成纤维细胞的制备[9]在手术过程中获得的增生性瘢痕组织,置于无菌操作台中,用手术剪将皮下组织彻底去除,保留带表皮的瘢痕组织,并将瘢痕组织切成1 mm×1 mm的小组织块,磷酸盐缓冲液(PBS)冲洗干净后,加入0.25 g/LⅡ型中性酶,4 ℃过夜后,再加入3倍体积的2%的Ⅰ型胶原酶,37 ℃培养2 h,即可获得单细胞悬液,1 500 r/min离心10 min,并将细胞溶解于含10%胎牛血清的DMEM培养基中。7 d后首次换液,往后每隔3 d换液1次,大约15 d细胞基本融合成片,以1∶2的比例进行传代,实验取2~4代。
1.4.2 MTT法检测细胞活力 取对数生长期的细胞,将细胞浓度调整为1×105/mL,接种于96孔板,培养24 h,去除培养基后。加入浓度为0、0.2、0.4、0.8 U/mL的BTXA,继续培养48 h,加入终浓度为5 mg/mL的MTT 20 μL,继续培养4 h后,将上清液弃去,并加入二甲基亚砜(DMSO)150 μL,振荡摇匀,在酶标仪570 nm处测定吸光度(A)值。
1.4.3 Hoechst染色检测细胞凋亡 取对数生长期的细胞,将细胞浓度调整为1×105/mL,接种于96孔板,培养24 h,去除培养基后。加入浓度为0、0.2、0.4、0.8 U/mL的BTXA,继续培养48 h后按照Hoechst染色试剂盒说明书进行操作,染色、固定并于显微镜下进行观察、拍照。
1.4.4 细胞周期检测 取对数生长期的细胞,将细胞浓度调整为1×105/mL,接种于6孔板,培养24 h,去除培养基后。加入浓度为0、0.2、0.4、0.8 U/mL的BTXA,继续培养48 h,收集细胞。按细胞周期检测试剂盒说明书进行检测。
1.4.5 Western blot 取对数生长期的细胞,将细胞浓度调整为1×105/mL,接种于6孔板,培养24 h,去除培养基后。加入浓度为(0、0.2、0.4、0.8 U/mL)的BTXA,继续培养48 h,收集细胞,并用细胞裂解液裂解细胞,于4 ℃,10 000 r/min离心10 min,获得蛋白样品。二喹啉甲酸(BCA)检测试剂盒检测蛋白浓度,蛋白煮沸变性,并上样,进行十二烷基磺酸钠凝胶电泳1~2 h后,湿法转膜30~50 min,5%脱脂奶粉封闭1 h后,于一抗溶液4 ℃过夜孵育,次日二抗溶液室温孵育1 h,最后于凝胶成像系统中曝光。并用Quantity one软件分析各蛋白灰度值。
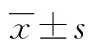
2 结 果
2.1 BTXA对增生性瘢痕成纤维细胞活力的影响 与对照组(0.75±0.07)比较,0.2、0.4、0.8 U/mL BTXA(0.59±0.06、0.43±0.04、0.34±0.03)可明显抑制增生性瘢痕成纤维细胞活力,差异具有统计学意义(P<0.05)。
2.2 BTXA对增生性瘢痕成纤维细胞凋亡情况的影响 与对照组[(2.38±0.24)%]比较,0.2、0.4、0.8 U/mL BTXA可明显提高增生性瘢痕成纤维细胞活力,其凋亡率分别为[(15.79±1.54)%、(27.32±2.69)%、(38.46±3.90)%],差异具有统计学意义(P<0.05)。见图1。
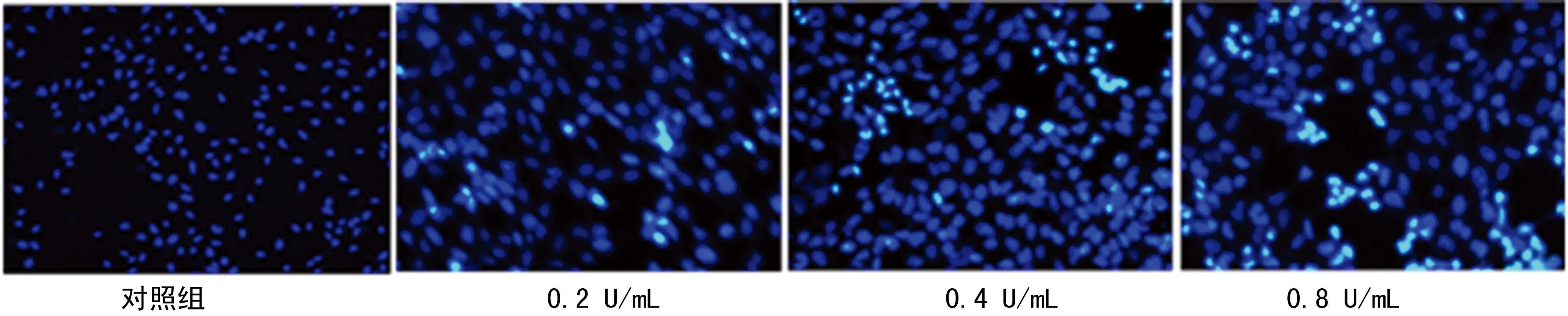
图1 BTXA对增生性瘢痕成纤维细胞凋亡情况的影响(×200)
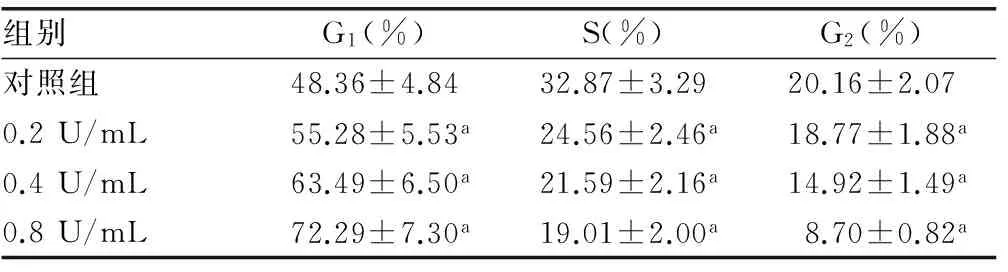
组别G1(%)S(%)G2(%)对照组48.36±4.8432.87±3.2920.16±2.070.2U/mL55.28±5.53a24.56±2.46a18.77±1.88a0.4U/mL63.49±6.50a21.59±2.16a14.92±1.49a0.8U/mL72.29±7.30a19.01±2.00a8.70±0.82a
a:P<0.05,与对照组比较。
2.3 BTXA对增生性瘢痕成纤维细胞细胞周期的影响 与对照组比较,0.2、0.4、0.8 U/mL BTXA能使G1期细胞数目明显增多,S期细胞数目明显减少,G2期细胞数目也明显减少,差异均具有统计学意义(P<0.05)。从而说明BTXA可使增生性瘢痕成纤维细胞细胞周期停滞在G1期。见表1。
2.4 BTXA对增生性瘢痕成纤维细胞细胞周期蛋白的影响 与对照组比较,0.2、0.4、0.8 U/mL BTXA皆能明显下调Cyclin D1及PCNA表达,差异均具有统计学意义(P<0.05)。见图2。

a:P<0.01,与对照组比较。
图2 BTXA对增生性瘢痕成纤维细胞细胞周期蛋白的影响
2.5 BTXA对增生性瘢痕成纤维细胞 PI3K/AKT信号通路的影响 与对照组比较,0.2、0.4、0.8 U/mL BTXA可明显抑制PI3K表达,并降低AKT磷酸化水平,差异均具有统计学意义(P<0.05)。见图3。
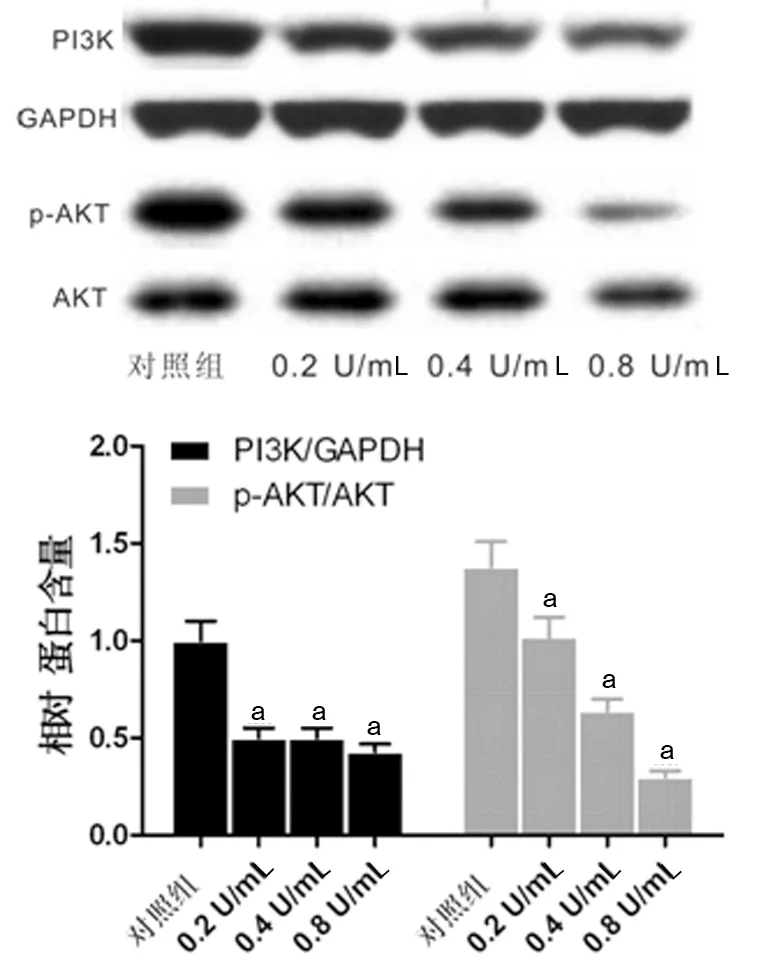
a:P<0.01,与对照组比较。
图3 BTXA对增生性瘢痕成纤维细胞PI3K/AKT信号通路的影响
3 讨 论
BTXA是目前用于神经毒理作用并且研究较为透彻的生物制剂,近年来发现其在整形美容中也具有一定的治疗作用,其应用领域也不断拓宽,成为许多临床手术的辅助手段或者一线治疗方法。临床研究表明,BTXA能减轻早期增生性瘢痕所引起的痛痒,能够促进瘢痕软化及萎缩,减轻挛缩,并使瘢痕颜色变淡,变平整,弹性更好[7-8]。而且国内学者的研究不仅证实了不同浓度的BTXA不仅能够抑制胶原蛋白的表达,还能显著地抑制人增生性瘢痕成纤维增殖,并诱导其凋亡[10-11]。Jeong等[12]研究表明BTXA能显著抑制增生性瘢痕成纤维细胞的分化及肿瘤坏死因子-β1(TGF-β1)的表达。Xiao等[13]研究也表明BTXA通过降低结缔组织生长因子(CTGF)表达,从而抑制增生性瘢痕成纤维细胞的生长及增殖。从而说明BTXA对增生性瘢痕成纤维细胞增殖具有显著的抑制作用,所以本研究将在此基础上探讨BTXA对增生性瘢痕成纤维细胞增殖抑制作用、凋亡诱导作用的具体机制。
本研究首先结合已报道文献[10]及MTT预试验获得0.2、0.4、0.8 U/mL BTXA对增生性成纤维细胞活力具有显著的抑制作用,接着采用Hoechst染色法证实此剂量BTXA还能显著地诱导细胞凋亡。而细胞的增殖受细胞周期调控,细胞周期的紊乱可能是成纤维细胞过度增殖的原因之一[14]。所以本研究继续通过流式细胞术检测BTXA对增生性瘢痕成纤维细胞周期的影响,结果表明0.2、0.4、0.8 U/mL BTXA能显著地延长G1期,而缩短S期及G2期,说明BTXA使细胞周期阻滞在G1期,导致细胞DNA复制和有丝分裂产生障碍,进而诱导细胞凋亡。细胞周期的调控由细胞周期蛋白调控,其中Cyclin D1与G1期密切相关,其表达量的增加说明了细胞加快进入了S期。另外PCNA是细胞核内DNA聚合酶辅助蛋白,其表达量与S期密切相关,并在S期表达量达到顶峰,是反映细胞增殖状态的有效指标。本研究显示,BTXA能显著下调Cyclin D1及PCNA表达,从而说明BTXA通过抑制G1期及S期相关蛋白表达,使细胞周期阻滞在G1期,并最终抑制细胞增殖,诱导细胞凋亡。
细胞的增殖与凋亡受多种信号通路调控,其中PI3K/AKT信号通路最为常见,并具有抗凋亡通路之称,此通路与细胞的生长、增殖、凋亡、分化周期密切相关。具体表现为PI3K接受到上游刺激信号后,被激活,从而促使4-二磷酸脂酰肌醇转化为3,4,5-三磷酸脂酰肌醇,并磷酸化AKT,AKT转入细胞核内,诱导下游基因(Cyclin D1及PCNA)的表达,从而调控细胞的生物学行为。研究显示增生性瘢痕中PI3K/AKT信号通路被激活[15]。所以本研究继续探讨BTXA对增生性瘢痕成纤维细胞中PI3K/AKT激活情况的影响。Western blot结果表明,BTXA能显著抑制PI3K表达,并降低AKT磷酸化水平,从而说明BTXA通过抑制PI3K/AKT信号通路,下调Cyclin D1及PCNA表达,并使细胞周期阻滞在G1期,最终抑制细胞增殖,并诱导细胞凋亡。
[1]Rha EY,Kim YH,Kim TJ,et al.Topical Application of a Silicone Gel Sheet with Verapamil Microparticles in a Rabbit Model of Hypertrophic Scar[J].Plast Reconstr Surg,2016,137(1):144-151.
[2]Zhang YF,Zhou SZ,Cheng XY,et al.Baicalein attenuates hypertrophic scar formation via inhibition of the transforming growth factor-beta/Smad2/3 signalling pathway[J].Br J Dermatol,2016,174(1):120-130.
[3]Zhu Z,Ding J,Shankowsky HA,et al.The molecular mechanism of hypertrophic scar[J].J Cell Commun Signal,2013,7(4):239-252.
[4]孙奎,吴晓明,张鸿霞,等.丝裂霉素C对瘢痕疙瘩成纤维细胞增殖与Smad2/3蛋白表达的影响[J].中国老年学杂志,2012,32(23):5215-5217.
[5]刘睿,李钦涛,齐平建.A型肉毒毒素对比面神经显微血管减压术治疗面肌痉挛的疗效观察研究[J].重庆医学,2016,45(3):417-419.
[6]Caliskan E,Gamsizkan M,Acikgoz G,et al.Intralesional treatments for hypertrophic scars:comparison among corticosteroid,5-fluorouracil and botulinum toxin in rabbit ear hypertrophic scar model[J].Eur Rev Med Pharmacol Sci,2016,20(8):1603-1608.
[7]王小玉,王小琴,刘琰,等.面部小面积瘢痕手术切口早期应用A型肉毒毒素注射联合强脉冲光照射的临床效果[J].实用皮肤病学杂志,2013,6(5):271-273.
[8]王育红,涂惠芳,杜芳,等.A型肉毒素抑制内眦赘皮术后瘢痕的观察[J].国际眼科杂志,2015,15(6):1103-1106.
[9]杜启翠,肖文林,孙桂兰,等.原代培养人增生性瘢痕成纤维细胞的生物学行为[J].中国组织工程研究,2013,17(7):1174-1179.
[10]李卫华,高玉伟,李德水,等.A型肉毒毒素引起人增生性瘢痕成纤维细胞的凋亡[J].中国组织工程研究,2013,17(24):4429-4435.
[11]李卫华,李德水,高玉伟,等.A型肉毒毒素可抑制人增生性瘢痕成纤维细胞增殖和胶原蛋白的合成[J].中国组织工程研究,2012,16(20):3667-3670.[12]Jeong HS,Lee BH,Sung HM,et al.Effect of botulinum toxin type a on differentiation of fibroblasts derived from scar tissue[J].Plast Reconstr Surg,2015,136(2):171e-178e.
[13]Xiao Z,Zhang M,Liu Y,et al.Botulinum toxin type a inhibits connective tissue growth factor expression in fibroblasts derived from hypertrophic scar[J].Aesthetic Plast Surg,2011,35(5):802-807.
[14]吴晓明,孙奎,张宏霞,等.丝裂霉素C影响增生性瘢痕成纤维细胞的凋亡[J].中国组织工程研究,2012,16(2):235-238.
[15]Zhu HY,Li C,Bai WD,et al.MicroRNA-21 regulates hTERT via PTEN in hypertrophic scar fibroblasts[J].PLoS One,2014,9(5):e97114.
Study of mechanism and inhibition of botulinum toxin type A on hypertrohic scar fibroblasts*
ZhangXue1,LanDong1,NingShuhua1,RanLiwei1,JiaHongxia1,YuSisi1,WangXiaojun2
(1.DepartmentofDermatologyandPlasticSurgery,theAffiliatedChaoyangHospitalofCapitalMedicalUniversity,Beijing100043,China;2.DepartmentofCosmeticSurgery,theAffiliatedBeijingUnionHospitalofChineseAcademyofMedicalSciences,Beijing100730,China)
Objective To explore the mechanism and inhibition of botulinum toxin type A (BTXA)on hypertrohic scar fibroblasts.Methods The cells were treated by 0 (control),0.2,0.4,0.8 U/ml BTXA for 48 h.Cell viability was detected by MTT assay.Cell apoptosis was detected by Hoechst staining.Cell cycle was detected by flow cytometry.The level of cell cycle related protein D1 (Cyclin D1),proliferation nuclear antigen (PCNA)and activation of phosphatidylinositol 3 kinase (PI3K)/ protein kinase B (AKT)signaling pathway were assayed by western blot.Results Compared with control group(0.75±0.07),0.2,0.4,0.8 U/mL BTXA(0.59±0.06,0.43±0.04,0.34±0.03)inhibited hypertrohic scar fibroblasts cell viability,increased cell apoptotic rate[control group(2.38±0.24)%;BTXA(15.79±1.54)%,(27.32±2.69)%,(38.46±3.90)%],down-regulated the expression of Cyclin D1(control group 1.57±0.18;BTXA 0.93±0.07,0.42±0.04,0.35±0.03)and PCNA(control group 1.46±0.16;BTXA 0.50±0.05,0.59±0.05,0.37±0.03),inhibited the expression of PI3K(control group 0.98±0.06;BTXA 0.49±0.04,0.50±0.04,0.39±0.03)and the phosphorylation of AKT(control group 1.38±0.08;BTXA 0.97±0.06,0.60±0.04,0.29±0.02),made cell cycle arrested in G1phase,The difference was statistically significant (P<0.05).Conclusion These results suggested BTXA inhibit proliferation via blocking the activation of PI3K/AKT signal pathway and down-stream related cell cycle related protein.
botulinum toxins;fibroblasts;cell cycle;hypertrohic scar;phosphatidylinositol 3 kinase/protein kinase B signal pathway
��·基础研究
10.3969/j.issn.1671-8348.2017.05.002
国家自然科学基金资助项目(81071571)。 作者简介:张雪(1981-),主治医师,硕士,主要从事创面修复、瘢痕治疗方面的研究。
R619+6
A
1671-8348(2017)05-0580-03
2016-06-19
2016-08-17)

