新型雌激素受体GPR30在非小细胞肺癌增殖中的作用研究*
阮姝琴,黄 伟,杨志祥,韦 凤,唐 敏
(重庆市人民医院:1.肿瘤血液科;2.胸外科 400013)
新型雌激素受体GPR30在非小细胞肺癌增殖中的作用研究*
阮姝琴1,黄 伟2△,杨志祥1,韦 凤1,唐 敏1
(重庆市人民医院:1.肿瘤血液科;2.胸外科 400013)
目的 研究G蛋白耦联受体30(GPR30)在非小细胞肺癌(NSCLC)中的表达及其与临床主要病理特征的关系,并分析GPR30和Ki-67表达的相关性,探讨雌激素通过激活GPR30受体信号途径调节NSCLC增殖的分子机制。方法 采用免疫组织化学方法检测80例术后非小细胞肺癌组织样本中GPR30和Ki-67的表达。加入17-β-雌二醇或G-1后,计数H1299细胞,流式细胞术检测细胞周期分布,最后通过Western blot方法检测G-1作用后ERK1/2的激活状态以及cyclin D1和P16蛋白的表达。结果 GPR30更多表达在腺癌、低分化、Ⅲ期NSCLC肿瘤组织,差异有统计学意义(P<0.05); GPR30表达和Ki-67呈中度相关性(r=0.502,P=0.000)。E2(或G-1)促进H1299细胞增殖,并且更多的细胞进入S期;加入G-1后,磷酸化ERK1/2以及cyclin D1表达增加,而p16蛋白表达减少,以上效应能被G-15或U0126预处理2 h阻断。结论 雌激素通过激活GPR30-EGFR-MAPKs信号转导途径促进H1299增殖。阻断GPR30信号途径可能成为NSCLC治疗的新靶点。
癌,非小细胞肺;细胞周期;细胞增殖;G蛋白耦联受体30;ki-67
非小细胞肺癌(non-small cell lung cancer,NSCLC)约占全部肺癌的80%,其发病及病理特点有明显的性别差异,不论是否吸烟,女性更易发展为肺腺癌,雌激素信号途径的激活可能参与NSCLC的发生发展[1]。G蛋白耦联受体30(G protein-coupled receptor 30,GPR30)是新发现的雌激素受体,已被证实参与乳腺癌、前列腺癌等多种恶性肿瘤的发病机制[2]。但在肺癌尤其是NSCLC中关于GPR30的研究鲜见报道。本研究拟在NSCLC术后组织中研究GPR30和Ki-67的表达及其与临床主要病理特征的关系,并以人肺腺癌细胞株H1299为模型,探讨雌激素通过激活GPR30受体信号途径调节NSCLC增殖的分子机制,为研究NSCLC尤其是女性肺癌的发病机制以及寻找新的肺癌肿瘤标志物和分子治疗靶点提供依据。
1 资料与方法
1.1 一般资料 NSCLC术后石蜡组织样本随机选取自本院2008年1月至2014年5月收治的80例NSCLC患者,术前均未接受过化放疗,年龄43~78岁,平均67岁,均经病理检查证实。H1299细胞购自中科院细胞库,使用添加10%胎牛血清的1640培养液,培养于含5%CO2饱和湿度的37℃恒温培养箱中,适时传代。
1.2 方法
1.2.1 主要试剂 G-1和G-15购自德国Merck Chemicals,17β-雌二醇购自美国Sigma,U0126购自美国CST,ERK1 (pT202/)/ERK2 (pT185)Phospho单克隆抗体、Anti-ERK1单克隆抗体、cyclin D1单克隆抗体、p16单克隆抗体、Ki-67单克隆抗体,α-tublin单克隆抗体、GPR30 多克隆抗体购自英国ABCAM。M-PER哺乳动物蛋白提取试剂盒和BCA蛋白分析试剂盒购自美国Thermo Scientific,EZ-ECL化学发光检测试剂盒(ECL A液+ECL B液)购自以色列Bioind。
1.2.2 增殖实验分组 取第三代生长状态良好的H1299细胞,先根据实验第3天加入的不同处理药物分为溶剂、E2、G-1 3组,再根据处理药物加入前2 h加入的抑制剂分别分为3组,共9组:溶剂、溶剂(G-15)、溶剂(U0126),E2、E2(G-15)、E2(U0126),G-1、G-1(G-15)、G-1(U0126),括号内为抑制剂。
1.2.3 免疫组织化学 采用免疫组织化学Elivision Plus法检测组织中GPR30和Ki-67的表达,用已知的阳性切片作阳性对照,用PBS代替一抗作阴性对照。
1.2.4 细胞增殖实验 H1299细胞以3×104个/孔的密度接种于24孔板。用完全培养基培养24 h后,换为无酚红的只含有2% 活性炭处理过的胎牛血清的培养基,并加入不同的处理药物,每两天更换一次新鲜的培养基。细胞分别在处理后第3天用胰酶消化后收集起来,用血细胞计数器计数。
1.2.5 流式细胞术检测细胞周期 取对数期生长的细胞用胰酶消化制成细胞悬液(浓度为5×105/mL),平铺于6孔板中,每孔加入2 mL,置于37℃、5%CO2孵箱中培养24 h,去除培养基,按不同分组进行药物处理。24 h后消化收集细胞,预冷的PBS洗涤2次,残留50 μL PBS,轻轻弹击离心管底部,适当分散细胞,加入1 mL冰浴预冷的70% 乙醇轻轻吹打混匀,-20 ℃冰箱固定过夜,离心去除固定液,预冷PBS洗涤1次,加入500 μL配制好的碘化丙啶染色液37 ℃避光温育30 min,300目(孔径40~50 μm)尼龙网过滤,BD Accuri C6流式细胞仪检测样品,Flowjo 7.6软件分析周期分布。
1.2.6 Western blot法 Western blot法检测cyclin D1、p16、磷酸化ERK1/2、Anti-ERK1蛋白在H1299细胞株中的表达。按说明书提取各细胞株总蛋白,按照BCA蛋白定量试剂盒操作说明测定蛋白浓度,样品均定量为5 g/L,每条泳道上样60 μg蛋白,经12% 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,电压80 V经80 min电转移至PVDF膜。5% 脱脂奶粉封闭2 h,加入一抗,4℃ 孵育过夜。TBST洗膜后,用二抗室温孵育1.5 h,TBST清洗,ECL发光并以凝胶显像仪显像。
1.2.7 免疫组织化学结果判断 由两位病理医师进行双盲法观察,对免疫组织化学结果进行评估。结果判读标准:阳性染色为棕黄色颗粒,GPR30表达在细胞膜或细胞质;Ki-67表达在细胞核。综合染色强度和分布范围进行评分,阴性为0分;染色弱或细胞质染色的细胞数小于10%为1分;染色清晰或染色强者细胞数10%~50% 为2分,染色强者细胞数大于50% 为3分。0~1分为阴性,2分及以上者为阳性。
1.3 统计学处理 用SPSS17.0软件对数据进行统计和分析。免疫组织化学实验相关性分析用Spearman法进行统计,组间比较采用χ2检验;细胞增殖实验结果用mean±SD表示,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 GPR30表达与NSCLC临床病理特征的关系 GPR30表达在腺癌、低分化、Ⅲ期肿瘤表达率更高,差异具有统计学意义(P<0.05);尽管和性别以及肿瘤大小的相关性差异无统计学意义(P>0.05),但在女性以及直径大于5 cm的肿瘤表达率更高;GPR30表达与淋巴结转移无相关性(P>0.05),见图1及表1。
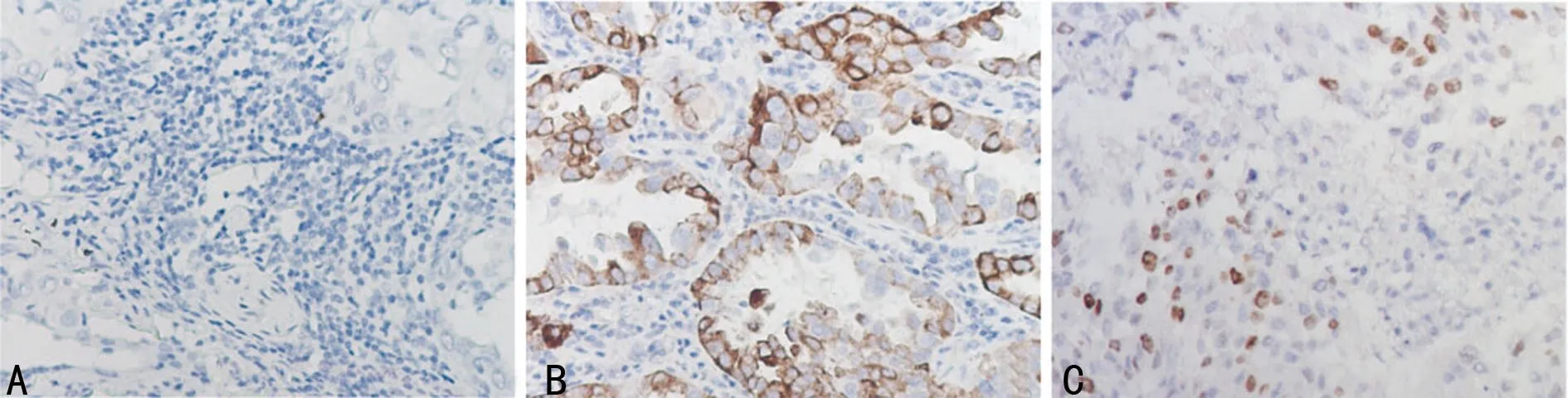
A:NSCLC组织阴性对照;B:GPR30在NSCLC组织中的表达;C:Ki-67在NSCLC组织中的表达。
图1 免疫组织化学检测GPR30和Ki-67在NSCLC组织中的表达(SP×400)
a:腺癌与鳞癌相比较。
2.2 GPR30表达在NSCLC组织样本中与Ki-67表达具有相关性 免疫组织化学结果显示GPR30的阳性表达率为46.25%(37/80),Ki-67为60.00%(48/80),两者经Spearman相关性分析呈正相关(r=0.502,P=0.000),见图1及表2。
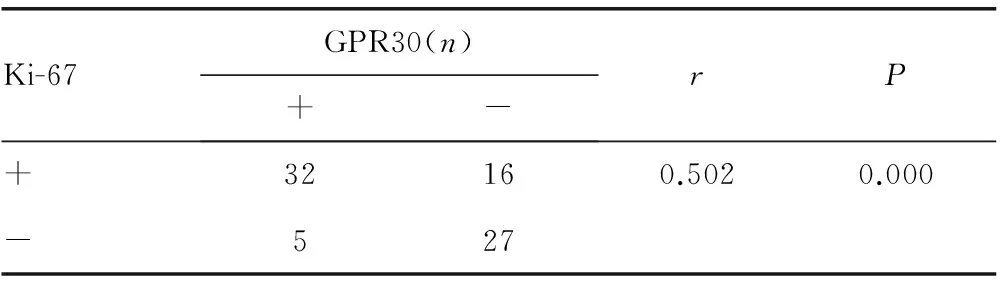
表2 NSCLC 组织中GPR30与Ki-67的相关性
2.3 激活GPR30促进了H1299细胞增殖 GPR30作为新的雌激素受体能与E2相结合,从而改变细胞的生物学功能。H1299细胞虽然不表达经典的雌激素受体ER,但GPR30表达阳性,因而能与E2结合。发现在实验第3天,加入E2或GPR30特异性激动剂G-1,H1299细胞计数明显增加(P<0.01,图2)。
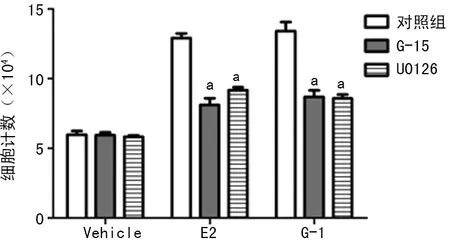
a:P<0.05,与对照组比较。
图2 E2或G-1促进H1299细胞增殖
2.4 激活GPR30对H1299细胞周期的影响 以G-1作为GPR30的刺激因素观察GPR30对H1299细胞周期的调节作用。实验发现加入G-1后第3天,更多的细胞进入了S期(25.17%),见图3。

图3 经过不同药物处理H1299细胞3 d后周期的分布

图4 不同作用时间的G-1在H1299细胞引起cyclin D1和 p16蛋白表达
2.5 GPR30促增殖作用与EGFR-MAPKs信号途径相关 在细胞增殖实验中也观察到在加入E2(或G-1)前用GPR30特异性拮抗剂G-15或MEK1/2 抑制剂U0126预处理2 h后,E2(或G-1)的促增殖作用被抑制(P<0.01)。见图2。类似的,在细胞周期实验中发现用G-15或U0126预处理后,细胞被阻滞在了G1期(69.44%,79.17%),见图3。进一步用Western blot方法检测了EGFR-MAPKs途径的重要信号分子ERK1/2的激活状态以及下游的细胞周期相关蛋白cyclin D1和p16蛋白的表达,发现在加入G-1后,磷酸化ERK1/2以及cyclin D1表达增加,而p16蛋白表达减少;而用G-15或U0126预处理2 h后,则变化相反(图4、5)。
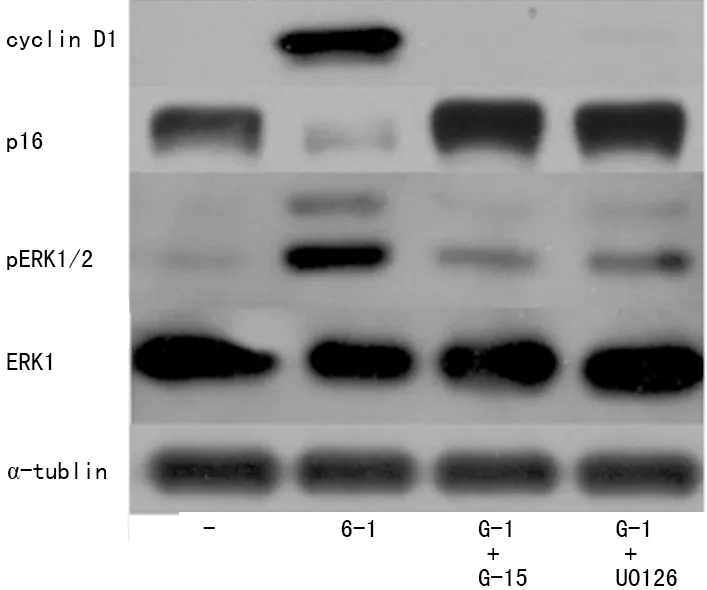
图5 G-1在H1299细胞通过EGFR-MAPKs信号转导途径调节cyclin D1和 p16蛋白表达
3 讨 论
近年来在激素相关的恶性肿瘤组织,如乳腺癌、子宫内膜癌、前列腺癌、卵巢癌、子宫内膜癌等中发现GPR30存在表达增加[2]。GPR30在大鼠肺部肿瘤也被检测到高水平表达,可能与雌激素引起的扩增信号应答有关[3]。GPR30在人类肺癌中的表达鲜见报道,国外2012年发表的一项研究结果证实,相较于正常肺组织和正常肺支气管上皮细胞,GPR30的表达在NSCLC组织及细胞系明显增高[4]。Ki-67是一种增殖细胞核抗原,其功能与有丝分裂密切相关,其表达水平与肿瘤细胞的增殖呈正相关。本研究发现GPR30在女性以及直径大于5 cm的NSCLC组织肿瘤表达率更高,与Ki-67的表达也呈正相关,提示GPR30在NSCLC的增殖中可能发挥作用。
GPR30不仅能通过其他信号途径间接调节雌激素的功能,也能直接与内源性雌激素、环境雌激素、三苯氧胺、特异性激动剂G-1等结合影响下游的快速(非基因组)/慢速(基因组)效应[2]。大量的研究已经证明,雌激素能促进表达经典雌激素受体ERα和ERβ的NSCLC细胞株增殖[5]。NSCLC细胞株H1299表达GPR30,但不表达经典的雌激素受体ER,可作为较好的研究GPR30的模型。本研究选用E2以及G-1作为GPR30的激活因素,发现两者均能促进H1299细胞株增殖,加入GPR30特异性拮抗剂G-15后能抑制其促增殖效应,提示E2或G-1是通过激活GPR30受体促进增殖。
GPR30属于G蛋白偶联受体(GPCRs),与其他GPCRs家族成员类似,雌激素或其他配体与GPR30结合后,GPR30活化其偶联G蛋白,解离出αβγ亚基进而激活Src相关酪氨酸激酶,接着活化基质金属蛋白酶(MMPs)促使肝素结合表皮生长因子(HB-EGF)释放,后者反式激活表皮生长因子受体EGFR,随后活化下游多条信号途径,继而参与细胞的增殖、迁徙和分化等,其中以EGFR-MAPKs途径最为重要。在乳腺癌、子宫内膜癌、卵巢癌、甲状腺癌和头颈部鳞癌等多种不同来源的肿瘤细胞系中都存在GPR30被配体激活后通过反式激活EGFR-MAPKs途径而促进增殖的现象[6]。对细胞周期的调节可能是GPR30影响增殖的重要机制,如c-fos,c-jun,cyclin D1、D2,p21,p53等与细胞凋亡和细胞周期相关的一些重要分子位于GPR30-EGFR-MAPKs信号途径的下游[7]。细胞周期蛋白cyclin D1是原癌基因,其编码的蛋白产物与细胞周期蛋白依赖性激酶CDK4或CDK6在细胞G1期,通过抑制CDK4的活性在细胞周期G1-S检查点中发挥正性调控作用,启动细胞周期并促进DNA合成,加速细胞增殖。p16基因作为肿瘤抑制基因,该基因编码的蛋白可与cyclin D1蛋白竞争调控CDK4/CDK6的活性,有效阻止细胞进入S期。大多数恶性肿瘤存在p16蛋白表达下调,在NSCLC组织中也检测到p16、cyclin D1蛋白的表达呈负相关[8]。在甲状腺癌细胞系,GPR30的激活通过上调cyclin D1表达而促进增殖[9]。本研究发现,更多的H1299细胞在G-1作用后进入了S期,且EGFR-MAPKs信号途径的关键分子ERK1/2活化增加,下游的细胞周期蛋白cyclin D1增加,p16蛋白表达下调,以后效应均能被G-15以及MEK1/2 抑制剂U0126阻断,提示EGFR-MAPKs途径参与了GPR30被激活后促进NSCLC细胞的增殖作用。
本研究结果证实了雌激素能通过GPR30-EGFR-MAPKs途径促进NSCLC细胞增殖,为探讨NSCLC发病特点的性别差异提供新的思路,对其分子机制的进一步研究将有助于寻找新的治疗靶点和制定新的治疗策略。
[1]Sathish V,Martin YN,Prakash YS.Sex steroid signaling:Implications for lung diseases[J].Pharmacol Ther,2015,150(2):94-108.
[2]Prossnitz ER,Barton,M.Estrogen biology:New insights into GPER function and clinical opportunities[J].Mol Cell Endocrinol,2014,389(1-2):71-83.
[3]Hamilton DH,Griner LM,Keller JM,et al.Targeting rstrogen teceptor dignaling with gulvestrant rnhances immune and chemotherapy-mediated cytotoxicity of human lung cancer[J].Clin Cancer Res,2016,22(24):6204-6216.
[4]Jala VR,Radde BN,Haribabu B,et al.Enhanced expression of G-protein coupled estrogen receptor (GPER/GPR30)in lung cancer[J].BMC Cancer,2012,12(7):624.
[5]Verma MK,Miki Y,Sasano H.Sex steroid receptors in human lung diseases[J].J Steroid Biochem Mol Biol,2011,127(3-5):216-222.
[6]Ruan SQ,Wang ZH,Wang SW,et al.Heregulin-β1-induced GPR30 upregulation promotes the migration and invasion potential of SkBr3 breast cancer cells via ErbB2/ErbB3-MAPK/ERK pathway[J].Biochem Biophys Res Commun,2012,420(2):385-390.
[7]Lappano R,De Marco P,De Francesco EM,et al.Cross-talk between GPER and growth factor signaling[J].J Steroid Biochem Mol Biol,2013,137(1):50-56.
[8]Zuryn A,Litwiniec A,Safiejko-Mroczka B,et al.The effect of sulforaphane on the cell cycle,apoptosis and expression of cyclin D1 and p21 in the A549 non-small cell lung cancer cell line[J].Int J Oncol,2016,48(6):2521-2533.
[9]Adele V,Daniela B,Lidia A,et al.17β-Estradiol,genistein,and 4-hydroxytamoxifen induce the proliferation of thyroid cancer cells through the G protein-coupled receptor GPR30[J].Mol Pharmacol,2006,70(4):1414-1423.
Study on the role of GPR30 in the proliferation of Non-small cell lung cancer*
RuanShuqin1,HuangWei2△,YangZhixiang1,WeiFeng1,TangMin1
(1.DepartmentofOncologyandHematology;2.DepartmentofThoracicSurgery,ChongqingGeneralHospital,Chongqing400013,China)
Objective To evaluate the expression of GPR30 and Ki-67 in Non-small cell lung cancer(NSCLC)and the relationship between them.The clinicopathological features of GPR30 in NSCLC were also analyzed.The molecular mechanism that estrogen mediated the proliferation of H1299 by activating GPR30 was further studied.Methods The expression of GPR30 and Ki-67 in 80 cases of specimens of NSCLC after surgery was examined using immunohistochemistry method.After 17-β-estradiol(E2)or G-1 added,H1299 cells were counted and the cell cycle distribution was analyzed by flow cytometry.Finally,the activated ERK1/2 and the expression of cyclin D1 and p16 after G-1 treatment in H1299 cells were examined through western blotting.Results Expressions of GPR30 was more in stage Ⅲ or low differentiation tissues or adenocarcinoma (P<0.05).A positive correlation between GPR30 and Ki-67 was further disclosed (r=0.502,P=0.000).The proliferation of H1299 cells was promoted and more cells entered S-phase after E2or G-1 treatment for 3 days,which could be inhibited after G-15 or U0126 pre-treatment for 2 hours.We further discovered that the activated ERK1/2 and cyclin D1 expression increased after G-1 treatment,which was blocked after G-15 or U0126 pre-treatment for 2 hours.The change of p16 was on the opposite.Conclusion A positive correlation existed between GPR30 and Ki-67.GPR30-EGFR-MAPKs signaling transduction pathway was involved in the estrogen-induced proliferation of NSCLC cells.Blocking GPR30 signaling pathway may be a promising new strategy for NSCLC treatments.
carcinoma,non-small-cell lung;cell cycle;cell proliferation;G protein-coupled receptor 30;ki-67
��·临床研究
10.3969/j.issn.1671-8348.2017.05.013
重庆市卫生局医学科研项目(2013-2-111);重庆市渝中区科技计划项目(20130144)。 作者简介:阮姝琴,博士,副主任医师,主要从事恶性肿瘤综合治疗及研究工作。△
,E-mail:jiangjj26@163.com。
R734.2
A
1671-8348(2017)05-0615-04
2016-07-21
2016-09-19)

