类固醇激素合成调节因子在小鼠下丘脑和卵巢上的分布
王彩云 , 潘 登 , 张召议 , 范奎奎 , 李 婷 , 杜晨光,2
(1.内蒙古农业大学兽医学院 , 内蒙古呼和浩特010018 ; 2.内蒙古农业大学职业技术学院 , 内蒙古包头014109)
类固醇激素合成调节因子在小鼠下丘脑和卵巢上的分布
王彩云1, 潘 登1, 张召议1, 范奎奎1, 李 婷1, 杜晨光1,2
(1.内蒙古农业大学兽医学院 , 内蒙古呼和浩特010018 ; 2.内蒙古农业大学职业技术学院 , 内蒙古包头014109)
下丘脑作为神经活动中枢具有调控能量平衡和生殖的重要作用。CYP17A1、类固醇激素急性调节蛋白(StAR)和1型蛋白(HSD3B1)作为对生殖过程中类固醇激素合成过程的关键调控因子,其在小鼠下丘脑和卵巢中表达部位尚不明确。本研究应用免疫荧光检测了小鼠下丘脑中上述调节因子的神经元表达位置和在卵巢中的分布情况。结果显示,CYP17A1在小鼠的下丘脑腹内侧核和穹窿处具有区域性分布的同时也表达在成熟的黄体组织中。HSD3B1主要表达在卵泡的颗粒细胞,StAR与CYP17A1在卵母细胞中存在共表达关系。上述结果提示,下丘脑中CYP17A1在下丘脑-垂体-性腺轴中,并可能参于调控小鼠卵巢类固醇激素的合成;StAR,HSD3B1不仅存在于下丘脑的神经元中,也同样存在于卵巢组织中,参与类固醇激素的合成。本文为进一步研究下丘脑调控卵巢合成类固醇激素的生理过程提供了基础。
下丘脑 ; 卵巢 ; CYP17A1 ; StAR ; HSD3B1
P45017A1(17α-hydroxylase/17,20-lyase cytochrome P450)是P450酶系家族中的微粒体,最初在人类肾上腺皮质网状带中发现的由CYP17A1基因进行编码。它在不同的机体组织中具有不同的酶活性,具体表现为:17α-羟化酶在肾上腺皮质部参与糖皮质激素的合成,17α-羟化酶和17,20-裂解酶在性腺中参与睾酮和雌二醇的合成[1]。类固醇激素急性调节蛋白(steroidogenic acute regulatory protein,StAR)是一个30 kDa大小的蛋白,调节类固醇激素从线粒体的外膜转运到线粒体的内膜的过程[2]。有研究表明,StAR的表达主要在原位的卵泡排卵前的颗粒细胞中和卵泡膜细胞黄体化后的细胞中。在3β-羟基类固醇脱氢酶系(3β-hydroxysteroid dehydrogenases)中,其1型蛋白(HSD3B1)在合成孕酮的过程中主要参与前体物质孕烯醇酮向孕酮的转化过程,并且在之前的研究中表明,HSD3B1在类固醇转化过程中具有一定的限速酶作用[3]。CYP17A1、StAR、HSD3B1在不同的黄体细胞中存在,并且高度的表达。三者的配合会引发类固醇激素的合成过程的顺利进行[4]。不仅调节雌二醇转化为孕酮的过程,同时,还与卵巢相关的类固醇的合成有关[5]。由此可见,这三者在调节卵巢中类固醇激素的合成过程中,发挥了关键性的作用,并且保障了生殖机能的顺利进行。促性腺激素(GnRH)分布在动物的下丘脑中,可以刺激垂体释放卵泡刺激激素(FSH)和黄体生成素(LH)。在雌性动物中,FSH和LH在下丘脑的调控下能够依次刺激卵泡的生长发育和黄体的形成;对于雄性动物而言,LH刺激间质类固醇合成睾丸激素,作用到睾丸间质和生精小管促进精子的成熟,FSH则影响配子的细胞增值和分化[6],因此大脑在调控雌性生殖功能方面具有举足轻重的作用。另外,在睾酮向雌二醇转化的过程中,CYP17A1、StAR、HSD3B1为这一过程的调控提供了转化环境和引导。本试验主要以雌性小鼠为研究对象。基于之前的研究结果,我们推测这些参与下丘脑对于生殖调控的关键性因子也应该体现在卵巢中的相应部位来发挥相应的功能。为了验证这一推测的可靠性,我们应用免疫荧光技术对合成类固醇激素的过程中发挥主要作用的3种因子(CYP17A1、StAR、HSD3B1)在下丘脑和卵巢上的表达部位进行荧光信号的定位,为进一步研究下丘脑调控卵巢的机理的研究奠定基础。
1 材料与方法
1.1 试验材料 试验中使用的小鼠品种为C57BL/6体重(22~25)g,雌性,购自北京维通利华实验动物技术有限公司。为避免试验中应激反应的出现,小鼠在试验前的5 d给予生理盐水的训练(上午9:00)。试验期间小鼠自由饮水和进食并在12 h昼夜交替的环境下进行饲养(7:00午前~7:00午后给予光照)。选取健康的小鼠进行下一步的试验。
1.2 小鼠性周期的鉴定 选取体重健康状态相近的小鼠(n=5),使用50 μL室温的生理盐水对小鼠的阴道上皮细胞进行冲洗,之后将小鼠的阴道上皮细胞滴加在防脱载玻片上,待液体自然风干后,滴加95%乙醇进行固定10 min,之后使用蒸馏水进行冲洗。自然风干后向其中滴加1%龙胆紫溶液,作用10 min,冲洗干净后使用光学显微镜进行观察(奥林巴斯XSP-2C)。
1.3 材料的获取和保存 用于免疫荧光的试验材料在取材之前先使用100 mL冷的生理盐水对小鼠进行灌注,之后换为4%多聚甲醛(PFA,pH值7.4,Sigma公司)灌注20 min。灌注后在冰上取小鼠的下丘脑和卵巢,并将组织放在4%PFA中进行6 h的固定。组织的脱水在30%蔗糖溶液中进行,直至开始切片。切片使用Lecia CM1950型冰冻切片机进行,小鼠下丘脑切片厚度为30 μm,卵巢的切片厚度为10 μm。
1.4 小鼠脑部神经元免疫荧光 组织在1%TritonX-100 (pH值7.4,T8787,Sigma公司)中预处理30 min,之后使用1%硼氢化钠(71321,Sigma公司)进行封闭前的预处理,30 min后转为封闭。封闭液使用3%正常驴血清(Normal Donkey Serum,017-000-121,Jackson)时间为1 h。之后使用Goat anti-CYP17A1(1∶200,ab48019 Abcam)一抗,脱色摇床上4 ℃ 过夜孵育。二抗使用Alexa 561标记的Donkey anti-Goat(1∶800,705-165-147,Jackson)室温进行处理,时间为2 h。组织使用PBST(含1%TritonX-100)进行清洗,完毕之后在多聚赖氨酸处理过的载玻片上进行贴片,风干过夜。使用Nikon C2 plus Confocal进行成像和图像的分析。试验结果中,小鼠脑布表达区域的判定以George Paxinos 和Keither B.J.Franklin编写的《小鼠脑布立体坐标》第二版中的标注为参考。
1.5 小鼠卵巢免疫荧光 卵巢组织切片后快速贴在防脱载玻片上(世泰)。待卵巢牢固贴在防脱载玻片上后,使用0.01 mol/L PBS避光进行清理。之后使用0.5%TritonX-100 (pH值7.4,T8787,Sigma公司)预处理30 min。之后使用3%正常驴血清进行封闭(Normal Donkey Serum,017-000-121,Jackson)1 h。一抗使用 Goat anti-CYP17A1(1∶200,ab48019,Abcam),Mouse anti-PCNA (1∶500,ab29,Abcam),和Rabbit anti-StAR (1∶250,ab203193,Abcam),4 ℃孵育过夜。之后使用0.01 mol/L PBS清洗3次,每次10 min。二抗使用Alx 561 Donley anti-Goat (1∶800,705-165-147,Jackson),Alx 488 Donkey anti-Mouse (1∶800,715-545-150,Jackson) 和 Alx 647 Donkey anti-Rabbit (1∶800,711-605-152,Jackson)进行特异性结合,室温避光孵育2 h。之后使用含有1%Tween-20 (Sigma公司)的0.01 mol/L PBS进行避光清洗。
2 结果
2.1 小鼠性周期的鉴定 在小鼠阴道上皮细胞结果中,小鼠的阴道上皮细胞在龙胆紫染色的结果下,呈现出无核角质化上皮细胞的形态(染色质染色不均匀,细胞皱缩,缺少细胞核),并且在视野中没有白细胞和有核上皮细胞的出现(见中插彩版图1),可以鉴定出小鼠所处的性周期为发情期。
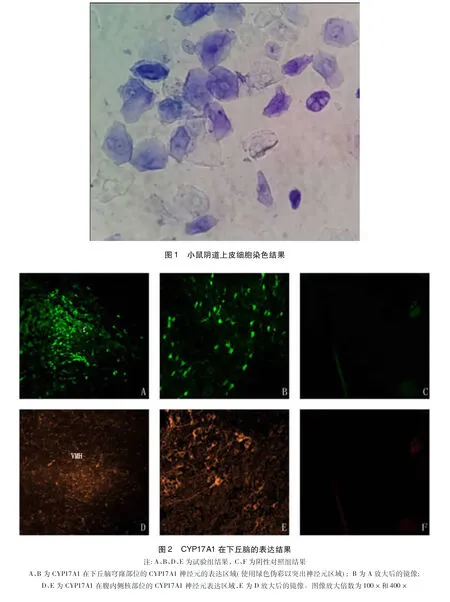
2.2 CYP17A1在下丘脑的表达 从试验结果中可以得知,CYP17A1在下丘脑的腹内侧核(ventromedial hypothalamic nucleus,VMH) 和穹窿(fornix,f)部位集中表达(Bregma=-1.70 mm)。CYP17A1神经元在小鼠下丘脑的穹窿(见中插彩版图2,A)和腹内侧核(见中插彩版图2,D)的表达区域的荧光结果,放大倍数为100 X。为了清晰的显示神经元的具体形态,我们对穹窿(见中插彩版图2,B)和腹内侧核(见中插彩版图2,D)进行了放大(400×)。从中我们可以看到试验组(A、B、D、E)的CYP17A1在小鼠下丘脑腹内侧核(ventromedial hypothalamic nucleus,VMH)和穹窿(fornix,f)部位均存在CYP17A1神经元荧光信号的集中表达,而且在其周围部位也有少量散在地表达,但是荧光信号并不明显。表达CYP17A1的神经元细胞染色结果清晰、荧光亮度远远高于背景荧光值,呈典型的神经元形态,有明显轴突,而且CYP17A1的荧光信号表达则表现为神经元的胞质部和膜上,可以看出细胞核中基本不表达CYP17A1的荧光信号。在阴性对照组中没有关于CYP17A1相关神经元荧光信号的表达。
2.3 CYP17A1在黄体和卵泡中的表达 从试验结果中可知,CYP17A1在小鼠黄体(见中插彩版图3,A)和次级卵泡(见中插彩版图3,B)中均有表达。CYP17A1集中表达在小鼠的黄体组织和次级卵泡的壁颗粒细胞。对于已经黄体化的卵巢组织部位,CYP17A1在卵巢的间质组织中没有显示出较强的荧光信号,在卵母细胞中存在CYP17A1的特异性荧光信号。
我们以CYP17A1和PCNA的免疫荧光双标,以体现未发育的卵泡和黄体中的CYP17A1的荧光信号变化。由中插彩版图4中可以看出,CYP17A1在未发育状态下的卵泡中集中表达在卵母细胞的位置,对于发育后的黄体细胞而言CYP17A1,则主要表现在黄体细胞中。
2.4 卵巢类固醇激素中CYP17A1,StAR,HSD3B1间的关系 由中插彩版图5可知,小鼠的卵巢中CYP17A1主要在发情期卵巢的黄体组织和卵母细胞中表达,CYP17A1的表达位置和StAR以及HSD3B1的表达信号都出现在小鼠的颗粒细胞中,其中CYP17A1和StAR的荧光信号还出现在卵巢的卵母细胞中,而HSD3B1在透明带中具有表达,卵母细胞中未检测到荧光信号的存在。
3 讨论
CYP17A1、HSD3B1、StAR作为调控小鼠类固醇激素合成和孕酮的合成过程中的关键的酶,在小鼠的卵巢周期性变化和性行为方面具有关键性的作用。本试验结果显示,CYP17A1在小鼠的下丘脑以及卵巢上均有表达分布,从而证明下丘脑具有调控生殖的相关因子的表达。
下丘脑作为动物机体的生命中枢,具有调节能量代谢和生殖的多重作用。值得注意的是,动物机体内可能存在有下丘脑-垂体-性腺轴,并且在小鼠的生殖和应激过程的反馈中发生主要的调控作用[7]。试验结果表明,下丘脑具有调节小鼠上述类固醇激素相关的酶存在,并且可能参与到卵巢的生理性变化的调控中进而影响小鼠的生殖活动。在雌性动物的性周期变化中,17β-雌二醇会在排卵前促进下丘脑的GnRH的释放,并且这种神经化学作用的发生会减少LH激素释放的减少和相应的作用的衰减[8]。在我们的试验结果中我们检测到了黄体发育过程中相关的调节因子CYP17A1的表达,并且有证据表明,下丘脑存在HSD3B1和StAR的表达,并且对于小鼠的类固醇激素的合成过程以及小鼠的LH峰的到来起到了关键性的作用,这种作用同样会有雌激素的参与和下丘脑弓状核雌激素α受体的调节[9]。这些结果在一定程度上说明了下丘脑和卵巢中的类固醇合成调节因子会在下丘脑和卵巢上同时发挥作用,并且这种作用可能是由下丘脑率先发出的指令,CYP17A1和HSD3B1在促进LH峰的到来的过程中起到了关键酶的作用[10]。
StAR则参与到了类固醇激素的转运过程和孕酮的合成过程。之前的研究表明,StAR在类固醇激素的合成过程中发挥了急性调节的作用,StAR缺陷小鼠在类固醇激素的合成过程中出现障碍[11],并且在StAR的作用过程中也会激活其关键性通路ERk 1/2[12]。我们的试验结果也表明,StAR在下丘脑和卵巢上均存在表达,并且StAR在发育中卵泡的卵母细胞内出现了较高的相对表达量。结合之前下丘脑-垂体-性腺轴的研究,我们猜测,下丘脑和卵巢在雌性小鼠类固醇激素的合成过程中共同发挥作用。
结合已有的结果我们可以得知,CYP17A1在成熟的黄体细胞和卵母细胞中的表达量较高,而在颗粒细胞中表达量相对较少,推测在卵巢合成类固醇激素的过程主要由黄体和卵母细胞主要分泌CYP17A1来参与调节其合成过程中的合成和裂解;颗粒细胞主要分泌HSD3B1来参与调控和限速作用;StAR则主要由颗粒细胞以及卵母细胞进行分泌,参与类固醇前体物质在细胞内的转运过程。这些在卵巢类固醇激素合成过程中的调节因子,同样在下丘脑调控FSH,LH激素分泌的过程中发挥了关键性的作用。
我们做的试验证实下丘脑存在有调节小鼠卵巢相关的类固醇激素合成所必需的关键酶CYP17A1,进一步与之前的下丘脑-垂体-性腺轴的研究内容相互印证。从而证明了,下丘脑具有参与调节小鼠卵巢周期性活动和生殖的基础。另外,在卵巢免疫荧光的结果中,StAR和CYP17A1在小鼠的卵母细胞内部存在共表达关系,可以推测小鼠的卵母细胞参与合成CYP17A1和StAR这两种关键的因子,从而进一步参与调控类固醇激素的合成过程以及在细胞内线粒体上的转运过程。HSD3B1作为小鼠下丘脑调节LH峰值的中间调控因子,其在卵泡颗粒细胞中的表达,说明 HSD3B1可能参与到颗粒细胞黄体化的过程当中。以上证据皆说明下丘脑可能参与到了小鼠卵巢对生殖活动机能的调节过程,但是这些关键因子在卵巢组织中具体的作用方式和调控过程有待于进一步研究。
本研究表明,下丘脑具有调节卵巢合成类固醇激素以及影响LH峰值到来的关键性因子CYP17A1的表达并且在小鼠的卵巢上具有相对应的表达。同时,也证明StAR、HSD3B1和CYP17A1在小鼠卵巢中参与相关类固醇激素的合成,小鼠类固醇激素的合成过程中需要卵母细胞的参与。下丘脑作为生命中枢可能参与调控卵巢的类固醇激素合成过程,为进一步研究下丘脑参与调节卵巢类固醇激素合成的研究打下了基础。
[1] Pikuleva I A,Waterman M R.Cytochromes P450:Roles in Diseases[J].Journal of Biological Chemistry,2013,288(24):17091-17098.
[2] Srivastava V,Dearth R K,Hiney J K,etal.The effects of low-level Pb on steroidogenic acute regulatory protein(StAR) in the prepubertal rat ovary[J].Toxicol Sci,2004,77(1):35-40.
[3] Sanchez P,Torres J M,Olmo A,etal.Effects of environmental stress on mRNA and protein expression levels of steroid 5alpha-Reductase isozymes in adult rat brain[J].Horm Behav,2009,56(3):348-353.
[4] Lavoie H A,King S R.Transcriptional regulation of steroidogenic genes:STARD1,CYP11A1 and HSD3B[J].Exp Biol Med(Maywood),2009,234(8):880-907.
[5] Kayani A R,Glister C,Knight P G.Evidence for an inhibitory role of bone morphogenetic protein(s)in the follicular-luteal transition in cattle[J].Reproduction,2009,137(1):67-78.
[6] Piomboni P,Governini L,Gori M,etal.New players in the infertility of a mouse model of lysosomal storage disease:the hypothalamus-pituitary-gonadal axis[J].Front Endocrinol(Lausanne),2014,4:204.
[7] Hough D,Swart P,Cloete S.Exploration of the Hypothalamic-Pituitary-Adrenal Axis to Improve Animal Welfare by Means of Genetic Selection:Lessons from the South African Merino[J].Animals(Basel),2013,3(2):442-474.
[8] Downs J L,Wise P M.The role of the brain in female reproductive aging[J].Mol Cell Endocrinol,2009,299(1):32-38.
[9] Eghlidi D H,Urbanski H F.Effects of Age and Estradiol on Gene Expression in the Rhesus Macaque Hypothalamus[J].Neuroendocrinology,2015,101(3):236-245.
[10] Nimz M,Spitschak M,Furbass R,etal.The pre-ovulatory luteinizing hormone surge is followed by down-regulation of CYP19A1,HSD3B1,and CYP17A1 and chromatin condensation of the corresponding promoters in bovine follicles[J].Mol Reprod Dev,2010,77(12):1040-1048.
[11] Lin D,Sugawara T,Strauss J R,etal.Role of steroidogenic acute regulatory protein in adrenal and gonadal steroidogenesis[J].Science,1995,267(5205):1828-1831.
[12] Fang L,Chang H M,Cheng J C,etal.TGF-beta1 downregulates StAR expression and decreases progesterone production through Smad3 and ERK1/2 signaling pathways in human granulosa cells[J].J Clin Endocrinol Metab,2014,99(11):E2234-E2243.
Expression of steroidogenic factor in mice ovary and brain
WANG Cai-yun1, PAN Deng1, ZHANG Zhao-yi , FAN Kui-kui1, LI Ting1, DU Chen-guang1,2
(1.College of Veterinary, Inner Mongolia Agricultural University, Hohhot 010018, China;2.Vocational and Technical College, Inner Mongolia Agricultural University, Baotou 014109, China)
Hypothalamus plays a key role in mice energy balance and reproduction.CYP17A1,StAR and HSD3B1 are key factors in mouse steroidogenic,but little evidence describes the expression of CYP17A1,StAR and HSD3B1 in mouse hypothalamus and ovary.The results showed that CYP17A1 was expressed in ventromedial hypothalamic nucleus and fornix area,while it was also expressed in lutein cells in mouse ovary.HSD3B1 was mainly expressed in granulosa cells.In the oocyte,CYP17A1 co-localized with StAR.These results suggest that CYP17A1 may regulate ovary metabolism and synthesis of steroid hormones in mice.We also demonstrated that in CYP17A1 existed hypothalamus-pituitary-gonadal axis in rodents and oocyte takes part in the steroid hormones synthesis.StAR and HSD3B1 were also localized in female mouse ovary and might play a key role in mouse steroid hormones synthesis.This study provides a basis for the study of hypothalamus to regulate ovary to synthase steroid hormones in the future.
Hypothalamus ; Ovary ; CYP17A1 ; StAR ; HSD3B1
DU Chen-guang

2016-09-14
国家自然科学基金(31160455,31660701);内蒙古自治区高校自然科学重点项目(NJZZ049)
王彩云(1969-),女(蒙古族),副教授,博士,研究方向为家畜解剖学,E-mail:576594761@qq.com
杜晨光,E-mail:dcglxj@163.com
R114
A
0529-6005(2017)02-0029-04

