翘嘴鳜铜锌超氧化物歧化酶重组蛋白表达、纯化及特性分析
肖 俊,许亮清,胡向萍,程周玉,胡宝庆,简少卿,阳 钢,文春根
(1.南昌大学生命科学学院,南昌,330031;2.南昌市科学院畜牧水产研究所,南昌,330038)
翘嘴鳜铜锌超氧化物歧化酶重组蛋白表达、纯化及特性分析
肖 俊1,许亮清2,胡向萍1,程周玉1,胡宝庆1,简少卿1,阳 钢1,文春根1
(1.南昌大学生命科学学院,南昌,330031;2.南昌市科学院畜牧水产研究所,南昌,330038)
超氧化物歧化酶(SOD)是清除生物体内超氧阴离子自由基的一种重要抗氧化酶。根据翘嘴鳜 (Sinipercachuatsi) Cu/Zn-SOD基因序列 (GenBank登录号: KJ558392.1) 设计表达引物,扩增获得截去信号肽后的一段460 bp的序列,序列经过鉴定后,构建了重组表达质粒pET-30a+ScCu/Zn-SOD,并将该质粒转入到BL21(DE3) 中,用IPTG诱导进行表达。经过优化表达条件得到可溶的ScCu/Zn-SOD重组蛋白(rScCu/Zn-SOD),纯化重组蛋白后测定rScCu/Zn-SOD的浓度和酶活性。结果发现在20 ℃和37 ℃条件下均能够诱导ScCu/Zn-SOD的表达。37 ℃时重组蛋白主要以包涵体形式存在。降低诱导温度和补充Cu2+/Zn2+可提高rScCu/Zn-SOD的表达量。在20 ℃、0.5 mmol/L IPTG条件下,添加0.5 mmol/L CuSO4和0.1 mmol/L ZnCl2于培养基中,重组蛋白的表达量明显升高。纯化后的重组蛋白浓度为0.14 mg/mL,酶活力为108.5 U/mg。rScCu/Zn-SOD最适温度为37 ℃,最适pH为7.0,可耐受5% 浓度的SDS蛋白质变性剂。
翘嘴鳜(Sinipercachuatsi);铜锌超氧化物歧化酶;原核表达;蛋白特性
超氧化物歧化酶 (Superoxide dismutase,SOD)是生物体的重要抗氧化酶之一,能够催化超氧阴离子发生歧化反应生成过氧化氢和水,平衡机体氧自由基水平,避免活性氧簇 (Reactiveoxygenspecies, ROS)的毒害作用[1]。SOD分为Cu/Zn-SOD、Mn-SOD和Fe-SOD三类,其中 Cu/Zn-SOD存在于真核生物的细胞浆内;Mn-SOD存在于真核生物和原核生物的线粒体中;Fe-SOD存在于原核细胞及少数植物细胞的叶绿体中[2]。
SOD不仅是一种抗氧化物酶,同时也是鱼体内重要的非特异性免疫因子之一,具有抑制病菌侵害和增强机体免疫力等作用[3-4]。还可以作为鱼类对水环境污染的指标[5]。鱼体中SOD抗氧化酶基因的表达水平或活性的变化,反映了机体的氧化损伤或受环境胁迫的状态[6,7]。鲢 (Hypophthalmichthysmolitrix) 在低氧胁迫条件下,肝和鳃组织的Cu/Zn-SOD mRNA表达水平显著上调[8]。重金属、过氧化氢及高温胁迫均能引起盘鲍 (Haliotisdiscus)及萼花臂尾轮虫 (Brachionuscalyciflorus) Cu/Zn-SOD mRNA的表达水平变化[9-10]。鳗弧菌 (Vibrioanguillarum) 刺激尖吻鲈 (Latescalcarifer) 后,其肌肉、鳃、肝脏和肾脏组织中的SOD mRNA表达量上调[11]。目前,已经从大西洋鲑鱼 (Trematomusbernacchii)[12]、斑马鱼 (Daniorerio)[13]、黑鲷 (Sparusmacrocephlus)[14]和鲢[15]等鱼体内成功克隆到Cu/Zn-SOD基因。另外,用大肠杆菌表达系统成功表达和诱导出具有生物活性的斑马鱼和黑鲷Cu/Zn-SOD融合蛋白[13,14]。
翘嘴鳜 (Sinipercachuatsi) 广泛分布于我国各大水系,是珍贵的淡水养殖鱼类。目前,已经在鳜体内成功分离免疫球蛋白 (IgM、IgD和 IgZ)、β-防御素、溶菌酶、白介素、干扰素调节因子及抗病毒基因viperin等非特异性免疫因子[16-19]。然而,还未见鳜SOD的报道。本研究在克隆出翘嘴鳜Cu/Zn-SOD (命名为ScCu/Zn-SOD) 基因的基础上[20],构建了鳜Cu/Zn-SOD的重组表达质粒pET-30a+ScCu/Zn-SOD,在大肠杆菌中诱导表达出可溶性目的蛋白,纯化了重组ScCu/Zn-SOD蛋白 (命名为rScCu/Zn-SOD),并对重组蛋白的稳定性进行了分析。以期为进一步研究SOD在鱼类中的免疫机制及蛋白功能提供理论基础。
1 材料和方法
1.1 实验材料
翘嘴鳜由南昌市科学院畜牧水产所惠赠,平均体重(300±5.12)g,为人工网箱养殖。实验之前,置于水族箱中暂养一周,期间采用连续不间断充气供养。
1.2 Cu/Zn-SOD 基因cDNA的 PCR 扩增
挑选健康的个体, 用Trizol法提取鳜肌肉总RNA。参照SMART cDNA Synthesis Kit (Clontech)操作手册 (Clontech公司)合成SMART-cDNA。根据ScCu/Zn-SOD基因的编码cDNA序列(GenBank accession no. KJ558392.1),利用Primer 5.0软件分析可用的酶切位点并设计表达引物ExCZSOD-F和ExCZSOD-R。上游表达引物ExCZSOD-F:GGAGAATTCATGGTACTAAAAGCTGTTTGTGTGT,含EcoRⅠ酶切位点(下划线所示)和起始密码子ATG;下游表达引物ExCZSOD-R:CCCAAGCTTTTACTGCGTGATGCCAATGACTC,含HindⅢ 酶切位点(下划线所示)和终止密码子TAA。引物5’ 端的3个碱基(GGA和CCC)为保护碱基,以保障碱基序列的粘性末端正常切开。以SMART-cDNA为模板,用高保真酶ExTaq 进行PCR扩增,PCR反应参数为:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。反应结束后,用1% 的琼脂糖凝胶电泳检测扩增效果,最后回收目的PCR产物。
1.3 重组表达质粒的构建
回收目的PCR产物和pET30-a(+) 载体分别用限制性内切酶EcoRⅠ和HindⅢ 进行双酶切,酶切体系为 20 μL (10 μL H2O,6 μL DNA或质粒,1 μLEcoRⅠ,1 μLHindⅢ, 2 mL 10×H buffer),37 ℃ 水浴酶切 4 h,酶切后用 1% 琼脂糖凝胶电泳检测是否酶切完全。用纯化试剂盒分别对酶切后的产物和质粒进行纯化。纯化后的DNA和质粒各 4 μL ,T4 DNA连接酶 1 μL ,T4 连接buffer 1 μL,总共 10 μL,4 ℃ 连接过夜。将连接产物转化至DH5α感受态细胞中,随后涂布于固体LB平板(Kana+),37 ℃ 培养过夜,次日筛选阳性克隆测序和双酶切验证。
1.4 rScCu/Zn-SOD可溶性诱导条件优化
将验证的重组质粒 (pET-30a+ScCu/Zn-SOD) 热激转化E.coliBL21 (DE3) 感受态细胞中,随后涂布于固体LB平板 (Kana+),37 ℃培养过夜,次日挑取阳性克隆菌做PCR验证。
将经验证的阳性克隆按1∶50的比例分别加入到50 mL液体LB培养基培养(Kana+)中,37 ℃,200 r/min振荡培养3 h至OD600 nm为0.6。取2 mL菌液作为未诱导的对照组,再加入异丙基硫代β-半乳糖苷 (IPTG) 至终浓度为0.5 mmol/L,37 ℃,200 rpm条件下进行诱导表达,并在2、4、6、8 h时间点分别收集2 mL菌液,以0.5 mmol/L IPTG浓度下诱导6 h的DE3空白质粒菌液作为阴性对照。将上述收集的各管菌液7 000 r/min离心10 min后弃上清,分别用500 μL 1×PBS (162 mmol/L Na2HPO4, 38 mmol/L NaH2PO4, pH 7.4) 洗涤沉淀两次后。再加 150 μL 1× PBS使沉淀中的菌体重悬,然后加入50 μL上样缓冲液(100 mmol/L Tris-HCl,pH 8.0,5% DTT,2% SDS,0.1% 溴酚蓝,10% 甘油),混匀后95 ℃ 加热10 min,采用10% 变性不连续的十二烷基硫酸钠-聚丙烯酰胺凝胶(10% SDS-PAGE)电泳对表达产物进行检测分析。
收集全部剩余菌液置于50 mL离心管中,7 000 r/min离心10 min,弃上清,用1× PBS洗涤两次,再用150 mL预冷的Binding buffer (300 mmol/L NaCl,50 mmol/L NaH2PO4,10 mmol/L 咪唑,pH 8.0) 重悬菌体,充分混匀。然后超声破碎(39 W,超声15 s,间隔15 s,冰浴)细胞10 min,菌液澄清后,4 ℃ 7 000 r/min离心30 min,收集超声破碎后上清与沉淀。挑取适量沉淀后加入1.5 mL离心管中,用500 μL 1×PBS重复洗涤2次后再用150 μL 1× PBS重悬,直接吸取150 μL上清置于1.5 mL离心管中,并且分别向2管中加入50 μL缓冲液,混匀后95 ℃ 加热10 min,用10% SDS-PAGE蛋白凝胶电泳检测rScCu/Zn-SOD在上清及沉淀中的表达情况。
为进一步研究rScCu/Zn-SOD可溶性表达的最佳诱导条件,将20 μL pET-30a+ScCu/Zn-SOD重组表达菌接种至1 mL LB液体培养基 (Kana+) 中,37 ℃ 过夜培养后,按1∶50的比例分装到4瓶10 mL LB液体培养基 (Kana+),设置A、B、C和D 4个诱导组。诱导组在37 ℃ 温度条件下,200 r/min振荡培养 3 h 至OD600 nm为0.6,再分别加入0.5 mmol/L IPTG 诱导剂,同时在C组和D组中加入0.5 mmol/L CuSO4和0.1 mmol/L 的ZnCl2添加剂诱导。诱导条件为A:37 ℃,未添加Cu2+/Zn2+; B:20 ℃,未添加Cu2+/Zn2+; C:37 ℃,添加0.5 mmol/L CuSO4和0.1 mmol/L 的ZnCl2; D:20 ℃,添加0.5 mmol/L CuSO4和0.1 mmol/L 的ZnCl2。诱导6 h后收集各组所得菌液,冰上超声破碎 (39 W,超声15 s,间隔15 s,冰浴),10% SDS-PAGE电泳检测各组rScCu/Zn-SOD可溶性表达。
优化最佳诱导条件确定后,进行大量诱导表达。按1∶100的比例接种于100 mL LB培养基,37 ℃ 恒温培养至OD600 nm值为 0.6,加入IPTG (120 mg/mL) 终浓度 1 mmol/L,诱导最佳时间 6 h。
分装诱导后的菌液,4 ℃ 4 100 g离心,收集菌体。每管菌体中加入6 mL预冷的1×Binding Buffer 重悬菌体,冰浴中超声破碎(功率39 W,超声15 s,间隔15 s)细胞10 min,至菌液澄清后4 ℃,7 000 r/min离心30 min,收集上清与沉淀,再通过10% SDS-PAGE电泳检测rScCu/Zn-SOD在上清及沉淀中的表达情况。
1.5 rScCu/Zn-SOD的纯化
取1 mL pET-30a+ScCu/Zn-SOD重组表达菌加入100 mL液体LB培养基(Kana+)中,37 ℃,200 r/min振荡培养3 h至OD600 nm为0.6,再加入0.5 mmol/L CuSO4、0.1 mmol/L ZnCl2和0.5 mmol/L 终浓度的IPTG,在20 ℃ 条件下进行诱导,诱导6 h后取少量菌液用于1%的琼脂糖凝胶电泳进行检测是否表达。将剩余的菌液进行超声破碎,收集破碎后上清液用于纯化。
参照AmerSham Biosciences 公司Ni2+离子亲和层析方法纯化重组蛋白,取超声破碎后上清液加入到已平衡的Ni-NTA His.Bind 层析柱中,先用20 mmol/L 咪唑浓度的洗脱缓冲液(300 mmol/L NaCl,50 mmol/L NaH2PO4,20 mmol/L 咪唑,pH 8.0)洗脱柱子,再用300 mmol/L 咪唑浓度的洗脱缓冲液(300 mmol/L NaCl,50 mmol/L NaH2PO4,300 mmol/L 咪唑,pH 8.0)洗脱目的蛋白,收集目的蛋白并取少量进行SDS-PAGE电泳检测。纯化完成后,将收集的目的蛋白液加入到透析袋中,完全浸泡在1 L TGE透析液(50 mmol/L Tris,0.5 mmol/L EDTA,50 mmol/L NaCl,10% 甘油,1% 甘氨酸,pH 8.0)中,4 ℃ 透析16 h以上。透析完成后,用干燥的聚乙二醇8 000进行蛋白浓缩,待袋内液体较少时将蛋白液分装于2 mL的离心管中,-80 ℃保存备用。
1.6 rScCu/Zn-SOD浓度的测定
采用Bradfard蛋白定量试剂盒(南京建成生物科技有限公司)测定重组 rScCu/Zn-SOD蛋白的浓度,重复取样测定4次,最后根据所得标准曲线计算目的蛋白浓度。

表1 标准曲线的制备
注:样品蛋白浓度=蛋白含量/所加样品体积
1.7 rScCu/Zn-SOD酶活性的测定
参照超氧化物歧化酶试剂盒(测分型)(南京建成生物科技有限公司)说明书,采用黄嘌呤氧化酶法测定rScCu/Zn-SOD的酶活性。待测样品中的Cu/Zn-SOD对超氧阴离子具有专一性的抑制作用,使形成的亚硝酸盐减少,比色时测定管在550 nm处的吸光值会低于对照管的吸光值,通过计算可求出待测样品中的Cu/Zn-SOD活力。计算公式为Cu/Zn-SOD活力=(A0-A1)×D/(A0×50%×C),A0和A1分别表示对照管吸光值和测定管吸光值,D为待测样品的稀释倍数,C是待测蛋白的浓度。
1.8 温度、pH和SDS对rScCu/Zn-SOD活性的影响
取纯化好的rScCu/Zn-SOD,分别检测温度、pH和SDS变性剂对该蛋白Cu/Zn-SOD活性的影响,为减少测定数据的误差,每个实验设置3个平行组,并重复测定3次。温度处理组中,将目的蛋白样品分别置于4、25、37、50、60、70、80和90 ℃水浴中保温10 min,再用酶标仪分别测定各组的吸光值,计算酶活性。pH处理组中,将蛋白样品分别加入pH 2~11的缓冲体系中,室温孵育1 h后测定酶活性。缓冲体系的配置分别为0.2 mol/L Citrate Buffer (pH 2.0、3.0、4.0、5.0和6.0),0.2 mol/L Tris-HCl Buffer (pH 7.0、8.0和9.0)以及0.2 mol/L Glycine/NaOH Buffer (pH 10.0和11.0)。变性剂处理组中,目的蛋白样品加入SDS至终浓度为1%~10%,室温处理1 h后测定酶活性。相对酶活力以各组测得的最高酶活性为100%,与其它条件下处理后测得的活性比较后获得相对酶活性作最终参考值,并用Excel绘制图。
1.9 数据处理
采用SPSS 19.0软件进行统计分析,实验数据结果用平均值±标准差(M±SD)表示。
2 结果
2.1 重组表达质粒双酶切验证
利用ExCZSOD-F和ExCZSOD-R引物扩增得到的ScCu/Zn-SOD基因表达片段大小为460 bp,pET-30a+ScCu/Zn-SOD重组表达质粒经EcoRⅠ和HindⅢ双酶切后出现质粒和目的基因2个条带,与预期大小相符(图1)。测序结果显示,回收得到的PCR产物序列与ScCu/Zn-SOD基因的编码区DNA序列一致,表明ScCu/Zn-SOD+pET-30a重组表达质粒构建成功。

图1 ScCu/Zn-SOD重组质粒的双酶切验证Fig.1 Identification of recombinant plasmid of ScCu/Zn-SOD by restriction enzyme digestion M.DNA Marker (DL2000);1.目的基因PCR产物;2.原始pET-30a质粒;3.重组后质粒;4.重组质粒双酶切产物
2.2 原核诱导表达
预测ScCu/Zn-SOD的蛋白分子量为17.0 ku,His标签分子量约为6.5 ku,所以ScCu/Zn-SOD融合蛋白大小约为23 ku。SDS-PAGE检测发现,0.5 mmol/L IPTG终浓度诱导后菌体在23 ku处有蛋白表达(泳道1~5),与预测蛋白大小一致。与阴性菌株(空白DE3,泳道8)和未诱导的阳性菌株(0 h,泳道1)相比,IPTG诱导后重组蛋白明显表达,且随着诱导时间的增加,其表达量也明显增加(泳道1~5);同时发现超声破碎后的上清(泳道7)中也有可溶性的目的蛋白表达(图2)。
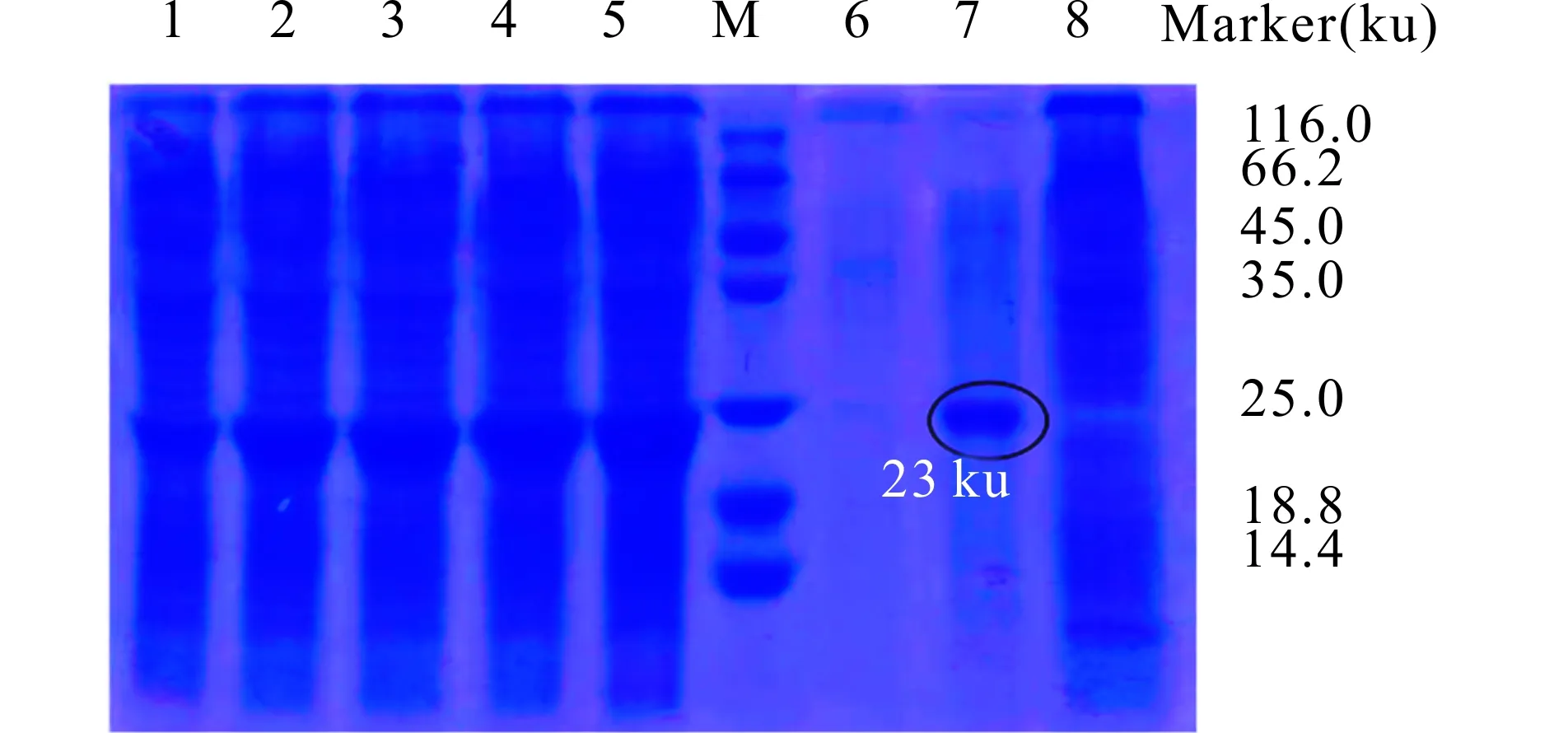
图2 重组ScCu/Zn-SOD的表达Fig.2 The expression of the recombinant ScCu/Zn-SODM.蛋白质Marker;1.未诱导的ScCu/Zn-SOD融合蛋白;2.IPTG诱导后2 h的ScCu/Zn-SOD融合蛋白;3.IPTG诱导后4 h的ScCu/Zn-SOD融合蛋白;4.IPTG诱导后6 h的ScCu/Zn-SOD融合蛋白;5.IPTG诱导后8 h的ScCu/Zn-SOD融合蛋白;6.IPTG诱导8 h后的沉淀;7.IPTG诱导8 h后的上清;8.空白DE3菌。
2.3 rScCu/Zn-SOD的诱导条件优化和纯化
37 ℃诱导条件下,重组ScCu/Zn-SOD蛋白主要是以包涵体的形式存在于大肠杆菌菌液中(泳道1和5)。在诱导时补充Cu2+/Zn2+后可在上清中少量表达(泳道6);20 ℃诱导条件下,虽然目的蛋白主要还是以包涵体的形式存在(泳道3,7),但上清中也同样有少量表达(泳道4,8)。补充Cu2+/Zn2+后,上清中的目的蛋白的表达量明显升高(泳道8)。将20 ℃补充Cu2+/Zn2+诱导6 h后超声上清中的目的重组蛋白进行纯化,SDS-PAGE蛋白胶电泳检测结果显示,在23 ku处得到单一的目的蛋白条带(图3)。

图3 重组ScCu/Zn-SOD的诱导条件优化(A)及蛋白纯化(B)Fig.3 The optimum induction condition (A) and protein purification (B) of the recombinant ScCu/Zn-SODA.不同条件下诱导重组ScCu/Zn-SOD蛋白在DE3中的蛋白表达。M.蛋白质Marker,1.37 ℃未添加Cu2+/Zn2+诱导后的沉淀;2.37 ℃未添加Cu2+/Zn2+诱导后的上清;3.20 ℃未添加Cu2+/Zn2+诱导后的沉淀;4.20 ℃未添加Cu2+/Zn2+诱导后的上清;5.37 ℃添加Cu2+/Zn2+诱导后的沉淀;6.37 ℃添加Cu2+/Zn2+诱导后的上清;7.20 ℃添加了Cu2+/Zn2+诱导后的沉淀;8.20 ℃添加了Cu2+/Zn2+诱导后的上清。B.rScCu/Zn-SOD的纯化。
2.4 纯化后rScCu/Zn-SOD的浓度和活性
标准曲线方程y=0.012 4x+0.037 9(图4)。待测蛋白样品OD595 nm的平均值为0.07,计算得到纯化后rScCu/Zn-SOD的浓度为0.14 mg/mL,酶活性为108.5 U/mg。

图4 BSA标准曲线Fig.4 Standard curve of BSA
2.5 温度、pH和SDS对rScCu/Zn-SOD酶活性的影响
rScCu/Zn-SOD的酶活性在37 ℃最高,与其它温度下测得的酶活性比较,在25~60 ℃保温10 min后的rScCu/Zn-SOD的酶活性稳定,相对酶活性保持在75%以上;低温和高温处理均会导致该酶活性的减弱,尤其在80 ℃以上高温处理后,相对酶活性迅速降到20%以下(图5A)。
在pH<4条件下,处理rScCu/Zn-SOD 1 h后,酶完全失活。随着pH的升高酶活逐渐升高。在pH 7 时,酶活性最高;当pH>10时,酶活性迅速降低到30%以下(图5B)。
以1%浓度的变性剂SDS处理后测得的酶活性为100%,随着SDS浓度的升高,该酶活性呈下降趋势,在5%浓度中的酶活性在70%以上,当SDS浓度升高到6%后,酶活性迅速降低到30%以下,表明该酶可耐受5%浓度的SDS(图5C)。

图5 温度(A)、pH(B)和SDS(C)对重组ScCu/Zn-SOD蛋白酶活性的影响Fig.5 Effects of temperature (A), pH (B) and SDS (C) on the enzyme activities of rScCu/Zn-SOD
3 讨论
在多种生物中克隆得到的Cu/Zn-SOD基因cDNA通过重组蛋白表达系统均成功诱导表达出具有生物活性的融合蛋白[12,21-23]。褶纹冠蚌(Cristariaplicata)Cu/Zn-SOD通过构建pET-30a重组表达质粒,在大肠杆菌中成功诱导出0.6 mg/mL的高纯度融合蛋白,酶活性高达5 300 U/mg[21];人Cu/Zn-SOD与pGEX-2T构建的重组质粒,在大肠杆菌中获得40%以上的高效表达,并分离和纯化得到酶活1 210 U/mg的融合蛋白[23];此外,从斑马鱼体内克隆得到的Cu/Zn-SOD基因cDNA与pET-20b质粒重组后在大肠杆菌中也诱导获得酶活性为2 000 U/mL的融合蛋白[13],黑鲷体内克隆得到的Cu/Zn-SOD基因cDNA与pET-20b质粒重组后在大肠杆菌中也诱导获得酶活性为1 600 U/mL的融合蛋白[14]。当外源基因在体外快速转录表达过程中,翻译后的肽链常常未能正常折叠,容易导致包涵体的形成[24]。ScCu/Zn-SOD在37 ℃诱导条件下,目的蛋白主要以包涵体的形式存在于沉淀中,而在20 ℃诱导时,上清中出现了可溶性的目的蛋白,表明降低诱导温度可实现蛋白体外的可溶性表达。另外,在诱导时通过添加Cu2+/Zn2+后可增加目的蛋白在上清中的表达量,说明在诱导时适量加入Cu2+/Zn2+离子也可促进Cu/Zn-SOD蛋白的可溶性表达。
重组诱导获得的融合蛋白常带有His、GST、HSV、Trx和Nus等特异性标签蛋白,在金属离子亲和层析中可与相应的金属离子特异性结合,从而可分离纯化出所需目的蛋白[25]。在构建重组表达质粒过程中,通过表达载体引入His亲和标签可以进行重组蛋白纯化。利用表达载体引入His亲和标签已经成功地获得褶纹冠蚌[21]、海湾扇贝(Argopectenirradias)[22]、斑马鱼[13]和人[23]的重组Cu/Zn-SOD蛋白。本研究采用的pET-30a表达载体,带有6个His组成的亲和标签,通过Ni离子亲和层析纯化后得到目的重组ScCu/Zn-SOD蛋白,并测得该蛋白浓度为0.14 mg/mL,Cu/Zn-SOD酶活力为108.5 U/mg。
Cu/Zn-SOD是一种金属蛋白酶,酶活性受到温度、pH、变性剂和金属离子等因素的影响[26]。从罗非鱼(Oreochromisniloticus)[27]、鲨鱼(Scoliadonsorrakowah)[28]中提取的Cu/Zn-SOD蛋白均可耐受70~80 ℃高温,表明天然形式的Cu/Zn-SOD蛋白具有较高的热稳定性。重组得到的人Cu/Zn-SOD蛋白在25~70 ℃温度范围内具有稳定的酶活性[23]。重组褶纹冠蚌Cu/Zn-SOD蛋白在10~60 ℃范围内酶的活性维持在80%以上[21]。本研究中重组ScCu/Zn-SOD蛋白在25~60 ℃范围内保持75%以上的酶活性,在80 ℃高温下才出现酶活性大幅下降。因此,通过重组获得的Cu/Zn-SOD蛋白具有与天然形式Cu/Zn-SOD蛋白相同的热稳定性。
金属蛋白酶所含金属离子在强酸环境中易脱落,而在强碱环境中其自身分子构象会发生不可逆变化,最终均会导致酶活性的减弱或丧失[29]。然而,可见紫外光谱和电子自旋共振显示天然形式Cu/Zn-SOD酶结构在pH 5.3~9.5范围内结构保持不变,显示出极强的结构稳定性[30]。重组褶纹冠蚌Cu/Zn-SOD蛋白在pH 2.0~9.0范围内酶活性保持在75%以上[21];重组人Cu/Zn-SOD蛋白在pH 5.0~10.5范围内酶活性维持稳定[23];斑马鱼的重组Cu/Zn-SOD蛋白在pH 7.5~11范围内均具有很高的酶活性[13];海湾扇贝的重组Cu/Zn-SOD蛋白在pH 5.8~9.0范围内均具有很高的酶活性[22]。另外,SDS作为一种蛋白质变性剂,可引起Cu/Zn-SOD蛋白分子构象和电荷分布的改变,从而影响其酶活性[31]。斑马鱼重组Cu/Zn-SOD蛋白可耐受浓度为6%的SDS[13]、褶纹冠蚌重组Cu/Zn-SOD蛋白可耐受浓度为8%的SDS[21]、人重组Cu/Zn-SOD蛋白可耐受浓度为7%的SDS[25]。本研究中rScCu/Zn-SOD可耐受SDS的浓度为5%,表明rScCu/Zn-SOD的酶活性相对稳定。
[1]迟春萍,陈子杨,徐 军,等.毕赤酵母表达铜锌超氧化物歧化酶中试工艺研究[J].中国兽医学报,2012,32(2):267-271.
[2] Fridovich I. Superoxide dismutases [J]. Annu Rev Biochem, 1975, 44: 147-159.
[3] Fridovich I. Superoxide radical and superoxide dismutases [J]. Annu Rev Biochem, 1995, 64(1): 97-112.
[4] Mruk D D, Silvestrini B, Mo M Y, et al. Antioxidant superoxide dismutase-a review: its function, regulation in the testis, and role in male fertility [J]. Contraception, 2002, 65(4): 305-311.
[5] Whitfield A K, Elliott M. Fishes as indicators of environmental and ecological changes within estuaries: a review of progress and some suggestions for the future [J]. J Fish Biol, 2002, 61(Supplement sA): 229-250.
[6] Marikovsky M, Ziv V, Nevo N, et al. Cu/Zn superoxide dismutase plays important role in immune response [J]. J Immunol, 2003, 170(6): 2993-3001.
[7] Ken C F, Lin C T, Shaw J F, et al. Characterization of fish Cu/Zn-superoxide dismutase and its protection from oxidative stress [J].Mar Biotechnol, 2003, 5(2): 167-173.
[8] Li Z, Liang H W, Li L, et al. Molecular cloning and differential expression patterns of copper/zinc superoxide dismutase and manganese superoxide dismutase inHypophthalmichthysmolitrix[J]. Fish Shellfish Immunol, 2011, 30(2): 473-479.
[9] Kim K Y, Sang Y L, Cho Y S, et al. Molecular characterization and mRNA expression during metal exposure and thermal stress of copper/zinc- and manganese-superoxide dismutases in disk abalone,Haliotisdiscusdiscus[J]. Fish Shellfish Immunol, 2007, 23(5): 1043-1059.
[10] Yang J, Dong S, Jiang Q, et al. Characterization and expression of cytoplasmic copper/zinc superoxide dismutase (CuZn SOD) gene under temperature and hydrogen peroxide (H2O2) in rotiferBrachionuscalyciflorus[J]. Gene, 2013, 518(2): 388-396.
[11] Dalziel J E, Shyan W S, Thai P, et al. Expression of human BK ion channels in Sf9 cells, their purification using metal affinity chromatography, and functional reconstitution into planar lipid bilayers [J]. J Chromatogr B, 2007, 857(2): 315-321.
[12] Santovito G, Cassini A, Piccinni E. Cu, Zn superoxide dismutase fromTrematomusbernacchii: Functional conservation and erratic molecular evolution in Antarctic teleosts [J]. Comp Biochem Physiol Part C Toxicol Pharmacol, 2006, 143(143): 444-454.
[13] Ken C F, Lin C T, Shaw J F, et al. Characterization of fish Cu/Zn-superoxide dismutase and its protection from oxidative stress [J].Mar Biotechnol, 2003, 5(2): 167-173.
[14] Lin C T, Lee T L, Duan K J, et al. Molecular cloning, characterization, and expression of a cDNA coding Copper/Zinc superoxide dismutase from black porgy [J]. J Agric Food Chem, 2000, 48(9): 4444-4447.
[15] Li Z, Liang H W, Li L, et al. Molecular cloning and differential expression patterns of copper/zinc superoxide dismutase and manganese superoxide dismutase inHypophthalmichthysmolitrix[J]. Fish Shellfish Immunol, 2011, 30(2): 473-479.
[16] Tian J, Sun B, Luo Y, et al. Distribution of IgM, IgD and IgZ in mandarin fish,Sinipercachuatsi, lymphoid tissues and their transcriptional changes after Flavobacterium columnare, stimulation [J]. Aquaculture, 2009, 288(1): 14-21.
[17] Wang G, Li J, Zou P, et al. Expression pattern, promoter activity and bactericidal property of β-defensin from the mandarin fishSinipercachuatsi[J]. Fish Shellfish Immunol, 2012, 33(3): 522-531.
[18] Sun B J, Wang G L, Xie H X, et al. Gene structure of goose-type lysozyme in the mandarin fishSinipercachuatsi, with analysis on the lytic activity of its recombinant inEscherichiacoli[J]. Aquaculture, 2006, 252(2-4): 106-113.
[19] Xiao J, Zhou Z C, Chen C, et al. Tumor necrosis factor-alpha gene from mandarin fish,Sinipercachuatsi: Molecular cloning, cytotoxicity analysis and expression profile [J]. Mol Immunol, 2007, 44(14): 3615-3622.
[20]程周玉,文春根,胡向萍,等.翘嘴鳜铜锌超氧化物歧化酶基因的分子克隆与原核表达[J].南昌大学学报(理科版),2015,39(6):587-596.
[21] Xu H H, Ma H, Hu B Q, et al. Molecular cloning, identification and functional characterization of a novel intracellular Cu-Zn superoxide dismutase from the freshwater mussel Cristaria plicata [J].Fish Shellfish Immunol, 2010, 29(4): 615-622.
[22] Bao Y, Li L, Xu F, et al. Intracellular copper/zinc superoxide dismutase from bay scallopArgopectenirradians: Its gene structure, mRNA expression and recombinant protein [J]. Fish Shellfish Immunol, 2009, 27(2): 210-220.
[23]刘建荣,赵晓瑜,宋小青,等.重组人Cu,Zn-SOD包含体的复性、纯化及复性蛋白稳定性研究[J].中国药学杂志,2007,42(13):969-974.
[24]龙建银,王会信.外源基因在大肠杆菌中表达的研究进展[J].生物化学与生物物理进展,1997(2):126-132.
[25] Dalziel J E, Shyan W S, Thai P, et al. Expression of human BK ion channels in Sf9 cells, their purification using metal affinity chromatography, and functional reconstitution into planar lipid bilayers [J]. J Chromatogr B, 2007, 857(2): 315-321.
[26]田春美,钟秋平.超氧化物歧化酶的现状研究进展[J].中国热带医学,2005,5(8):1730-1732.
[27]吴燕燕,李来好,郝志明,等.罗非鱼肝脏中超氧化物歧化酶的提取、纯化与分析[J].水产学报,2007,31(4):518-524.
[28]张尔贤,李建喜.鲨鱼肝超氧化物歧化酶的纯化与部分性质研究[J].中国药学杂志,1999(4):231-233.
[29]梅光泉,廊惠芳.超氧化物歧化酶中微量元素的化学行为和生物学功效[J].微量元素与健康研究,2003,20(5):59-62.
[30] Salin M L, Oesterhelt D. Purification of a manganese-containing superoxide dismutase fromHalobacteriumhalobium[J]. Arch Biochem Biophys, 1988, 260(2):806-810.
[31]王伟伟,刘存岐,李道季.3种虾超氧化物歧化酶部分理化性质比较[J].水产科学,2009,28(4):200-204.
(责任编辑:张潇峮)
Analysis and characterization on recombinant protein ofCu/Zn superoxide dismutase fromSinipercachuatsi
XIAO Jun1, XU Liang-qing2, HU Xiang-ping1, CHENG Zhou-yu1,HU Bao-qing1, JIAN Shao-qing1, YANG Gang1, WEN Chun-gen1
(1.SchoolofLifeSciences,NanchangUniversity,Nanchang, 330031,China;2.InstituteofAnimalHusbandryandAquaculture,Nanchang, 330038,China)
Superoxide dismutases (SODs) are one family of important antioxidant enzymes involved in scavenging superoxide anion free radical in organisms. In the present paper, the expression primer was designed by Cu/Zn-SOD gene sequence ofSinipercachuatsi(named as ScCu/Zn-SOD, accession numbers: KJ558392.1). A truncated signal peptide sequence with 460 bp was amplified. After identification of the sequence, the constructed recombinant expression plasmid (pET-30a+ScCu/Zn-SOD) was transformed into BL21(DE3), and was expressed by induction with IPTG. The soluble recombinant protein of ScCu/Zn-SOD (designated as rScCu/Zn-SOD) was obtained by optimized expression condition, and the concentration and activity of rScCu/Zn-SOD was measured after the purification of recombinant protein. The results showed that the expression of ScCu/Zn-SOD could be induced under 20 ℃ and 37 ℃ conditions. The rScCu/Zn-SOD was mainly aggregated to form inclusion bodies at 37 ℃. The expression quantity of rScCu/Zn-SOD could be improved by reduction induction temperature and supplement Cu2+/Zn2+. The addition of 0.5 mmol/L CuSO4and 0.1 mmol/L ZnCl2in culture medium was optimal under 20 ℃ and 0.5 mmol/L IPTG condition, and the expression quantity of rScCu/Zn-SOD was obviously increased. The results can provide basic data for the research on functional characterization of SOD protein.
Sinipercachuatsi; Cu/Zn superoxide dismutase; Prokaryotic expression; Recombinant protein; Protein characterization
2016-08-04;
2016-11-02
南昌市科技支撑计划项目(2012-KJ2C-NY-SC-002);国家自然基金(31472305, 31460697, 21467015);江西省教育厅项目(GJJ12024, GJJ10378);江西省自然科学基金 (20132BAB204019)
肖 俊(1991-),男,硕士研究生,专业方向为水产动物疾病学。E-mail:874370756@qq.com 通讯作者:文春根。E-mail:cgwen@ncu.edu.cn
S917.4
A
1000-6907-(2017)02-0011-07

