9份烟草品种(系)及其航天诱变后代的TRAP分析
冯俊彦,蒲志刚*,李明,张聪,阎文昭,王勇,邢小军,刘东阳
(1.四川省农业科学院生物技术核技术研究所,四川成都610066;2.四川省烟草公司凉山州公司,四川西昌615000)
9份烟草品种(系)及其航天诱变后代的TRAP分析
冯俊彦1,蒲志刚1*,李明1,张聪1,阎文昭1,王勇2,邢小军2,刘东阳2
(1.四川省农业科学院生物技术核技术研究所,四川成都610066;2.四川省烟草公司凉山州公司,四川西昌615000)
为了研究烟草航天诱变育种规律,充分利用该技术创制烟草育种材料、培育新品种,利用航天诱变技术处理9份我国主要烟草品种(系)种子,繁育多代待其性状稳定后,在每个品种(系)中随机选择20份诱变单株,利用42对目标序列多态性引物对其进行遗传多样性分析。共检测到200条变异条带,各品种(系)变异条带数为1~45条,其中LS-2产生的变异条带最少,仅有1条,云烟85产生的变异条带最多,为45条;通过对各品种(系)的遗传相似性分析和聚类分析表明,烟草品种(系)及其航天诱变后代的遗传相似系数变幅为0.32~1.00,其中烟草品种K346及其航天诱变后代的差异最大,遗传相似系数仅为0.32。在各品种航天诱变后代中均存在遗传相似系数为1.0的单株;K346、翠碧一号、云烟85及其诱变后代中都存在原始亲本与诱变单株遗传相似系数为1.0的现象,而云烟317、云烟87、红花大金元、K326、CF209及其诱变单株中没有出现。航天诱变育种技术可对参试烟草品种产生较好的诱变效果,烟草品种不同,其变异程度差异较大;在烟草基因组上航天诱变位点的发生具有一定随机性,但是推测在烟草基因组上可能存在容易发生诱变的区域。这些研究结果将为航天诱变育种技术在烟草育种中的应用提供理论依据。
烟草;TRAP标记;航天诱变;多态性分析
将空间诱变技术与传统育种技术相结合实现农作物航天诱变育种的方法已经得到国内外育种家的广泛认可,具有广阔的发展前景。目前,关于作物航天诱变规律的研究较少,亟需对其进行深入研究,丰富和完善航天诱变育种理论,更好的指导育种实践
工作。随着人类对太空环境探索的不断深入,太空环境中独特的微重力、高能重粒子和高真空环境对动植物的诱变作用也越来越受到研究者的关注。航天育种在这一背景下应运而生,它以航天飞机、空间站、返回式卫星等运载工具搭载生物材料,经过空间环境诱变后返回地面,再结合传统育种手段进行新种质、新品种(系)[1]选育。研究表明,航天诱变育种具有传统育种手段以及其它诱变方法难以达到的效果,如诱变频率高,变异幅度大,多数变异能够遗传等[2-3]。目前该技术已在动物[4-5]、植物[6-7]、微生物[8-9]育种中得到了广泛应用,取得了大量的研究成果。烟草属于茄科烟属一年或多年生经济作物,原产于美洲,澳大利亚和南太平洋岛屿,除极地外,在世界其它地方都有种植。烟草在我国的种植历史已有近400年,是我国重要的经济作物[10]。丰富烟草种质资源,培育高产、优质烟草品种,满足经济、社会发展需求,是我国烟草育种研究的重要方向。由于受可利用种质资源、杂交亲和性等因素的限制,传统烟草育种方法已经很难满足烟草品种更新换代的要求,随着科学技术的发展,利用航天诱变育种方法进行烟草种质资源创制和烟草品种改良,将是未来烟草育种发展的重要方向。本研究以9份烟草品种(系)及其航天诱变后代为研究材料,利用TRAP(Target Region Amplification Polymorphism)分子标记对其进行扫描分析,旨在揭示不同烟草品种航天诱变后的变异情况,初步探索航天诱变对烟草基因组的诱变规律,为航天育种技术在烟草育种中的应用提供理论依据。
1 材料与方法
1.1 材料
以9份我国主栽烟草品种(系)(表1)未经诱变的原始材料作为对照材料,从各品种(系)航天诱变后代经多代繁育后的性状稳定单株中,随机选择每个品种约20个单株作为研究材料。全部供试材料均由四川省烟草公司凉山州公司提供。

表1 参试烟草品种(系)的编号、名称Table 1 The numbers,names and origins of tobacco accessions

表2 本研究中使用的TRAP引物序列Table 2 The sequences of TRAP primers used in this study
1.2 方法
1.2.1 基因组DNA提取2015年9月参试烟草品种及其航天诱变后代种植于四川省烟草公司凉山州公司种植基地(距离西昌市区30 km),取各材料幼嫩叶片,按照改良CTAB法提取DNA[21]。用含有20 ng/μl RNA酶的1×TE缓冲液溶解DNA,除去DNA中的RNA。使用Scandrop(Analyticgena)微量核酸测定仪,测定DNA浓度和纯度,根据测定结果,用1×TE缓冲液将DNA原液稀释到50 ng/μl,抽取2μl加5μl溴酚蓝,用1%琼脂糖检测DNA质量。
1.2.2 PCR反应TRAP引物(表2)及PCR反应体系按照Feng等[11]的方法进行,引物合成由生工生物工程(上海)股份有限公司合成。具体PCR反应体系如下:总体系20μl,包括100 ng烟草基因组DNA,1×buffer,1.5 Mm MgCl2,200μM dNTP,0.25 μM引物,0.5 U Taq酶。所需试剂购自北京天根生物技术公司。
TRAP反应程序包括:94℃预变性5 min,94℃变性1 min,35℃退火1 min,72℃延伸1 min,5个循环;然后94℃变性1 min,50℃退火1 min,72℃延伸2 min,35个循环;最后72℃终延伸7 min,慢慢冷却至12℃[11]。
1.2.3 PCR产物检测PCR产物中加入5μl上样缓冲液(40%蔗糖,0.025%溴酚蓝),用2%的琼脂糖凝胶进行电泳分离检测。
1.3 数据处理及统计分析
根据检测样品中电泳条带的有、无,采用二进位制记录,在相同迁移率处有带记为1,无带记为0,记录所有引物扩增数据,利用NTSYSpc2.11软件进行各品种(系)及其诱变后代的遗传相似系数计算及聚类分析。
2 结果与分析
2.1 TRAP标记扩增多态性分析
利用42对目标序列多态性(TRAP)引物,对9份烟草品种及其航天诱变后代进行扫描,结果表明42对TRAP引物在参试烟草材料中共扩增得到565条稳定条带,平均每对引物扩增条带13.45条,扩增条带都在80~2000 bp范围内。以各烟草品种(系)原始材料为对照,比对其航天诱变后代材料进行,结果表明,在9个烟草品种(系)航天诱变后代中共扩增得到200条变异条带,多态性条带比率为35.40 %。各品种产生的变异条带数差别较大,其中LS-2产生变异条带数最少,仅有1条,而云烟85产生的变异条带最多,为45条。
2.2 烟草品种(系)及其航天诱变后代的遗传相似性分析

图1 K346及其航天诱变后代的遗传相似性分析Fig.1 Genetic similarity analysisof K346 and its spacemutation offspring

图2 TRAP引物F1X5/sa12-700对翠碧一号及其航天诱变SP4单株的PCR扩增产物电泳图Fig.2 The electrophoresis results of Cuibiyihao and it’s SP4 mutagenesis progenies amplified by TRAP primer F1X5/sa12-700

图3 翠碧一号及其航天诱变后代的遗传相似性分析Fig.3 Genetic similarity analysis of Cuibiyihao and its space mutation offspring
利用42对TRAP标记,对9个烟草品种(系)及其航天诱变后代进行扫描,对各品种(系)及其航天诱变后代之间的遗传相似系数(Genetic Similarity)进行分析,结果表明,9个烟草品种(系)及其航天诱变后代的遗传相似系数变幅处于0.32~1.00,其中烟草品种K346及其航天诱变后代的差异最大,遗传相似系数仅为0.32。在K346、翠碧一号和云烟85中存在原始亲本与航天诱变后代部分单株之间遗传相似系数为1.0的现象;而云烟317、云烟87、红花大金元、K326、CF209未发现。各参试品种(系)航天诱变后代中均存在遗传相似系数为1.0的单株,其中CF209的航天诱变后代中存在1个遗传相似系数为1.0的分组,其包含的个体数最多,有12株。K326和云烟317的航天诱变后代中存在4个遗传相似系数为1.0的分组,分别包含4个、3个、3个、2个单株。在云烟85、云烟87、翠碧一号航天诱变后代中,分别有1组包含2个遗传相似系数为1.0的单株。红花大金元航天诱变后代中,有2组遗传相似系数为1.0的单株,分别包括7个和3个单株。在K326航天诱变个体中,分别有三组遗传相似系数为1.0,分别包括4个、3个、3个单株。遗传相似性聚类结果表明航天诱变后代的变异程度与烟草品种(系)有一定关系。在同一烟草品种(系)中可能存在容易受到航天诱变而发生变异的热点区域。
2.3 烟草品种(系)及其航天诱变后代的聚类分析
LS-2:利用TRAP分子标记对LS-2及其19份航天诱变单株的扫描结果显示,在诱变后代中仅发现一条变异条带,表明航天诱变对烟草品种LS-2的遗传诱变影响较小。

图4 云烟85及其航天诱变后代的遗传相似性分析Fig.4 Genetic similarity analysis of Yunyan85 and its space mutation offspring
K346:当遗传相似度(GS)为0.68时,K346及其航天诱变后代可以聚为3大类,类Ⅰ包括对照亲本以及其他18份材料;类Ⅱ包括4份材料;类Ⅲ包括2份材料;初步表明航天诱变对K346具有较大的诱变作用。从聚类图中可以看出,对照亲本1及其2、4、5、19;8、14、17、20;6、16;9、10;11、12五组诱变单株被分别聚到一起,表明个体之间的变异程度差异较大,推测基因组中可能存在的易变位点导致变异后代单株的遗传变异相似(图1)。
翠碧一号:当遗传相似度(GS)为0.68时,翠碧一号及其航天诱变单株被聚为5大类,类Ⅰ包括对照亲本及其它9份材料;类Ⅱ包括1份材料;类Ⅲ包括1份材料;类Ⅳ包括2份材料;类Ⅴ包括15份材料,表明翠碧一号经航天诱变后变异丰富。在聚类图中遗传相似系数的分布可以看出,翠碧一号经过航天诱变之后其后代的个体在基因组水平的变异较大,个别单株与对照的遗传相似性变异尤为明显(图2)。仅有22、23变异单株被完全聚到了一起(图3)。
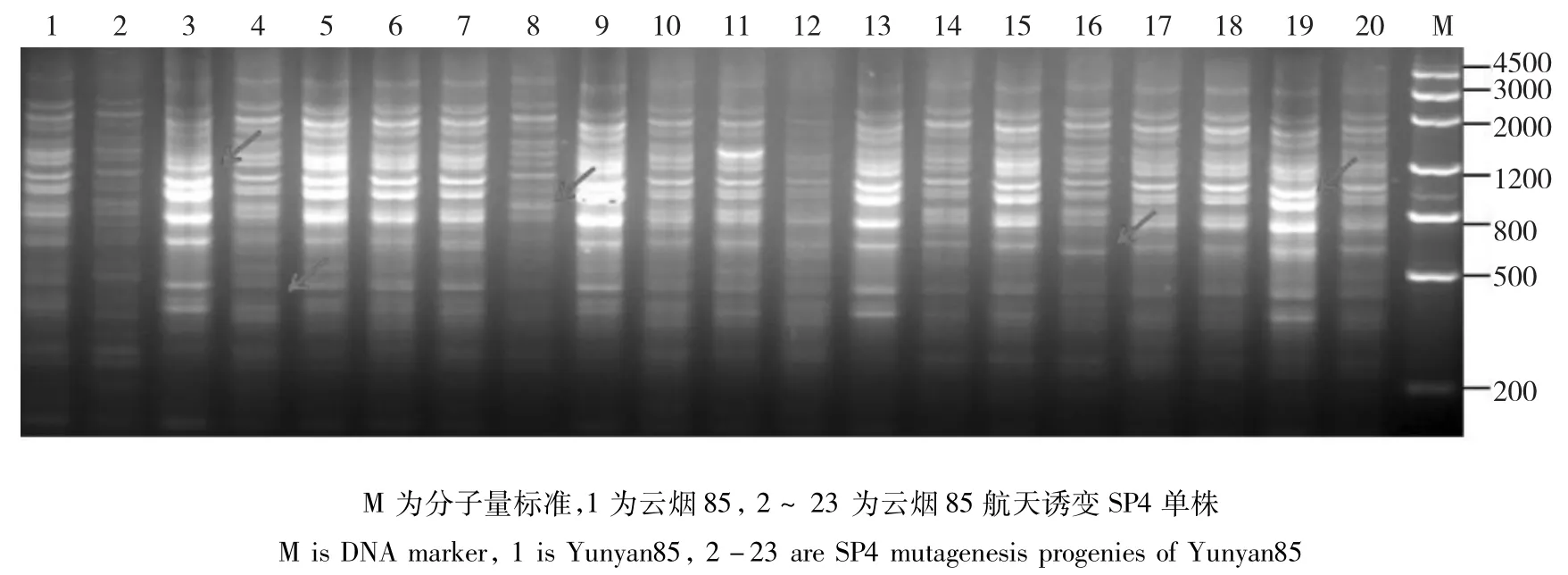
图5 TRAP引物F1X5/Odd26-700对云烟85及其航天诱变SP4单株的PCR扩增产物电泳图Fig.5 The electrophoresis results of Yunyan85 and it’s SP4 mutagenesis progenies amplified by TRAP primer F1X5/Odd26-700

图6 云烟317及其航天诱变后代的遗传相似性分析Fig.6 Genetic similarity analysis of Yunyan317 and its spacemutation offspring
云烟85:当遗传相似度(GS)为0.68时,云烟85及其航天后代诱变材料可以划分为2大类(图4),类Ⅰ包括对照亲本以及18份航天诱变单株;类Ⅱ包括1份航天诱变材料,表明航天诱变对云烟85产生的基因组影响较小。从聚类图中遗传相似系数的分布可以看出,类Ⅱ包括1份材料,与亲本及其它诱变单株的遗传差异较大;类Ⅰ又可划分为两个亚类,分别包括11份、8份材料,区别较明显。云烟85的航天诱变后代材料在基因组水平的单株变异不大,但仍然有对个别单株造成了显著的基因组变异。仅有6、7诱变单株被完全聚到了一起(图5)。
云烟317:当遗传相似度(GS)为0.68时,云烟317及其航天诱变后代可划分为2大类,类Ⅰ包括对照亲本及其19份航天诱变材料;类Ⅱ包括1份材料,表明航天诱变对云烟317基因组造成的变异较小。在聚类图中遗传相似系数的分布可以看出,云烟317经过航天诱变后,后代普遍在基因组水平发生了变异,但是变异幅度较小,仅有个别植株变异较大(图6)。

图7 云烟87及其航天诱变后代的遗传相似性分析Fig.7 Genetic similarity analysis of Yunyan87 and its space mutation offspring
云烟87:当遗传相似度(GS)为0.68时,云烟87及其航天后代诱变材料可以划分为4大类(图7),类Ⅰ包括对照亲本及其航天诱变后代18份,类Ⅱ包括1份材料,类Ⅲ包括1份材料,类Ⅳ包括2份材料。在聚类图中遗传相似系数的分布可以看出,云烟87的航天诱变后代中的个别单株在基因组水平的变异较大,大部分诱变单株变异幅度不大(图8),初步表明航天诱变对云烟87产生的诱变幅度较小。
红花大金元:当遗传相似度(GS)为0.68时,红花大金元及其航天诱变后代可以划分为3大类(图9),类Ⅰ包括对照亲本及4份航天诱变后代;类Ⅱ包括15份航天诱变材料;类Ⅲ包括1份航天诱变材料。在聚类图中遗传相似系数分布可以看出,红花大金元经过航天诱变后大部分后代在基因组水平的变异较大,个别单株与对照材料间变异尤为明显(图10)。其中,3、5、6、7、8、9、15以及18、19、20两组材料经航天诱变后,变异位点大体相同,遗传相似性非常高。

图8 TRAP引物F1X5/Ga5-800对云烟87及其航天诱变SP4单株的PCR扩增产物电泳图Fig.8 The electrophoresis results of Yunyan87 and its SP4 mutagenesis progenies amplified by TRAP primer F1X5/Ga5-800

图9 红花大金元及其航天诱变后代的遗传相似性分析Fig.9 Genetic similarity analysis of Honghuadajinyuan and its space mutation offspring
K326:当遗传相似度(GS)为0.68时,K326及其航天诱变后代可以划分为2大类,类Ⅰ包括对照亲本及其17份诱变单株;类Ⅱ包括7份诱变单株。在聚类图中遗传相似系数的分布可以看出,K326经过航天诱变后大部分单株在基因组水平都发生了一定程度的变异,仅有部分单株变异较小,大部分诱变后代变异较大(图11)。其中,6、7、9、22;12、17;16、18、25及3、4、20四组材料经诱变后,遗传相似系数为1.00。
CF209:当遗传相似度(GS)为0.68时,CF209及其航天诱变后代可以划分为4大类,类Ⅰ仅包括对照亲本;类Ⅱ包括14份材料;类Ⅲ包括1份材料;类Ⅳ包括1份材料。在聚类图中遗传相似系数的分布可以看出,CF209经航天诱变后,大部分单株在基因组水平都发生了变异,仅有少部分单株变异较大,表明航天诱变对CF209造成的遗传变异较大(图12)。

图10 TRAP引物F1X5/Odd15-700对红花大金元及其航天诱变SP4单株的PCR扩增产物电泳图Fig.10 The electrophoresis results of Honghuadajinyuan and it’s SP4 mutagenesis progenies amplified by TRAP primer F1X5/Odd15-700
3 讨论
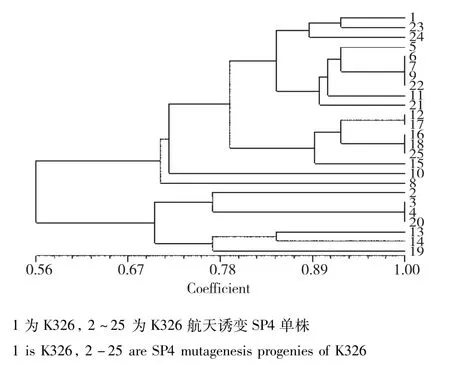
图11 K326及其航天诱变后代的遗传相似性分析Fig.11 Genetic similarity analysis of K326 and its space mutation offspring

图12 CF209及其航天诱变后代的遗传相似性分析Fig.12 Genetic similarity analysis of CF209 and its space mutationoffspring
近年来,随着航天技术的快速发展,航天诱变育种技术在小麦[13]、水稻[14]、玉米[15-16]、大豆[17-18]等粮食作物[19-20],以及蔬菜[21-22]、牧草[23-24]、园林植物[25-26]、药用植物[27]中得到广泛的应用[28],表现出良好的诱变效果,成为植物育种的有效方法。本研究利用航天诱变技术对9份烟草品种进行诱变,获得了不同品种(系)稳定遗传的突变材料,利用TRAP分子标记技术对9个烟草品种及其稳定突变体进行扫描,初步证明利用航天诱变技术可以获得烟草基因组突变体。
目标区域多态性标记技术是Hu和Vick基于已克隆的功能基因保守区域设计开发出来的[29],该技术已在水稻[30]、小麦[11]、向日葵[31]等多种作物中得到了广泛的应用。本研究利用该标记技术对烟草突变体材料进行扫描,实现对突变体基因组多位点的高效扫描。由于该标记技术是基于已克隆基因的保守区域来开发设计的,因此该标记的扫描结果与功能基因关联的可能性较其它标记高。
航天诱变技术在创造新种质、培育新品种等方面取得了可喜的成就,创制大量的农作物新种质,选育出一批新品种,取得了显著的经济效益和社会效益。近年来有关航天诱变技术进行烟草研究的报道逐渐增多,大多研究都主要集中在突变体表型研究上,对航天诱变的理论研究还不够深入[1,9],对有关诱变规律以及突变体分子生物学水平的研究较少,但是这些研究对烟草航天育种理论的完善和育种效率的提高具有重要作用,所以在今后的研究中应加强这些方面法人研究进一步完善航天诱变育种理论,提高航天诱变育种效率。
4 结论
本研究发现航天诱变对不同烟草品种(系)均会产生可遗传变异,但是烟草品种(系)不同,其对航天诱变的敏感性不同,形成诱变位点数量也不同;在烟草基因组上航天诱变位点的出现具有一定的随机性。此外本研究发现在不同品种(系)诱变后代中存在遗传相似性极高的变异单株,推测在烟草基因组上存在易发生诱变的区域。这些研究结果为航天诱变育种技术在烟草育种中的应用提供理论依据。
[1]密士军,郝再彬.航天诱变育种研究的新进展[J].黑龙江农业科学,2002(4):31-33.
[2]Ruyters G,Braun M.Plant biology in space:recent accomplishments and recommendations for future research[J].Plant Biology,2014,16(1):4-11.
[3]Paul AL,Amalfitano CE,Ferl RJ.Plantgrowth strategies are remodeled by spaceflight[J].BMC plant biology,2012,12(1):232.
[4]刘波,曾志南,叶金聪,等.太空搭载卤虫诱变效应的AFLP分子标记检测[J].台湾海峡,2008,27(4):417-421.
[5]杨丞,李官成,李跃辉,等.太空诱变宫颈癌细胞的生物学研究[J].中南大学学报(医学版),2007,32(3):380-386.
[6]曹丽,钱鹏,张紫晋,等.航天搭载小麦矮秆突变体DMR88-1矮化效应分析[J].核农学报,2015,29(11):2049-2057.
[7]刘永柱,许立超,郭涛,等.2个三系杂交稻保持系航天诱变效应的研究.华南农业大学学报,2013,34(3):292-299.
[8]马丽,魏海霞,汪倩倩,等.航天诱变毛霉ZY-3在腐乳生产中的应用研究[J].中国酿造,2015,34(4):62-65.
[9]张学林,刘长庭.空间微生物制药研究进展[J].中国医药导报,2015,12(8):30-32.
[10]杨铁钊.烟草育种学[M].北京:中国农业出版社,2003:1-5.
[11]Feng J,Chen G,Wei Y,et al.Identification and geneticmapping of a recessive gene for resistance to stripe rust in wheat line LM168-1[J].Mol breed,2014,33(3):601-609.
[12]NeiM,LiWH.Mathematicalmodel for studying genetic variation in terms of restriction endonucleases[J].Proc Natl Acad Sci USA,1979,76:5269-5273.
[13]杨攀,雷振生,吴政卿,等.航天诱变小麦新品种郑麦3596的选育[J].作物杂志,2014(5):163-164.
[14]吴钟,陈文阳,高云.广东省水稻诱变育种进展及展望[J].广东农业科学,2013,40(8):4-7.
[15]乔晓,石海春,柯永培,等.玉米航天诱变SP3株系的遗传变异分析[J].玉米科学,2012,20(3):15-21.
[16]张采波,吴章东,徐冬平,等.玉米空间诱变后代SP4选系配合力效应分析[J].遗传,2013,35(7):903-912.
[17]郑伟.大豆航天育种研究进展[J].辐射研究与辐射工艺学报,2015,33(5):50101-50101.
[18]Kittang AI,Iversen TH,Fossum KR,et al.Exploration of plant growth and development using the European Modular Cultivation System facility on the International Space Station[J].Plant Biology,2014,16(3):528-538.
[19]李海晶,蒋博,范术丽,等.棉花航天诱变芽黄突变体蛋白组学分析[J].棉花学报,2013,25(4):345-351.
[20]李万红,阎巧凤,申幸福.谷子空间诱变育种研究进展[J].现代农业科技,2012(6):97-97.
[21]赵国臣,宁艳东,张志民,等.我国航天诱变育种的现状及其在蔬菜育种上的应用[J].吉林蔬菜,2013(1):55-56.
[22]甘仪梅,张树珍,武媛丽,等.作物航天诱变育种变异特征研究进展[J].广东农业科学,2015,42(1):119-123.
[23]黄春琼,刘国道,白昌军.热带牧草种质资源收集,保存与创新利用研究进展[J].草地学报,2015,23(4):672-678.
[24]杨红善,常根柱,包文生,等.紫花苜蓿航天诱变田间形态学变异研究[J].草业学报,2012,21(5):222.
[25]罗志平,孟兰贞,张勇.园林植物育种中辐射育种的应用研究[J].农业与技术,2015(6):131.
[26]崔彬彬,孙宇涵,李云.木本植物航天诱变育种研究进展[J].核农学报,2013,27(12):1853-1857.
[27]孔四新,崔旭盛,李海奎.药用植物太空育种研究进展[J].中国农学通报,2014,30(6):273-278.
[28]肖蓓.我国有200多种“航天育种”农作物培育成功[J].农业工程,2013,2(12):48.
[29]Hu J,Vick BA.Target region amplification polymorphism:a novel marker technique for plant genotyping[J].Plant Mol Bio Rep,2003,21(3):289-294.
[30]朱志凯,方良俊,招倩婷,等.水稻TRAP-PCR反应体系优化与P-糖蛋白基因片段的分析[J].分子植物育种,2008,6(1): 65-70.
[31]Chen J,Hu J,Vick BA,et al.Molecular mapping of a nuclear male-sterility gene in sunflower(Helianthusannuus L.)using TRAP and SSR markers[J].Theo App Gene,2006,113(1):122-127.
(责任编辑 李洁)
Analysis of 9 Tobacco Varieties(lines)and Their Space M utation Progenies w ith TRAP M arkers
FENG Jun-yan1,PU Zhi-gang1*,LIMing1,ZHANG Cong1,YANWen-zhao1,WANG Yong2,XING Xiao-jun2,LIU Dong-yang2
(1.Biotechnology and Nuclear Technology Research Institute,Sichuan Academy of Agricultural Sciences,Sichuan Chengdu 610061,China;2.Liangshan District Tobacco Company of China Tobacco Chuanyu Industrial Co.,Ltd.,Sichuan Liangshan 615000,China)
It is very significant to explore the law of spaceflightmutation breeding in creating new tobacco breedingmaterials.This studywas focused on using spaceflightmutation technique to induce seedsof9 tobacco varieties(lines)mutation,then breed to SP4 generation in the field.About20 plants per varieties(lines)were randomly selected,and analyzed with 42 TRAP primers.200 variation bandswere detected,and 1 to 45 variation bandswere obtained in different varieties(lines).1 variation bandswas found in LS-2,and 45 variation bands were found in Yunyan85,indicating spacemutation induce resultswas different in different tobacco varieties(lines),and different tobacco varieties(lines)showed different sensitivity to spaceflightmutation.Genetic similarity and cluster analysis showed the genetic similarity coefficient ranged from 0.32 to1.000 in different tobacco varieties(lines)and their spacemutation SP4progenies.K346 and its spacemutation SP4 progenies showed the biggest difference,and the genetic similarity coefficientwas0.32.The genetic similarity coefficient1.0 was detected in all varieties(lines)and their spacemutation SP4 progenies,K346,Cuibiyihao and Yunyan85 had genetic similarity coefficient 1.0 between parents and its spacemutation SP4progenies.These results were not detected inYunyan317,Yunyan87,Honghuadajinyuan,K326 and CF209.The individual plant variation had certain relation with plant variety,and also there could be some hot spots in the same variety thatwaseasily induced by spacemutation.This studywillprovide a theoretical basisof spacemutation breeding technology to tobacco breeding research.
Tobacco;TRAPmarker;Spacemutation;Genetic diversity
S572
A
1001-4829(2017)2-0273-07
10.16213/j.cnki.scjas.2017.2.006
2016-04-06
中国烟草总公司四川省公司科技专项“航天及辐射诱变创制烟草育种新材料”[(2012)03001]
冯俊彦(1985-),男,四川成都人,博士,植物生物技术育种,E-mail:junyanfeng@live.cn,*为通讯作者。

