14-3-3 zeta蛋白过表达与他莫昔芬治疗乳腺癌耐药的关系
凌人,凌今,2,陈仲华,刘丹丹,赵宏圻,柯友涛
(1.金华广福医院 病理科,浙江 金华 321000;2.复旦大学 药学院,上海 201203)
14-3-3 zeta蛋白过表达与他莫昔芬治疗乳腺癌耐药的关系
凌人1,凌今1,2,陈仲华1,刘丹丹1,赵宏圻1,柯友涛1
(1.金华广福医院 病理科,浙江 金华 321000;2.复旦大学 药学院,上海 201203)
目的:探讨14-3-3 zeta蛋白过表达与他莫昔芬治疗乳腺癌耐药的关系。方法:采用免疫组织化学S-P法对80例雌激素受体阳性乳腺癌组织中14-3-3 zeta蛋白表达进行检测,根据14-3-3 zeta蛋白表达情况将患者分组,结合每组生存情况评价14-3-3 zeta蛋白过表达与他莫昔芬治疗乳腺癌耐药的关系。结果:癌组织中14-3-3 zeta蛋白表达总阳性率为96.25%(77/80),其中强阳性占51.25%(41/80),中等阳性占23.75%(19/80),弱阳性占21.25%(17/80)。14-3-3 zeta蛋白过表达与临床病理因素无明显相关性。随访结果显示,14-3-3 zeta蛋白过表达组患者在应用他莫昔芬治疗后更容易复发,生存期明显较短。细胞实验表明,提高乳腺癌细胞中14-3-3 zeta蛋白表达可以增强其对他莫昔芬的耐药性,反之,抑制14-3-3 zeta蛋白表达可有效提高他莫昔芬治疗的敏感性。结论:14-3-3 zeta蛋白可以作为他莫昔芬治疗乳腺癌耐药评估的生物标记物,检测乳腺癌组织内14-3-3 zeta蛋白表达可以用于评估他莫昔芬治疗乳腺癌的疗效。
乳腺肿瘤;14-3-3 zeta;免疫组织化学法;他莫昔芬;细胞凋亡
临床上对于雌激素受体(estrogen receptor,ER)阳性的乳腺癌患者常针对性地选用ER拮抗剂(如他莫昔芬)进行内分泌治疗。然而,内分泌治疗的有效率仅50%~60%[1-2]。内分泌治疗无效的患者往往会因首次治疗失败而错过最佳治疗时机,生存质量和生存时间大打折扣。因此,寻求一种新的生物标记物结合ER表达来更加准确地评估乳腺癌内分泌治疗的有效性显得格外重要。
14-3-3 zeta蛋白是一种细胞信号转录蛋白,通过结合磷酸丝氨酸蛋白介导信号转导,在细胞凋亡中发挥重要作用。本研究应用免疫组织化学方法检测14-3-3 zeta蛋白在80例激素依赖型乳腺癌组织中的表达,探讨其过表达与他莫昔芬治疗乳腺癌耐药的相关性,并通过改变乳腺癌MCF-7细胞株的14-3-3 zeta蛋白表达进一步验证该蛋白表达与他莫昔芬治疗乳腺癌耐药的相关性,旨在为临床更加合理地制定诊疗方案提供科学依据。
1 资料和方法
1.1 一般资料 收集我院2006至2014年间经手术治疗的乳腺癌患者80例作为研究对象,并对其临床和病理资料进行整理和分析。纳入标准:①原发性乳腺癌;②术前未经过任何抗肿瘤治疗;③经过2位以上病理科医师确诊;④免疫组织化学重新检测ER表达为阳性(染色细胞比率大于10%);⑤使用内分泌治疗作为首次治疗方案;⑥病例及随访记录完整。研究对象均为女性,平均年龄46±8岁(38~62岁),参照2015年St.Gallen国际乳腺癌大会共识:术后Luminal A型通常仅需内分泌治疗,Luminnal B型全部患者均需内分泌治疗,大多数要辅助化疗,对有淋巴结转移且直径在5 cm以上患者予以放疗。
1.2 方法
1.2.1 免疫组织化学染色:所有标本均经4%中性甲醛固定,常规石蜡切片,HE染色。另取切片,采用免疫组织化学S-P法,鼠抗人14-3-3 zeta单克隆抗体作为一抗,1:100稀释,参照说明书设置染色程序,并由Leica Bond-Max全自动免疫组织化学染色仪完成。一抗和二抗购自美国Abcam公司,抗体稀释工作液、DAB显色试剂盒购自Leica公司。每批染色均设有阳性对照、阴性对照,对照切片出现预期结果的同批染色切片方可进一步读判。14-3-3 zeta蛋白阳性染色为棕黄色颗粒,主要位于胞浆。免疫组织化学染色的结果判定根据其着色强度×肿瘤细胞阳性率:染色深,且染色细胞比率超过50%者为强阳性染色(+++);染色强度中等,且染色细胞比率25%~50%者为阳性染色(++);染色较浅,且染色细胞比率10%~25%者为弱阳性染色(+);定位处没有染色,或者染色细胞比率<10%者为阴性染色(-)。
1.2.2 细胞培养:乳腺癌MCF-7细胞株采用含10%胎牛血清和双抗的RPMI 1640培养基在37 ℃、5% CO2条件下培养,每2~3 d传代1次,取对数生长期细胞用于实验。
1.2.3 细胞转染:将重组质粒DNA经大肠杆菌Ecoli DH5α在含氨苄青霉素的LB培养基中增殖,提纯。细胞在转染前铺板,使其在转染时密度为90%~95%时,使用50 μL无血清RPMI 1640培养基稀释1.0 μg DNA。使用50 μL RPMI 1640培养基稀释3 μL Lipofectamine 2000试剂(购于Invitrogen公司)。混合上述配置的2种试液,直接将复合物加入到每孔中,摇动培养板,轻轻混匀。在37 ℃,5% CO2培养箱中孵育48 h后,弃去培养液,每孔用2 mL PBS清洗1遍,再用1 mL RPMI 1640清洗2遍,加入不含血清的RPMI 1640培养基继续培养。24 h后在倒置荧光显微镜下观察细胞生长情况和细胞内增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的表达情况,采用细胞计数法评价转染效率。每孔取3个不同的视野分别计数细胞总数和有绿色荧光的细胞数。转染效率=(发绿色荧光的细胞数/细胞总数)×100%。
1.2.4 RNA干扰:14-3-3 zeta RNA干扰双链siRNA合成序列:14-3-3 zeta特异性序列为5’-AAAGUUCUU GAUCCCCAAUGC-3’,对照序列为5’-CAGUCGCGUUUGCG ACUGG-3’。细胞铺板生长至1×106后,使用Lipofectamine Plus试剂盒与100 nmol/L的siRNA按照说明书操作进行转染。
1.2.5 TUNEL凋亡检测:PBS清洗细胞2次,随后用4%多聚甲醛固定细胞30~60 min。用PBS清洗细胞,加入含0.1% Triton X-100的PBS冰浴孵育2 min。按末端转移酶(terminal deoxynucleotidyl transferase,TdT)与荧光标记液1:24比例配置TUNEL检测液,每个样品加入50 μL,37 ℃避光孵育60 min,用抗荧光淬灭封片液封片后荧光显微镜450 nm波长下观察,绿色荧光为TUNEL染色阳性细胞。对随机5个视野下的细胞总数和阳性细胞进行计数,并计算阳性率。
1.3 统计学处理方法 采用SPSS18.0统计学软件进行数据分析。计数资料采用卡方检验,计量资料采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学染色结果 14-3-3 zeta表达为胞浆着色,镜下呈均匀一致的棕黄色颗粒(见图1),总阳性率为96.25%(77/80),其中强阳性占51.25%(41/80),中等阳性占23.75%(19/80),弱阳性占21.25%(17/80),阴性占3.75%(3/80)。
2.2 生存分析 根据14-3-3 zeta表达强弱将80例患者分为2组,分别记录其96个月内乳腺复发、转移、死亡的不良事件发生情况。14-3-3 zeta高表达组共41例患者,观察期内发生不良事件10例,发生率为24.4%(10/41);14-3-3 zeta低或中表达组共39例患者,观察期内发生不良事件2例,发生率为5.1%(2/39)。统计学数据显示,14-3-3 zeta高表达组患者发生不良事件概率显著高于14-3-3 zeta低表达组患者(χ2=24.4,P<0.05)。见图2。
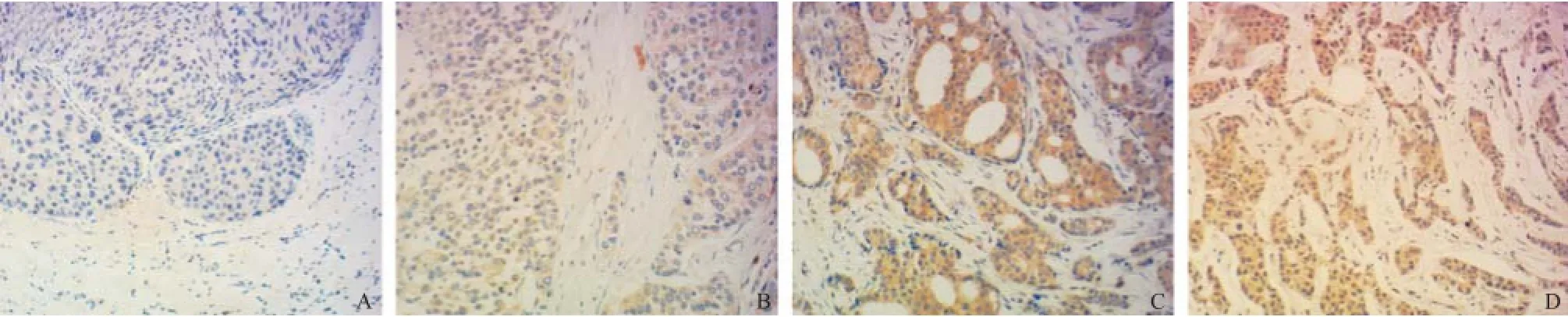
图1 乳腺癌组织中14-3-3 zeta蛋白免疫组织化学染色图(×200)

图2 14-3-3 zeta过表达与患者内分泌治疗后无进展生存期的生存曲线图
2.3 14-3-3 zeta表达与临床病理因素的相关性 通过对14-3-3 zeta表达情况与患者各临床病理因素的统计学分析得出:14-3-3 zeta的表达与患者年龄、患侧、病理分级、肿瘤大小、脉管累及、神经累及、Ki67、Her2过表达型均无相关性(P>0.05),见表1。
2.4 细胞药敏结果 通过对MCF-7细胞进行转染,14-3-3 zeta表达水平明显提高(P<0.05)(见图3A)。对于未转染和转染14-3-3 zeta基因的MCF-7细胞分别进行他莫昔芬处理72 h。检测其凋亡水平发现,转染14-3-3 zeta基因后MCF-7细胞凋亡率显著降低(P<0.05),2组差异有统计学意义(见图3B)。未转染14-3-3 zeta基因的MCF-7细胞经他莫昔芬处理后凋亡显著增加(见图4A),转染14-3-3 zeta基因的MCF-7细胞经他莫昔芬处理后细胞凋亡不明显(见图4B)。随后,采用合成的siRNA对于MCF-7细胞进行处理,下调14-3-3 zeta基因表达至原表达量的50%(P<0.05)(见图5A),再用他莫昔芬处理细胞,结果显示下调14-3-3 zeta表达量后细胞凋亡显著增高(见图5B)。未干扰14-3-3 zeta基因表达的MCF-7细胞经他莫昔芬处理后凋亡较少(见图6A),干扰下调14-3-3 zeta基因表达的MCF-7细胞经他莫昔芬处理后细胞凋亡显著增加(见图6B)。

表1 14-3-3 zeta表达与临床因素相关性
3 讨论
乳腺癌细胞会特异性地表达ER、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor rece-ptor-2,HER2)、Ki-67等多种蛋白[3-4]。以上述这些蛋白作为生物标记物,根据其表达情况可将乳腺癌分为Luminal A型、Luminal B型、Her2型和基底样型等4种分子分型。其中,针对ER阳性的Luminal型乳腺癌患者,内分泌治疗是首选治疗措施。
他莫昔芬是乳腺癌内分泌治疗的代表性药物,它是一种雌二醇竞争性拮抗剂,能与乳腺细胞的雌激素受体结合,不刺激转录或作用微弱[5]。理论上来说,他莫昔芬作为一种ER拮抗剂对ER阳性患者均具有疗效[6]。然而,由于乳腺癌遗传异质性基因的存在,激活ER并非唯一的或主要的促进乳腺癌细胞增殖的途径[7]。这使得应用内分泌治疗中,有40%~50%的ER阳性患者对内分泌治疗药物发生耐药,致使后续的针对性治疗变得更为困难[8]。
14-3-3蛋白家族具有高度保守的氨基酸序列,几乎存在于一切真核生物体内[9]。14-3-3蛋白在人体中存在有7种亚型,其中14-3-3 zeta基因位于2号染色体p25.1区段,含有6个外显子,表达的14-3-3 zeta蛋白含有245个氨基酸。14-3-3 zeta蛋白缺乏内源性酶活性,主要功能是通过形成二聚体或异质二聚体对目标蛋白的丝氨酸/苏氨酸位点进行磷酸化而实现的。14-3-3 zeta可以磷酸化MEKK1的调控结构区域,抑制caspase-3对MEKK1 N端调控结构域的作用,阻碍凋亡信号转导[10-11]。14-3-3 zeta还可以通过对BCL2-associated agonist of cell death(Bad)蛋白Ser136磷酸化阻碍其由细胞浆转运到线粒体,进而发挥抗凋亡的作用。反之,当细胞分裂周期蛋白2(cell division cycle protein 2,CDC2)磷酸化Bad的Ser128后,14-3-3 zeta则无法磷酸化Bad的Ser136,从而诱导细胞凋亡。研究[12-14]发现,14-3-3 zeta蛋白通过作用于细胞信号转导,促进多种恶性肿瘤细胞的增殖或抑制细胞凋亡。

图3 转染14-3-3 zeta前后MCF-7细胞对他莫昔芬处理的药敏结果

图4 14-3-3 zeta转染MCF-7细胞前后他莫昔芬处理的TUNEL染色图(×400)

图5 干扰14-3-3 zeta前后MCF-7细胞对他莫昔芬处理的药敏结果
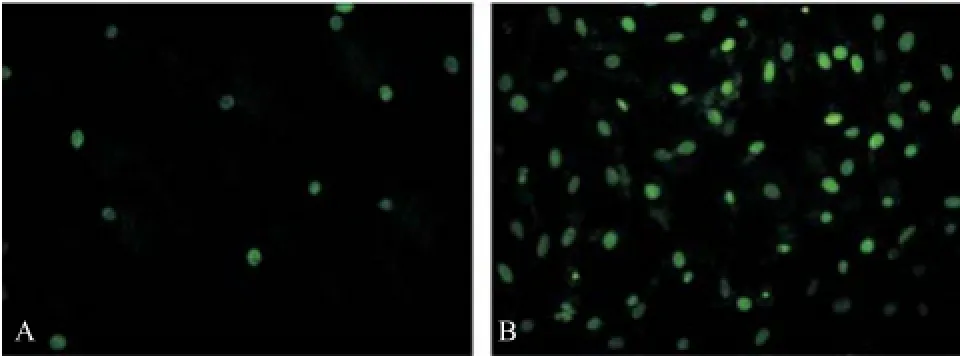
图6 干扰MCF-7细胞内14-3-3 zeta表达前后他莫昔芬处理的TUNEL染色图(×400)
14-3-3蛋白表达异常可能破坏正常细胞的内稳态,导致肿瘤和其他疾病的发生。比如14-3-3δ是一种肿瘤抑制基因,其表达缺失常见于乳腺癌中。反之,其他14-3-3蛋白在多种癌症中常表现为高表达,其临床生物学意义目前已有所发现[15]。DANES等[16]研究表明,乳腺癌早期会发生14-3-3 zeta过表达,其促进人乳腺上皮细胞化生。在约40%晚期乳腺癌患者中会发生14-3-3 zeta高表达,这些患者往往会复发,且生存时间明显缩短[17]。在这些复发的乳腺癌患者中,仅有小于30%的乳腺癌患者Her2表达阳性,而约有40%的患者14-3-3 zeta表达强阳性。因此,14-3-3 zeta作为一种不良预后的生物标记物会更加准确。本课题组在前期研究中发现[11],14-3-3 zeta在乳腺癌组织中显著高表达,统计发现其与临床病理因素无明显相关,推测其与肿瘤分化、进展无直接联系;ER阳性组患者癌组织内14-3-3 zeta蛋白表达显著高于ER阴性组,提示14-3-3 zeta在乳腺癌中的上调可能受到激素影响,其高表达可能与内分泌治疗疗效之间存在相关性。本研究对使用他莫昔芬治疗的乳腺癌患者癌组织中的14-3-3 zeta蛋白进行检测,对照其生存情况发现,癌组织中14-3-3 zeta高表达组的患者复发率较14-3-3 zeta低表达组显著升高。在8年随访期里,14-3-3 zeta高表达组中患者的无进展生存率较14-3-3 zeta低表达组低约15%,且差异有统计学意义。此外,14-3-3 zeta的表达与患者临床资料均不相关,属于他莫昔芬耐药的独立相关因素。本研究数据表明,提高乳腺癌细胞中14-3-3 zeta的表达可以增强肿瘤细胞对他莫昔芬的耐药性,而降低14-3-3 zeta的表达则有效提高他莫昔芬的敏感性,本研究结果与临床观察结果相符。
综上所述,14-3-3 zeta蛋白高表达促进了乳腺癌细胞对内分泌治疗的耐受,下调该基因表达能显著增强细胞凋亡,提高内分泌治疗灵敏度。临床上观察,14-3-3 zeta蛋白高表达还预示乳腺癌患者较短的生存期。因此,14-3-3 zeta蛋白高表达可以作为乳腺癌内分泌治疗的生物标记物,检测乳腺癌组织内14-3-3 zeta蛋白表达可准确评估患者预后。
[1] KIM S I, LEE Y, SON Y, et al. Assessment of breast cancer patients’ knowledge and decisional conf ict regarding tamoxifen use[J]. J Korean Med Sci, 2015, 30(11): 1604-1611.
[2] KIM J, LEE J, JANG S Y, et al. Anticancer effect of metformin on estrogen receptor-positive and tamoxifen-resistant breast cancer cell lines[J]. Oncol Rep, 2016, 35(5): 2553-2560.
[3] 罗华荣, 徐铖, 郑海红, 等. 乳腺实性乳头状癌的临床病理特征[J]. 温州医科大学学报, 2015, 45(5): 364-368.
[4] SANCHEZ-MUNOZ A, GARCIA-TAPIADOR A M, MARTINEZ-ORTEGA E, et al. Tumour molecular subtyping according to hormone receptors and HER2 status def nes different pathological complete response to neoadjuvant chemotherapy in patients with locally advanced breast cancer[J]. Clin Transl Oncol, 2008, 10(10): 646-653.
[5] 李光明, 段百芸. 托瑞米芬联合他莫昔芬应用于晚期乳腺癌治疗效果及生存质量分析[J]. 中国普通外科杂志, 2016, 25(3): 463-466.
[6] 蔡加琴, 孙红, 魏晓霞, 等. 下调长链非编码RNA H19对他莫昔芬耐药乳腺癌侵袭能力的影响[J]. 中国药学杂志, 2016, 51(11): 880-883.
[7] 魏丽, 段红洁, 牛秀珑, 等. 雌激素受体β在乳腺癌他莫昔芬内分泌治疗耐药中的作用[J]. 中国肿瘤生物治疗杂志, 2015, 22(01): 52-56.
[8] 张燕青, 王连生. 基因多态对他莫昔芬疗效影响研究进展[J]. 中国药理学与毒理学杂志, 2012, 26(3): 411-414.
[9] 齐凤杰, 邸金娜, 赵树鹏. 乳腺癌中组织14-3-3σ和cyclin B1的表达及其临床意义[J]. 中国肿瘤生物治疗杂志, 2011, 18(2): 211-215.
[10] NEAL C L, YAO J, YANG W, et al. 14-3-3 zeta overex-pression def nes high risk for breast cancer recurrence and promotes cancer cell survival[J]. Cancer Res, 2009, 69(8): 3425-3432.
[11] 凌人, 凌今, 倪型灏, 等. 乳腺癌RCL、TAOK1、14-3-3 zeta、ZNF706蛋白表达的临床病理意义[J]. 温州医科大学学报, 2014, 44(11): 817-821.
[12] JIN L M, HAN X H, JIE Y Q, et al. 14-3-3zeta silencing retards tongue squamous cell carcinoma progression by inhibiting cell survival and migration[J]. Cancer Gene Ther, 2016, 23(7): 206-213.
[13] MORRISON D K. The 14-3-3 proteins: integrators of diverse signaling cues that impact cell fate and cancer development[J]. Trends Cell Biol, 2009, 19(1): 16-23.
[14] CHIANG C W, HARRIS G, ELLIG C, et al. Protein phosphatase 2A activates the proapoptotic function of BAD in interleukin-3-dependent lymphoid cells by a mechanism requiring 14-3-3 dissociation[J]. Blood, 2001, 97(5): 1289-1297.
[15] LI Y, ZOU L, LI Q, et al. Amplif cation of LAPTM4B and YWHAZ contributes to chemotherapy resistance and recurrence of breast cancer[J]. Nat Med, 2010, 16(2): 214-218.
[16] DANES C G, WYSZOMIERSKI S L, LU J, et al. 14-3-3 zeta down-regulates p53 in mammary epithelial cells and confers luminal filling[J]. Cancer Res, 2008, 68(6): 1760-1767.
[17] HODGKINSON V C, EAGLE G L, DREW P J, et al. Biomarkers of chemotherapy resistance in breast cancer identified by proteomics: Current status[J]. Cancer Lett, 2010, 294(1): 13-24.
(本文编辑:吴昔昔)
The relationship between 14-3-3 zeta protein over-expression and tamoxifen resistance in breast cancer
LING Ren1, LING Jin1,2, CHEN Zhonghua1, LIU Dandan1, ZHAO Hongqi1, KE Youtao1.
1.Department of Pathology, Jinhua Guangfu Hospital, Jinhua, 321000; 2.School of Pharmacy, Fudan University, Shanghai, 201203
Objective:To investigate the relationship between 14-3-3 zeta protein over-expression and tamoxifen resistance in breast cancer.Methods:The 14-3-3 zeta protein expression was detected in the cancerous tissues of 80 breast patients using immunohistochemistry. Based on the follow-up visits, survival status in both high and low 14-3-3 zeta expression groups were analyzed.Results:The total positive ratio of 14-3-3 zeta protein expression in subjects was 96.25% (77/80). Among the total positive ratio, the strong positive ratio, moderate positive ratio and weakly positive ratio were 51.25% (41/80), 23.75% (19/80) and 21.25% (17/80), respectively. The 14-3-3 zeta protein over-expression was related to clinical pathological features. According to the follow-up results, the patients in 14-3-3 zeta high expression group would cause the relapse easily for a short survival time. The results of vitro experiment indicated that the Tamoxifen resistance was enhanced after increasing the expression of 14-3-3 zeta protein. Conversely, the down-regulation of 14-3-3 zeta protein expression would reduce the tamoxifen resistance.Conclusion:As a biomarker of tamoxifen resistance, 14-3-3 zeta protein can be used for evaluating therapeutic eff cacy by detecting its expression in breast cancer tissue.
breast neoplasms; 14-3-3 zeta; immunohistochemistry; tamoxifen; cell apoptosis
R361.2
A
10.3969/j.issn.2095-9400.2017.03.008
2016-09-21
金华市科技计划项目(2014-3-088);浙江省医药卫生一般研究计划项目(2015KYB419)。
凌人(1957-),女,安徽合肥人,副主任医师。

