牛腹泻病毒的PCR检测方法
林春丽 张海波 陈红霞 侯春燕 云雨生/内蒙古维克生生物科技有限公司
牛腹泻病毒的PCR检测方法
林春丽 张海波 陈红霞 侯春燕 云雨生/内蒙古维克生生物科技有限公司
本研究是通过PCR技术对新生牛是否带有牛病毒性腹泻病毒进行检验,排除其患病牛,制备无病毒血清,进一步用于兽药的研制。
一、材料与方法
(一)材料
1.主要试剂。RNAiso plus购自Takara公司;氯仿、无水乙醇、75%酒精,DEPC水、ddH2O、DNA Marker购自TakaRa公司;核酸染料购自百泰克有限公司;高速低温离心机购自Sigma公司;PCR扩增仪为美国伯乐公司,型号为S1000;凝胶成像仪。
2.样品。共30个样本包括:28个未知样本均为新生牛初血清;空白对照;阴性对照和阳性对照。
(二)方法
1.PCR检测。PCR技术,即聚合酶链式反应(polymerase chain reaction,PCR)是由Saiki发明,其技术对世界生物医学的巨大推动作用,获得了1992年的诺贝尔医学奖。由美国PE-Cetus公司的Kary Banks Mulis在1985年建立的。这项技术可在试管内的经数小时反应就将特定的DNA片段扩增数百万倍,这种迅速获取大量单一核酸片段的技术在分子生物学研究中具有举足轻重的意义,极大地推动了生命科学的研究进展。它不仅是DNA分析最常用的技术,而且在DNA重组与表达、基因结构分析和功能检测中具有重要的应用价值。
二、操作步骤。
(一)样品提取前准备
1.器材准备。1 000μl枪,200μl枪,50μl枪、1 000μl枪头,200μl枪头,75%酒精棉,止血钳,EP管,EP管架等。
2.提取步骤。
(1)取2 ml无菌无酶EP管,加入RNA Siso Plus(裂解液)900μL(加液过程中如枪头接触到EP管壁或其他物品,需更换枪头),再分别吸取待测血清样品、阳性对照、阴性对照各200μL于EP管中,每加一次样品换一次枪头。轻轻上下颠倒摇匀,至底部无沉淀,颜色均一,冰盒中静置5min。将已检测样品放回-20℃冷冻保存。(阴性对照放在中间顺序)
(2)12 000 r/min、4℃,离心1 min。加入200μL的氯仿,上下颠倒20次混匀,至颜色均一为乳粉色,冰盒中静置8 min。
(3)12 000 r/min、4℃、离心15 min。在离心剩余2 min时准备新1.5 ml无菌无酶EP管,加入800μl-20℃预冷的异丙醇。从离心机轻拿轻放取出EP管。(离心后液体分为三层,底层为有机溶液层,中层蛋白质,上层上清液含RNA)。吸取400μl上清液(分两次200μl吸取,吸取上层液体时切勿碰触或吸取中层蛋白质),放入事先加好异丙醇的新1.5 ml EP管中,轻轻上下颠倒20次摇匀,-20℃静置20 min。
(4)12 000 r/min、4℃、离心15 min。离心机中EP管摆放方向保持一致,以使沉淀在管底同一侧。若离心后不出沉淀继续-20℃放置10~20 min后离心。弃上清,保留沉淀。沉淀即为RNA提取物,量很少,在倒上清液时注意,切勿将沉淀倒出。
(5)加入1 ml 75%乙醇(DEPC水配制,加乙醇过程中如枪头接触到EP管壁或其他物品,需更换枪头),轻轻上下颠倒,洗涤沉淀,将沉淀悬浮起来即可。
(6)7 500 r/min、4℃、离心5 min。弃上清,保留沉淀。用200μl枪头将管底残余乙醇液体吸净,吸取一个样品换一个枪头,注意不要碰触和吸取到RNA沉淀。
(7)EP管中的RNA在超净工作台中室温下自然干燥10 min。加入20μL的无RNase水(将水加到沉淀上),轻弹溶解沉淀,短期使用-20℃保存,长期使用保存于-70℃下。
(二)引物设计
根据Genebank数据库,使用引物设计软件Primeier 5.0设计BVDV特异性引物如下。
gB1、gB2引物
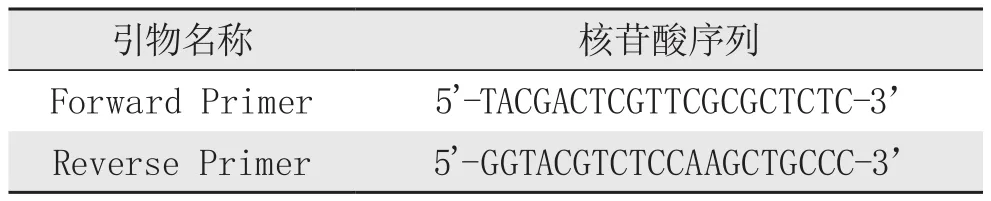
FR oe rv we引ar s物red名 PP称rrii m meerr 5 5''--TG AG CT GA AC CG核TT CC苷GT TC酸TC CA序GA CG列GC CT TG CC TC CC --33’’
gE1、gE2引物:
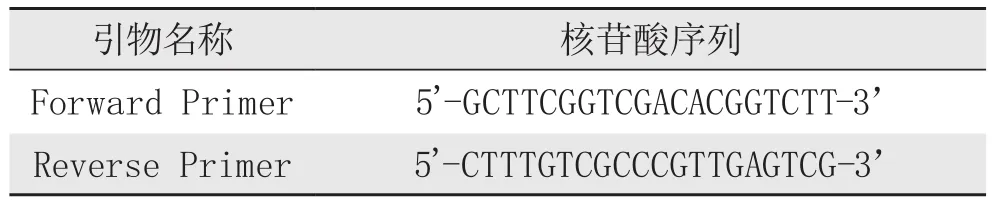
FR oe rv we引ras物red名 PP称rrii m meerr 5 5''--CGTCTTTTGCTG核CGG苷TCCC酸GCAG序CA T列CT GG GA T GT CCTGT --33’’
PCR操作程序
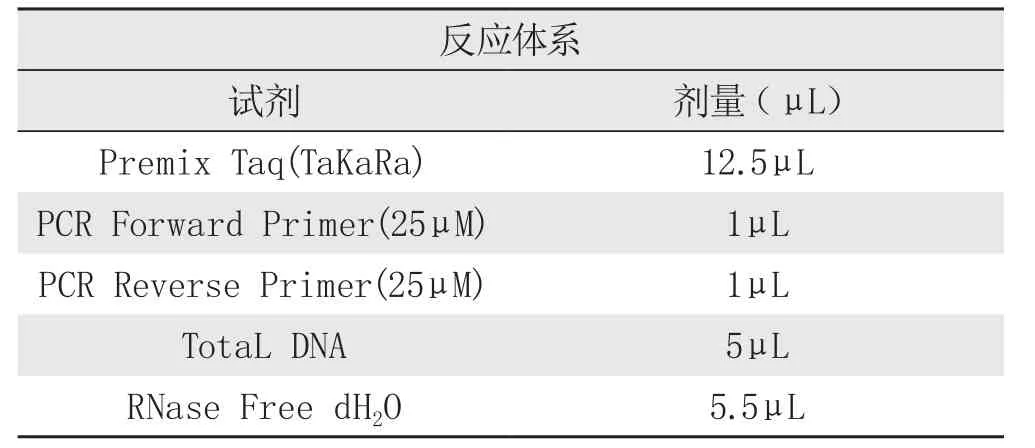
?
PCR反应参数设定
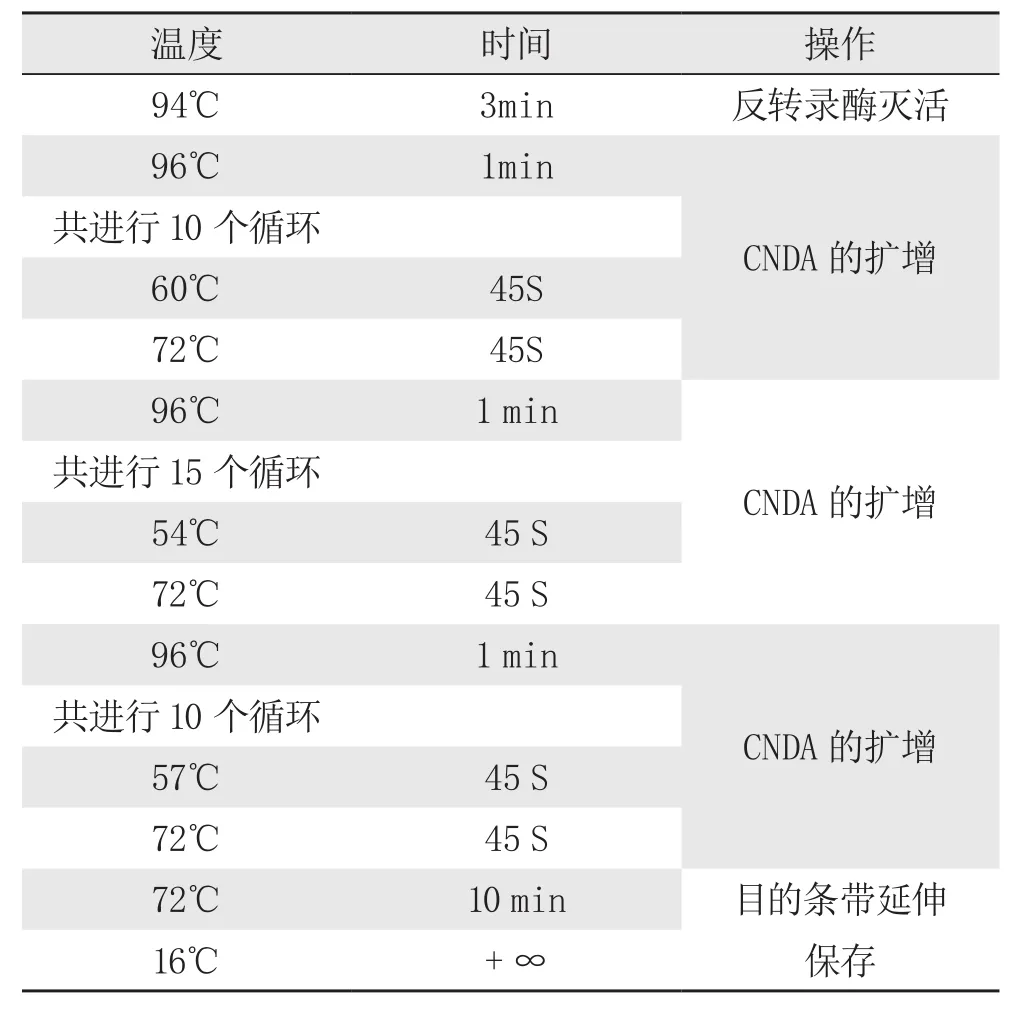
注:按照上述表格所示,反应体系配制在冰盒上进行,设定好反应程序后,将装有上述体系液体PCR反应管,包括对照管(空白PCR体系管和水样PCR体系管)放入Smart CycLer System中按照表格中参数设定PCR仪进行PCR反应。

图1 PCR仪
(三)电泳分析
1.制胶。称取1.35 g琼脂糖粉放入锥形瓶中(注:倒入过程中避免琼脂糖粉末粘在锥形瓶壁上。)加入90 ml 1*TBE溶液,微波炉加热无絮状物至完全溶解(注:至少沸腾3次),取出锥形瓶后,冷却至60℃左右,加入17μL的核酸染料,摇至彻底混匀后倒入带有梳子的胶槽中(轻轻混匀即可,避免气泡产生),冷却凝固40 min。
2.电泳。
(1)将制好的胶放入电泳槽中,倒入1*TBE,液位高于胶面2 mm。
(2)用移液枪取20μl 6×Loading Buffer于载玻片上,并取3μl加至PCR产物管中反复吹打三次混匀后吸取10μl混合液加入琼脂糖凝胶点样孔中,从左面第二个孔开始依次点样品、阴性对照与阳性对照,最后取7μl marker点于第一个孔中。
(3)将电泳仪正负极对应连接,开启电泳仪电源开关,在120V电压下电泳50 min。将跑完的琼脂糖凝胶从电泳槽取出,放在凝胶成像仪中,进行观察。
三、结果判定
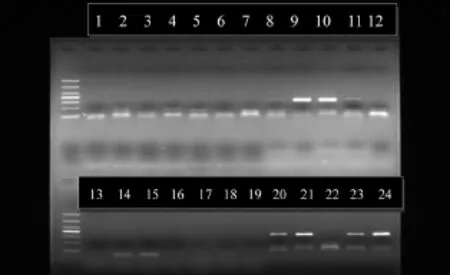
图2 未感染与感染样本对照
如图2,12号为阴性对照,无明亮的;24号为阳性对照,出现明亮的条带,证明实验成立。剩余样本在316 bp处,8号、9号、10号、11号、20号、21号、23号出现明亮的条带,说明该样本血清样本染牛腹泻病毒。
四、影响PCR检测因素
(一)dNTP的质量与浓度
1.dNTP的质量与浓度和PCR扩增效率有密切关系。dNTP粉呈颗粒状,如保存不当易变性失去生物学活性。在PCR反应中,dNTP应为50~200 umol/L,尤其是注意4种dNTP的浓度要相等( 等摩尔配制),如其中任何一种浓度不同于其它几种时(偏高或偏低),就会引起错配。浓度过低又会降低PCR产物的产量。dNTP能与Mg2+结合,使游离的Mg2+浓度降低。
2.Mg2+浓度。Mg2+对PCR扩增的特异性和产量有显著的影响,在一般的PCR反应中,各种dNTP浓度为200 umol/L 时,Mg2+浓度为1.5~2.0 mmol/L 为宜。Mg2+浓度过高,反应特异性降低,出现非特异扩增,浓度过低会降低Taq DNA聚合酶的活性,使反应产物减少。
3.温度与时间的设置。基于PCR原理三步骤而设置变性-退火-延伸三个温度点。在标准反应中采用三温度点法,双链DNA在90℃~95℃变性,再迅速冷却至40℃~60℃,引物退火并结合到靶序列上,然后快速升温至70℃~75℃,在Taq DNA 聚合酶的作用下,使引物链沿模板延伸。对于较短靶基因(长度为100~300 bp时)可采用二温度点法, 除变性温度外、退火与延伸温度可合二为一,一般采用94℃变性,65℃左右退火与延伸(此温度Taq DNA酶仍有较高的催化活性)。
4.循环次数。循环次数决定PCR扩增程度。PCR循环次数主要取决于模板DNA的浓度。一般的循环次数选在30~40次之间,循环次数越多,非特异性产物的量亦随之增多。
(二)影响PCR特异性的因素
通过上述内容,可以看出有许多因素可以影响PCR的特异性。
1.退火步骤的严格性:提高退火温度可以减少不匹配的杂交,从而提高特异性。
2.减短退火时间及延伸时间可以减少错误引发及错误延伸。
3.引物二聚体是最常见的副产品,降低引物及酶的浓度也可以减少错误引发,尤其是引物的二聚化.
4.改变MgCl2浓度可以改进特异性,这可能是提高反应严格性或者对Taq酶的直接作用。
一般认为PCR产物应在48 h以内完成电泳检测,有些最好于当日电泳检测,大于48 h后带型就会出现不规则,甚至消失。
(略)

