苯并-15-冠-5/离子液体体系液液萃取锂
束玉珍,吴继宗,邓惟勤,钱红娟
中国原子能科学研究院 放射化学研究所,北京 102413
苯并-15-冠-5/离子液体体系液液萃取锂
束玉珍,吴继宗,邓惟勤,钱红娟
中国原子能科学研究院 放射化学研究所,北京 102413

苯并-15-冠-5;离子液体;锂萃取
锂在自然界中存在两种稳定的同位素6Li和7Li,丰度分别为7.53%和92.47%[1],两者在核工业中都起着重要的作用。由于7Li中子吸收截面小,常用作反应堆中的传热介质和中子减速剂,高浓度的7LiOH还可以用来调节压水堆中冷却剂的pH[2-3]。6LiH可用于热中子屏蔽,富集度大于90%的6Li可作为氚增殖剂用于实现DT核聚变反应[4]。随着全球经济的高速发展,环境问题和能源危机不断加剧,绿色高效的聚变能成为各国开发热点,我国已将开发和利用核聚变能作为“核能发展规划”的第三步战略目标[5]。因此,锂同位素分离尤其是6Li的富集对新型核能的开发和利用具有重要的意义。
锂同位素分离常见的方法有汞齐法、液液萃取法、离子交换色层法、分子蒸馏法、熔盐电解法、激光法、电磁法等。但目前应用于工业大规模生产的只有锂汞齐法,但汞齐法在分离过程中使用了大量的汞,对环境和人类安全造成了巨大威胁,因此各国都在寻找一种绿色高效的分离方法替代汞齐法。目前与汞齐法最相近的分离方法为冠醚液液萃取法,由于冠醚对锂同位素具有较好的选择性,因此该萃取体系一般可获得较高的同位素效应[6-7],且同位素交换速度较快,反萃简便,易于回流倒相。但普通有机溶剂萃取分离体系存在的最大问题为体系分配比和交换容量较小,达不到工业生产要求,此外普通有机溶剂易挥发、有毒性、稳定性差。近年来,离子液体成为了绿色化学研究的热点,它具有难挥发、不易燃、对热稳定、能溶解多种化合物等优点[8-9],作为一种性能优良的溶剂,与冠醚相结合在碱金属和碱土金属萃取中得到了广泛研究和应用[10-13]。因此将离子液体取代传统有机溶剂,作
为稀释剂引入到冠醚萃取体系中,有望建立一种绿色高效便于工业应用的锂同位素分离体系。
由于苯并-15-冠-5(B15C5,结构见图1(a))孔径略大于锂离子直径,使锂离子更易进入冠醚环,且对6Li具有更高的选择性,因此对锂同位素表现出较好的萃取分离能力,且结构简单,易于合成,因此本工作选择B15C5为萃取剂,而1-丁基-3-甲基咪唑双(三氟甲烷磺酰)亚胺盐([C4MIm]NTf2)离子液体(结构见图1(b))具有低熔点、低粘度、高稳定性等优点,且对B15C5具有较高的溶解性,因此选为本体系的稀释剂,建立了B15C5-[C4MIm]NTf2/锂盐水溶液萃取分离体系。通过前期大量实验证实本体系具有较高的同位素分离能力,单级分离系数可达1.025~1.045,因此单级分离系数不再是体系考察的重点,体系分配比D的提高更具有实际意义。因此本工作主要考察体系平衡时间并通过冠醚浓度、锂盐浓度、温度和pH条件对分配比D的影响来评估和优化体系性能,以获得更大的分配比和交换容量,并通过对配合物晶体结构的解析来探讨Li+在该体系中的萃取机理。
1 实验部分
1.1 仪器与试剂
U-2900紫外-可见分光光度计,日本日立公司;台式pH计,梅特勒-托利多公司;Burker Smart ApexⅡ单晶X射线衍射仪,德国 Bruker公司;800型离心沉淀机,上海手术器械厂;Gemini 2旋转流变仪,英国马尔文仪器公司。
苯并-15-冠-5、三氟甲磺酸锂、双三氟甲基磺酸亚胺锂,以上均为分析纯,阿法埃莎化学有限公司;1-丁基-3-甲基咪唑双(三氟甲烷磺酰)亚胺盐,纯度不小于99%,中国科学院兰州化学物理研究所;GSB 04-1734-2004锂标准溶液,国家有色金属及电子材料分析测试中心;钍试剂,苯-2-胂酸钠-(1偶氮)二羟基萘-3,6-二磺酸钠(钍试剂),化学纯,市售;氢氧化钾、盐酸、硝酸、30%过氧化氢(质量分数),以上均为分析纯,北京化工厂;乙醇和氯化锂,分析纯,国药集团化学试剂有限公司。实验所用水均为超纯水(电阻率为18.2 MΩ·cm)。

(a)——苯并-15-冠-5,(b)——1-丁基-3-甲基咪唑双(三氟甲烷磺酰)亚胺盐([C4MIm]NTf2)图1 苯并-15-冠-5和[C4MIm]NTf2离子液体的结构Fig.1 Structures of benzo-15-crown-5 and [C4MIm]NTf2
1.2 实验方法
萃取过程:将萃取剂B15C5溶于[C4MIm]NTf2离子液体配成一定浓度有机相,与水相锂盐溶液按相比1∶1混合摇匀10 min后离心分相,测定两相锂含量,计算分配比D。
液液萃取反应如式(1):
(1)
D计算如式(2):
(2)
式中:co(Li)和ca(Li)分别为交换平衡后有机相和水相锂浓度。其中两相中锂的含量用紫外可见分光光度法测定,具体步骤参见文献[14]。
单晶的制备和测定:由于离子液体蒸汽压极低,无法通过溶剂挥发法获得晶体,因此本工作采用降温法从有机相获得晶体。具体方法为:用1.5 mol/L 的B15C5/C4离子液体萃取高浓锂盐,LiCl、LiNTf2和LiOTf的浓度分别为2、3 mol/L和4 mol/L,温度为40 ℃,充分交换后恒温静置分相,取有机相于室温(15~20 ℃)静置数日后形成无色透明晶体。用单晶X射线衍射仪收集晶体数据,晶体结构用SHELXL程序解出。
2 结果与讨论
2.1 萃取平衡
20 ℃下,用1 mol/L B15C5/[C4MIm]NTf2有机相萃取1 mol/L 锂盐溶液,相比为1∶1,按不同时间混合后迅速离心分相,不同萃取时间下分配比的变化列入表1。由D的变化可知,LiNTf2、LiCl和LiOTf达萃取平衡所需时间均不大于30 s;而传统有机溶剂体系如(4-叔丁基苯并-15-冠-5)-C6H5I/LiClO4-H2O[15]和B15C5-CHCl3/LiI-H2O[16]体系达到萃取平衡所需时间也小于30 s,因此,虽然离子液体体系粘度高于传统有机溶剂体系,但萃取平衡较快,满足体系交换要求。
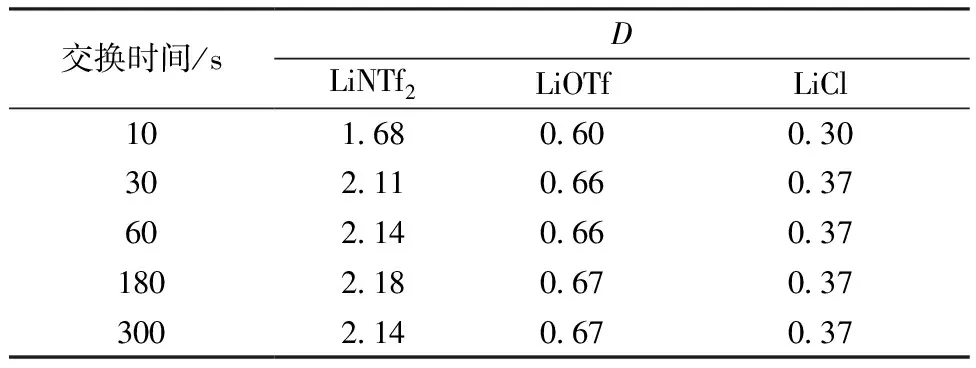
表1 萃取平衡
注:t=20 ℃,1 mol/L B15C5/[C4MIm]NTf2,1 mol/L 锂盐溶液,相比为1∶1
2.2 B15C5和锂盐浓度对分配比的影响
在20 ℃下,按相比1∶1,分别用不同浓度的B15C5/[C4MIm]NTf2离子液体萃取2 mol/L锂盐溶液,分配比D随B15C5浓度的变化列入表2。由表2可知,LiNTf2、LiCl和LiOTf的分配比均随着B15C5初始浓度的增加而增加,与文献[17]中冠醚浓度的影响规律一致,当B15C5为1.5 mol/L时LiNTf2分配比可达1.2,同等条件下三种锂盐分配比大小为LiNTf2>LiOTf>LiCl。

表2 B15C5浓度对分配比的影响
注:t=20 ℃,相比1∶1,2 mol/L锂盐溶液
在20 ℃下,按相比1∶1,用1 mol/L的B15C5/[C4MIm]NTf2离子液体分别萃取不同浓度的锂盐溶液,分配比D随锂盐浓度的变化列入表3。由表3可知,体系分配比随着锂盐浓度的增加而降低,当锂盐浓度从0.5 mol/L升至3 mol/L时,LiNTf2的分配比从6.8降至0.52,LiCl从0.62降至0.13,LiOTf从1.1降至0.37。
综上可知,锂盐和冠醚浓度对分配比D均有显著影响,提高有机相中B15C5浓度和适当降低水相锂盐浓度均有利于提高体系的分配比。不同锂盐阴离子对体系分配比也有显著影响,大的有机阴离子更有利于分配比的提高,小的无机阴离子Cl-分配比最低,但也远高于同等条件下普通有机溶剂萃取体系(如B15C5-CHCl3/LiCl-H2O体系,当B15C5为0.186 mol/L,LiCl为2 mol/L时,分配比仅为1.62×10-5[16];而0.3 mol/L开链冠醚PAIV-40%正辛醇-60%磺化煤油体系萃取1 mol/L LiCl时分配比也仅为8.40×10-4[18])。此外,交换后有机相锂浓度与锂盐和冠醚初始浓度呈正相关,而有机相锂浓度是决定体系交换容量和效率的重要因素,汞齐法分离的高效性除了与较高的单级分离系数有关外,还与其高容量有关,本工作中LiNTf2和LiOTf体系在合适条件下有机相锂浓度均可达0.6 mol/L以上,具有建立大容量交换体系的基础。至今许多冠醚液液交换体系未达工业生产要求最主要原因之一是分配比和有机相锂容量较低,体系分离效率达不到级联的要求,而本体系选择合适的冠醚和锂盐浓度可获得较高的分配比和单级分离系数。

表3 锂盐浓度对分配比的影响
注:t=20 ℃,相比1∶1,1 mol/L的B15C5/[C4MIm]NTf2离子液体
2.3 温度对分配比的影响
按1∶1相比,用1 mol/L B15C5/[C4MIm]NTf2离子液体在不同温度下萃取1 mol/L锂盐溶液,体系分配比D随温度的变化列入表4。由表4可知:在常用的操作温度范围内,温度的波动对分配比D无显著影响。一般温度越低越有利于提高同位素效应[19],但在低温下有机相粘度较大(见图2),流动性变差,会降低体系交换效率,因此考虑粘度及分离效果,工业上适宜的操作温度可选20 ℃左右。
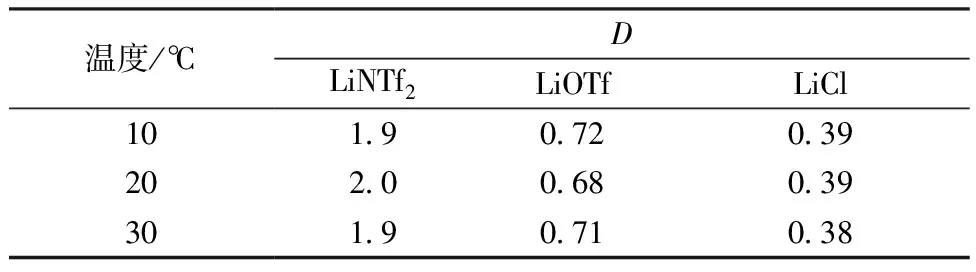
表4 温度对分配比的影响
注:1∶1相比,1 mol/L B15C5/[C4MIm]NTf2离子液体,1 mol/L锂盐溶液

c(B15C5),mol/L:■——0,○——0.5,▲——0.8,△——1.2图2 不同浓度B15C5/[C4MIm]NTf2离子液体混合液的粘度-温度曲线Fig.2 Viscosity curves of various concentration of B15C5/[C4MIm]NTf2 solution at different temperatures
2.4 pH对分配比的影响
已有的研究[18,20]表明,pH对冠醚萃取分离体系的分配比影响较大,因此pH是萃取分离体系需重点考察的条件之一。前期研究表明,体系在碱性条件下稳定性下降,因此以下仅考虑中性和弱酸性条件下分配比的变化。在20 ℃下按相比1∶1,用1 mol/L B15C5/[C4MIm]NTf2离子液体萃取不同酸度的1 mol/L LiCl溶液,分配比随pH的变化列入表5。由表5可知,LiCl初始溶液pH在1~7变化时,分配比无显著变化。金建南等[18]对PAIV-40%正辛醇-60%磺化煤油/LiBr-H2O体系的研究显示,pH=3时分配比最小,而H+浓度在0.1~2.0 mol/L,分配比却随着酸度的增加而增加。因此,pH对不同体系分配比具有不同的影响,这可能是由萃取机理的差异引起的,传统有机溶剂萃取体系为中性络合物萃取方式,而离子液体萃取体系可能存在阳离子交换萃取方式,因此本体系在中性及弱酸性条件下,

表5 pH对LiCl体系分配比的影响
注:20 ℃,相比1∶1,1 mol/L B15C5/[C4MIm]NTf2离子液体,1 mol/L LiCl溶液
分配比受锂盐溶液pH的影响甚微,初始锂盐的pH可在较宽范围内选择。
2.5 有机相的反萃
反萃是回流倒相的必要过程,需将流出交换单元的有机相中的锂彻底转入水相,再通过浓缩返回交换单元。反萃剂需简单易得,不引入杂质,因此本工作选纯水为反萃剂,用10倍体积的水经多次反萃将有机相中锂转移至水相,反萃曲线示于图3。由图3可知,经4次反萃,可将99%锂盐转入水相,且反萃过程中两相清晰,易分相,无界面污物,无乳化、沉淀等现象,因此该离子液体萃取体系反萃过程无技术障碍。

Vo∶Va=1∶10■——LiOTf,●——LiNTf2,▲——LiCl图3 反萃水体积与累积反萃率曲线Fig.3 Curves of stripping efficiency at different volumes of water
2.6 离子液体中配合物晶体结构的研究


图4 配合物[Li4(B15C5)4(OH)2(H2O)](NTf2)2的晶体结构Fig.4 Crystal structure of the complex [Li4(B15C5)4(OH)2(H2O)](NTf2)2
三种锂盐经萃取交换后在离子液体中获得的晶体均为同一种晶体,而文献[20]中锂盐与结合了B15C5和离子液体的介孔硅胶交换后,络合物晶体的阴离子也同为离子液体阴离子,因此在离子液体体系中,锂离子萃入有机相的方式可能存在两种,分别为中性复合物萃取和离子交换萃取,两种萃取过程示于图6,B15C5在两相接触时进入水相并与Li+络合,络合阳离子与锂盐阴离子形成离子对从水相进入有机相,此外,水中络合阳离子还可能与有机相中离子液体阳离子进行交换,锂盐阴离子不参与该萃取过程。两种萃取反应见式(3)、(4)。
(1) 锂盐中性复合物萃取过程
(3)
(2) 锂盐阳离子交换萃取过程
(4)


表6 配合物[Li4(B15C5)4(OH)2(H2O)](NTf2)2的晶体数据
注:1Å=0.1 nm
中性络合物进入有机相,络合阳离子主要可能以阳离子交换的方式进入有机相,若以阳离子交换为主,则进入有机相的锂盐阴离子较少,因此最终析出的络合物晶体也为[Li4(B15C5)4(OH)2(H2O)](NTf2)2。

图5 配合物[Li4(B15C5)4(OH)2(H2O)](NTf2)2的晶胞结构Fig.5 Crystal unit cell structure of the complex [Li4(B15C5)4(OH)2(H2O)](NTf2)2
3 结 论
以B15C5为萃取剂、绿色稳定的[C4MIm]NTf2离子液体为稀释剂所建立的锂同位素液液萃取分离体系具有较优的性能:虽然有机相粘度稍高,但萃取平衡速度较快,与传统液液萃取体系无异;通过调节B15C5和锂盐浓度体系可获得较高的分配比,其中LiNTf2的D值可达6.8,且LiNTf2和LiOTf有机相锂浓度均可达到0.6 mol/L以上,有望建立高效大容量的交换体系;温度对体系D值影响不大,适宜的操作温度可选20 ℃左右;pH在1~7范围内对D值无显著影响。此外对络合物晶体的研究发现,锂盐与B15C5均形成1∶1络合物,离子液体体系中Li+可能多数以阳离子交换方式萃入有机相。B15C5-[C4MIm]NTf2/锂盐萃取体系对锂同位素分离具有高效、绿色、大容量等优点,具有工业化应用前景。

图6 冠醚-离子液体液液萃取锂的机理Fig.6 Mechanism of liquid-liquid extraction for lithium on crown ether-ionic liquid system
[1] Michiels E, Bikvre P D. Absolute isotopic composition and the atomic weight of a natural sample of lithium[J]. Inr J Mass Spectrom Ion Phys, 1983, 49(2): 265-274.
[2] 李廷伍.化学交换法分离锂同位素[J].原子能科学技术,1990,24(2):87-90.
[3] Nishizawa K, Watanabe H, Ishino S, et al. Lithium isotope separation by cryptand (2B, 2, 1) polymer[J]. J Nucl Sci Technol, 1984, 21(2): 133-138.
[4] Rhinehammer T B, Wittenberg L J. Evaluation of fuel resources and requirements for the magnetic fusion energy program, MLM-2419[R]. Miamisburg Ohio (USA): Mound Lab, 1978.
[5] 潘传红.国际热核实验反应堆(ITER)计划与未来核聚变能源[J].物理,2010,39(6):375-378.
[6] Nishizawa K, Takano T, Ikeda I, et al. Extractive separation of lithium isotopes by crown ethers[J]. Sep Sci Technol, 1988, 23(4&5): 333-345.
[7] 束玉珍,吴继宗,邓惟勤.冠状化合物在锂同位素分离中的应用[J].核化学与放射化学,2015,37(1):12-17.
[8] 李汝雄.绿色溶剂-离子液体的合成与应用[M].北京:化学工业出版社,2004:20-27.
[9] Rogers R D, Seddon K R. Ionic liquids-solvents of the future[J]. Science, 2003, 302(5646): 792-793.
[10]Dai S, Ju Y H, Barnes C E. Solvent extraction of strontium nitrate by a crown ether using room-temperature ionic liquids[J]. J Chem Soc, Dalton Trans, 1999, 8: 1201-1202.
[11]Visser A E, Swatloski R P, Reichert W M, et al. Traditional extractants in nontraditional solvents: groups 1 and 2 extraction by crown ethers in room-temperature ionic liquids[J]. Ind Eng Chem Res, 2000, 39(10): 3596-3604.
[12]Dietz M L, Dzielawa J A. Ion-exchange as a mode of cation transfer into room-temperature ionic liquids containing crown ethers: implications for the “Greenness” of ionic liquids as diluents in liquid-liquid extraction[J]. Chem Commun, 2001, 20: 2124-2125.
[13]Dietz M L, Stepinski D C. A ternary mechanism for the facilitated transfer of metal ions into room-temperature ionic liquids (RTILs): implications for the “Greenness” of RTILs as extraction solvents[J]. Green Chem, 2005, 7(10): 747-750.
[14]张丽华,刘焕良,宋游.冠醚分离锂同位素工艺中锂的分光光度分析[J].原子能科学技术,2006,40(2):206-211.
[15]方胜强,支克正,傅立安,等.4-叔丁基苯并-15冠-5液-液萃取法分离锂同位素[J].核化学与放射化学,1987,9(3):142-147.
[16]Nishizawa K, Ishino S, Watanabe H, et al. Lithium isotope separation by liquid-liquid extraction using benzo-15-crown-5[J]. J Nucl Sci Technol, 1984, 21(9): 694-701.
[17]傅立安,方胜强.多醚液-液萃取体系中各种因素对锂的热力学同位素效应的影响[J].核化学与放射化学,1989,11(3):142-148.
[18]金建南,王全基,孟明礼,等.用开链冠醚PAIV溶剂萃取分离锂同位素[J].四川大学学报(自然科学版),1999,36(5):903-906.
[19]丘陵.化学法分离同位素原理[M].北京:原子能出版社,1990:31
[20]Zhou W, Sun X L, Gu L, et al. A green strategy for lithium isotopes separation by using mesoporous silica materials doped with ionic liquids and benzo-15-crown-5[J]. J Radioanal Nucl Chem, 2014, 300: 843-852.
Liquid-Liquid Extraction of Lithium by Benzo-15-Crown-5/Ionic Liquid System
SHU Yu-zhen, WU Ji-zong, DENG Wei-qin, QIAN Hong-juan
China Institute of Atomic Energy, P. O. Box 275(88), Beijing 102413, China

benzo-15-crown-5; ionic liquid; lithium extraction
2016-03-25;
2016-04-13
束玉珍(1988—),女,江苏镇江丹阳人,博士,核燃料循环与材料专业,E-mail: shuyuzhen320@163.com
O615.11
A
0253-9950(2017)02-0151-07
10.7538/hhx.2017.39.02.0151

