胃癌BGC-823细胞中HIF-1α、HIF-2α对PKM2的调控作用
舍 玲,唐 勇,曲颜丽
胃癌BGC-823细胞中HIF-1α、HIF-2α对PKM2的调控作用
舍 玲,唐 勇*,曲颜丽
目的 研究siRNA特异性沉默人胃癌BGC-823细胞中缺氧诱导因子(HIF-1α、HIF-2α)后PKM2的表达情况,探索HIF-1α、HIF-2α对胃癌细胞内PKM2的调控作用。方法 用Realtime RT-PCR及Western blot法检测转染HIF-1α、HIF-2α及Control siRNA后细胞内PKM2表达情况。结果 RNA干扰技术能有效沉默BGC-823细胞中的HIF-1α、HIF-2α。转染HIF-1α、HIF-2α siRNA后,PKM2在mRNA及蛋白表达水平均下降(P<0.05),其中siRNA抑制HIF-1α后,PKM2下调最明显;转染Control siRNA后,PKM2在mRNA及蛋白表达水平均无明显变化(P>0.05)。结论 HIF-1α和HIF-2α均参与调控PKM2的表达,其中HIF-1α起主要调控作用,HIF-1α、HIF-2α与PKM2共同促进肿瘤的Warburg效应。
BGC-823细胞;缺氧诱导因子;M2型丙酮酸激酶;Warburg效应
0 引言
实体肿瘤内普遍缺氧,其缺氧水平主要由缺氧诱导因子(Hypoxia inducible factors,HIFs)调节[1]。为了能够在缺氧状态下继续产生足够的能量,维持一系列生命活动,肿瘤细胞主要采取糖酵解代谢形式,快速大量地产生ATP供能,这一现象称为Warburg效应(Warburg effect)[2]。HIFs、M2型丙酮酸激酶(Pyruvate kinase M2)已被多项研究证实是肿瘤细胞Warburg效应的重要调控因子。HIFs是肿瘤细胞适应缺氧表达的一种核转录因子,缺氧状态下可转录激活多种下游靶基因,使缺氧的肿瘤细胞能保持氧稳态,以耐受缺氧状态[1]。PKM2是糖酵解途径中重要的限速酶,PKM2在肿瘤细胞核中与HIF-1α相互作用充当HIF-1α的辅助转录因子[3]。有大量研究证实,HIF-1α与PKM2之间存在相互作用,可相互促进表达,鲜有研究探索HIF-1α、HIF-2α对PKM2调控的对比。本研究中,我们检测了siRNA抑制HIFs后,胃癌BGC-823细胞内PKM2的表达情况,探索HIFs对胃癌BGC-823细胞内PKM2的调控差异。
1 材料与方法
1.1 试剂 GAPDH抗体、HIF-1α、HIF-2α、Control siRNA购自美国Santa Cruz公司;兔抗人HIF-1α、HIF-2α多克隆抗体、兔抗人PKM2多克隆抗体、羊抗兔IgG二抗、BGC-823细胞株、氯化钴购自武汉博士德公司;蛋白提取试剂盒、蛋白检测试剂盒购自凯基生物公司;组织细胞RNA微量提取试剂盒、SDS-PAGE凝胶制备试剂盒购自索莱宝公司;转染试剂Lipofectamine2000购自Thermo公司;Opti-MEM培养液购自Gibco公司;RT-PCR 试剂盒购自Takara公司;SYBR Green荧光实时定量PCR试剂盒购自Life Technologies;RPMI 1640培养液购自Hyclone公司;胎牛血清购自杭州四季青生物有限公司;引物由生工生物工程公司合成。
1.2 方法
1.2.1 培养细胞 用含10%胎牛血清的RPMI1640培养液,于37 ℃、5% CO2培养箱中培养胃癌BGC-823细胞,至对数期时,接种于六孔板进行转染。
1.2.2 siRNA转染细胞 取对数期生长的细胞接种于六孔板,待细胞生长至60%~70%的融合面积时,选用LipofectamineTM2000,按其说明书进行转染操作,每孔加入转染混合液500 mL,分别转入HIF-1α、HIF-2α及Control siRNA。培养6 h后,换为RPMI1640培养基,继续培养48 h后,可提取细胞。
1.2.3 实时荧光定量PCR检测mRNA表达 细胞经处理后,提取RNA,应用Takara逆转录试剂盒说明书进行反转录合成cDNA,配置20 μL的反应液,每个样本重复3个孔,于实时荧光定量PCR仪(型号:7500fast)进行反应,反应条件:50 ℃ 2 min、95 ℃ 2 min预变性,95 ℃ 15 s、60 ℃ 15 s、72 ℃ 1 min,40个循环后测得各组Ct值,绘制标准曲线,以GAPDH为内参照,实验重复3次,用2-ΔΔCt方法进行相对定量分析。PCR引物见表1。

表1 PCR引物
1.2.4 Western blot法检测蛋白表达 收集、提取并检测各组蛋白浓度后,取25 μg总蛋白,经用10%的SDS-PAGE胶进行电泳,电转移至PVDF膜,以5%的脱脂奶粉封闭90 min,放入一抗(HIF-1α、HIF-2α、PKM2以1∶200稀释,GAPDH以1∶1 000稀释)中,4 ℃冰箱孵育过夜。用TBST清洗3遍后,加入HPR标记的羊抗兔二抗(以1∶2 000稀释),室温孵育1 h,TBST清洗3遍后,用ECL发光法显色。应用Bio-red Chemi DOC MP全能型成像分析系统摄取图像,并分析图形灰度值。
2 结果
2.1 siRNA沉默HIF-1α、HIF-2α的效果 与未转染组比较,转染HIF-1α、HIF-2α组mRNA、蛋白的表达量均下调(P<0.05)。未转染组与转染Control siRNA组之间差异无统计学意义 (P>0.05),见图1~图3、表2。
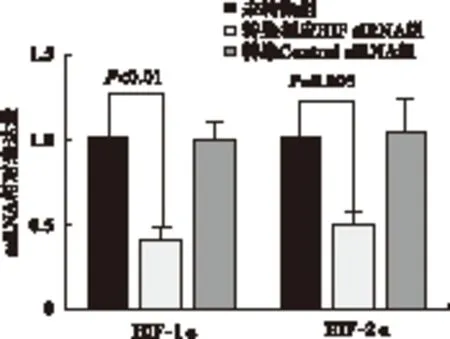
图1 RT-qPCR法检测RNAi对BGC-823细胞中HIF-1α、 HIF-2α mRNA表达的影响
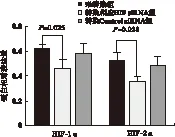
图2 Western blot法检测RNAi对BGC-823细胞中 HIF-1α、HIF-2α蛋白表达的影响

图3 Western blot法检测RNAi对BGC-823细胞中 HIF-1α、HIF-2α蛋白表达的影响 注:A.未转染组,B.转染相应HIF siRNA组,C.转染Control siRNA组表2 不同处理组间HIF mRNA及蛋白表达数据
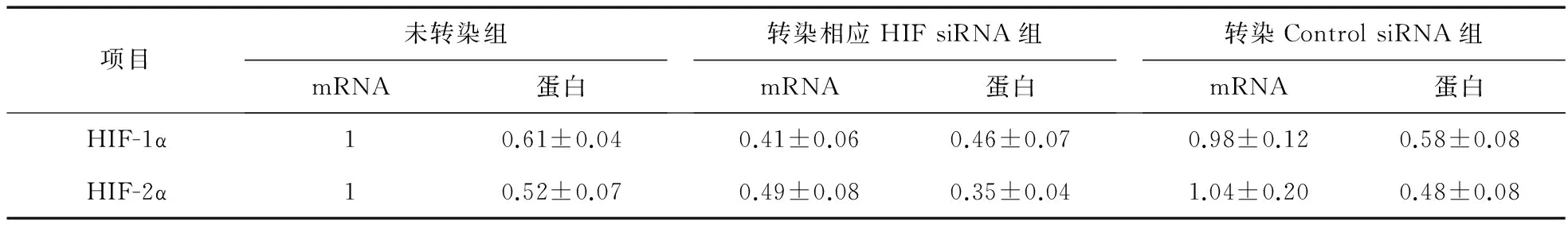
项目未转染组mRNA蛋白转染相应HIFsiRNA组mRNA蛋白转染ControlsiRNA组mRNA蛋白HIF-1α10.61±0.040.41±0.060.46±0.070.98±0.120.58±0.08HIF-2α10.52±0.070.49±0.080.35±0.041.04±0.200.48±0.08
2.2 siRNA沉默HIF-1α、HIF-2α后对PKM2 mRNA及蛋白表达水平的影响 与未转染组比较,转染各组(分别为转染HIF-1α、HIF-2α、Control siRNA组)PKM2的mRNA表达量分别为0.74±0.04、0.77±0.06、1.05±0.21。除未转染组与转染Control siRNA组差异无统计学意义(P>0.05),其余各组与未转染组比较,差异均有统计学意义(P<0.05),见图4。
未转染组、转染HIF-1α siRNA组、转染HIF-2α siRNA组、转染Control siRNA组PKM2的蛋白表达量分别为0.55±0.06、0.36±0.06、0.42±0.07、0.58±0.11。转染HIF-1α、HIF-2α后,PKM2表达水平均下降(P<0.05),其中siRNA抑制HIF-1α后,PKM2下调最明显;转染Control siRNA后,PKM2蛋白表达无明显改变(P>0.05),见图4、图5。
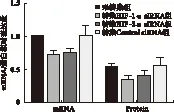
图4 RNAi对BGC-823细胞中PKM2 mRNA及蛋白表达的影响

图5 Western blot法检测各处理组蛋白的表达 注:A.未转染组,B.转染HIF-1α siRNA组,C.转染HIF-2α siRNA组,D.转染Control siRNA组
3 讨论
胃癌是中国发病率极高的恶性肿瘤之一,2015年其死亡率仅次于肺癌,位居第二[4]。在胃癌中HIFs及PKM2高表达,共同促进胃癌细胞Warburg效应,在胃癌的增殖、转移、凋亡、预后等过程中起重要作用。HIFs包括3种,其中,HIF-1和HIF-2是参与缺氧调节最重要的2种缺氧诱导因子,HIF-1、HIF-2的区别是α亚基不同,β亚基是HIFs的结构性亚基,在细胞内的表达水平相对稳定,两者的HIF-1β亚基相同。在常氧状态下,α亚基迅速降解,在低氧状态下,α亚基降解受阻,HIF-α会持续稳定表达,不断积聚,之后移至细胞核,与核内HIF-1β结合形成二聚体HIF[5]。研究表明,HIF-1α[6-7]、HIF-2α[8-10]的高表达不仅是反映胃癌组织缺氧的重要指标,其在胃癌增殖、转移、预后等过程中起到极其重要的作用。研究表明,胃癌中PKM2高表达与肿瘤TNM分期、淋巴转移、预后差显著相关[11-13]。此外,PKM2在胃肠道恶性肿瘤患者血清、粪便样品中呈高表达,在胃癌的诊断方面有重要的价值[14]。
本研究发现,HIF-1α、HIF-2α、PKM2蛋白及mRNA在常氧下均表达。用RNA干扰技术特异性沉默HIF-1α、HIF-2α后,二者的蛋白及mRNA均受到明显抑制,提示RNA干扰技术成功抑制了细胞内HIFs的转录及翻译。同时,其下游调控因子PKM2的蛋白及mRNA随HIF-1α、HIF-2α表达的下降亦降低,其中HIF-1α抑制后,PKM2的表达下降更明显。而转染Control siRNA组与未转染组间比较,HIFs、PKM2表达无明显变化。提示HIF-1α、HIF-2α均可调控PKM2的表达。而目前研究发现,HIF-1α与PKM2通过PHD3[3]、双加氧酶JMJD5[15]、EGFR[16]、STAT3[17]、mTOR[18]等介导相互作用。目前研究显示,在脂类代谢中,HIF-2α是起到主要调控作用的因子[19],而在糖代谢途径中,HIF-1α是发挥主导功能的调控因子。关于HIF-2α对糖代谢调控的研究甚少,早期Song等[20]研究发现,在胃癌HIFs中,仅HIF-1α调控糖代谢。Shah等[21]研究发现,HIF-2α在乳腺癌细胞代谢途径方面起主要作用。Xu等[22]研究发现,在人红白血病细胞中,HIF-2α通过调控pmt1调节细胞糖代谢。越来越多的研究发现,HIF-2α在调节糖代谢方面亦起到重要调节作用,本研究发现,HIF-2α对PKM2有调控作用,但具体的调控机制尚待进一步研究发现。
综上所述,HIF-1α、HIF-2α调控PKM2的表达,三者在促进肿瘤代谢方面起重要作用,本研究为以HIF-1α、HIF-2α、PKM2为靶点的基因治疗提供了一定的依据,旨在通过抑制信号通路和能量限制联合治疗肿瘤,进而有望通过围绕HIFs的综合治疗使恶性肿瘤成为一种普通的慢性病。
[1] Weljie AM,Jirik FR.Hypoxia-induced metabolic shifts in cancer cells:moving beyond the Warburg effect[J].Int J Biochem Cell Biol,2011,43(7):981-989.
[2] Vander HMG,Cantley LC,Thompson CB.Understanding the Warburg effect:the metabolic requirements of cell proliferation[J].Science,2009,324(5930):1029-1033.
[3] Luo W,Hu H,Chang R,et al.Pyruvate kinase M2 is a PHD3-stimulated coactivator for hypoxia-inducible factor 1[J].Cell,2011,145(5):732-744.
[4] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].Ca:A Cancer J Clinicians,2016,66(2):115-132.
[5] Majmundar AJ,Wong WJ,Simon MC.Hypoxia-inducible factors and the response to hypoxic stress[J].Mol Cell,2010,40(2):294-309.
[6] Zhang ZG,Zhang QN,Wang XH,et al.Hypoxia-inducible factor 1 alpha (HIF-1α) as a prognostic indicator in patients with gastric tumors:a meta-analysis[J].Asian Pac J Cancer Prev,2013,14(7):4195-4198.
[7] Wang Y,Li Z,Zhang H,et al.HIF-1α and HIF-2α correlate with migration and invasion in gastric cancer[J].Cancer Biol Ther,2010,10(4):376-382.
[8] Zheng F,Du F,Zhao J.Clinicopathological differences and prognostic value of hypoxia-inducible factor-2α expression for gastric cancer:evidence from Meta-analysis[J].Medicine (Baltimore),2016,95(7):e2871.
[9] Ren Y X,Li SL,Chen KS,et al.Clinical significance of hypoxia-inducible factor-2α expression in gastric carcinoma[J].World Chinese J Digestol,2010,18(18):1923-1927.
[10]Tong WW,Tong GH,Chen XX,et al.HIF2α is associated with poor prognosis and affects the expression levels of survivin and cyclin D1 in gastric carcinoma[J].Int J Oncol,2015,46(1):233-242.
[11]Gao Y,Xu D,Yu G,et al.Overexpression of metabolic markers HK1 and PKM2 contributes to lymphatic metastasis and adverse prognosis in Chinese gastric cancer[J].Int J Clin Exp Pathol,2015,8(8):9264-9271.
[12]Kwon OH,Kang TW,Kim JH,et al.Pyruvate kinase M2 promotes the growth of gastric cancer cells via regulation of Bcl-xL expression at transcriptional level[J].Biochem Biophys Res Commun,2012,423(1):38-44.
[13]Wu J,Hu L,Chen M,et al.Pyruvate kinase M2 overexpression and poor prognosis in solid tumors of digestive system:evidence from 16 cohort studies[J].Onco Targets Ther,2016,9:4277-4288.
[14]吴刚,闫文锋,张建成,等.胃癌患者血清肿瘤型M2丙酮酸激酶水平变化及意义[J].医药论坛杂志,2015,8(1):14-15.
[15]Wang HJ,Hsieh YJ,Cheng WC,et al.JMJD5 regulates PKM2 nuclear translocation and reprograms HIF-1α-mediated glucose metabolism[J].Proc Natl Acad Sci U S A,2014,111(1):279-284.
[16]Yang W,Xia Y,Ji H,et al.Nuclear PKM2 regulates β-catenin transactivation upon EGFR activation[J].Nature,2011,480(7375):118-122.
[17]Demaria M,Poli V.PKM2,STAT3 and HIF-1α:the Warburg′s vicious circle[J].JAKSTAT,2012,1(3):194-196.
[18]Anastasiou D,Poulogiannis G,Asara JM,et al.Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses[J].Science,2011,334(6060):1278-1283.
[19]Rankin EB,Rha J,Selak MA,et al.Hypoxia-inducible factor 2 regulates hepatic lipid metabolism[J].Mol Cell Biol,2009,29(16):4527-4538.
[20]Song IS,Wang AG,Yoon SY,et al.Regulation of glucose metabolism-related genes and VEGF by HIF-1alpha and HIF-1beta,but not HIF-2 alpha,in gastric cancer[J].Exp Mol Med,2009,41(1):51-58.
[21]Shah T,Krishnamachary B,Wildes F,et al.HIF isoforms have divergent effects on invasion,metastasis,metabolism and formation of lipid droplets[J].Oncotarget,2015,6(29):28104-28119.
[22]Xu QQ,Xiao FJ,Sun HY,et al.Ptpmt1 induced by HIF-2α regulates the proliferation and glucose metabolism in erythroleukemia cells[J].Biochem Biophys Res Commun,2016,471(4):459-465.
Regulation effect of HIF-1α and HIF-2α on PKM2 in BGC-823 cells of gastric cancer
SHE Ling,TANG Yong*,QU Yan-li
(Department of Gastroenterology,Affiliated Tumor Hospital of Urumqi Medical University,Urumqi 830011,China)
Objective To compare the expression of PKM2 in BGC-823 cells after transfection with small interfering RNA of hypoxia-inducible factors (HIF-1α and HIF-2α) and investigate the effect of HIF-1α and HIF-2α on the regulation of PKM2 in gastric cancer.Methods Small RNA interference (RNAi) was used to silence BGC-823 cells.The mRNA and protein expression levels of HIF-1α,HIF-2α and PKM2 were detected by quantitative real-time reverse transcription PCR and western blotting.Results Small RNA interference (RNAi) could effectively silence the expressions of HIF-1α and HIF-2α genes and down-regulate the expression of PKM2 (P<0.05),and the levels of PKM2 decreased most obviously when being transfected with HIF-1α siRNA.The expression of PKM2 levels did not change significantly (P>0.05) when being transfected with control siRNA.Conclusion The results suggest that HIF-1α and HIF-2α are both involved in regulating PKM2.Compared to HIF-2α pathway,HIF-1α pathway plays a major role in regulating PKM2,and thus they all contribute to the Warburg effect of tumor.
BGC-823 cell;Hypoxia-inducible factors;Pyruvate kinase M2;Warburg effect
2016-11-10
新疆医科大学附属肿瘤医院消化内科,乌鲁木齐 830011
新疆维吾尔自治区自然科学基金(2015211C124)
10.14053/j.cnki.ppcr.201704004
*通信作者

