药物处理对失眠症斑马鱼睡眠的影响以及相关作用机制
何东方,张丽军,刘梅颜
· 论著 ·
药物处理对失眠症斑马鱼睡眠的影响以及相关作用机制
何东方1,张丽军1,刘梅颜1
目的 观察药物处理对失眠症斑马鱼睡眠的改善作用,并探讨银杏叶滴丸(GBP)对γ-氨基丁酸A型受体α1亚单位(GABRA1)和褪黑素受体1类亚型(MTNR1)mRNA表达的影响。方法 采用咖啡因诱导活体斑马鱼建立失眠模型,分别水溶给予GBP(低剂量组56 μg/mL、中剂量组167 μg/mL、高剂量组500 μg/mL)、金纳多(Ginaton,低剂量组56 μg/mL、中剂量组167 μg/mL、高剂量组500 μg/mL)和氯化锂(阳性对照组,500 μM),同时设置正常对照组和失眠组,应用行为分析仪定量斑马鱼处于失眠状态的时间,评价GBP对斑马鱼睡眠的改善作用。另取失眠模型斑马鱼,水溶给予GBP 56、167、500 μg/mL,同时设置正常对照组和失眠组,采用RT-PCR检测GABRA1和MTNR1 mRNA的相对表达量。结果 在观察的1 h(3600 s)内,失眠组斑马鱼失眠时间多于正常对照组,(1598 ±277)s vs.(1240 ±129)s,差异有统计学意义(P<0.01)。阳性对照组斑马鱼失眠时间为(1368±170)s,少于失眠组,差异有统计学意义(P<0.05)。低剂量、中剂量、高剂量的GBP对睡眠的改善作用分别为72%、95%和97%。低剂量、中剂量、高剂量的Ginaton对睡眠的改善作用分别为78%、80%和95%。与正常对照组比较,GBP低剂量组GABRA1 mRNA相对表达量降低,差异有统计学意义(P<0.01);失眠组、GBP中剂量组和高剂量组无明显变化,差异无统计学意义(P均>0.05);与失眠组比较,GBP低剂量组GABRA1 mRNA相对表达量降低,差异有统计学意义(P<0.01)。MTNR1 mRNA相对表达量:与正常对照组比较,失眠组、GBP低剂量组和高剂量组降低,差异有统计学意义(P均<0.01),GBP中剂量组无明显变化,差异无统计学意义(P>0.05);与失眠组比较,GBP低剂量组、中剂量组和高剂量组均升高,差异有统计学意义(P均<0.01)。结论 低、中、高浓度银杏叶滴丸和金纳多对失眠症斑马鱼睡眠均有显著改善作用;银杏叶滴丸改善睡眠的可能机制为抑制GABRA1的表达和改善MTNR1的表达。
斑马鱼;失眠;抑郁;γ-氨基丁酸A型受体;褪黑素受体
抑郁是一种心境障碍,与正常的悲伤情绪密切相关[1]。抑郁表现为显著且持续的情绪失落、活动力明显减退、思维及认知能力迟缓等,同时还会导致一些精神生理的变化,如睡眠及食欲的紊乱,影响到患者的工作与生活,严重者甚至会有自杀倾向[2-4]。抑郁的发生及复发率很高,其发病年龄也十分宽泛[5],抑郁患者常伴有顽固性睡眠障碍,表现为失眠、入睡困难、早醒、睡眠节律紊乱、睡眠质量差等[2,6]。有研究表明[7],睡眠障碍是抑郁症的伴随症状,睡眠问题已经作为抑郁症的诊断标准之一,同时睡眠质量也是评价治疗效果的指标之一。
斑马鱼是一种具有多重优点的模式脊椎动物,与人类基因组相似度高达87%,在神经系统、心血管系统和肾脏系统等方面都与人类具有相似的发育机制与特点[8]。近年来斑马鱼已被越来越多地应用于生物医学研究,如建立人类疾病模型、进行药理毒理实验、筛选药物[9]。目前己有大量研究观察抗焦虑药、镇静药、抗抑郁药等作用于神经系统的药物及小分子化合物对斑马鱼成鱼的影响[10-12],同时也有研究观察评价斑马鱼睡眠模型[13-15]。
金纳多为一种国际标准银杏叶提取物,有大量文献证实其对抑郁、焦虑、失眠等精神类疾病具有一定的治疗作用[16-18]。而国内的银杏叶提取物与金纳多相比在提取工艺上存在很大差别,故国内外的银杏叶提取物并不能完全等同来看。国内各厂家生产的银杏叶制剂也不完全相同[19],银杏叶滴丸(GBP)是各类银杏叶制剂中的独家剂型,鲜有报道其在抗抑郁、改善睡眠质量方面的作用。本实验采用咖啡因诱导斑马鱼造成失眠模型,给予GBP和Ginaton治疗,从行为学角度考察GBP对失眠症斑马鱼睡眠的改善作用。在抗抑郁、焦虑、失眠等机制的研究中,γ-氨基丁酸A(GABAA)受体和褪黑素(Mt)受体的相关靶点不断受到关注[20-23]。故从银杏叶滴丸对γ-氨基丁酸A型受体α1亚单位(GABRA1)和褪黑素受体1类亚型(MTNR1)mRNA相对水平的影响来探讨其抗抑郁、改善睡眠的生物靶点及其作用机制。
1 材料与方法
1.1 实验动物 实验所用斑马鱼品系为野生型AB系斑马鱼,参照Westerfield的养殖方法[24],饲养于杭州环特生物科技有限公司斑马鱼实验室[SYXK(浙)2012-0171],该斑马鱼研究平台符合AAALAC国际认证的要求。斑马鱼胚胎的繁殖以自然成对交配的方式进行。共900尾,年龄为受精后1天(1 dpf),后续实验中选用5 dpf的斑马鱼,饲养于28℃的养鱼水中。因为胚胎可以从自身的卵黄囊中获取营养物质,所以在9 dpf内不需要喂食。
1.2 实验药物与仪器试剂
1.2.1 实验药物 银杏叶滴丸(万邦德制药集团股份有限公司)、金纳多(德国威玛舒培博士大药厂)、咖啡因(阿拉丁试剂上海有限公司)、氯化锂(LiCl,阿拉丁试剂上海有限公司)。使用前将银杏叶滴丸、咖啡因和金纳多用100%的二甲基亚砜(DMSO)配置成浓度为50 mM的母液,备用;将LiCl用超纯水配置成浓度为50 mM的母液,备用。
1.2.2 仪器试剂 解剖显微镜(SMZ645,Nikon)、96孔板(Nest Biotech)、行为分析仪(V3,View Point Life Sciences)、PCR扩增仪(Bioer)、超微量分光光度计(Thermo)、水平电泳仪(北京六一)、凝胶成像系统(培清)、6孔板(Nest Biotech)、ReverTra Are-α-反转录试剂盒(TOYOBO)、2×PCR MasterMix(BioTeKe)、DL2,000 DNA Marker(TAKARA)、TRI reagent(Invitrogen)、DEPC水(生工生物)。
1.3 方法
1.3.1 失眠斑马鱼模型制备和分组 选取5 dpf野生型AB系斑马鱼,在解剖显微镜下挑选发育正常的斑马鱼,不同分组与处理:正常对照组,正常饲养,未处理;失眠组,用咖啡因(200 μM)做诱导剂处理斑马鱼24 h;GBP治疗组,用咖啡因和GBP同时水溶给样方式处理斑马鱼24 h;Ginaton治疗组,用咖啡因和Ginaton同时水溶给样方式处理斑马鱼24 h;阳性对照组,用咖啡因和氯化锂(500 μM)同时水溶给样方式处理斑马鱼24 h。
1.3.2 确定药物的最大耐受浓度(MTC) 随机选取480尾斑马鱼于6孔板中,分为16个实验组,每组各30尾。即正常对照组、失眠组、GBP治疗组、Ginaton治疗组,按不同的浓度各分为7组,GBP的浓度分别为:25、50、100、250、500、1000和2000 μg/ml,Ginaton的浓度分别为:25、50、100、250、500、1000和2000 μg/ml。24 h后,观察斑马鱼反应情况,并统计各实验组的死亡数量与毒性情况,确定两种药物的MTC。
1.3.3 评价药物对失眠症斑马鱼睡眠的改善作用依据1.3.2的结果得到GBP和Ginaton的MTC,选取各自的MTC、1/3 MTC和1/9 MTC分别设为高剂量组、中剂量组和低剂量组。同时设置正常对照组、失眠组和阳性对照组,共计9个组别,每组均30尾斑马鱼,在28℃培养箱中孵育。24 h后,每个实验组随机选择10尾斑马鱼,应用行为分析仪定量斑马鱼处于失眠状态的时间(T)。失眠状态为斑马鱼处于黑暗环境中的静止状态,失眠时间即处于静止状态的时间,观察时间为1 h。药物对失眠症斑马鱼睡眠改善的计算公式如下:

1.3.4 GBP对GABRA1和MTNR1 mRNA相对表达水平的影响 各组取30尾药物干预24 h后的AB系斑马鱼,用柱式TRIzol总RNA抽提试剂盒提取组织总RNA,扩增生成cDNA。GABRA1上游引物序列:5'-ACCACAGTGTTCACCAGGAT T-3',下游:5'-ACGCCCGAGTCTACGCT-3';扩增片段大小572 bp。MTNR1上游引物序列:5'-CCCCTGGGTGGTGACTTT-3',下游:5'-CGA TGGCGATGCCTGTAATG-3';扩增片段大小302 bp。β-actin上游引物序列5'-CATCAGCATGGCT TCTGCTCTGTATGG-3',下游:5'-GACTTGTCA GTGTACAGAGACACCCT-3';扩增片段大小389 bp。PCR反应条件:94℃预变性2 min,94℃变性30 s,57℃退火30s,72℃延伸30 s,共36个循环,扩增产物进行琼脂糖凝胶电泳,紫外分析仪观察结果,凝胶成像分析系统(JS-680D)进行扫描。分别测定GABRA1、MTNR1及β-actin的吸光度值。以β-actin作为内参基因,得到各组光密度数据,基因相对表达量计算公式如下:

1.4 统计学方法 数据采用SPSS 19.0统计软件分析,计量资料以(±s)表示,组间资料比较用方差分析,两两比较采用Dunnett’s T检验。以P<0.05为差异有统计学意义。
2 结果
2.1 药物的最大耐受浓度 GBP和Ginaton设置的浓度分别为:25、50、100、250、500、1000和2000 μg/ml,其中1000 μg/ml和2000 μg/ml浓度下斑马鱼全部死亡(表1)。故MTC确定为500 μg/ml,为高剂量组;1/3 MTC为167 μg/ml,为中剂量组;1/9 MTC为56 μg/ml,为低剂量组。
2.2 药物对失眠症斑马鱼睡眠的改善作用 在观察的1 h(3600 s)内,失眠组斑马鱼失眠时间多于正常对照组,(1598 ±277)s vs. (1240 ± 129)s,差异有统计学意义(P<0.01),表明模型建立成功。阳性对照组斑马鱼失眠时间为(1368±170)s,少于失眠组,差异有统计学意义(P<0.05),睡眠改善作用为64%,表明LiCl对斑马鱼失眠症具有明显的改善作用。低剂量、中剂量、高剂量的GBP对睡眠的改善作用分别为72%、95%和97%。低剂量、中剂量、高剂量的Ginaton对睡眠的改善作用分别为78%、80%和95%(图1~2)。

表1 药物浓度反应情况

图1 药物对斑马鱼失眠时间的改善作用(与失眠组相比,aP<0.05,bP<0.01,各组n=10)
2.3 GBP对GABRA1和MTNR1 mRNA相对表达水平的影响 与正常对照组比较,GBP低剂量组GABRA1 mRNA相对表达量降低,差异有统计学意义(P<0.01);失眠组、GBP中剂量组和高剂量组无明显变化,差异无统计学意义(P均>0.05);与失眠组比较,GBP低剂量组GABRA1 mRNA相对表达量降低,差异有统计学意义(P<0.01)(图3)。MTNR1 mRNA相对表达量:与正常对照组比较,失眠组、GBP低剂量组和高剂量组降低,差异有统计学意义(P均<0.01),GBP中剂量组无明显变化,差异无统计学意义(P>0.05);与失眠组比较,GBP低剂量组、中剂量组和高剂量组均升高,差异有统计学意义(P均<0.01)(图4)。

图2 药物对斑马鱼失眠症的改善作用(与失眠组相比,aP<0.05,bP<0.01,各组n=10)
3 讨论
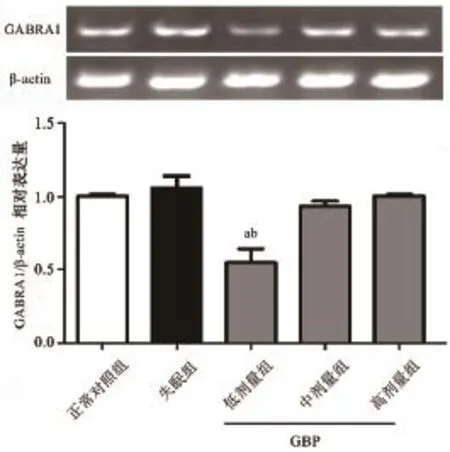
图3 各组GABRA1 mRNA的相对表达量(与正常对照组比较,aP<0.05,与失眠组比较,bP<0.01)

图4 各组MTNR1 mRNA的相对表达量(与正常对照组比较,aP<0.05,与失眠组比较,bP<0.01)
抑郁症主要表现为情绪低落和兴趣减退,大部分患者存在睡眠问题,包括失眠及嗜睡[25]。一项流行病学调查表明,处于抑郁发作期的患者中存在失眠问题的占59.1%,而没有睡眠问题的只有7.2%;在诊断为抑郁障碍并且无其他精神障碍的患者中,存在失眠问题的占到了58.8%,而没有睡眠问题只有8%[26]。由此可见,抑郁症患者中睡眠障碍的发生率高,且以失眠为主要表现形式。本实验采用咖啡因诱导斑马鱼造成失眠模型,以LiCl(临床作为心境稳定剂使用[27])为阳性对照药,给予GBP和Ginaton治疗,从行为学角度,GBP和Ginaton均能通过减少失眠时间来改善斑马鱼的睡眠质量。GBP和Ginaton均为银杏叶提取物,其主要有效成分为黄酮醇苷类和萜内酯类,有研究表明Ginaton中的二萜内酯(一类萜内酯)具有抗抑郁作用[28],白果内酯(一种倍半萜内酯)也可能对抑郁样行为和认知障碍有作用,这种保护作用可能是通过下丘脑-垂体-肾上腺轴达到的[29],推测GBP的萜内酯成分同样具有抗抑郁作用。
γ-氨基丁酸(GABA)是中枢神经系统中最重要的抑制性神经递质,其在阻断兴奋性的传导过程中起决定性作用[30]。GABA受体根据结构和药理作用不同,分为离子型受体(GABAA、GABAC)和代谢型受体(GABAB),其中GABAA受体是最重要的一种[31]。GABAA为很多临床神经活性药物的作用靶点,其受体功能障碍与失眠、抑郁、焦虑、癫痫等密切相关[21]。目前所识别出的GABAA受体亚基种类有8个亚基族的23种单体(α1-6、β1-6、γ1-4、δ、ε、ρ1-3、θ、π)[32],其中α亚基对其药理作用至关重要,镇静效应是由GABAA受体α1亚单位介导的;α2、α3亚单位可能与抗焦虑、抗惊厥、肌松作用有关;而含α5受体的选择性反激活剂可能为痴呆症的治疗提供有效途径[22,33-35]。本实验中,检测了GBP对GABAA受体α1亚单位(GABRA1)表达的影响,结果显示GBP能显著降低其mRNA的表达,故推测GBP可能通过下调GABRA1的表达对失眠斑马鱼起到镇静作用,改善睡眠质量。
褪黑素(MTN)是由松果体分泌的一种吲哚类神经内分泌激素,参与调节睡眠觉醒节律。MTN与特异性的受体结合后进入细胞内,启动细胞信号转导,影响神经营养因子的表达,进而调节睡眠障碍、生物节律紊乱和抑郁情绪[36]。5-羟色胺(5-HT)是MTN的前体,抑郁症患者脑内5-HT含量的降低可以致MTN合成减少[20]。2009年2月,阿戈美拉汀(一种褪黑素受体激动剂以及5-HT2C受体的拮抗剂)获得欧盟上市许可,用于抑郁症成人患者的治疗。有临床研究证实阿戈美拉汀能增加海马部位神经元的可塑性及神经元再生,具有明显的抗抑郁作用,且起效较快,对抑郁以及伴随的焦虑症状均有较好的疗效[37]。哺乳动物中普遍存在褪黑素受体(MTNR)的两类亚型,分别为MTNR1和MTNR2[38]。有研究表明,MTNR1与治疗失眠和睡眠紊乱密切相关[39,40]。在本次斑马鱼失眠模型研究中,检测了GBP对MTNR1 mRNA水平的影响,结果显示GBP能显著提高其表达,故推测GBP可以通过上调MTNR1 mRNA表达对失眠斑马鱼起到改善睡眠的作用。
综上所述,本实验采用咖啡因诱导斑马鱼造成失眠模型,给予GBP和Ginaton治疗,从行为学角度证实了GBP确实对失眠症斑马鱼的睡眠具有改善作用;GBP对GABRA1和MTNR1 mRNA水平的影响进一步来探讨其抗抑郁、改善睡眠的生物靶点及其作用机制,但仍需进一步研究以发掘其深层机制。
[1] Belmaker RH,Agam G. Mechanisms of disease: Major depressive disorder[J]. New Engl J Med,2008,358(1):55-68.
[2] X Liu. Sleep and adolescent suicidal behavior[J]. Sleep,2004,27(7):1351-8.
[3] Perlis ML,Giles DE,Buysse DJ. Self-reported sleep disturbance as a prodromal symptom in recurrent depression[J]. J Affect Disord,1997, 42(2-3):209-12.
[4] O'Brien EM,Chelminski I,Young D. Severe insomnia is associated with more severe presentation and greater functional deficits in depression[J]. J Psychiatr Res,2011,45(8):1101-5.
[5] Bauer M,Tharmanathan P,Volz HP. The effect of venlafaxine compared with other antidepressants and placebo in the treatment of major despression: a meta-analysis[J]. Eur Arch Psychiatry Clin Neurosci,2009,259(3):172-85.
[6] Murphy MJ,Peterson MJ. Sleep Disturbances in Depression[J]. Sleep Med Clin,2015,10(1):17-23.
[7] 陆峥. 伴发睡眠障碍抑郁症的治疗[J]. 中华精神科杂志,2013,46(3):179-80.
[8] 刘晓金,陈华利,高燕,等. 斑马鱼模式研究现状及应用情况进展[J].辽宁中医药大学学报,2016,18(4):125-7.
[9] 孙超,张森,高立栓,等. 斑马鱼疾病模型的研究简述[J]. 中国新药杂志,2016,25(20):2340-3.
[10] Wang Y,Li S,Liu W,et al. Vesicular Monoamine Transporter 2 (Vmat2)knockdown elicits anxiety-like behavior in zebrafish[J]. Biochem Biophys Res Commun,2016,470(4):792-7.
[11] Liu X,Ning G,Jia L,et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment[J]. Pharmacol Biochem Behav,2014,127:82-9.
[12] Pérez MR,Pellegrini E,Cano-Nicolau J,et al. Relationships between radial glial progenitors and 5-HT neurons in the paraventricular organ of adult zebrafish- potential effects of serotonin on adult neurogenesis[J]. Eur J Neurosci,2013,38(9):3292-301.
[13] 谢晨,杨文佳,于心同,等. 睡眠研究中相关动物选择的进展[J]. 中国实验动物学报,2012,20(2):87-92.
[14] Zhdanova IV. Sleep and its regulation in zebrafish[J]. Rev Neurosci, 2011,22(1):27-36.
[15] Appelbaum L,Wang GX,Maro GS,et al. Sleep-wake regulation and hypocretin-melatonin interaction in zebrafish[J]. Proc Natl Acad Sci U S A,2009,106(51):21942-7.
[16] Montes P,Ruizsánchez E,Rojas C,et al. Ginkgo biloba Extract 761: A Review of Basic Studies and Potential Clinical Use in Psychiatric Disorders[J]. CNS Neurol Disord Drug Targets,2015,14(1):132-49.
[17] Naprienko MV,Esin RG,Mukhametova ER,et al. Tanakan as a multimodal cytoprotective factor in general medicine[J]. Zh Nevrol Psikhiatr Im S S Korsakova,2015,115(11):146-51.
[18] Kasper S. Phytopharmaceutical treatment of anxiety, depression, and dementia in the elderly: evidence from randomized, controlled clinical trials[J]. Wien Med Wochenschr,2015,165(11-12):217-28.
[19] 谢培山. 银杏叶标准提取物EGb761及银杏叶制剂的质量评价(待续)[J]. 中国中药杂志,1999,24(1):3-5.
[20] 张红霞,黄荣清,肖炳坤,等. 褪黑素在抑郁症中的研究[J]. 科学技术与工程,2010,10(1):160-6.
[21] 黄莉莉,于爽,李廷利. γ-氨基丁酸受体介导的四逆散改善睡眠作用[J]. 中药药理与临床,2012,28(6):11-4.
[22] 房芳芳,张惠云. GABAA受体调控途径及相关神经精神类疾病用药进展[J]. 医学综述,2012,18(7):969-72.
[23] Golombek DA,Pévet P,Cardinali DP. Melatonin effects on behavior: possible mediation by the central GABAergic system[J]. Neurosci Biobehavi Rev,1996,20(3):403-11.
[24] Westerfield M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio)[M]. 3rd edition,1995,University of Oregon Press:Eugene OR,385.
[25] Dauvilliers Y,Lopez R,Ohayon M,et al. Hypersomnia and depressive symptoms: methodological and clinical aspects[J]. BMC Med,2013,11(1):78.
[26] Soehner AM,Kaplan KA,Harvey AG. Prevalence and clinical correlates of co-occurring insomnia and hypersomnia symptoms in depression[J]. J Affect Disord,2014,167(10):93-7.
[27] Rui Z,Yi L,Yong H,et al. Mice heterozygous for cathepsin D deficiency exhibit mania-related behavior and stress-induced depression[J]. Prog Neuropsychopharmacol Biol Psychiatry,2015,63:110-8.
[28] Liang Z,Bai S,Shen P,et al. GC-MS-based metabolomic study on the antidepressant-like effects of diterpene ginkgolides in mouse hippocampus[J]. Behav Brain Res,2016,314:116-24.
[29] Wu R,Shui L,Wang S,et al. Bilobalide alleviates depression-like behavior and cognitive deficit induced by chronic unpredictable mild stress in mice[J]. Behavioural Pharmacology,2016, 27(7):596-605.
[30] Mary C,Johnston GA. The "ABC" of GABA receptors: a brief review [J]. Clin Exp Pharmacol Physiol,1999,26(11):937-40.
[31] 王世明,张颖奇,李晓立. GABAA受体研究进展[J]. 中国局解手术学杂志,2001, 10(3):307-8.
[32] Olsen RW,Sieghart W. GABAA receptors: subtypes provide diversity of function and pharmacology[J]. Neuropharmacology,2009,56(1):141-8.
[33] Atack JR,Hallett DJ,Tye S,et al. Preclinical and clinical pharmacology of TPA023B, a GABAA receptorα2/α3 subtype-selective partial agonist[J]. J Psychopharmacol,2011,25(3):329-44.
[34] Knust H,Achermann G,Ballard T,et al. The discovery and unique pharmacological profile of RO4938581 and RO4882224 as potent and selective GABAA alpha5 inverse agonists for the treatment of cognitive dysfunction[J]. Bioorg Med Chem Lett,2009,19(20):5940-4.
[35] Atack JR. GABAA receptor alpha2/alpha3 subtype-selective modulators as potential nonsedating anxiolytics[J]. Curr Top Behav Neurosci,2010,2:331-60.
[36] Schumacher J,Jamra RA,Becker T,et al. Evidence for a relationship between genetic variants at the brain-derived neurotrophic factor (BDNF) locus and major depression[J]. Biological Psychiatry,2005,58 (4):307-14.
[37] Banasr M,Soumier A,Hery M,et al. Agomelatine, a new antidepressant, induces regional changes in hippocampal neurogenesis[J]. Biol Psych iatry,2006,59(11):1087-96.
[38] Von GC,Stehle JH,Weaver DR. Mammalian melatonin receptors: molecular biology and signal transduction[J]. Cell and Tissue Res,2002,309(1):151-62.
[39] 牟丽,曾丽玲,张小虎,等. 唑吡坦对大鼠下丘脑内睡眠相关基因表达的影响[J]. 中国老年学杂志,2009,29(17):2202-3.
[40] Wesensten NJ,Balkin TJ,Reichardt RM,et al. Daytime sleep and performance following a zolpidem and melatonin cocktail[J]. Sleep,2005,28(1):93-103.
Influence of drug treatment on sleep in zebra fishes with insomnia and relevant mechanism
HE Dong-fang*, ZHANG Li-jun, LIU Mei-yan.*Department of Cardiology, Beijing Anzhen Hospital, Capital University of Medical Sciences, Beijing 100029, China.
LIU Mei-yan, E-mail: china_lmy@hotmail.com
Objective To observe the relief effect of drug treatment on sleep in zebra fishes with insomnia, and discuss the influence of Ginkgo Biloba Pills (GBP) on mRNA expressions of γ-aminobutyric acid type A receptor-1 (GABRA1) and melatonin receptor-1 (MTNR1). Methods The insomnia model was established by caffeine in living zebra fishes, and zebra fishes were respectively given GBP (56 μg/mL, GBP low-dose group; 167 μg/mL, GBP mid-dose group; 500 μg/mL, GBP high-dose group), Ginaton (56 μg/mL, Ginaton low-dose group; 167 μg/mL, Ginaton mid-dose group; 500 μg/mL, Ginaton high-dose group), and lithium chloride (500 μM, positive control group), and at the same time normal control group and insomnia group was set up. The duration of zebra fishes being insomnia condition was quantified by using behavior analyzer, and relief effect of GBP on zebra fishes’ sleep was reviewed. In addition zebra fishes with insomnia were selected and given GBP [56 μg/mL (GBP low-dose subgroup), 167 μg/mL (GBP mid-dose subgroup) and 500 μg/mL (GBP high-dose subgroup)], and at the same time normal control subgroup and insomnia subgroup was set up for detecting the relative mRNA expressions of GABRA1和MTNR1 by using RT-PCR. Results The insomnia duration was longer in insomnia group than that in normal control group [(1598 ±277) s vs. (1240 ±129) s, P<0.01] within observation time for 1 h (3600 s). The insomnia duration was shorter in positive control group (1368±170) s than that in insomnia group (P<0.05). The meliorating effect of GBP on sleep reached, respectively, by 72% in GBP low-dose group, by 95% in GBP mid-dose group and by 97% in GBP high-dose group. The meliorating effect of Ginaton on sleep reached, respectively, by 78% in Ginaton low-dose group, by 80% in Ginaton mid-dose group and by 95% in Ginaton highdose group. The relative expression of GABRA1 mRNA decreased in GBP low-dose subgroup compared with normal control subgroup (P<0.01), had no significant changes in insomnia subgroup, GBP mid-dose subgroup and GBP high-dose subgroup (all P>0.05), and decreased in GBP low-dose subgroup compared with insomnia subgroup(P<0.01). The relative expression of MTNR1 mRNA decreased in insomnia subgroup, GBP low-dose subgroup and GBP high-dose subgroup compared with normal control subgroup (all P>0.01), had no significant changes in GBP mid-dose subgroup (P>0.05), and increased in GBP low-dose subgroup, GBP mid-dose subgroup and GBP highdose subgroup compared with insomnia subgroup (all P<0.01). Conclusion Low-dose, mid-dose and high-dose GBP and Ginaton all have significant meliorating effect on sleep in zebra fishes with insomnia, and the possible mechanism may be the inhibition of GABRA1 expression and melioration of MTNR1 expression.
Zebra fishes; Insomnia; Depression; γ-Aminobutyric acid type A receptor; Melatonin receptor
R749.7
A
1674-4055(2017)03-0326-05
1100029 北京,首都医科大学附属北京安贞医院心脏中心
刘梅颜,E-mail:china_lmy@hotmail.com
10.3969/j.issn.1674-4055.2017.03.20

