草莓多酚的提取工艺优化及其抑菌活性研究
李芬芳 +马艳弘 赵密珍 黄开红 段云青

摘要:在单因素试验基础上,通过正交试验设计法优化草莓多酚的提取工艺条件,并探讨草莓多酚的體外抑菌活性。结果表明:草莓多酚的最佳提取工艺为料液比1 g ∶[KG-*3]20 mL,提取温度60 ℃,提取时间2 h,乙醇浓度50%,各因素对多酚得率影响由大到小依次为提取时间、提取温度、料液比,最后是乙醇浓度;验证试验结果表明,在此条件下草莓多酚得率为2.448 mg/g;所提多酚具有显著的抑菌效果,其对金黄色葡萄球菌、大肠杆菌和沙门氏菌的最低抑制浓度分别达0.6、0.8、0.9 mg/mL,且在一定浓度范围内,其抑菌能力与多酚浓度呈现一定的剂量效应关系。
关键词:草莓;多酚;有机溶剂;提取工艺;抑菌活性
中图分类号: TS201.1文献标志码: A
文章编号:1002-1302(2017)03-0155-04
收稿日期:2016-02-29
基金项目:江苏省农业科技自主创新资金[编号:CX(15)1021];江苏省重点研发计划(现代农业)项目(编号:BE2015350);江苏省句容市农业科技支撑计划(编号:NY2016228842)。
作者简介:李芬芳(1991—),女,河南洛阳人,硕士研究生,主要从事生化分析研究。E-mail:lifenfang1991@163.com。
通信作者:段云青,博士,讲师,硕士生导师,主要从事植物营养与生态环境研究。E-mail:duan_yq@163.com。
草莓(Fragaria×ananassa Duck)别称凤梨草莓、红莓、洋莓、地莓,属蔷薇科(Rosaceae)草莓属(Fragaria)多年生草本植物,果实色泽鲜艳,香味浓郁,柔软多汁,甜酸适口,是世界上栽培最广泛的保健浆果,素有水果皇后之美誉[1]。草莓果实营养丰富,其浆果富含多糖、维生素、矿质元素,还富含花青素、黄酮、单宁类、酚酸等生物活性物质[2-4],营养价值和经济价值极高,其抗氧化能力高达苹果、桃、梨、番茄、柑橘等园艺产品的2~11倍[5]。酚类物质为草莓中最主要的抗氧化物质基础,具有抗氧化、抗癌、抗肿瘤、抑菌、抑制高血压和高血脂、预防心血管疾病等多种生理功效[6-9]。随着人们对食品绿色、健康、营养、保健等需求的提高,植物多酚等次生代谢产物的相关研究受到越来越多研究者的关注,其开发应用前景极其广阔。
我国是世界草莓生产大国,拥有最大的栽培面积和广泛的优质草莓品种资源,近年来,通过大量引进国外优质草莓品种,我国草莓的种类和数量已经位于世界前列。国内对草莓的食用形式、贮藏、釆后保鲜等研究较多,但对草莓的活性物质及其生理功能的研究与国际先进水平仍存在一定的差距。
植物多酚的提取分离及生物活性已成为众多研究者关注的焦点。植物多酚的提取方法包括溶剂萃取法、超声辅助提取法、微波提取法以及酶解辅助提取法等[10-12]。其中溶剂萃取法因其工艺简便、成本低廉、便于后续分离纯化等优点成为目前国内使用最广泛的多酚提取方法。目前国内多酚提取、分离、生物活性的研究主要集中在茶多酚、苹果多酚等少数几种,而有关草莓多酚的高效提取与抗菌活性却鲜见报道。鉴于此,本试验系统研究了草莓多酚的有机溶剂提取工艺及其抑菌活性,以期为草莓多酚的生产与应用提供科学依据。
1材料与方法
1.1材料与试剂
草莓,由江苏省农业科学院园艺研究所提供;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus arueus)、沙门氏菌(Salmonella),由江苏省农业科学院农产品加工研究所提供;福林酚试剂(1N),购自源叶生物技术有限公司;无水乙醇、没食子酸、碳酸钠、胰蛋白胨、酵母浸粉、氯化钠、琼脂,均为分析纯试剂,购自北京奥博星生物技术有限责任公司。
1.2仪器与设备
FW100高速万能粉碎机(天津市泰斯特仪器有限公司);HJ-6A多头磁力搅拌器(江苏常州国华仪器有限公司);DK-8D型电热恒温水槽(上海精宏实验设备有限公司);微孔板分光光度计(美国伯腾仪器有限公司);JJ-500电子天平(江苏常熟市双杰测试仪器厂);MP220 pH计(梅特勒-托利多仪器有限公司);LRH-150生化培养箱(上海一恒科技有限公司);TGL-16B台式离心机(上海安亭科学仪器厂);RE6000型旋转蒸发仪(上海亚荣生化仪器厂);SW-CJ-1D型单人净化工作台(江苏苏州净化设备有限公司);ZD-F12真空冷冻干燥机(江苏南京载智自动化设备有限公司)。
1.3方法
1.3.1草莓多酚提取方法
将新鲜草莓洗净、沥干水分、破碎打浆,与一定浓度的乙醇溶液混合均匀,恒温提取一定时间,4 000 r/min离心20 min,沉淀再重复提取1次,合并2次上清,得多酚提取液。提取液经旋转蒸发仪浓缩,AB-8大孔树脂纯化[13],50%乙醇溶液洗脱2次,合并洗脱液,再经旋转蒸发仪浓缩,真空冷冻干燥至恒质量,得草莓多酚粉。
1.3.2提取工艺单因素试验
一定量的草莓打浆后放入250 mL锥形瓶中,以不同浓度乙醇溶液为提取液提取多酚,重复提取2次,研究料液比、乙醇浓度、提取温度、提取时间等4个因素对草莓多酚提取率的影响,确定每一因素的最佳水平。具体方法如下。
料液比:乙醇浓度70%,料液比分别为1 ∶[KG-*3]5、1 ∶[KG-*3]10、1 ∶[KG-*3]15、1 ∶[KG-*3]20、1 ∶[KG-*3]25、1 ∶[KG-*3]30、1 ∶[KG-*3]35(g ∶[KG-*3]mL),提取时间2 h,提取温度50 ℃。
乙醇浓度:乙醇浓度分别为30%、40%、50%、60%、70%、80%、90%、100%,料液比1 g ∶[KG-*3]20 mL,提取时间2 h,提取温度50 ℃。
提取温度:乙醇浓度为70%,料液比1 g ∶[KG-*3]20 mL,提取温度分别为20、30、40、50、60、70 ℃,提取时间2 h。
提取时间:乙醇浓度为70%,料液比1 g ∶[KG-*3]20 mL,提取温度50 ℃,提取时间分别为0.5、1.0、1.5、2.0、2.5、3.0、35、4.0 h。
1.3.3提取工艺正交试验
在上述单因素试验基础上,以料液比、乙醇浓度、提取温度、提取时间为试验因素,每因素设计3个水平进行正交设计(表1),计算多酚得率,以确定草莓多酚最佳提取条件。
1.3.4草莓多酚得率测定
总酚含量采用Folin-Ciocalteu法测定。
1.3.4.1标准曲线的绘制
配置浓度为0.01、0.02、0.03、0.04、0.05 mg/mL的没食子酸标准溶液;分别取1 mL,加蒸馏水5 mL、Folin-Ciocalteu显色剂1 mL、7.5%碳酸钠溶液 3 mL,混匀,45 ℃水浴1.5 h后,在760 nm处测吸光度。以没食子酸浓度为横坐标,吸光度为纵坐标作标准曲线,所得回归方程为y=0.011 3x+0.002,相关系数r2=0.999 8。
1.3.4.2多酚提取得率的测定
取草莓多酚提取液1 mL,依次加入蒸馏水5 mL、Folin-Ciocalteu显色剂1 mL、7.5%碳酸钠溶液3 mL,混匀,45 ℃水浴1.5 h,在760 nm处测吸光度。根据标准曲线计算草莓多酚含量,再按照如下公式计算多酚提取得率:
[JZ]多酚得率(按没食子酸计)(mg/g)=(C×V/m)×100%,
式中:C为比色杯中多酚质量浓度(mg/mL),V为多酚提取液总体积(mL);m为草莓总质量(g)。
1.3.5草莓多酚体外抑菌试验
预先将大肠杆菌、金黄色葡萄球菌、沙门氏菌从斜面转接至已灭菌的LB培养基中活化,然后分别挑取菌苔,用无菌水制成含菌数约为106 CFU/mL的菌悬液。于无菌条件下分别进行抑菌圈试验和最小抑菌浓度试验。
抑菌圈试验[16]:以无菌水作溶剂,準确称取一定量草莓多酚粉,分别配制浓度为0.056、0.112、0.224、0.448、0.896 mg/mL 的草莓多酚溶液。将无菌滤纸片(直径6mm)放入多酚溶液中,4 ℃条件下浸泡2 h。将LB培养基倒入无菌培养皿,凝固后分别取0.1 mL大肠杆菌、金黄色葡萄球菌、沙门氏菌菌悬液滴于培养基平板上,用涂布棒均匀涂布,静置10 min。将分别浸有不同浓度草莓多酚溶液的滤纸片均匀放置于平板上,以浸有无菌生理盐水的滤纸片为对照,在37 ℃条件下培养24 h,观察滤纸片周围的抑菌圈,并通过测定其抑菌直径比较不同浓度多酚溶液的抑菌效果。
最小抑菌浓度(MIC)试验:参照张赟彬等的方法[17]将草莓多酚加入50 ℃无菌LB培养基,混和均匀,使其在培养基的终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mg/mL,将含有不同浓度草莓多酚的培养基倒入无菌培养皿中,凝固后分别滴加大肠杆菌、金黄色葡萄球菌、沙门氏菌菌悬液各0.5 mL,用涂布棒均匀涂布,静置10 min后在 37 ℃ 下培养24 h,找出肉眼未见有菌生长的草莓多酚浓度即为最小抑菌浓度(MIC)。
2结果与分析
2.1草莓多酚提取单因素试验结果与分析
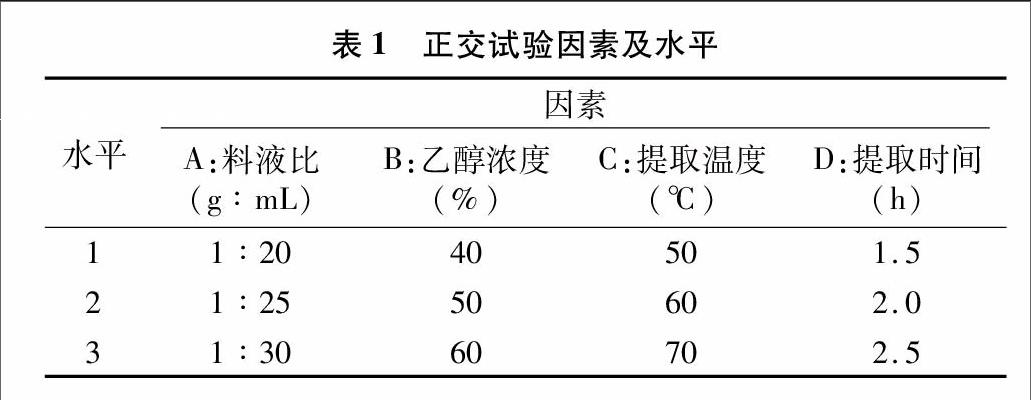
2.1.1料液比对草莓多酚得率的影响
由图1可见,在料液比1 g ∶[KG-*3]20 mL以内,随溶剂量逐渐增大,多酚提取率逐渐增加;当达料液比1 g ∶[KG-*3]20 mL后,继续增大溶剂量,提取率增加不再明显。较高的溶剂量有利于多酚类物质的溶出,但是溶剂量过大也会造成资源的浪费并对后续分离纯化造成不利影响。考虑到物料及溶剂的利用率,最终确定最佳提取料液比为1 g ∶[KG-*3]20 mL。
[TPLFF1.tif][FK)]
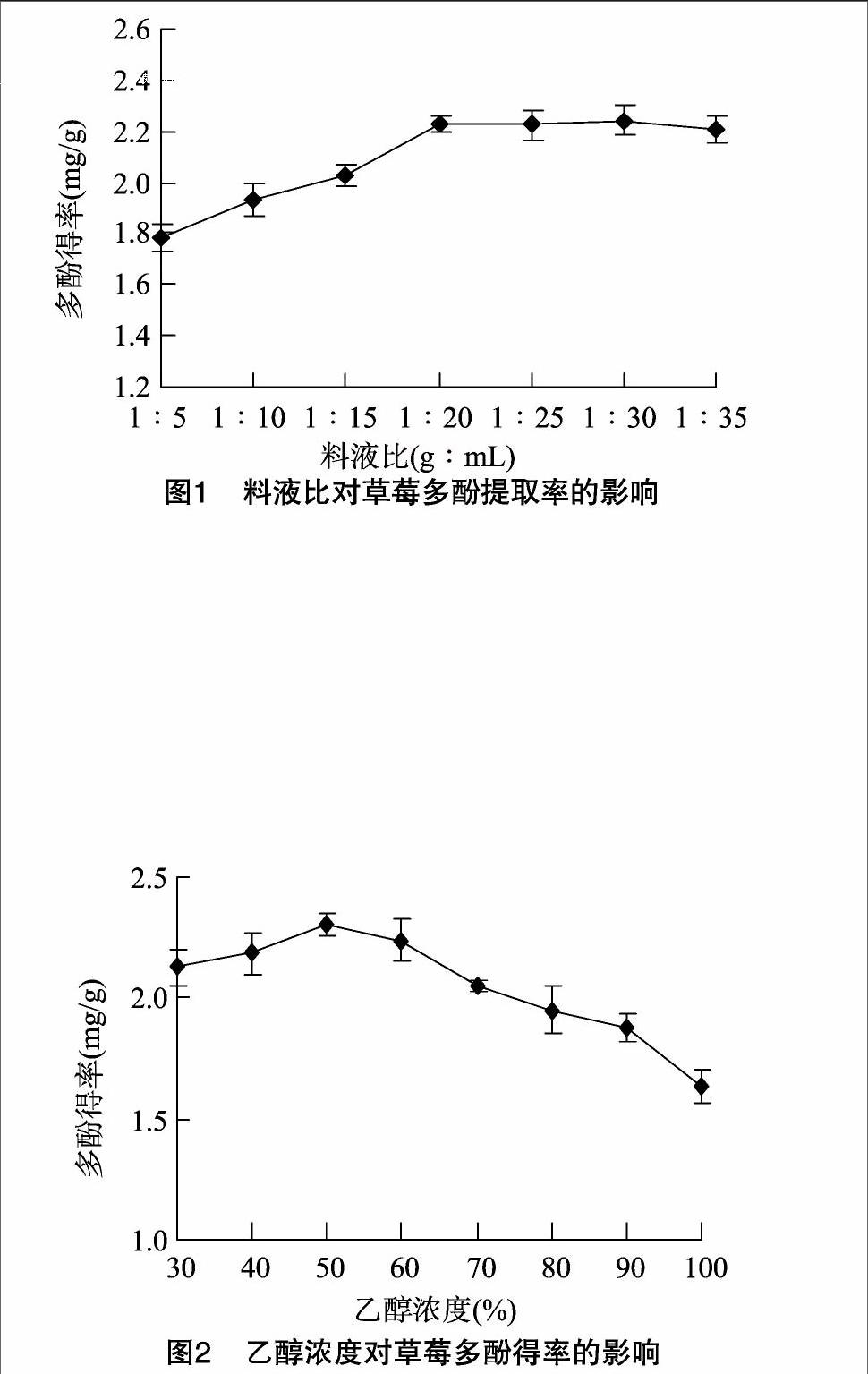
2.1.2乙醇浓度对草莓多酚得率的影响
由图2可见,当乙醇浓度小于50%时,随着乙醇浓度升高,总多酚提取率逐渐提高,当乙醇浓度达到50%时,总多酚的提取率达到最大,此后随着乙醇浓度升高,提取率逐渐减小。可能是由于过高浓度的乙醇溶液会引起细胞蛋白质变性,影响多酚类物质溶出,因而提取率降低[18]。最终确定最佳提取乙醇浓度为50%。
2.1.3提取温度对草莓多酚得率的影响
由图3可见,小于60 ℃范围内,随着提取温度升高,提取率逐渐增大,当温度大于60 ℃后,多酚得率呈下降趋势。表明温度升高有利于多酚的溶出,但是温度太高,草莓中酚类物质有可能因温度过高发生氧化等变化[19]。从节能经济出发,确定最佳提取温度为 60 ℃。
[TPLFF3.tif][FK)]
2.1.4[JP2]提取时间对草莓多酚提取得率的影响
由图4可见,在提取时间2 h以内,多酚提取率随提取时间的延长而逐渐增加,超过2 h以后,提取率增加渐趋平缓。表明充足的提取时间可以使溶剂充分接触,从而提高得率,当时间超过2 h后,多酚溶出基本达到平衡状态。因此,确定最佳提取时间为2 h。[JP]
[FK(W12][TPLFF4.tif][FK)]
2.2草莓多酚提取正交试验结果
在单因素试验基础上,采用L9(34)正交试验优化多酚提取工艺,结果见表2。由表2极差R可知,4个因素对草莓多酚提取得率影响的主次关系为D>C>A>B,即提取时间>提取温度>料液比>乙醇浓度。草莓多酚提取的最佳组合为A1B2C2D2,即料液比为1 g ∶[KG-*3]20 mL,提取时间2 h,乙醇浓度50%,提取60 ℃。按照此条件进行5次验证试验,测得草莓多酚提取得率(按没食子酸计)为2.448 mg/g。
2.3草莓多酚的抑菌试验结果
2.3.1不同浓度草莓多酚抑菌效果
以金黄色葡萄球菌、大肠杆菌、沙门氏菌为供试菌株,通过检测抑菌圈直径比较 0.056、0.112、0.224、0.448、0.896 mg/mL等不同浓度的草莓多酚溶液对3种菌的抑菌效果。由图5和表3可知,草莓多酚对3种试验菌的生长均有抑制作用,且3种试验菌的抑菌圈直径大小与多酚浓度呈明显的剂量效应关系;草莓多酚对金黄色葡萄球菌的抑制作用最为明显,对3种菌的抑菌能力强弱排序为金黄色葡萄球菌>大肠杆菌>沙门氏菌。
2.3.2草莓多酚的最低抑菌浓度分析
由表4可知,草莓多酚对不同微生物的生长抑制作用存在较大差异,0.9 mg/mL以上浓度才会对3种供试均有抑菌效果。在较低浓度条件下,其对金黄色葡萄球菌的抑制作用最强,对大肠杆菌效果次之,而对沙门氏菌的抑菌效果最差。对沙门氏菌、金黄色葡萄球菌、大肠杆菌的MIC分别为0.9、0.6、0.8 mg/mL。从表4还可知,随着浓度降低,平皿上菌落生长越来越多。说明多酚浓度与其抑菌效果呈现一定的量效关系。
3结论
草莓是国内外市场上深受消费者喜爱的特色保健浆果,但草莓的易腐特性常常会导致草莓丰产不丰收。因此,采用深加工技术开发各类草莓多酚营养保健品是草莓产业发展的必然途径。本试验采用常规溶剂法提取草莓多酚,并通过单因素试验和正交试验法确定草莓多酚最佳提取工艺条件为料液比1 g ∶[KG-*3]20 mL、乙醇浓度50%、提取温度60 ℃、提取时间 2 h。各因素对多酚得率的影响从大到小依次为提取时间、提取温度、料液比、乙醇浓度。该最佳工艺条件下草莓多酚的提取率(按没食子酸计)为2.448 mg/g。
多酚是多羟基酚类化合物的总称,具有广谱的抗菌活性,分子中的酚羟基是抑菌的结构基础,多酚与蛋白质分子的多点结合作用,及其通过抑制酶活性而抑制代谢过程,是其阻止并抑制微生物浸染、构成抗菌活性的重要原因。此外,多酚还可以通过破坏细胞膜结构、增加细胞通透性、影响细胞能量代谢从而对微生物起毒害作用[20-21]。近年来茶多酚、苹果多酚等物质的抑菌作用时有报道,但有关草莓多酚的抑菌活性还未见报道。本试验通过滤纸片法抑菌试验检测草莓多酚对大肠杆菌、金黄色葡萄球菌、沙门氏菌均有抑菌能力;对3种菌抑制能力由大到小排序依次为金黄色葡萄球菌>大肠杆菌>沙门氏菌;对3种细菌的最低抑制浓度分别为金黄色葡萄球菌0.6 mg/mL、大肠杆菌0.8 mg/mL、沙门氏菌0.9 mg/mL。
总之,本试验优化的草莓多酚提取工艺安全高效,所得草莓多酚具有良好的抗菌活性,可作为天然的植物抗菌剂应用于食品防腐与医疗保健。但草莓多酚作为由多种酚类物质组成的混合物,其中每种物质的抑菌活性和作用机理如何、是否存在协同增效作用等,仍需要进一步深入研究。
[HS2]参考文献:
[1]Kalt W,Forney C,Martin A,et al. Antioxidant capacity,vitamin C,phenolics,and anthocyanins after fresh storage of small fruits[J]. Journal of Agricultural and Food Chemistry,1999,47(11):4638-4644.
[2]Tulipani S,Mezzetti B,Antioxidants C F,et al. Antioxodants,phenoloc compounds,and nutritional quality of different strawberry genotypes[J]. Journal of Agricultural and Food Chemistry,2008,56(3):696-704.
[3]Cai Y,Luo Q,Sun M,et al. Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J]. Life Sciences,2004,74(17):2157-2184.
[4]Sellappan S,Akoh C,Krewer G. Phenolic compounds and antioxidant capacity of Georgia-grown blueberries and blackberries[J]. Journal of Agricultural and Food Chemistry,2002,50(8):2432-2438.
[5]羅娅,王小蓉,张勇,等. 不同提取条件对草莓果实抗氧化物质和抗氧化活性的影响[J]. 食品科学,2011,32(14):108-112.
[6]Hadi S,Bhat S,Azmi A,et al. Oxidative breakage of cellular DNA by plant polyphenols:a putative mechanism for anticancer properties[J]. Seminars in Cancer Biology,2007,17(5):370-376.
[7]Shoenfeld Y,Sherer Y,Harats D. Artherosclerosis as an infectious,inflammatory and autoimmune disease[J]. Trends in Immunology,2001,22(6):293-295.
[8]Malenci[KG-*5]c[DD(-1*2][HT6]'[DD)] D,Maksimovi[KG-*5]c[DD(-1*2][HT6]'[DD)] Z,Popovi[KG-*5]c[DD(-1*2][HT6]'[DD)] M,et al. Polyphenol contents and antioxidant activity of soybean seed extracts[J]. Bioresource Technology,2008,99(14):6688-6691.
[9]吳建华,吴志瑰,裴建国,等. 多酚类化合物的研究进展[J]. 中国现代中药,2015,17(6):630-636.
[10]唐福才,姚敦琛,关天旺,等. 龙眼核中多酚提取及抗氧化活性的研究[J]. 食品研究与开发,2015,36(12):5-9.
[11]伍鹤,王远亮,赵琳,等. 蓝莓多酚提取方法及功能活性研究进展[J]. 食品与机械,2015(2):257-261.
[12]许惠玲,蔡为荣,曹天亮,等. 荷叶多酚提取优化及其在黄酒中的应用[J]. 食品工业科技,2015,36(8):277-281.
[13]刘莉,唐新玥,张欣珂,等. 板栗壳中多酚的提取纯化及其抑制α-葡萄糖苷酶活性的研究[J]. 食品工业科技,2015,36(6):265-268.
[14]Amin I,Norazaidah Y,Hainida K I. Antioxidant activity and phenolic content of raw and blanched Amaranthus species[J]. Food Chemistry,2006,94(1):47-52.
[15]Mahdavi R,Nikniaz Z,Maryam R,et al. Determ ination and comparison of total polyphenol and vitamin C contents of natural fresh and commercial fruit juices[J]. Pakistan Journal of Nutrition,2010,9(10):968-972.
[16]李建慧,马会勤,陈尚武. 葡萄多酚抑菌效果的研究[J]. 中国食品学报,2008,8(2):100-107.
[17]张赟彬,孙晔,龚钢明. 甘薯多酚提取液的抑菌试验研究[J]. 食品与机械,2007,23(5):87-89.
[18]颜栋美,李仁菊,丘华,等. 金花茶多酚提取工艺的研究[J]. 现代食品科技,2007,23(9):45-49.
[19]欧阳玉祝,李勇,吴道宏,等. 路边青多酚的稳定性及其热降解动力学[J]. 食品科学,2011,32(15):46-48.
[20]钱丽红,陶妍,谢晶. 茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J]. 微生物学通报,2010,37(11):1628-1633.
[21]孙红男,孙爱东,苏雅静,等. 苹果多酚抑菌效果的研究[J]. 北京林业大学学报,2010,32(4):280-283.[HJ][FL)]

