高效液相色谱检测番茄与土壤中的吩胺霉素残留
刘红玉 陈梦现 欧晓明 付启明 文珊
摘 要:吩胺霉素是我国具有自主知识产权的新型抗生素类杀菌剂.选取番茄及三类理化性质不同的土壤为研究对象,建立了吩胺霉素在上述基质中的液相色谱检测方法.土壤中吩胺霉素选择混合液(V氨水∶V乙醇∶V二氯甲烷=1∶2∶3)振荡提取,番茄中吩胺霉素采用乙腈振荡提取,碱性氧化铝柱净化.土壤与番茄中的平均回收率分别为80.2%~95.7%和80.1%~85.6%,RSD(相对标准偏差)分别为2.14%~4.17%和4.12%~5.17%.吩胺霉素的最小检出量为0.2 ng,在基质中最低检测限为0.01 mg/kg.本方法简单可靠,基质效应弱,符合农药残留分析要求,可用于土壤和番茄中吩胺霉素的残留检测.
关键词:吩胺霉素;番茄;土壤;高效液相色谱;基质效应
中图分类号:X592 文献标识码:A
Abstract:Phenazine1carboxamide is a new pesticide. This paper evaluates the residue of phenazine1carboxamide in tomato and three kinds of soils. New methods for determining phenazine1carboxamide residue in these matrices were developed by high performance liquid chromatography detection. Phenazine1carboxamides from soil with ammonia water + ethanol + dichloromethane = 1+2+3(v/v) and from tomato with acetonitrile were exacted, followed by chromatography columns (basic aluminum) cleanup. The mean recoveries of phenazine1carboxamide in soil and tomato were 80.2% to 95.7% and 80.1% to 85.6% respectively, while the relative standard deviations were 2.14% to 4.17% and 4.12% to 5.17%, respectively. The minimum detectable quantity of phenazine1carboxamide was 0.2 ng, and the limit of detection was 0.01 mg/kg. In a whole, this method is simple and reliable, and has weak matrix effects, which satisfies the requirement of pesticide residue analysis. It is applicable to determine the phenazine1carboxamide residues in soil and tomato.
Key words:phenazine1carboxamide; tomatoes; soil; HPLC; matrix effects
农药可以杀虫、杀菌、除草,改善作物的生长环境,为作物生产带来效益,然而不合理地使用农药也会带来环境风险和经济损失.生物农药活性成分属于天然成分,具有对人类和动物安全、难产生生物抗性、可有效控制病虫害等优点[1],是未来农药发展的趋势.
吩胺霉素是我国具有自主知识产权的新型抗生素类杀菌剂.它由绿针假单胞菌nlsy001(Pseudomonas chlororaphis)通过微生物培养、发酵、提取而获得,是一种对多种真菌性植物病害具有良好抑制效果的新型生物农药.吩胺霉素易溶于丙酮、二氯甲烷、乙醇等有机溶剂,在水中的溶解性较差,化学性质稳定,分子式为C13H9N3O,分子量为223.2.
目前国内关于吩胺霉素的研究报告较少.熊件妹等[2]曾研究了吩胺霉素对黄瓜枯萎病的抑制作用.关于吩胺霉素在土壤以及农产品中的殘留检测方法尚未有报告.高效液相色谱已广泛应用于环境基质中有机污染物质的检测[3].本文选取番茄、3类土壤为研究对象,初步研究吩胺霉素在上述基质中的提取检测方法,以期为土壤以及农产品中的吩胺霉素的残留检测提供科学依据.
1 材料与仪器
1) 仪器:高效液相色谱仪, LC20ADXR(日本岛津公司);AUW220D型分析天平(日本岛津公司);Scout SE型电子天平(奥豪斯仪器有限公司);RE52A型旋转蒸发仪(上海亚荣生化仪器厂);HY1B型回旋振荡器(江苏金坛医疗仪器厂);SC3614型低速离心机(安徽中科中佳科学仪器有限公司),0.22 μm有机相膜.
2) 试剂与样品:吩胺霉素标准品,95%(农业部农药检定所);甲醇为色谱级;二氯甲烷、乙腈、正己烷、乙酸乙酯、无水硫酸钠、无水硫酸镁、氯化钠均为分析纯;碱性氧化铝(100~200 μm);稀氨水(V浓氨水∶V纯水=1∶9);番茄来自湖南化工研究院未施用吩胺霉素实验田; 土壤选择未被吩胺霉素污染的吉林黑土、北京潮土以及湖南红土,其理化性质见表1(湖南省化肥农药质量监督检验授权站检测).
2 实验标准方法
2.1 标准曲线绘制
称取0.026 3 g的吩胺霉素标准样品于50 mL容量瓶中,乙腈定容,配制成500 mg/L的储备液,使用前保存于4 ℃的冰箱.将储备液用乙腈配制成质量浓度为0.01 mg/L, 0.05 mg/L, 0.10 mg/L, 0.50 mg/L, 1.00 mg/L, 10.00 mg/L的系列标准溶液,绘制标准曲线.
2.2 基质匹配标准溶液[4]
将提取后的空白样品基质,添加0.01 mg/L, 0.05 mg/L, 0.10 mg/L, 0.50 mg/L, 1.00 mg/L, 10.00 mg/L系列标准溶液,配制基质匹配标准溶液.
2.3 样品前处理
2.3.1 样品制备
用匀浆搅拌机将清洗后的番茄绞碎,用采样袋收集;土壤取样深度15 cm,多点均质采样后混合,经自然风干,过40 μm筛,用采样袋收集,样品使用前均储存于4 ℃条件下.
2.3.2 土壤的提取净化
称取20 g土壤于150 mL塑料离心瓶,提取液(V氨水∶V乙醇∶V二氯甲烷=1∶2∶3)60 mL振荡提取40 min,4 000 r/min条件下离心8 min,将上清液过脱脂棉转移至分液漏斗;残渣用20 mL二氯甲烷洗涤,洗涤液并入分液漏斗,用二氯甲烷振荡萃取2次,每次50 mL,分层,合并有机相.有机相过无水硫酸钠后收集于圆底烧瓶,45 ℃水浴旋转蒸发至近干,冷却后用2 mL乙腈+甲醇(V乙腈∶V甲醇=1∶1)定容,过0.22 μm有机相膜待检测.
2.3.3 番茄的提取净化
称取20 g番茄样品于150 mL玻璃锥形瓶中,50 mL乙腈振荡提取40 min,将提取液过脱脂棉转移至分液漏斗,残渣用20 mL二氯甲烷洗涤,洗涤液并入分液漏斗,用二氯甲烷振荡萃取2次,每次50 mL,分层,合并有机相.有机相过无水硫酸钠后收集于圆底烧瓶,45 ℃水浴旋转蒸发至近干,5 m L正己烷溶解,待净化.
采用干法装柱,玻璃层析柱中依次装入2 g无水硫酸钠、2 g碱性氧化铝和2 g无水硫酸钠,并不断用吸耳球轻轻敲打至填充密实.10 mL正己烷预淋层析柱后上样,用15 mL正己烷+二氯甲烷(体积比为8∶2)混合液淋洗,弃去淋洗液,继续用150 mL乙酸乙酯洗脱目标物,洗脱液收集于圆底烧瓶中,于45 ℃水浴旋转蒸发至近干,2 mL乙腈+甲醇(体积比1∶1)定容,过0.22 μm有机相膜待检测.
2.4 仪器条件
2.4.1 高效液相色谱条件
色谱柱为WelcholtimateAQGg,150 mm×4.6 mm;柱温40 ℃,检测器为PDA,检测波长254 nm;流动相:甲醇水(体积比49∶51, 10 min),甲醇水(体积比95∶5, 5 min),甲醇水(体积比49∶51, 5 min);进样量20 μL.吩胺霉素保留时间9 min左右,标准品色谱图如图1所示.
2.4.2 检测条件的确定
通过检测器全扫描发现吩胺霉素在254 nm处有较强的吸收峰,且对目标物没有干扰,故选择为检测波长.
以甲醇与水体积比为49∶51,目标物可以较早出峰,峰型较好,且能与杂质完全分离,故选择为流动相.
3 结果与讨论
3.1 标准曲线
取0.01 mg/L, 0.05 mg/L, 0.10 mg/L, 0.50 mg/L, 1.00 mg/L, 10.00 mg/L质量浓度的系列标准溶液,在测定条件下,以峰面积(y)进样质量浓度(x)作标准曲线,得到仪器对吩胺霉素响应的线性关系.测得吩胺霉素标准曲线方程为y=234 578x-1 253.5(R2=1).
3.2 添加回收实验
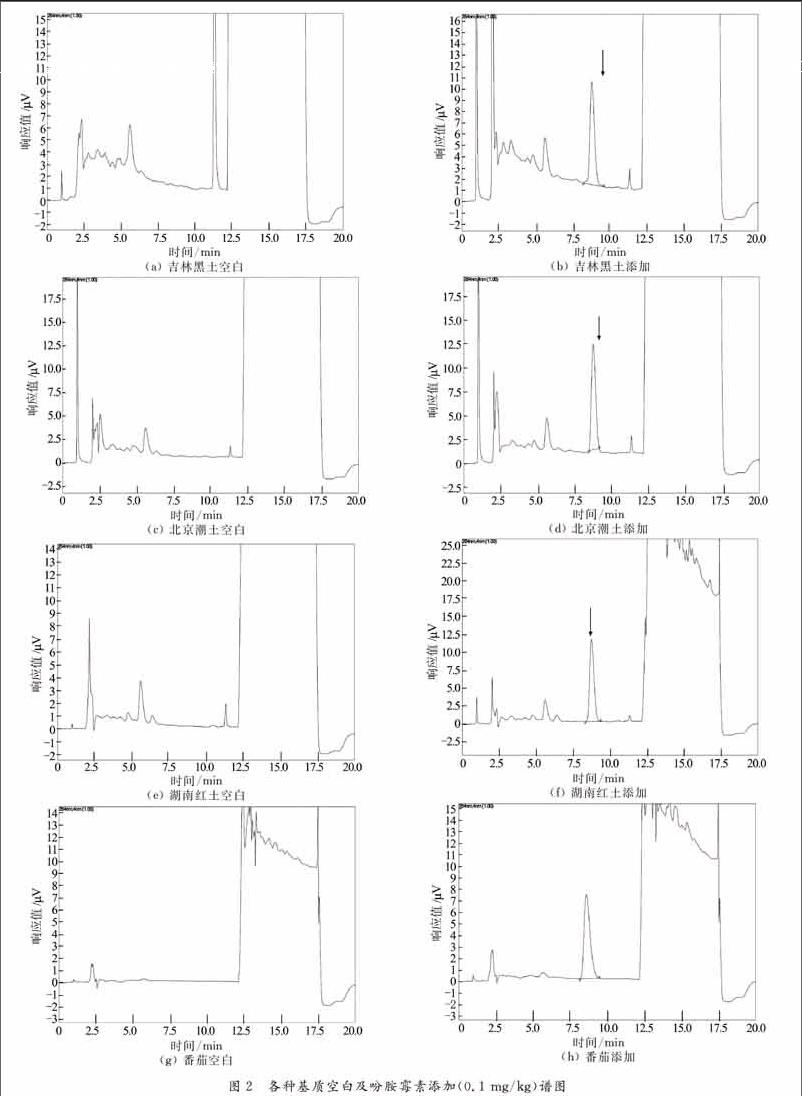
称取番茄及3类土壤空白样品,添加吩胺霉素标准品,分别做0.01 mg/kg, 0.10 mg/kg, 1.00 mg/kg三个添加水平,每个水平重复5次,按上述分析方法提取、净化并做HPLC测定,计算添加回收率,结果见表2.在上述检测条件下,吩胺霉素各样本典型色谱图见图2.
根据上述检测条件,得到吩胺霉素最小检出限为0.2 ng,在土壤和番茄中的最低检测限为0.01 mg/kg.3类土壤与番茄中的平均回收率分别为80.2%~95.7%和80.1%~85.6%,RSD分别为2.14%~ 4.17%和4.12%~5.17%.采用的方法满足农药残留分析标准[5],为该农药检测提供了参考方法.
3.3 土壤的提取
依据地理位置、物理化学性质的不同,选取了吉林黑土、北京潮土和湖南紅土3种典型土壤,确定了适合3类土壤的吩胺霉素提取方法,并探讨了土壤性质与称样量对回收率的影响.
3.3.1 提取溶剂的选择
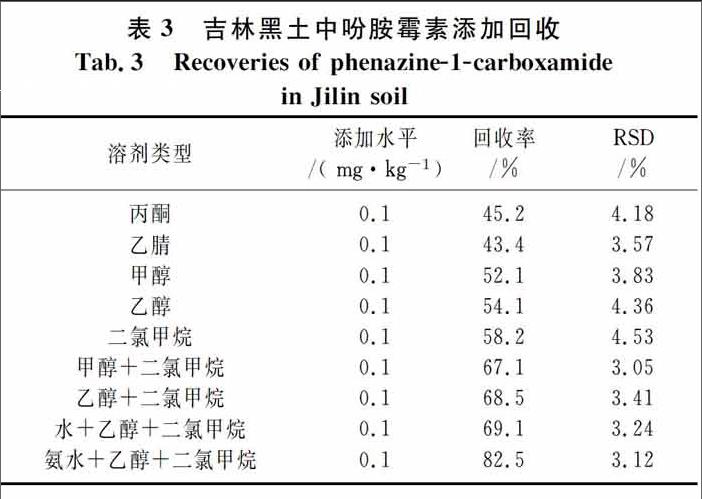
吩胺霉素在丙酮、乙醇、甲醇、乙腈中的溶解性较好,但单独使用以上溶剂,回收率均低于55%(表3),这可能是由于极性较强的单一溶剂不能解吸出土壤中的吩胺霉素.使用二氯甲烷作为提取溶剂,回收率有所增加,但仍低于60%,可能是因为土壤中含有一定量的水分,二氯甲烷无法完全浸入土壤孔隙.使用极性溶剂乙醇或甲醇与二氯甲烷的混合提取剂可有效浸入土壤,溶解农药,回收率明显增加(见表3).由于乙醇毒性低,且与二氯甲烷混合后回收率更高,故作为最终提取溶剂.
上述实验表明,无论单独使用极性还是非极性溶剂提取,回收率均较低,采用极性与非极性溶剂混合液有利于提取,结论与 Gans[6]和Hussen[7]的结果一致.
土壤pH值对农药的吸附也存在影响[8].为了进一步提高回收率,本文对比了中性条件与碱性条件下的提取,发现碱性条件有利于提取(见表3).最终确定混合液(V氨水∶V乙醇∶V二氯甲烷=1∶2∶3)60 mL作为提取溶剂.
3.3.2 土壤性质对回收率的影响
回收率与土壤的有机质含量有关,有机质含量越高对农药的吸附性越强[9-10],越不利于提取.吩胺霉素在3种土壤(理化性质见表1)中的添加回收率,从低到高的顺序为吉林黑土<北京潮土<湖南红土;有机质含量从高到底的顺序为吉林黑土>北京潮土>湖南红土,两者呈负相关性,R2为0.584 7~0.730 1.
Kodesova等[11]发现农药在土壤中的吸附与阳离子代换量有显著的正相关性,影响回收率.吩胺霉素在土壤中的回收率与阳离子代换量也成反比关系,黑土的阳离子代换量最高,回收率最低,湖南红土的阳离子代换量最低,回收率最高,R2为0.946 3~0.993 6.
土壤黏粒对某些农药的吸附影响甚至比有机质等其他因素的影响更大[12].本研究发现回收率与土壤黏粒呈负相关性,R2为0.590 6~0.735 4,黏粒含量增加会导致土壤中吩胺霉素的吸附性增大,造成回收率降低.
3.3.3 土壤质量对回收率的影响
研究了5 g, 10 g, 20 g吉林黑土添加0.1 mg/kg吩胺霉素的添加回收.发现土壤称样量越大,回收率越低,5 g样品的回收率为86.1%,10 g样品的回收率为84.6%,20 g样品的回收率为82.5%.原因可能在于土壤越多,不饱和吸附位点越多,被吸附的农药越多;同时相同体积的提取剂无法有效浸入质量较大的土壤空隙,解吸出农药.
3.4 番茄的提取
3.4.1 提取溶剂的选择
由于乙腈提取时的共萃物较少,且在盐溶液中与水容易分离,经常作为首选提取溶剂[13].实验对比了乙腈、甲醇、丙酮的提取结果,在回收率相近的情况下,乙腈提取杂质最少,最终确定乙腈为提取溶剂.
3.4.2 净 化
吸附剂的选择:试验对比了弗罗里硅土、硅胶、碱性氧化铝、活性炭/碱性氧化铝(1∶200)对番茄样品的净化效果.结果发现:弗罗里硅土与硅胶作为吸附剂,乙酸乙酯洗脱出杂质产生干扰.活性炭/碱性氧化铝(1∶200)虽然可以去除杂质,但活性炭的吸附能力过强,乙酸乙酯、甲醇或二氯甲烷均无法有效地将目标物洗脱下来.碱性氧化铝可以有效地吸附杂质,同时乙酸乙酯可以将目标物洗脱,最终确定碱性氧化铝作为吸附剂.
洗脱溶剂:用碱性氧化铝作吸附剂,正己烷无法有效洗脱出杂质;用二氯甲烷预淋洗时,会将部分目标物与杂质共同洗脱;使用正己烷+二氯甲烷(V正己烷∶V二氯甲烷=8∶2)混合液可以洗脱杂质,同时目标物可以保留于层析柱中,达到目標物与杂质分离的效果.预淋后,用二氯甲烷和乙酸乙酯继续洗脱,均可将目标物洗脱,不产生干扰;而甲醇作洗脱溶剂,能洗脱出乙酸乙酯无法洗脱的杂质,产生干扰.由于乙酸乙酯洗脱效果较二氯甲烷好,所以选择乙酸乙酯作为洗脱溶剂.
淋洗体积:对比了120 mL和150 mL的乙酸乙酯洗脱回收率.当用120 mL乙酸乙酯洗脱时,平均回收率为84.7%,用150 mL乙酸乙酯洗脱时,平均回收率为92.7%,所以最后以150 mL乙酸乙酯淋洗目标物.
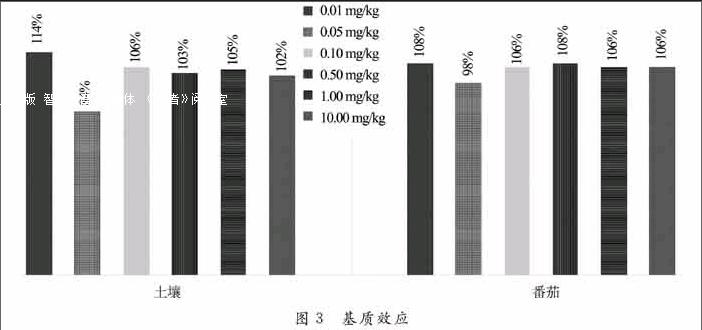
3.5 基质效应
采用色谱检测时,可能会产生基质效应.本文使用相对响应值法来评价基质效应.计算公式如下:
基质效应值=B/A×100%.
式中: A 为溶剂中农药的响应值;B为空白基质中农药的响应值.
提取后的基质空白分别添加了0.01 mg/L,0.05 mg/L, 0.10 mg/L, 0.50 mg/L, 1.00 mg/L和10.00 mg/L标准溶液,图3为2种空白基质效应值.土壤(吉林黑土)基质中,基质效应值为84%~114%,在0.05 mg/kg呈现弱的基质减弱作用,其他浓度呈现弱的基质增强作用.番茄基质效应值为98%~108%,0.05 mg/kg呈现弱的基质减弱作用,其他浓度呈现弱的基质增强作用.基质效应与浓度之间没有线性关系,2种基质效应总体较弱.
相对响应值法表明基质效应对HPLC检测番茄与土壤中吩胺霉素干扰较小,用土壤和番茄基质匹配溶液校正后的回收率与用乙腈溶剂校正的回收率相比偏离较小.
4 结 论
本文建立了高效液相色谱检测吩胺霉素在土壤和番茄中残留的方法.实验发现,3类土壤对吩胺霉素的吸附性较强,选取提取液(V氨水∶V乙醇∶V二氯甲烷=1∶2∶3),可以达到良好的提取结果;番茄对吩胺霉素吸附性较弱,采用乙腈提取,以碱性氧化铝为吸附剂,正己烷+二氯甲烷(体积比8∶2)为预淋洗剂,乙酸乙酯为洗脱溶剂,可以达到良好的杂质去除效果.土壤有机质含量、阳离子代换量、黏粒、称样量均对回收率产生一定影响.土壤和番茄中平均回收率分别为80.2%~95.7%和80.1%~85.6%,RSD分别为2.14%~4.17%和4.12%~5.17%,在基质中最小检出量为0.2 ng,最低检测限`为0.01 mg/kg,本方法基质效应弱,符合农药残留分析的要求.
参考文献
[1] ZHANG W J, JIANG F B, GOU J F. Global pesticide consumption and pollution: with China as a focus[J]. Proceedings of the International Academy of Ecology and Environmental Sciences, 2011, 1(2):125-144.
[2] 熊件妹,向妙莲,刘伟. 吩胺霉素对黄瓜枯萎病的室内毒力测定及田间应用研究[J]. 生物灾害科学,2013,36(4):363-365.
XIONG Jianmei, XIANG Miaolian, LIU Wei. Toxicity of fenanmyin against cucumber Fusarium wilt and its field effect trials[J]. Biological Disaster Science, 2013, 36(4):363-365.(In Chinese)
[3] 范长征,王聪,鲁伦慧,等.湘江四环素及抗性基因含量特征及其季节变化[J]. 湖南大学学报:自然科学版, 2015,42(6):107-112.
FAN Changzheng, WANG Cong, LU Lunhui, et al. Occurrence and seasonal changes of tetracycline antibiotics and antibiotic resistance genes in the Xiang River [J]. Journal of Hunan University: Natural Sciences, 2015,42(6):107-112. (In Chinese)
[4] 黃宝勇,欧阳喜辉,潘灿平.色谱法测定农产品中农药残留时的基质效应[J].农药学学报,2005,7(4):299-305.
HUANG Baoyong, OUYANG Xihui, PAN Canping. Matrix effects in the analysis of pesticide residue in agroproducts by chromatographic methods [J].Chinese Journal of Pesticide Science, 2005,7(4):299-305. (In Chinese)
[5] 钱传范.农药残留分析原理与方法[M].北京:化学工业出版社,2011.
QIAN Chuanfan. Principle and method of pesticide residue analysis[M]. Beijing: Chemical Industry Press, 2011. (In Chinese)
[6] GAN J, PAPIERNIK S K, KOSKINEN W C, et al. Evaluation of accelerated solvent extraction (ASE) for analysis of pesticide residues in soil[J].Environmental Science & Technology,1999,33(18):3249-3253.
[7] HUSSEN A, WESTBOM R, MEGERSA N, et al. Optimisation of pressurised liquid extraction for the determination of p,pDDT and p,pDDE in aged contaminated Ethiopian soils[J]. Analytical and Bioanalytical Chemistry, 2006, 386(5): 1525-1533.
[8] SHENG G, YANG Y, HUANG M, et al. Influence of pH on pesticide sorption by soil containing wheat residuederived char[J]. Environmental Pollution, 2005, 134(3): 457-463.
[9] WEBER J B, WILKERSON G G, REINHARDT C F. Calculating pesticide sorption coefficients(Kd) using selected soil properties[J]. Chemosphere,2004, 55(2): 157-166.
[10]许秀莹,宋稳成,王鸣华,等.氟啶胺在土壤中的吸附解吸与淋溶特性[J].中国环境科学,2013,33(4):669-673.
XU Xiuying, SONG Wencheng, WANG Minghua, et al. Adsorptiondesorption and leaching characteristics of fluazinam in soils[J]. China Environmental Science, 2013, 33(4):669-673. (In Chinese)
[11]KODESOVA R, KOCAREK M, KODES V, et al. Pesticide adsorption in relation to soil properties and soil type distribution in regional scale[J]. Journal of Hazardous Materials, 2011,186(1):540-550.
[12]DUROVIC R, GAJIC U J, DORDEVIC T. Effects of organic matter and clay content in soil on pesticide adsorption processes[J]. Pesticide and Phytomedicine, 2009, 24(1):51-57.
[13]ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solidphase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003,86(2):412-431.

