肝癌组织HNF4α mRNA 定量检测方法的建立与初步应用
张伟,董政,孔慧芳,张百龙,毛威,高旭东,荣义辉
·原发性肝癌·
肝癌组织HNF4α mRNA 定量检测方法的建立与初步应用
张伟,董政,孔慧芳,张百龙,毛威,高旭东,荣义辉
目的建立一种定量检测肝细胞癌(HCC)组织肝细胞核因子4α(HNF4α)mRNA的方法。方法取手术获得的HCC组织16例,提取总RNA,逆转录PCR扩增获得全长HNF4α mRNA对应cDNA产物,经TA克隆后,测序确认。根据获得序列,设计检测HNF4α mRNA引物及MGB荧光探针。以体外转录HNF4α mRNA为标准品,建立一步法逆转录荧光定量PCR检测方法,同时设定β-actin mRNA为内参对照,最终计算得到组织HNF4α mRNA水平。采用免疫组化染色检测HNF4α蛋白表达,比较HNF4α mRNA水平与HNF4α蛋白表达的对应结果。结果HCC组织HNF4α mRNA定量标准曲线斜率为-3.237,相关系数r值达0.994,β-actin mRNA定量标准曲线斜率为-3.037,相关系数r值为0.996,表明建立的方法可用于检测HNF4α mRNA定量(V-4α值),16例HCC组织HNF4α mRNA与HNF4α蛋白表达结果呈一致性对应关系。结论我们初步成功建立了定量检测HCC组织HNF4α mRNA水平方法,其意义还需要进一步研究。
肝细胞癌;肝细胞核因子4α;逆转录荧光定量PCR法
肝细胞癌(hepatocellular carcinoma,HCC)是指发生于肝细胞的恶性肿瘤,是侵袭力最强的恶性肿瘤之一,在东南亚地区较为常见[1,2],超过80%HCC患者同时伴有病毒性肝炎和肝硬化[1-3]。研究发现[4-9],肝细胞核因子4α(hepatocyte nuclear factor 4α,HNF4α)是核激素受体超家族HNF4的成员之一,是一种保守性的配体依赖性转录因子,处于转录因子网络调控的上游,可通过多种机制参与肝脏特异性基因的表达和调控,是肝细胞正常生理功能发挥和维持的关键调控因子之一[10-12]。HNF4α表达异常与各种肝脏疾病,如非酒精性脂肪肝、原发性肝癌、肝纤维化和病毒性肝炎等密切相关[13-17]。目前认为,HNF4α是HCC治疗的潜在靶点,并可作为HCC患者治疗后预测其预后的参考指标,HNF4α蛋白在肝组织中的表达强弱直接影响HCC患者预后。但到目前为止,采用免疫组化法检测组织HNF4α表达,存在检测时间长,结果易受读片医师主观判断的影响等缺点。我们建立了实时荧光定量PCR法检测HCC组织HNF4α mRNA水平,确定其阈值,以判断HCC组织HNF4α水平的高低作为临床快速定量检测的手段,以判定HCC组织的分化程度,为HCC患者的早期诊断和预后提供依据。
1 材料与方法
1.1 标本来源2014年1月~2015年12月在解放军第302医院经手术切除并经病理学检查确诊为HCC组织16例,男性13例,女性3例;年龄30~78岁,平均年龄为51.17±10.9岁。标本保存于组织RNA保存液中,冻存于-80℃。
1.2 主要试剂和仪器组织RNA保存液、PCR产物纯化试剂盒和组织RNA提取试剂盒(Qiagen,德国),DEPC(Sigma,美国),Ex TaqHS(TaKaRa,美国),RNase Inhibitor和T-A克隆试剂盒(Promega,美国),M-MLV逆转录酶(Fermentas,立陶宛),质粒提取试剂盒(上海生工,中国),DNA纯化试剂盒(Qiagen,德国),体外RNA制备试剂盒(Promega,美国)。β-actin mRNA标准品【全国临床实验标准委员会(NCCLs),中国】,抗HNF4α单克隆抗体(Eptomics,美国),免疫组化试剂盒和DAB显色试剂盒(中杉金桥,中国),其它生化试剂均为国产分析纯。台式高速低温离心机(Thermo,美国),实时荧光定量PCR仪(宏石,中国)。
1.3 引物探针设计与合成自NCBI获得HNF4α cDNA序列(GenBanknumber:NM_000545),按照序列信息(表1)合成HNF4α扩增引物以及荧光定量探针。
1.4 肝组织HNF4α mRNA的提取及cDNA扩增取HCC手术患者获得的新鲜肿瘤组织或液氮保存的冰冻HCC组织,立即加入液氮,在研钵内研碎。然后,严格按照Qiagen组织RNA提取试剂盒说明书提取总RNA。按照逆转录试剂盒说明书以oligd T引物在42℃作用90 min,70℃15 min,灭活逆转录酶,将mRNA逆转录为cDNA。PCR扩增体系:2× PCR Mix 25μl,4αF 0.5μl,4αR 0.5μl,cDNA产物5μl,加ddH2O补足到50 μl;PCR扩增条件:94℃3 min;94℃15 s,55℃20 s,72℃40 s,35个循环;72℃10 min;4℃保持。将全部PCR产物加入至1%TAE琼脂糖凝胶中,110 v,25 min,进行电泳鉴定,在约500 bp的位置出现阳性条带,对样本进行切胶,按照试剂盒说明回收目的PCR产物片段,以30 μl EB重溶产物DNA,置于-20℃保存。

表1 HNF4α mRNA和β-actin扩增引物及探针
1.5 全长HNF4αcDNA的克隆在1.5 ml EP管中,加T4 DNA连接酶Buffer 1μl,pGEM-T Easy载体(50ng)1μl,HNF4αcDNA胶回收产物3 μl,T4 DNA连接酶(3 U/μl)1μl,加ddH2O补足至10 μl,轻柔混匀后,短暂离心,置于4℃过夜。自-70℃冰箱中取出JM109感受态细胞,置于冰上5 min,待菌液完全融化后,轻柔吹打混合,取感受态细胞50 μl,将其加入到连接体系的EP管中,静置于冰上20 min,在42℃水浴中热击1 min,确保转化EP管不会震动。随后,迅速将EP管移到冰浴中,让细胞冷却2 min。在每管连接反应的转化细胞中加入平衡至室温的SOC培养基500 μl。在转化管恒温振荡器中振荡培养,37℃,180 r/m摇菌1 h。按照每细菌培养板300 μl转化培养基比例将培养基均匀涂布于含有X-Gal/IPTG/氨苄青霉素的固体平板培养皿表面。将培养皿置于37℃过夜。次日,挑取白色单克隆菌斑进行鉴定。取双蒸水10 μl,加入PCR反应管中,采用无菌牙签挑取白色单克隆菌落,置于水中冲涮,再在复制板胶上划数下,将编好号的PCR管置于95℃金属浴中10 min,随后冰浴3 min,裂解细菌。将复制板置于37℃孵箱中过夜培养。以裂解菌液产物为模板,与前述1.4中PCR反应条件和体系相同,进行目的片段扩增。扩增产物经1%TAE琼脂糖凝胶电泳鉴定,出现目的片段则为阳性克隆。取阳性克隆菌液送测序鉴定。
1.6 体外转录合成cRNA,制备标准品提取测序正确的HNF4α全长cDNA克隆质粒,按照前述1.4中引物扩增HNF4α全长基因,利用Qiagen公司的PCR产物纯化试剂盒进行纯化回收,之后将其作为模板,按照Promega公司体外RNA制备试剂盒进行体外转录。转录产物经无RNase的Dnase I消化,除去其中的DNA模板后,75℃10 min,将DNase I灭活,经RT-PCR验证所合成的cRNA,测定其A260吸收值,并计算浓度为1.0×108copies/10 μl,保存于-70℃备用。
1.7 检测HNF4α mRNA荧光定量RT-PCR反应条件的优化和标准曲线的建立以制备的cRNA为模板,对反应体系中的引物、MGB探针、dNTP、Mg2+浓度以及退火温度进行优化筛选,选择灵敏度高、背景信号低、扩增荧光信号曲线呈典型S型的反应条件作为最适反应条件。然后,用灭菌双蒸水将纯化的质粒标准品倍比稀释至108、107、106、105、104、103、102copies/ml,采用最适条件进行PCR反应。在反应结束后,根据扩增曲线情况,设定和调整CT值的基线和阈值,通过收集的荧光曲线和CT值,计算机自动绘制标准曲线。
1.8 HCC组织HNF4α免疫组化检测及其HNF4α mRNA阈值的确定免疫组化主要步骤:采用Maxvision法,将切片置于60℃烤箱1 h;脱蜡水化,即石蜡切片经二甲苯15 min,梯度酒精100%、100%、95%、90%、80%、70%各5 min;蒸馏水新配的3%H2O2室温浸泡10 min,蒸馏水冲洗3次;将切片浸入0.01mol/L枸橼酸盐缓冲液(PH 6.0),在高压锅中加热2 min,冷却至室温。PBS洗涤5 min×3次。滴加适当稀释(1:150)的一抗,37℃放置1 h,PBS洗涤5 min×3次。滴加二抗(1:1000),37℃放置20 min,PBS洗涤5 min×3次。滴加新配DAB显色剂,室温下控制显色时间(约5 min),蒸馏水终止显色时间;苏木素复染核,冲洗,1%盐酸酒精分化,自来水冲洗。梯度酒精70%、80%、90%、95%、100%、100%脱水各5 min,二甲苯20 min,中性树胶封片。至少2名病理学医师在双盲情况下对免疫组织化学检测结果进行读片,结果判定方法和参照标准具体如下:(1)染色强度(intensity)评分标准:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;(2)染色程度(extent)评分标准:在显微镜下随机选取5个视野,根据每个视野中阳性细胞的比例进行评分,0%为0分,1%~10%为1分,11~50%为2分,51%~80%为3分,>80%为4分;(3)免疫组化评价标准:染色强度得分与染色程度得分相乘,结果0~1分为0级,2~4分为1级,5~7分为2级,8~12分为3级;(4)表达水平判断标准:0~1级定义为蛋白低表达,2~3级定义为蛋白高表达。同时提取HCC组织mRNA,用建立的方法检测HNF4α mRNA和内参照β-actin,分别将HNF4α mRNA和β-actin mRNA定量水平取lg值后相比,得到肝组织HNF4α mRNA水平(V-4α)。V-4α=[lg(HNF4α mRNA定量水平)]/lg (β-actin mRNA定量水平)。将V-4α水平与免疫组化检测结果0~3对应,从而得到V-4α的阈值。
2 结果
2.1 HNF4α基因cDNA扩增情况取HCC患者外科手术切除的癌旁组织2份(患者A和患者B),提取肝组织总RNA,经特异性引物扩增,获得HNF4αcDNA 1.5 kb产物,其1%TAE鉴定见图1。

图1 HNF4a cDNA扩增产物电泳鉴定
2.2 HNF4α基因cDNA克隆情况取PCR产物鉴定条带位置正确的样本,经胶回收目的片段,蓝白斑筛选(图2A),挑取白色阳性克隆菌落行PCR鉴定(图2B),将菌液送测序、鉴定,结果显示蓝白斑筛选斑点均匀清晰,患者A和患者B分别挑选4个菌斑进行菌落PCR,结果显示克隆基因阳性且位置正确。

图2 目的片段的克隆及鉴定
2.3 检测HNF4α mRNA的荧光定量RT-PCR反应条件的建立及优化情况在PCR管中加入体外转录生成的cRNA 3 μl,作为标准品模板,经多次重复性实验发现,该检测方法最适反应总体积为50 μL,其中模板3 μL;最适的引物浓度为0.2 μmol/L,探针浓度为0.3 μmol/L,Mg2+浓度为3.0 mmol/L,Taq DNA为1.25U,M-MLV逆转录酶为300U,RNase Inhibitor为50 U。PCR反应最适循环参数为42℃5 min,94℃3 min;之后94℃15 s,56℃15 s,72℃30 s,3个预扩增循环;94℃15 s,60℃30 s,40个循环。
2.4 检测HNF4α mRNA和β-actin mRNA标准曲线的建立经梯度稀释的cRNA标准品在扩增后呈现典型的S型扩增曲线,对荧光信号分析显示,在108、107、106、105、104、103、102copies/ml范围内,7个点具有良好的线性关系,斜率为-3.237,相关系数r值达0.994,表明该标准品达到实验要求。将2.5×108copies/ml的β-actin mRNA标准品经稀释为108、106、105、103copies/ml,标准曲线斜率为-3.037,相关系数r值为0.996。以样本的拷贝数对数(X)为横坐标,检测的循环数CT值为纵坐标建立标准曲线,结果见图3,以用于HNF4α mRNA和β-actin mRNA的绝对定量。
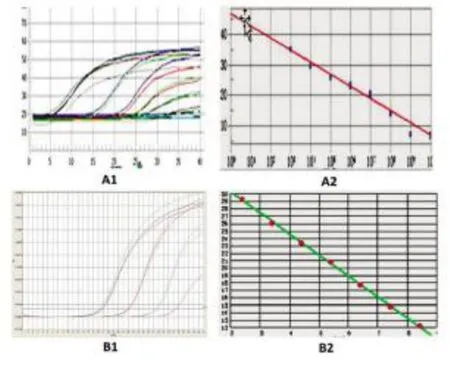
图3 检测HNF4α mRNA和β-actin mRNA的荧光定量PCR扩增曲线和标准曲线
2.5 HCC组织HNF4α蛋白表达情况经免疫组化检测,在16例HCC组织中,发现13例(81.3%)HNF4α蛋白表达阳性,其中0级3例(18.8%),1级6例(37.5%),2级5例(31.3%),3级2例(12.5%,图4)。

图4 HCC组织HNF4α蛋白表达情况(SP,400×)
2.6 HCC组织HNF4α mRNA水平与HNF4α蛋白表达强度的对应比较检测16例HCC组织HNF4α mRNA和β-actin mRNA,按上述方法计算V-4α值。免疫组化检测结果与V-4α值的对应结果为:0级对应V-4α≤0.15;1级对应0.15<V-4α≤0.45;2级对应0.46<V-4α≤0.77;3级对应V-4α>0.77(表2),结果显示HNF4α mRNA定量结果与HNF4α蛋白表达强度结果有一致性的对应关系,但HNF4α mRNA定量结果更快捷,人为主观影响因素更小,为后续大样本分析其对应关系,可能得到更精确的阈值,为临床提供更可靠的诊断支持。

表2 HCC组织HNF4α mRNA水平与HNF4α蛋白表达强度比较
3 讨论
积极寻找预测HCC发生、转移或复发,判断HCC患者预后的肿瘤标志物成为目前HCC研究的重点及热点内容[18]。HNF4α作为一个新的HCC生物标志物,在HCC的诊断,判断肿瘤转移或复发、治疗结果和预后等方面可能具有重要价值。HNF4α在正常肝组织中表达最高,高分化和中分化组织肿瘤HNF4α表达高于低分化肝细胞癌。鉴于HNF4α蛋白只在细胞内表达,临床只能采用免疫组化检测判断HNF4α蛋白在HCC组织中的表达量。我们建立了检测HCC组织HNF4α mRNA的定量方法,通过内参矫正后,可以反映HCC组织HNF4α的表达量。我们随机挑选16例HCC患者检测HNF4α mRNA水平,同时采用免疫组化法检测了HNF4α蛋白表达,经比较两者结果,得到了HNF4α mRNA水平阈值,即0级对应V-4α≤0.15,1级对应0.15<V-4α≤0.45,2级对应0.46<V-4α≤0.77,3级对应V-4α>0.77。这样可以快速判断HCC组织的分化程度,从而获得其生物学性质的判定。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics.Ca Cancer J Clin,2008,58:71-96.
[2]Farazi PA,DePinho RA.Hepatocellular carcinoma pathogenesis: fromgenestoenvironment.NatRevCancer,2006,6(9): 674-687.
[3]Bosch FX,Ribes J,Cleries R,et al.Epidemiology of hepatocellular carcinoma.Clin Liver Dis,2005,9:191-211.
[4]Jiang H,Lucy MC.Involvement of hepatocyte nuclear factor-4 in the expression of the growth hormone receptor 1A messenger ribonucleic acid in bovine liver.Mol Endocrinol,2001,15(6): 1023-1034.
[5]Sladek FM,Zhong WM,Lai E,et al.Liver-enriched transcription factor HNF-4 is a novel member of the steroid hormone receptor superfamily.Genes Dev,1990,4(12b):2353-2365.
[6]Yin C,Lin Y,Zhang X,et al.Differentiation therapy of hepatocellular carcinoma in mice with recombinant adenovirus carrying hepatocyte nuclear factor-4alpha gene.Hepatology,2008,48(5): 1528-1539.
[7]Fan TT,Hu PF,Wang J,et al.Regression effect of hepatocyte nuclearfactor4αonlivercirrhosisinrats.JDigDis,2013,14(6):318-327.
[8]王燕平,贺琪,吴飞,等.Wnt3a对肝星状细胞增殖活化以及转化生长因子β/Smad表达的影响.中华肝脏病杂志,2013,21(2):111-115.
[9]Bagwell AM,Bailly A,Mychaleckyj JC,et al.Comparative genomic analysis of the HNF-4α transcription factor gene.Mol Genet Metab,2004,81(2):112-121.
[10]Watt AJ,Garrison WD,Duncan SA.HNF4:a central regulator of hepatocyte differentiation and function.Hepatology,2003,37(6): 1249-1253.
[11]Chiang JY.Hepatocyte nuclear factor 4α regulation of bile acid and drug metabolism.Expert Opin Drug Metab Toxicol,2009,5(2):137-147.
[12]Ishiyama T,Kano J,Minami Y et al.Expression of HNFs and C/EBP alpha is correlated with immunocytochemical differentiation of cell lines derived from human hepatocellular carcinomas,hepatoblastomas and immortalized hepatocytes.Cancer Sci,2003,94(9):757-763.
[13]Hatziapostolou M.An HNF4α-miRNA inflammatory feedback circuit regulates hepatocellular oncogenesis.Cell,2011,147(6): 1233-1247.
[14]Yue HY,Yin C,Hou JL,et al.Hepatocyte nuclear factor 4 alpha attenuates hepatic fibrosis in rats.Gut,2010,59(2):236-246.
[15]He F,Chen EQ,Liu L,et al.Inhibition of hepatitis B virus replicationby hepatocyte nuclear factor 4-alpha specific short hairpin RNA.Liver Int,2012,32(5):742-751.
[16]何文萍,于东升,年雪,等.HNF4α在非酒精性脂肪肝发生发展中的机制研究.药物生物技术,2016,23(3):213-217.
[17]朱云萌,冯骥良,宋晨朝,等.HBV相关肝癌组织HBsAg和HNF4α表达及其与组织学分化的关系.实用肝脏病杂志,2015,18(5):517-520.
[18]Parkin DM,Bray F,Feriay J,et al.Global cancer statisties,2002.CA Cancer J Clin,2005,55(2):74-108.
(收稿:2016-11-17)
(本文编辑:陈从新)
EstablishmentofRT-PCRforthedetectionofhepatocytenuclearfactor4αinhepatocellular carcinoma
Zhang Wei,Dong Zheng,Kong Huifang,et al.Research Center for Liver Cancer,302nd Hospital,Beijing,100039
ObjectiveTo establish a quantified reverse transcription-polymerase chain reaction(RT-PCR)for the detection of hepatocyte nuclear factor 4α(HNF4α)mRNA in hepatocellular carcinoma tissues.Method Total RNA was extracted from 16 cancerous tissues of patients with hepatocellular carcinoma(HCC).The fulllength cDNA was obtained by RT-PCR and the products was sequenced after TA cloning.Then,the primer and MGB fluorescent probe were designed for HNF4α mRNA quantification.A one-step RT quantitative PCR assay was established and β-actin mRNA acted as internal control.The HNF4aα mRNA levels in the tissues was calculated.The expression of HNF4α protein was also detected in cancerous tissues by immunohistochemical staining.ResultsThequantitativedetectionofHNF4αmRN(V-4α)inHCCtissueswasestablished successfully,and the slope of the standard curve was-3.237 with the correlation coefficient(r)being 0.994.The standard curve of β-actin mRNA was-3.037,and the correlation coefficient(r)was 0.996.The HNF4α mRNA levels were consistent with the HNF4α protein expression in the 16 HCC tissues.ConclusionWe successfully establish a quantitative PCR for the detection of HNF4α mRNA in HCC patients,which warrants further study.
Hepatocellularcarcinoma;Hepatocytenuclearfactor4α;Quantifiedreversetranscriptionpolymerase chain reaction
10.3969/j.issn.1672-5069.2017.03.012
100039北京市解放军第302医院肝脏肿瘤诊疗与研究中心
张伟,男,35岁,硕士研究生,主治医师。主要从事肝癌临床诊治研究。E-mail:yanjiu3369@126.com
荣义辉,E-mail:ryh3021977@hotmail.com

