小鼠脑脊髓炎病毒自然感染调查以及人工感染小鼠试验
袁 文,张 钰,黄碧洪,罗银珠,王 静,潘金春,吴瑞可,郭鹏举,黄 韧
(广东省实验动物重点实验室,广东省实验动物监测所,广州 510663)
研究报告
小鼠脑脊髓炎病毒自然感染调查以及人工感染小鼠试验
袁 文,张 钰,黄碧洪,罗银珠,王 静,潘金春,吴瑞可,郭鹏举,黄 韧
(广东省实验动物重点实验室,广东省实验动物监测所,广州 510663)
目的 了解小鼠脑脊髓炎病毒(TMEV)自然感染情况,探究人工感染TMEV小鼠体内各脏器组织中病毒分布及血清抗体变化。方法 采用酶联免疫吸附试验(ELISA)和荧光定量RT-PCR(qRT-PCR)检测方法对2010年~2015年广东地区采集的SPF级小鼠、开放环境饲养的小鼠以及野生褐家鼠临床样本进行TMEV检测。36只ICR小鼠经脑内接种TMEV BeAn病毒,每天观察动物的临床症状,在接种第0、3、7、10、17、21、31、39、46 天每个时间点分别对3只动物安乐死,剖检并取血清和组织脏器样本进行TMEV检测。结果 SPF级小鼠TMEV抗体阳性率为5.29%(n=2834),核酸阳性率为27.27%(n=457);开放环境饲养的小鼠的抗体和核酸阳性率分别为71.95%(n=82)和53.66%(n=82);野生褐家鼠中核酸阳性率为25.93%(n=27)。TMEV阳性小鼠中仅有两只小鼠表现有明显的临床症状。盲肠内容物、粪便和脑是qRT-PCR检测的最佳选择样本。ICR小鼠脑内接种TMEV BeAn病毒后第3 d可在脑、心脏、肝脏、肺脏和胃中检测到病毒核酸,脾脏、肾脏和盲肠中未检测到病毒核酸。肝脏、心脏、肺脏和胃中的病毒在接种后第10天已完全清除,脑中的病毒一直持续存在到第46天试验结束。小鼠感染后第7天可以检测到抗体,随后抗体水平逐渐升高,接种后17 d抗体阳性率达100%,并一直到46 d都可以维持较高的抗体水平。人工感染小鼠呈隐性感染,临床上并未表现明显症状和眼观病理变化。结论 广东地区实验小鼠和野生褐家鼠均存在TMEV感染,且感染率较高。小鼠接种TMEV BeAn毒株后呈隐性感染,感染小鼠第7天可以产生抗体且持续存在。病毒在感染小鼠肝脏、心脏、肺脏和胃中短时间存在,而在脑中长期存在。qRT-PCR与ELISA两种检测方法具有较好的一致性,qRT-PCR检测方法可作为实验动物国家标准的有力补充。
小鼠脑脊髓炎病毒(TMEV);感染;检测
小鼠脑脊髓炎病毒(Theiler’s murine encephalomyelitis virus,TMEV)属于微RNA病毒科,心病毒属,核酸为负链单股RNA。该病毒主要侵害小鼠中枢神经系统,多数呈隐性感染,感染小鼠不表现临床症状,有时表现脑脊髓炎和后肢麻痹等症状[1]。根据神经毒力不同TMEV分为两个亚群:第一亚群由高毒力毒株组成,以GDVII 株和FA 株为代表,可引起急性致命性脑炎;第二亚群为低毒力毒株,如BeAn株和DA株,可引起持续性中枢神经系统感染,导致单核细胞浸润和脱髓鞘[2,3]。TMEV感染小鼠引起的脱髓鞘疾病与人多发性硬化症(MS)在免疫学和组织病理学方面类似,是研究MS的理想动物感染模型[4]。
TMEV呈世界范围流行,是目前实验小鼠中最常见的一种病毒之一。我国小鼠群的TMEV感染率较高,上世纪90年代报道普通小鼠群中感染率达8~35%[1], 2014年王翠娥等报道实验小鼠中抗体阳性率为15.1%(n=325)[5]。TMEV感染不仅对实验动物本身造成危害,对科研工作也造成潜在干扰,因此,TMEV是实验动物国家标准《实验动物微生物学等级及监测》(GB14922.2-2011)中SPF级小鼠需要排除的病原[6]。
本研究采用酶联免疫吸附试验(ELISA)和荧光定量RT-PCR(qRT-PCR)两种检测方法对2010年~2015年广东地区实验小鼠TMEV流行情况进行调查,并通过脑内接种TMEV感染实验小鼠,对病毒和抗体在人工感染小鼠体内消长规律进行研究,为该病毒的监测、防控及检测方法的应用提供参考依据。
1 材料和方法
1.1 病毒和细胞
TMEV BeAn毒株(ATCC VR-995)和BHK-21细胞(ATCC CCL-10)购自美国典型微生物菌种保藏中心。复苏BHK-21细胞,细胞在含10%胎牛血清(浙江天杭生物科技有限公司)DMEM高糖培养液(Gibco公司,美国)培养3 d~5 d,待细胞长至单层,传代分瓶,分瓶后待细胞长至80%~90%密度,弃去生长液,加入500 μL TMEV病毒液于75 cm2细胞瓶中,37℃、5% CO2培养箱吸附l h,弃去瓶中的病毒液加入无血清的DMEM细胞维持液,37℃、5% CO2培养箱培养3 d~5 d,当细胞病变达“+++ ~ ++++”时,收获细胞培养病毒液,-80℃冻存,反复冻融3次后,3 500 r/min离心30 min去除细胞碎片,留上清即为收获的TMEV病毒液,传代3次,收获的病毒液用qRT-PCR对病毒拷贝数进行定量。
1.2 实验动物
36只,雌性,3周龄,SPF级ICR小鼠购于北京维通利华实验动物有限公司(生产许可证号:SCXK(京)2012-0001),(质量合格证号:11400700121383),动物饲养于广东省实验动物监测所二级生物安全感染实验室内(使用许可证号:SYXK(粤)2012-0122),实行光照/黑暗各12 h昼夜循环,自由进食及饮水。动物实验开展通过广东省实验动物监测所动物使用和管理委员会审批(I-IACUC2015003)。所有小鼠经ELISA检测确定为TMEV抗体阴性。
1.3 临床样本
临床样本来源包括:(1)2010年~2015年广东地区监督检测抽检和委托送检的SPF级活体小鼠、小鼠血清或小鼠粪便,共计2834份。(2)2014年广州市两个开放环境中饲养的小鼠82只。(3)在其中一家开放设施附近捕获的野生褐家鼠27只。无菌采集活体小鼠和野生褐家鼠的血清和盲肠内容物,-20℃保存,血清用于抗体检测,盲肠内容物和粪便用于核酸检测。
1.4 人工感染试验
27只ICR小鼠接种前禁食不禁水过夜,取浓度为1.0×108copies/μL的病毒液,脑内注射病毒液20 μL/只。动物接种病毒后,连续观察46 d,每天观察动物的外观、行为活动、饮食和精神状态等。在接种的第0天取3只动物,以及感染后第3、7、10、17、21、31、39、46天时,随机各取3只动物,每只小鼠腹腔注射0.1 mL 0.1%戊巴比妥钠麻醉,然后摘眼球采血并制备血清,置-20℃冰箱待测抗体。随后,小鼠脱颈椎安乐死,剖检,快速采集心脏、肝脏、脾脏、肺脏、肾脏、脑、胃和盲肠及内容物等样本,置-20℃冰箱待测病毒核酸。9只ICR小鼠单独饲养作为哨兵鼠,在第10、21和31天各取3只哨兵鼠进行抗体和核酸检测。
1.5 血清抗体检测
小鼠血清采用TMEV ELISA抗体检测试剂盒(美国XpressBio公司)进行检测,具体操作步骤按试剂盒说明书进行。
1.6 病毒核酸检测
1.6.1 样本处理和总RNA抽提:每个组织和粪便样本取0.2 g,加入600 μL的PBS缓冲液,再加入6~8粒氧化锆研磨珠,于HerosBio TL2020高通量组织研磨仪(北京鼎昊源科技有限公司)上研磨3 min~5 min,将研磨后匀浆液10 000 r/min离心10 min,取200 μL上清液用核酸抽提试剂盒(TIANamp Viral RNA Kit,天根公司)抽提总RNA,使用DEPC水将总RNA的浓度调整到10 ng/μL。
1.6.2 qRT-PCR:qRT-PCR检测参照本实验室建立检测方法进行操作[7],略有改动。使用PrimeScriptTMRT Master Mix (Perfect Real Time)(Takara公司,大连)将总RNA进行反转录,得到的cDNA采用PremixExTaqTM(Probe qPCR)(Takara公司,大连)进行荧光定量PCR扩增。反应体系为:2×PremixExTaq10 μL、TMEV检测上下游引物终浓度均为0.5 μmol/L,探针终浓度0.4 μmol/L, cDNA 模板2 μL,加RNase Free dH2O至20 μL。反应条件为:95℃ 30 s,一个循环;95℃ 5 s,60℃ 34 s,45个循环,60℃延伸结束后收集荧光。采用TMEV质粒标准品作为参照对样本中的病毒拷贝数进行定量检测。
1.7 数据处理及统计分析
采用SPSS 22.0软件和GraphPad Prim 5软件进行数据处理及统计分析,两种方法检测结果比较采用配对计数资料McNemar法进行一致性检验,用Kappa值进行评价。
2 结果
2.1 小鼠自然感染调查结果
2.1.1 抗体检测结果:抗体检测结果见表1,从表中可知2010年~2015年广东地区SPF级小鼠TMEV抗体阳性率为5.29%(n=2834),而开放环境中饲养小鼠的阳性率为71.95%(n=82)。
2.1.2 核酸检测结果:核酸检测结果见表2,从表中可知2010年~2015年广东地区SPF级小鼠TMEV核酸阳性率为27.35%(n=457),开放环境饲养小鼠的阳性率为53.66%(n=82),而开放设施A附近捕获的野生褐家鼠阳性率为25.93%(n=27)。用检测的上下游引物对其中三份阳性样本进行测序验证,测序结果显示三个样本扩增的基因序列相同,均为84 bp。通过 Genebank上的Blast软件进行序列比对,阳性样本的序列与Genebank上的TMEV毒株(登录号EU718732)的同源性为100%,证明临床样本为TMEV阳性样本。
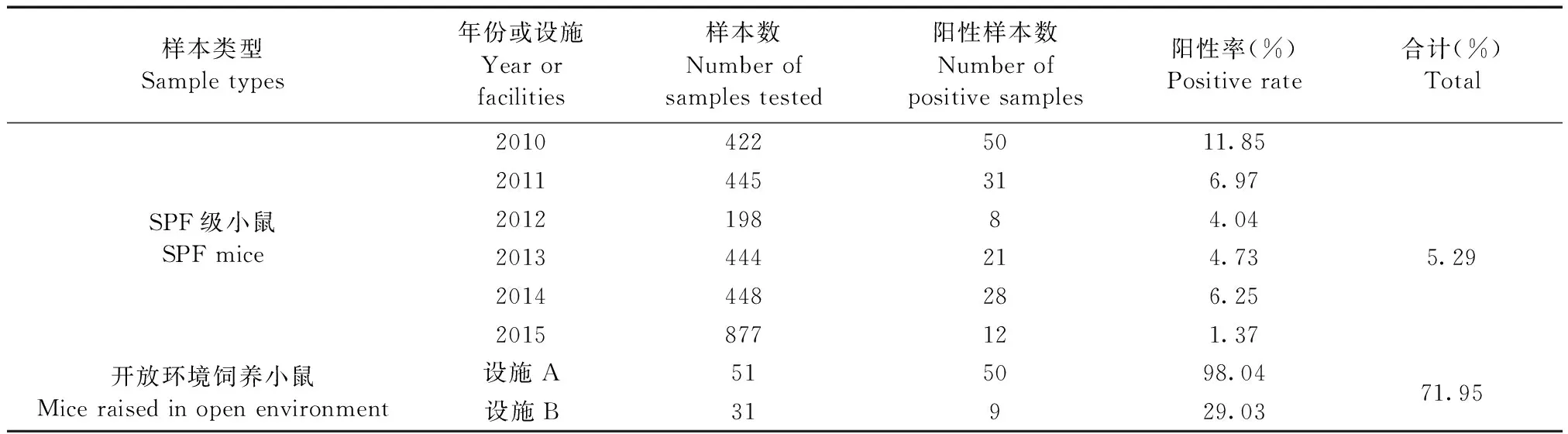
表1 小鼠TMEV抗体阳性率统计
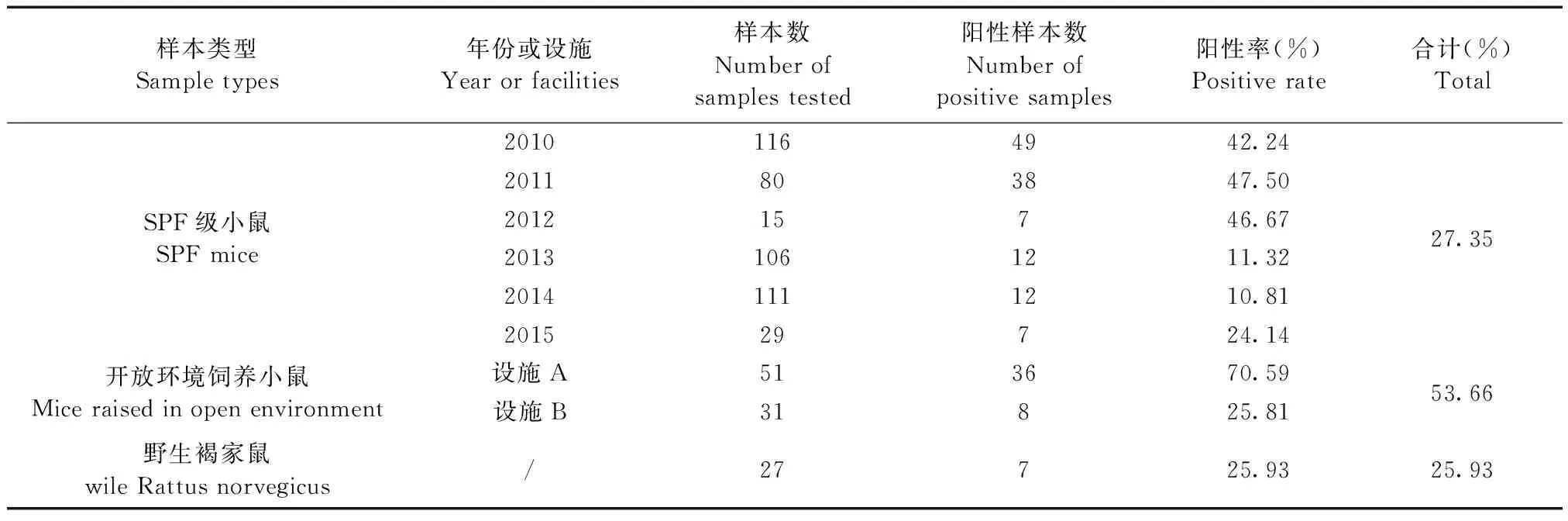
表2 小鼠TMEV核酸阳性率统计
2.1.3 ELISA和qRT-PCR方法比较:采用ELISA和qRT-PCR两种方法对其中一个设施的小鼠进行6年的跟踪检测,该设施 TMEV抗体阳性率和核酸阳性率分别为34.33%和35.32%(n=201),结果见图1。采用配对计数资料McNemar法进行一致性检验,用Kappa值进行评价,统计分析结果表明:以ELISA检测结果为标准,荧光定量PCR结果与其比较,差异无统计学意义(P=0.868),说明两种方法诊断TMEV感染结果一致。两种检测方法吻合系数Kappa=0.605(P=0.000),说明两种检测方法具有较好的一致性(表3)。此外,回顾调查发现该设施检出的TMEV阳性鼠中有2只小鼠有明显的临床症状,其中一只表现为后肢瘫痪,另一只表现为头歪向一侧,并伴有转圈行为,两只小鼠均排除其他病原感染。
2.1.4 TMEV病毒在自然感染小鼠主要脏器中的分布:应用qRT-PCR方法对16只自然感染小鼠粪便、盲肠内容物、脑、脾脏、肝脏、心脏、肺脏、肾脏和胃等主要脏器进行检测,查看TMEV病毒在小鼠体内的分布情况,分析哪些样本是该方法的最佳检测样本。结果发现粪便和盲肠内容物中检出率最高,其次是脑和肝脏,小鼠脾脏、心脏、肺脏、肾脏和胃也可检出TMEV核酸,结果见表4。因此在使用qRT-PCR方法进行TMEV检测时,粪便、盲肠内容物和脑是最佳的待检样本。

表3 ELISA与qRT-PCR检测小鼠临床样本结果比较
注:“+”表示阳性,“-”表示阴性。
Note. “+” represents positive result,“-” represents negative result.
2.2 小鼠人工感染试验
2.2.1 临床观察:ICR小鼠接种TMEV后,外观、行为、饮食和精神状态等都无明显变化,病理剖检无明显眼观病理学变化,小鼠呈现隐性感染状态。
2.2.2 血清抗体滴度变化:小鼠接种TMEV后第7 天开始产生抗体(A值≥0.3为阳性),17 d后抗体阳性率达100%(n=3),抗体水平随着感染时间增加逐渐升高,抗体水平在39 d达到高峰,此后至46 d可一直维持高水平(图2)。
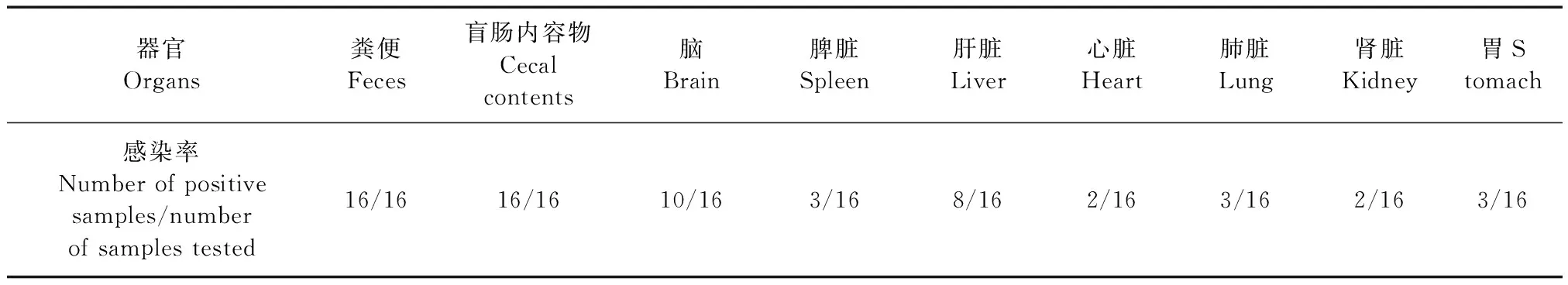
表4 TMEV病毒在自然感染小鼠脏器中的分布
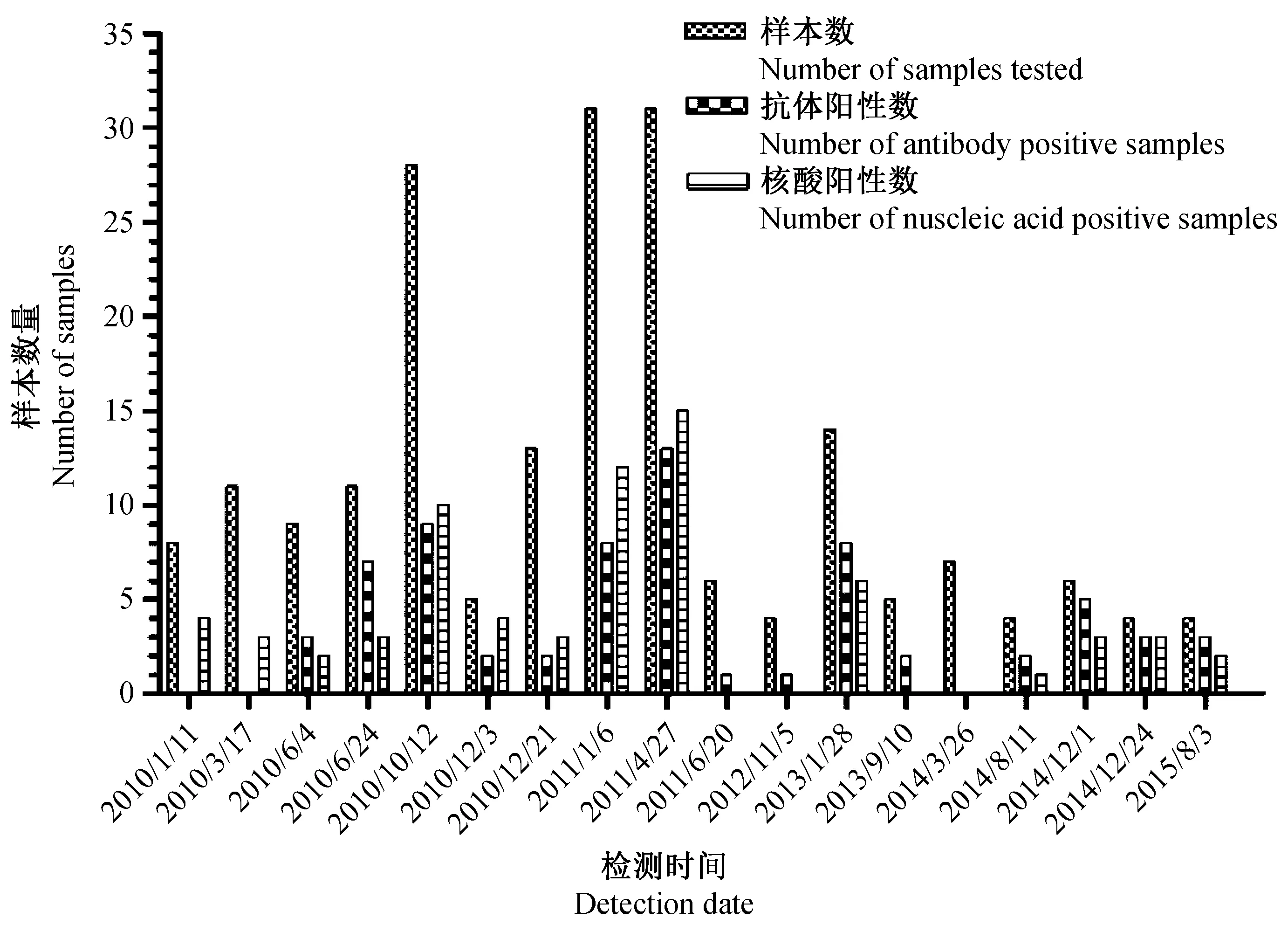
图1 2010~2015年某设施TMEV感染情况Fig.1 The infection of TMEV detected by ELISA and qRT-PCR in one facility from 2010 to 2015
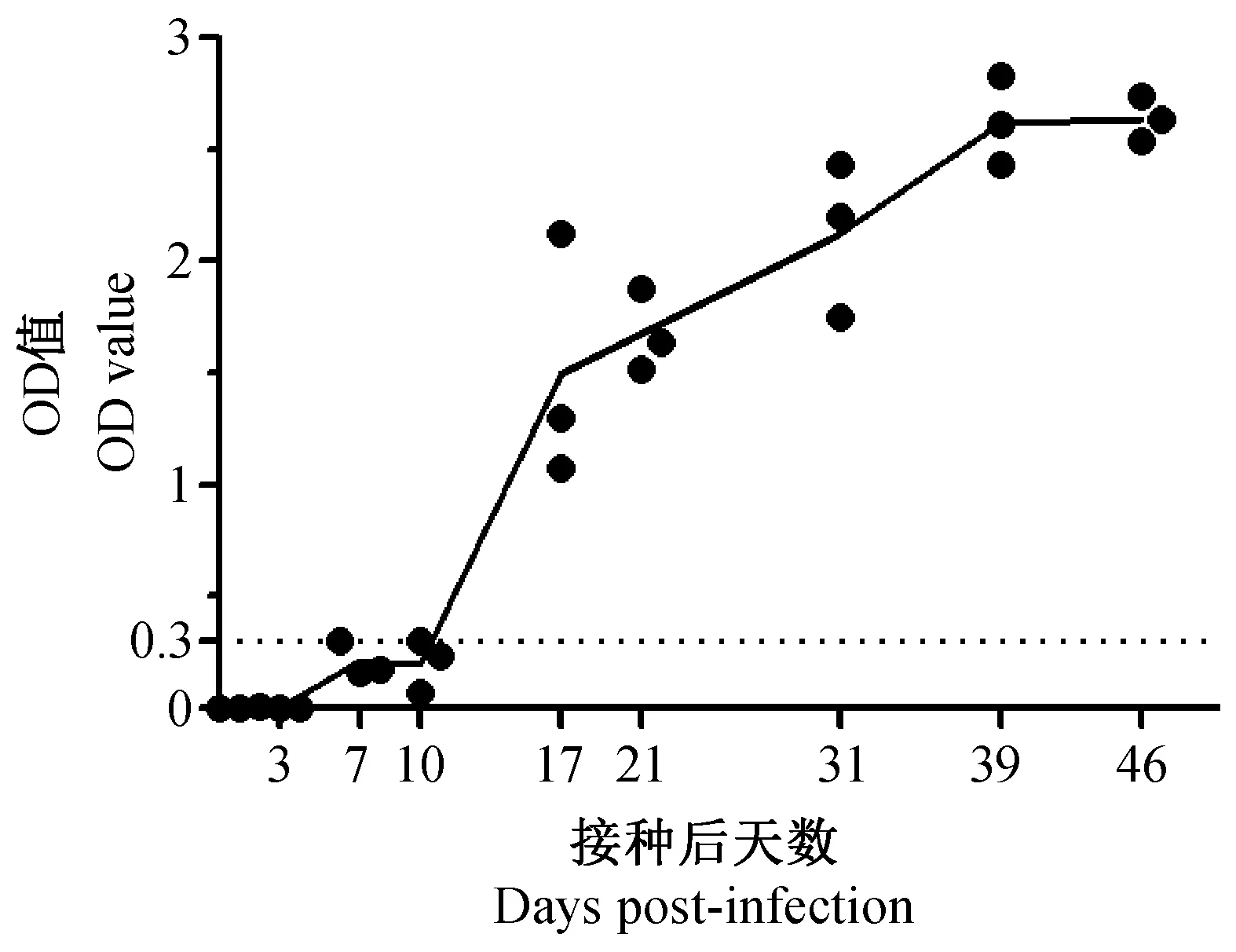
图2 ICR小鼠接种TMEV后血清抗体测定(n=3)Fig.2 Determination of antibody against TMEV in infected mice (n=3)
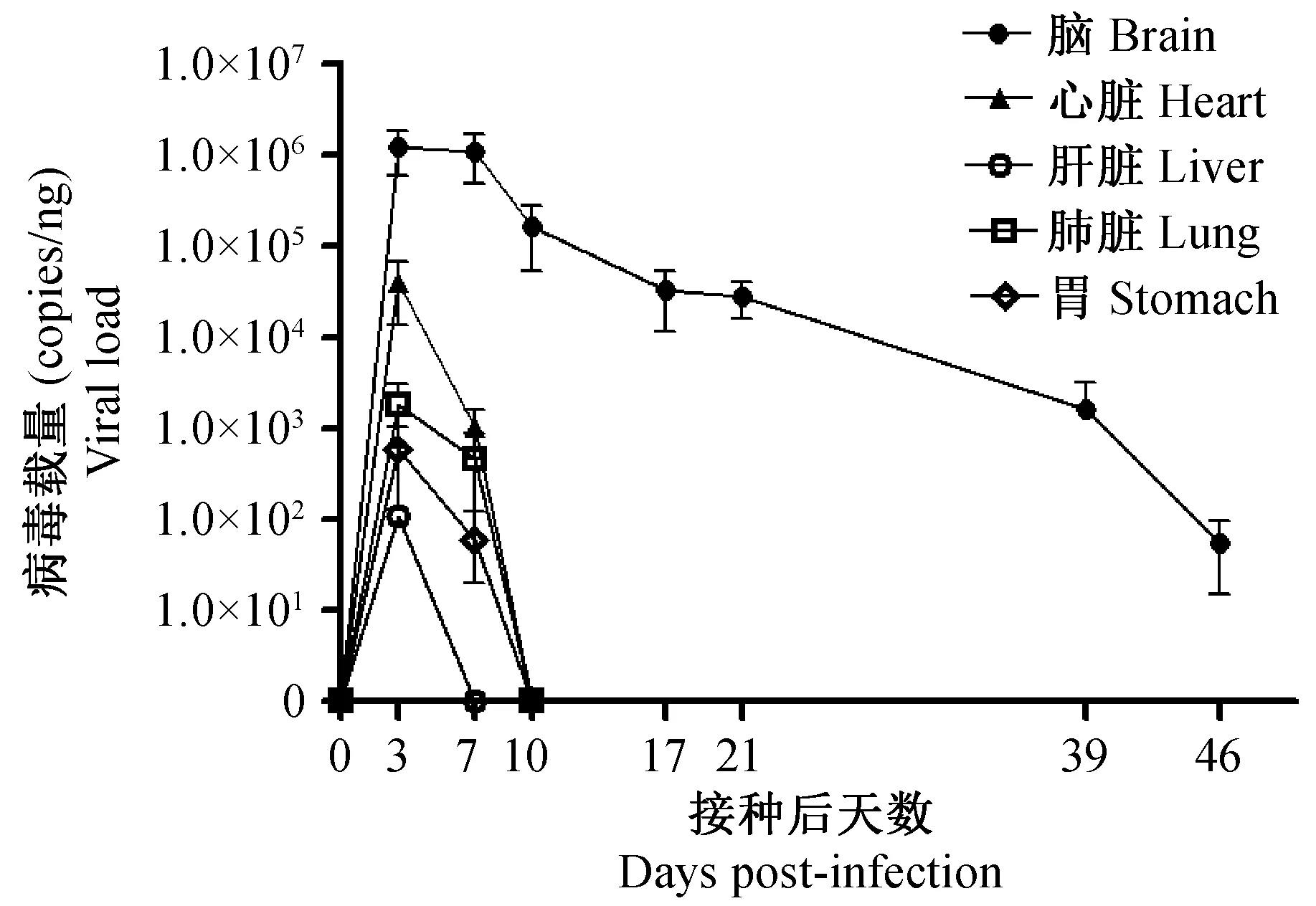
图3 各组织脏器病毒载量(n=3)Fig.3 Viral loads of TMEV in organs and tissues (n=3)
2.2.3 病毒核酸检测结果:由图3可知,小鼠接种病毒后第3天,在脑、心脏、肝脏、肺脏和胃中可检测到病毒核酸,脾脏、肾脏、盲肠中未检测到病毒核酸。接种后第7 天,肝脏中病毒消失,接种后第10天,心脏、肺脏和胃中的病毒消失。脑中的病毒一直持续到第46 天试验结束,病毒载量呈递减趋势。接种后第3 天,各组织脏器的病毒载量高低依次为脑、心脏、肺脏、胃和肝脏。
3 讨论
本研究通过对2010年~2015年广东地区实验小鼠TMEV感染状况进行调查,结果发现SPF级小鼠TMEV抗体阳性率为5.29%(n=2834),核酸阳性率为27.27%(n=457),各年度均有检出,说明广东地区实验小鼠存在TMEV感染,且感染率较高。需要说明的是,本次检测试验中SPF级小鼠核酸检测一般在某一批次的动物抗体检测为阳性之后进行,大部分批次中抗体阴性小鼠未再进行核酸检测,因此,虽然核酸阳性数量(n=125)与抗体阳性数量(n=150)差距不大,但是由于核酸检测的样本总数(n=457)小于抗体检测的样本总数(n=2834),得出的结果是SPF级小鼠TMEV核酸阳性率远大于抗体阳性率。通过回顾性调查发现TMEV感染主要存在于实验动物使用设施,而且发生感染的设施主要又来源于饲养基因工程小鼠的设施,这些设施由于频繁引进基因工程小鼠,又未进行有效的检验检疫,因此将病毒带入设施。有两家实验小鼠生产单位在2010年曾检测出TMEV感染,但通过淘汰感染小鼠、净化环境设施和重新引种后清除了TMEV感染。此外,开放环境饲养的小鼠的抗体和核酸阳性率分别为71.95%和53.66%,远高于屏障环境下饲养的小鼠。已有的研究证明野生小家鼠是TMEV的自然宿主[8],本实验从其中一个开放环境设施附近捕获的野生褐家鼠检出TMEV核酸,证明野生褐家鼠也可以携带TMEV并将病毒传染给实验小鼠。目前,TMEV只是国家标准中SPF级小鼠“必要时”需排除的病原,一些单位可能忽略了TMEV检测,鉴于上述调查结果,我们建议各小鼠生产单位和使用单位应该重视TMEV的监测。
TMEV属于肠道病毒,通过粪-口途径传播,本研究原计划采用低毒力的TMEV BeAn毒株经口接种方式模拟自然感染,但接种多次实验均未获成功,后采用脑内接种方式才获成功。人工感染试验发现ICR小鼠在感染低毒力TMEV毒株后呈隐性感染,临床上并未表现明显症状和眼观病理变化。已有的研究认为通过细胞适应的病毒经脑接种后,病毒可以通过血脑屏障进入外周血循环,最终引起病毒血症和内脏器官感染,其中肠道中的病毒可以长期复制,而外神经系统器官中的病毒在接种后7~14 d即被清除[9]。本实验中小鼠接种病毒后只在脑、心脏、肝脏、肺脏和胃中检测到病毒核酸,脾脏、肾脏和盲肠中未检测到病毒核酸。肝脏、心脏、肺脏和胃中的病毒在接种后第10天已完全清除。病毒在感染小鼠体内的分布与文献报道有一定差异,造成这种差异的原因可能与接种的毒株有关。由于本次人工感染试验研究中病毒不在肠道中复制增殖,小鼠没有通过粪便排毒,进而感染哨兵鼠,因此哨兵鼠的抗体和核酸检测均为阴性。本实验通过脑内接种方式进行TMEV人工感染试验,获得了TMEV在小鼠体内各脏器组织中病毒分布及血清抗体变化情况,为TMEV动物感染模型制作和评价提供了参考。
目前实验动物国家标准中建议的TMEV检测方法主要为血清抗体检测方法,如ELISA和间接免疫荧光试验(IFA)方法等[10]。但血清学检测不适合用于病毒早期感染和免疫缺陷小鼠的诊断,具有一定局限性。以PCR为代表的分子生物学检测方法可以用于病原的直接检测,具有快速、简便、灵敏、特异等优点,已成为病毒感染诊断的重要手段。本研究同时应用ELISA和qRT-PCR两种检测方法对TMEV进行检测分析,自然感染试验中,对其中一设施中的自然感染样本进行了6年跟踪比较检测,结果发现两种检测方法具有较好的一致性,说明两种检测方法均适用于TMEV感染的诊断。此外,从检测结果我们发现,在对部分动物个体进行检测时两种检测方法存在一定差异,其中一个主要原因与动物个体的抗原和抗体消长规律不一致有关,人工感染试验结果也证明这一点;另外一个原因可能与方法的灵敏度有关。然而,在对动物群体进行检测时,两种方法的检测结果一致性较高;而且,两种方法的检测结果可以互为补充,防止阳性动物漏检。因此,在对动物群体进行TMEV监测时,建议综合应用抗体和核酸两种方法同时进行检测,更加有效地对动物健康状态进行评价。
应用qRT-PCR方法对TMEV自然感染小鼠的盲肠内容物、粪便和主要脏器进行检测,结果发现盲肠内容物、粪便和脑中MNV阳性检出率高于其他器官组织。因此在使用qRT-PCR方法进行TMEV检测时,盲肠内容物、粪便和脑是最佳的待检样本。人工感染试验中,小鼠接种TMEV后第7天就可以检测到抗体,之后抗体水平逐渐升高,17 d后抗体阳性率达100%,并一直到46 d都可以维持较高的抗体水平,说明7 d~17 d可作为早期抗体检测时间点。而应用qRT-PCR检测方法可在接种后第3天从多个脏器检出病毒核酸,证实qRT-PCR可以应用于病毒早期感染诊断。国内外研究人员建立了多种PCR检测技术应用于TMEV检测并取得了较好的结果[7,11-13],本研究通过对TMEV自然感染和人工感染临床样本进行综合检测分析,证实qRT-PCR可以有效地应用于TMEV感染诊断,可以作为实验动物国标补充检测方法。
(致谢:感谢本所的何丽芳在动物感染实验中所做的工作。)
[1] 田克恭. 实验动物病毒性疾病 [M]. 北京:中国农业出版社. 1992: 76-83.
[2] Lehrich JR, Arnason BG, Hochberg FH, et al. Demyelinative myelopathy in mice induced by the DA virus [J]. J Neurol Sci, 1976, 29(2-4): 149-160.
[3] Lipton HL. Theiler’s virus infection in mice: an unusual biphasic disease process leading to demyelination [J]. Infect Immunity,1975,11(5): 1147-1155.
[4] Oleszak EL, Chang JR, Friedman H, et al. Theiler’s virus infection: a model for multiple sclerosis [J]. Clin Microbiol Rev, 2004, 17(1): 174-207.
[5] 王翠娥, 陈立超, 周倩, 等. 实验大鼠和小鼠多种病毒的血清学检测结果分析 [J]. 实验动物科学, 2014, 31(2): 20-24.
[6] 国家质量监督检验检疫总局. 实验动物微生物学等级及检测 [S]. GB 14922. 2-2011.
[7] 袁文, 张钰, 王静, 等. 小鼠脑脊髓炎病毒非编码蛋白(UTR)片段实时荧光定量PCR标准品的构建 [J]. 实验动物与比较医学, 2012, 32(1): 1-6.
[8] Lipton H, Kim BS, Yahikozawa H, et al. Serological evidence that Mus musculus is the natural host of Theiler’s murine encephalomyelitis virus [J]. Virus Res, 2001, 76(1): 79-86.
[9] Fox JG. The mouse in biomedical research, 2nd ed [M].. Elsevier, AP, Amsterdam; Boston. 2007: 311-323.
[10] 国家质量监督检验检疫总局.实验动物小鼠脑脊髓炎病毒检测方法 [S]. GB 14926.26-2001.
[11] Bootz F, Sieber I, Popovic D, et al. Comparison of the sensitivity of in vivo antibody production tests with in vitro PCR-based methods to detect infectious contamination of biological materials [J]. Lab Anim, 2003, 37(4): 341-351.
[12] Trottier M, Schlitt BP, Lipton HL. Enhanced detection of Theiler’s virus RNA copy equivalents in the mouse central nervous system by real-time RT-PCR [J]. J Virol Methods, 2002, 103(1): 89-99.
[13] 李晓波, 付瑞, 王吉, 等. 小鼠脑脊髓炎病毒RT-PCR方法的建立及初步应用 [J]. 中国比较医学杂志, 2015, 25(10): 17-20.
Investigation on the natural infection of Theiler’s murine encephalomyelitis virus and study on experimental infection of the virus in mice
YUAN Wen,ZHANG Yu,HUANG Bi-hong, LUO Yin-zhu,WANG Jing,PAN Jin-chun,WU Rui-ke,GUO Peng-ju,HUANG Ren
(Guangdong Key Laboratory of Laboratory Animals,Guangdong Laboratory Animals Monitoring Institute, Guangzhou 510663, China)
Objective To investigate the natural infection of Theiler’s murine encephalomyelitis virus (TMEV) in mice, and to survey the distribution of virus in tissues and the changes of serum antibody in the experimentally TMEV-infected mice. Methods Enzyme linked immunosorbent assay (ELISA) and fluorescence quantitative RT-PCR (qRT-PCR) assay were used to detect the antibody and nucleic acid of TMEV in clinical samples. These samples included SPF mice collected from Guangdong area in 2010-2015, mice obtained from a non-barrier laboratory rodent colony, and wildRattusnorvegicuslive-trapped around the non-barrier laboratory rodent colony. 36 ICR mice were intracerebrally inoculated with TMEV BeAn strain. The clinical signs of the animals were observed daily post-inoculation. Three mice were euthanatized at day 0, 3, 7, 10, 17, 21, 31, 39 and 46 post-inoculation (dpi), respectively. Tissue and serum samples were collected for TMEV detection. Results The TMEV antibody and nucleic acid positive rates of SPF mice collected from Guangdong area in 2010-2015 were 5.29% (n=2834) and 27.27% (n=457), respectively. The TMEV antibody and nucleic acid positive rates of the mice obtained from a non-barrier laboratory rodent colony were 71.95% (n=82) and 53.66% (n=82), respectively. The TMEV nucleic acid positive rate of wildRattusnorvegicuswas 25.93% (n=27). In the TMEV positive mice, only two mice showed obvious clinical symptoms. The cecal contents, feces and brain samples were the best candidates for qRT-PCR assay. The viral nucleic acid could be detected in the brain, heart, liver, lung and stomach of ICR mice at 3 dpi, but no viral nucleic acid was detected in the spleen, kidney, and cecum. The viruses in liver, heart, lungs and stomach were completely cleared at 10 dpi, and the viruses persisted in the brain throughout the experiment. The TMEV antibody could be detected at 7 dpi, and then the antibody positive rate reached 100% at 17 dpi. The antibody level increased gradually and maintained up to 46 days. ICR mice showed latent infection after TMEV inoculation, with no obvious symptoms and eye pathological changes. Conclusions The experimental mice and wildRattusnorvegicusin Guangdong area are both infected with TMEV, and the infection rate is high. The mice inoculated with TMEV BeAn strain show latent infection. The TMEV antibody produced in mice can be detected at 7 dpi and persisted until the end of the experiment. The viruses are found in the liver, heart, lung and stomach for a short time, but are persisted in the brain for a long time. There is a good consistency of TMEV detection between qRT-PCR and ELISA. The qRT-PCR assay can be used as a powerful complement method for the national standard of laboratory animals.
Theiler’s murine encephalomyelitis virus (TMEV);Infection;Detection; PCR; ELISA; Mice; Rats
广东省科技计划项目(2014B070706006,2013B060400028,2014A070705003)。
袁文(1979-),男,助理研究员,研究方向:实验动物病毒学。E-mail:ywen010101@163.com。
黄韧(1959-),男,研究员,主要从事实验动物学的研究。E-mail:labking@sohu.com。
R-33
A
1671-7856(2017) 04-0075-07
10.3969.j.issn.1671-7856. 2017.04.013
2016-11-15

