ICR小鼠下颌第一磨牙牙胚发育的动态组织学观察
董 宁,刘 岩,张田田,阮建平
(陕西省颅颌面精准医学研究重点实验室,西安交通大学口腔医学院口腔预防科,西安,陕西 710004)
研究报告
ICR小鼠下颌第一磨牙牙胚发育的动态组织学观察
董 宁,刘 岩,张田田,阮建平
(陕西省颅颌面精准医学研究重点实验室,西安交通大学口腔医学院口腔预防科,西安,陕西 710004)
目的 了解ICR小鼠下颌第一磨牙牙胚的发育时序特点,为使用小鼠研究牙齿发育机制和相关影响因素提供实验基础。 方法 分别取E(胚胎)11.5、E12.5、E13.5、E14.5、E15.5、E16.5、E17.5和E18.5 d的胎鼠和PN(出生后)2 d的新生小鼠的头部或下颌骨,固定脱钙包埋后行连续切片,进行HE染色,在显微照相系统下进行观察记录,分析ICR小鼠磨牙牙胚发育的动态变化规律。 结果 E11.5 d为牙胚发育始动,E12.5 d牙胚向蕾状期过渡,E13.5 d进入蕾状期,帽状期为E14.5~E15.5 d,钟状期开始于E16.5 d,出生后2 d牙体硬组织开始逐渐形成。结论 ICR小鼠胚胎11 d至出生后第2天是研究下颌第一磨牙牙胚发育机制的最佳时机。
牙齿发育;ICR小鼠;下颌第一磨牙;
牙齿的发育是外胚层来源的上皮细胞及颅神经脊来源的间充质细胞相互作用的结果,因此牙齿是研究上皮-间充质反应的重要器官模型之一,也是研究器官发育分子机制的一个经典模型系统[1]。然而,不同于一般的器官发生,牙齿的形成经历了发育、矿化和萌出3个不同的阶段,其复杂性远远甚于其他组织。从而使人们对其发育机制的了解和认识程度远远低于其他组织。因此,了解ICR小鼠下颌第一磨牙牙胚的发育时序特点,为进一步研究牙齿的发育形成机制和相关影响因素提供模式实验动物就显得尤为重要。
1 材料和方法
1.1 实验动物及实验环境
SPF级鼠龄为4周的ICR小鼠,体重18~20 g,购自于西安交通大学医学部医学实验动物中心[SCXK(陕)2012-003],实验于西安交通大学医学部医学实验动物中心动物房进行[SYXK(陕)2012-005],常规饲食饮水。
1.2 仪器与试剂
SW-CJ-1F超净工作台(苏净安泰,中国苏州);TOMY ES-315型高压蒸汽消毒器(Tomy,日本);石蜡切片机(Leica,德国);恒温培养箱(Memmert,德国);Nikon DXM1200显微照相系统(Nikon,日本)。
多聚甲醛、10% EDTA、无水乙醇、二甲苯、双氧水、氯化钙、碳酸氢钾、碳酸氢钠、磷酸二氢钠、苏木素伊红(HE)染色试剂盒。以上试剂均为国产市售分析纯。
1.3 动物实验
ICR小鼠以雌雄比2:1合笼,观察阴道栓出现的当日中午定为胚胎发育的0.5 d(E0.5),新生鼠鼠龄计算以出生当天中午定为出生后第0.5天 (PN0.5)。对孕鼠分笼饲养,分别取样本为E11.5、E12.5、E13.5、E14.5、E15.5、E16.5、E17.5和E18.5的胎鼠和PN1、PN2的新生小鼠。每组30个样本,分别产自3个不同母体,且保证取材时各组孕鼠生命体征平稳无异常,胎鼠分离后测量头径,组内各标本误差不超过1 mm。孕鼠及新生小鼠脱颈处死后,分离胎鼠头部(E11.5、E12.5、E13.5、E14.5、E15.5)或下颌骨(E16.5、E17.5、E18.5、PN1、PN2)用PBS清洗后置于4%多聚甲醛液中,4℃固定24~48h。梯度脱水,石蜡包埋。E16.5~PN2标本需先经过pH 7的10% EDTA脱钙,隔日换液至完全脱钙(即探针刺穿无阻力)。将石蜡标本,以5 μm厚度进行连续切片,头部标本作冠状切片,下颌骨标本行矢状切片。捞片,60℃烤箱烘干备用;切片预热,经二甲苯脱蜡后,梯度酒精(100%、95%、80%、70%)脱水,流水冲洗5 min,PBS洗3次;行HE染色组织切片。光学显微照相系统观察并记录结果,统计各发育期内不同牙胚形态特征出现的频次,计算百分率。
2 结果
2.1 ICR小鼠下颌第一磨牙牙胚形态学观察
所有的ICR孕鼠均在E19.5d生产,即PN1d。
E11.5:口腔上皮局部增生下陷,形成牙板上皮(图1A)。
E12.5:上皮细胞增殖聚集,牙板上皮进一步增厚,向蕾状期过渡(图1B)。
E13.5:增厚的牙板上皮内陷入间充质,形成上皮蕾,周围有增生的间充质细胞集聚包绕,进入蕾状期(图1C)。
E14.5:上皮蕾继续向间充质中生长,体积增大,上皮基底部向内凹陷,表明牙胚发育开始向帽状期发育(图1D)。
E15.5:牙胚进入帽状期。上皮继续延伸,基底凹陷进一步加深,形如帽子,即为成釉器。成釉器可见三层细胞结构:外釉上皮层、内釉上皮层和星网状层。成釉器中央基底上方可见釉结。下方的间充质细胞形成球形凝聚区,构成牙乳头。外周可见明显的细胞及结缔组织包绕构成牙囊(图1E)。
E16.5:牙胚进入钟状早期。成釉器继续生长,星网状层增厚,其与内釉上皮层之间出现中间层细胞,上皮凹陷更深,其周缘继续生长,上皮转折处为颈环,成釉器形似吊钟,即为钟状期(图1F)。
E17.5:牙胚进入钟状期。上皮继续伸长,颈环结构更加明显,中间层细胞清晰可辨,牙尖处可见继发釉结形成(图1G)。
E18.5:牙冠形态已可辨认,内釉上皮层内陷加深,内釉上皮层极化明显,逐渐变为高柱状,对应牙乳头有间充质细胞层诱导分化为可辨的成牙本质细胞层。未见牙体硬组织产生(图1H)。
PN1(E19.5):牙体硬组织开始分泌形成,牙胚发育进入钟状晚期。内釉上皮细胞向高柱状形态分化成为成釉细胞,中间层更加明显可见。牙尖处可见逐渐发育成熟的成釉细胞和成牙本质细胞开始分泌形成釉基质和前期牙本质(图1J)。
PN2:牙体组织继续形成中。牙冠形态更加清晰可辨,各层结构明确。前期牙本质继续沉积增厚,其上可见薄层牙本质和新生牙釉质,牙尖处尤为明显(图1K)。
2.2 统计分析
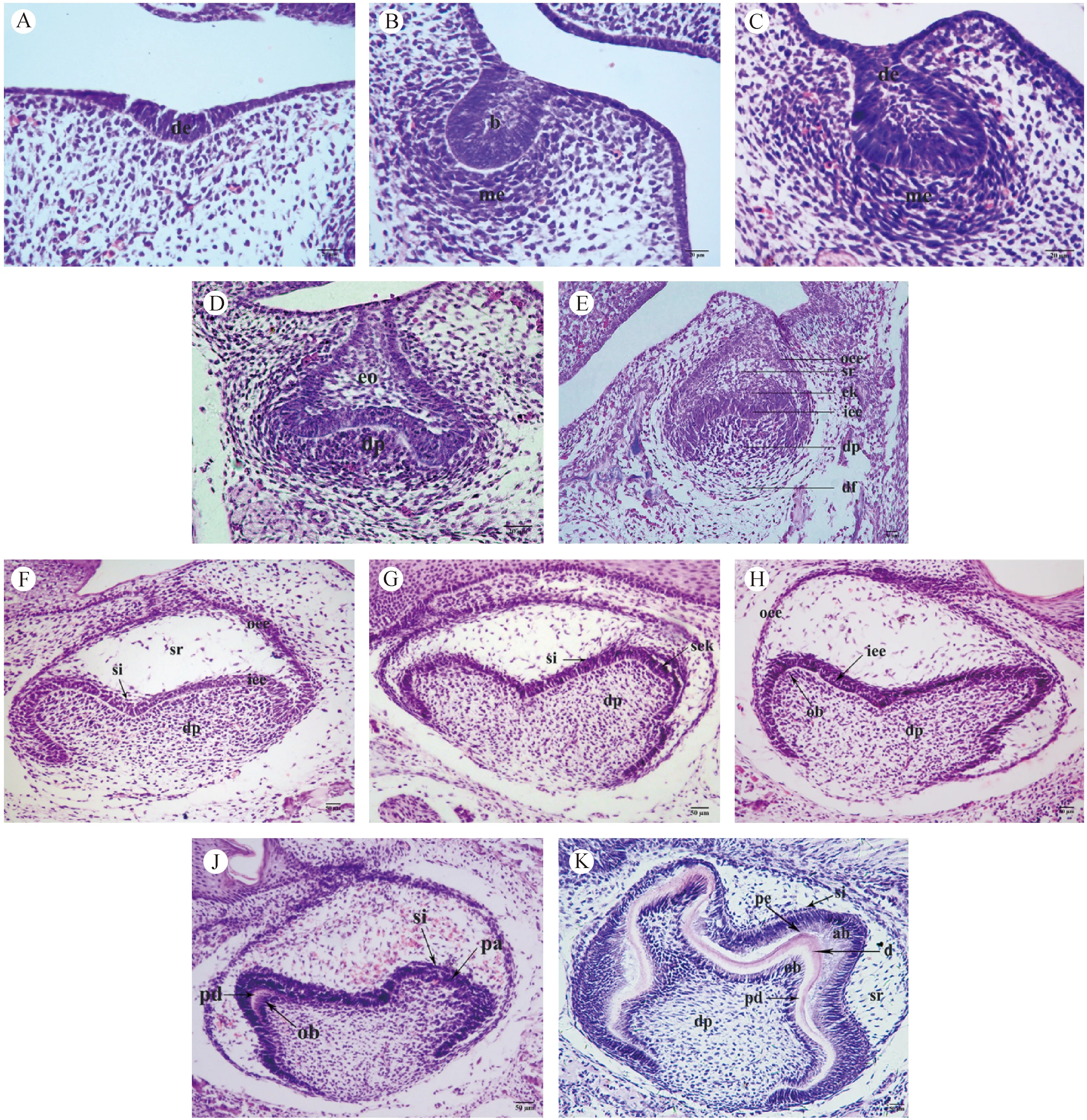
注:A:E11.5牙板上皮增厚、内陷;B:E12.5牙胚向蕾状期发育;C:E13.5进入蕾状期;D:E14.5帽状期;E:E15.5帽状期;F:E16.5钟状早期;G:E17.5钟状期;H:E18.5钟状期;J:PN1(E19.5)钟状晚期;K:PN2进入牙体组织形成期。de,牙板上皮;b,上皮蕾;me,间充质细胞层;eo,成釉器;dp,牙乳头;oee,外釉上皮层;sr,星网状层;ek,釉结;iee,内釉上皮层;df,牙囊;si,中间层;sek,继发釉结;ob,成牙本质细胞;pa,前成釉细胞;pd,前期牙本质;ab,成釉细胞;pe,前期牙釉质;d,牙本质。图1 不同发育阶段ICR小鼠下颌第一磨牙牙胚HE染色形态学观察(A-E标尺=20 μm; F-K标尺=50 μm)Note. A:Proliferation of dental sheet at E11.5;B:Tooth germ developing to bud stage at E12.5;C:Bud stage at E13.5;D:Cap stage at E14.5;E:Cap stage at E15.5;F:Early bell stage at E16.5;G:Bell stage at E17.5;H:E18.5 during bell stage;J:Late bell stage at PN1(E19.5);K:Presence of dentin and enamel at PN2. de,dental epithelium;b,bud;me,mesenchyme;eo,enamel organ;dp,dental papilla;oee,outer enamel epithelium;sr,stellate reticulum;ek,enamel knot;iee,inner enamel epithelium;df,dental follicle;si,stratum intermedium;sek,secondary enamel knot;ob,odontoblasts;pa,pre-ameloblasts;pd,pre-dentin;ab,ameloblasts;pe,pre-enamel;d,dentin.Fig.1 Morphological characteristics of the ICR mouse first mandibular molar tooth germ during developmental stages(A-E, Bar=20 μm; F-K,Bar=50 μm)
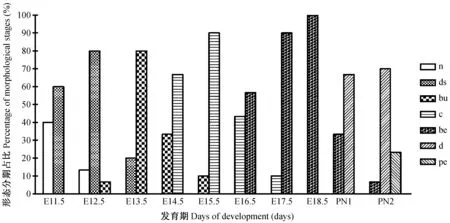
注:n,无改变;ds,牙板;bu,蕾状期;c,帽状期;be,钟状期;d,牙本质;pe,前期牙釉质。图2 各发育期的牙胚形态学特征分布Note. n, none; ds, dental sheet; bu, bud stage; c, cap stage; be, bell stage; d, dentin; pe, pre-enamel.Fig.2 Distribution of morphological features during the first mandibular molar tooth germ development stages of the ICR mouse
对各发育期内观察到的形态学特征进行汇总,以出现频次计算百分比。结果显示(图2),60%的样本在E11.5 d观察到了牙板上皮增厚,可以明确ICR小鼠下颌第一磨牙牙胚发育始动于胚胎11.5d。而80%的样本在E13.5 d观察到蕾状期牙胚形态特征,E14.5 d到E15.5 d组具备帽状期形态特征的样本分别占66.7%和90%。与之类似,一半以上的样本在E16.5 d进入钟状期,并在PN1d到达钟状晚期,开始分泌牙体硬组织(66.7%);而PN2d90%以上的样本观察到牙本质及早期牙釉质的分泌形成。
3 讨论
牙齿的形成是一连续过程,包括三个主要阶段:牙胚的发育、牙体组织形成和牙齿萌出。从口腔外胚层的增厚起始,牙胚发育历经蕾状期、帽状期,最终在钟状期形成牙冠的形态,此阶段为牙胚形态发生完成期;随后牙齿发育进入牙本质及牙釉质等组织分化形成阶段,当牙冠接近发育完全时,牙根开始发生,其间伴随牙周组织逐渐形成,直至萌出后。与其他胚胎器官相似,牙胚的发育也是口腔上皮和外胚间充质之间相互诱导、时序性作用的结果,是一个复杂的、多因素调控的生物学过程[2]。许多生物分子被证实参与了牙胚发育中的细胞分化和牙形态发生的调控,如各种生长因子、粘附分子、转录因子、信号分子、细胞外基质分子等[3-5]。但是关于牙胚发育确切机制的研究仍在深入进行中,这个过程中仍有新的因子不断地被发现报道出来。
发育生物学的基础性研究中,一直采用小鼠牙齿作为动物模型之一来研究上皮-间充质交互反应、组织分化、模式发育等[6]。与小鼠相比,猪、狗乃至猴等大型动物的生理基础和牙齿发育再生模式与人类更为接近,且RETN基因同源性分析结果显示这些大型动物与人类的亲缘关系更近[7]。其中,小型猪不仅被证实为是较为理想的异种移植供体,且在口腔医学研究领域也有应用小型猪建立牙髓坏死模型及颌骨改建方面的研究[8,9]。然而,大型动物昂贵的使用成本、繁殖及研究周期长、基因组信息不完善等缺点使其在基因水平和分子机制研究领域的应用远不及小型啮齿类动物模型应用广泛[10-12]。而小鼠牙胚获取方便、易于基因操控及体外培养,同时可异位移植发育分化为牙齿样器官[13]。更重要的是,尽管与人的牙列不同,但小鼠的磨牙牙胚发育与人类牙齿发育阶段类似,并在发育早期具有相似的分子调控机制和基因表达[14]。证明小鼠磨牙可以被当作研究人类牙齿生理及病理性发育的良好模型,因此确定小鼠磨牙的发育时序对于进一步从分子生物学角度研究牙齿生长发育规律有着重要的意义。然而研究发现不同品系小鼠不仅繁殖能力及行为学表现不同,且主要脏器和器官的重量和长度均存在显著性差异[15,16],ICR小鼠的胃和大脑、心、脾较KM小鼠和NIH小鼠更大[17,18]。在牙齿发育中,不同品系的小鼠其磨牙胚发育阶段亦略有不同[19,20]。ICR小鼠由于其繁殖力强、遗传操控性好等特点,已成为国际上最为通用的实验品系之一。而对ICR小鼠磨牙胚发育的时相规律目前尚未见有报道。
本研究动态观察了ICR小鼠牙胚从开始发育到硬组织形成这一过程的形态学变化。发现ICR小鼠的妊娠期为19.5 d,这与BALB/c近交系小鼠[21]和ICR/Jcl系小鼠[19]的妊娠时间一致,接近于albino系小鼠的20 d[22]。啮齿类动物磨牙发育中首个出现的可观察到的形态学特征是牙板的形成,表现为E11-E12 d出现口腔上皮的局部增厚[23]。实验观察到ICR小鼠在E11.5 d出现上皮增厚,牙胚开始发育,这与BALB/c近交系小鼠和albino系小鼠和Swiss小鼠的E11到E12 d的发育开始时间基本一致[24],而比ICR/Jcl系小鼠的E12.5 d稍早。牙胚的发育始动于上皮与间充质的反应,调控因素非常繁杂,上皮中特异性表达的信号分子Shh、Wnt、BMP等,间充质中转录因子Msx1和Pax9等,以及FGF与BMP信号通路间的拮抗反应都决定着牙胚早期发育的时序和方向[25-27],而不同物种的调控机制不尽相同。联系本研究观察到的结果可以推断,不同品系小鼠之间,其牙胚发育早期涉及的信号调控机制也并不完全相同。随后的发育过程中,牙板上皮不断向内折叠,形成成釉器,而周围包绕细胞不断聚集形成牙齿间充质,二者开始相互诱导促使牙胚不断发育,经历蕾状期、帽状期、钟状期直至发育完成。本实验观察到,ICR小鼠牙胚在E13.5 d处于蕾状期,E14.5 d开始向帽状期过渡;E15.5 d可观察到明显的原发性釉结,显示此时期牙胚进入牙尖形态分化期;E16.5 d进入钟状早期,随着牙胚不断发育,牙尖位置及牙冠形态愈加成型,至钟状晚期,上皮来源的成釉细胞和间充质来源的成牙本质细胞逐渐分化形成并明显分层排列;PN1开始出现硬组织矿化;此结果与BALB/c近交系小鼠和C57小鼠较为一致,而均略早于ICR/Jcl系小鼠(蕾状期E13-E14、帽状期E15~E16、钟状早期E17),可能与时间点的计算方式不同有关。
本实验通过观察ICR小鼠的下颌第一磨牙牙胚动态发育过程,表明:E11.5d为牙胚发育的起始阶段,蕾状期为E13.5,帽状期为E14.5-E15.5,钟状期开始于E16.5,出生后两天牙体硬组织开始逐渐形成,预示着牙胚发生的完成,牙齿发育进入组织形成期。实验结果为将来针对牙胚特定发育时期的研究提供了可靠依据。
[1] Thesleff I. Current understanding of the process of tooth formation: transfer from the laboratory to the clinic [J]. Aust Dent J, 2014, 59 (Suppl 1): 48-54.
[2] Thesleff I. Epithelial-mesenchymal signaling regulating tooth morphogenesis [J]. Cell Sci, 2003, 116: 1647-1648.
[3] Zhang YD, Chen Z, Song YQ, et al. Making a tooth: growth factors, transcription factors, and stem cells [J]. Cell Res, 2005,15: 301-316.
[4] Pispa J, Thesleff I. Mechanisms of ectodermal organogenesis [J]. Dev Biol, 2003, 262: 195-205.
[5] Li L, Yuan G, Liu C, et al. Exogenous fibroblast growth factor 8 rescues development of mouse diastema vestigial tooth ex vivo [J]. Dev Dyn, 2011, 240: 1344-1353.
[6] Thesleff I, Pispa J. The teeth as models for studies on the molecular basis of the development and evolution of organs [M]. In: CM Chuong, RG Landes, eds. Molecular Basis of Epithelial Appendage Morphogenesis. Austin, TX 1998: 157-179.
[7] 鲁帅尧,龙海亭,禹文海,等. 人类与部分实验动物RETN基因同源性分析 [J]. 中国实验动物学报,2012, 20(5): 69-73.
[8] 庞琳琳,张会永,杨关林. 巴马小型猪在医学研究中的应用进展 [J]. 中国实验动物学报,2014, 22(1): 94-98.
[9] 陈华. 小型猪在医学研究领域的应用进展 [J]. 中国实验动物学报,2008, 16(5): 366-367.
[10] Tuker AS, Fraser GJ. Evolution and developmental diversity of tooth regeneration [J]. Semin Cell Dev Biol, 2014, 25-26: 71-80.
[11] 王福, 吴志芳, 李阳, 等.利用大型动物模型研究牙发育及再生的优劣势 [J]. 口腔医学研究,2015, 31(6): 549-554.
[12] 刘新玉,董伟,张连峰. 小鼠的遗传分析技术及疾病模型 [J]. 中国比较医学杂志, 2005(1): 45-47.
[13] Zhang YD, Chen Z, Song YQ, et al. Making a tooth: growth factors, transcription factors, and stem cells [J]. Cell Res. 2005, 15(5): 301-316.
[14] Lan Y, Jia S, Jiang R. Molecular patterning of the mammalian dentition [J]. Semin Cell Dev Biol, 2014, 25-26: 61-70.
[15] 李腾飞,孙秀萍,石哲,等. 不同品系小鼠在三种常见抑郁检测方法中的行为学表现 [J]. 中国比较医学杂志, 2011, 21(8): 20-23.
[16] 殷昆仑,张长勇,王天奇,等. GDF-9和BMP-15在不同品系小鼠中的多态性和生殖能力关联分析 [J]. 中国比较医学杂志, 2013, 23(3): 8-13.
[17] 胡一江,李辉,刘海燕,等. 三个不同品种小鼠主要器官重量及长度的比较 [J]. 中国比较医学杂志, 1997, 7(2): 100-101.
[18] 卢胜明,胡建武,车路平,等. 10种常用SPF级实验大、小鼠体重及主要脏器的测定 [J]. 实验动物科学, 2007, 24(3): 12-16.
[19] Gaete M,Lobos N,Torres-Quitana MA.Mouse tooth development time sequence determination for the ICR/Jcl strain [J]. J Oral Sci, 2004, 46(3): 135-141.
[20] Gaunt, WA. The development of the molar pattern of the mouse (Mus musculus) [J]. Acta Anat (Basel), 1955; 24(3-4): 249-68.
[21] 陈筑, 高波, 李明云. BALB/c小鼠下颌第一磨牙的动态组织学观察 [J]. 贵州医药,2012, 36(9): 776-778.
[22] Cohn SA. Development of the molar teeth in the albino mouse [J]. Am J Anat, 1957, 101: 295-320.
[23] Ruch JV. Tooth morphogenesis and differentiation [M]. In Dentin and Dentinogenesis, A. Linde, ed. (Boca Raton, FL: CRC Press), 1984, pp. 47-79.
[24] Dassule HR, MacMahon AP. Analysis of epithelial-mesenchymal interactions in the initial morphogenesis of the mammalian tooth [J]. Dev Biol, 1998, 202: 215-227.
[25] Chen J, Lan Y, Baek JA, et al. Wnt/beta-catenin signaling plays an essential role in activation of odontogenic mesenchyme during early tooth development [J]. Dev Biol, 2009, 334: 174-185.
[26] Neubüser A, Peters H, Ballings R, et al. Antagonistic interactions between FGF and BMP4 signaling pathways: A mechanism for positioning the sites of tooth formation [J]. Cell, 1997, 90: 147-55.
[27] O’Connell DJ, Ho JW, Mammoto T, et al. A Wnt-bmp feedback circuit controls intertissue signaling dynamics in tooth organogenesis [J]. Sci Signal, 2012; 5(206): ra4.
Establishment of first mandibular molar development of the time sequence in ICR mice
DONG Ning, LIU Yan, ZHANG Tian-tian, RUAN Jian-ping
(Clinical Research Center of Shaanxi Province for Dental and Maxillofacial Diseases, Department of Preventive Dentistry, College of Stomatology, Xi’an Jiaotong University, Xi’an 710004, China)
Objective This study aims to understand the characteristics of the time sequence of ICR mouse first mandibular molar tooth germ development through dynamic observation. Methods Tooth germ of Embryos (E11.5, E12.5, E13.5, E14.5, E15.5, E16.5, E17.5 and E18.5) and postnatal (PN1, PN2) mice were obtained. The heads (E11.5-E15.5) and mandibles (E16.5-PN2) of mice were dissected, fixed and embedded for serial sections and HE staining. All the results were assessed under light microscopy. Results The tooth germ underwent various development stages including the bud, cap and bell stages. Mouse odontogenesis was initiated at E11.5. Proliferation of oral epithelium formed the bud stage at E13.5. Then the cap stage was observed at E14.5- E15.5 and the bell stage was appeared beginning from E16.5. The pre-dentin was observed at PN1, as well as the dentin at PN2. Conclusions Establishing the regular development pattern of the first mandibular molar of ICR mice will provide a reliable basis for the future use in the specific tooth germ developmental research.
Odontogenesis; ICR Mouse; First mandibular molar tooth; Development
陕西省科技计划项目(2015SF-153)。
董宁(1981-),男,研究方向:口腔预防医学。Email: donnin@163.com。
阮建平(1959-),男,研究方向:牙齿发育及氟化物对牙齿的影响。Email: ruanjp@mail.xjtu.edu.cn。
R-33
A
1671-7856(2017) 04-0063-06
10.3969.j.issn.1671-7856. 2017.04.011
2016-11-01

