植物生长调节剂对彩色棉胚珠离体培养纤维发育的影响
张小萌 刘松江 龚文芳 孙君灵 庞保印 杜雄明
植物生长调节剂对彩色棉胚珠离体培养纤维发育的影响
张小萌**刘松江**龚文芳 孙君灵 庞保印 杜雄明*
中国农业科学院棉花研究所 / 棉花生物学国家重点实验室, 河南安阳 455000
天然彩色棉是理想的绿色、环保、健康纺织原料。本研究以棕1-61、RT白絮、绿棉CC28为材料, 采取不同浓度的植物生长调节剂处理胚珠, 在离体培养30 d后观察纤维显色状况, 测量纤维长度并称取胚珠鲜重、纤维干重和胚珠干重。采用新复极差法进行多重比较。结果表明, 水杨羟基肟酸和氟啶酮处理下, 棕色棉和绿色棉纤维颜色均变淡, 且浓度越高颜色越浅; 添加低浓度尿素、氯霉素和芸薹素唑可以使棕色棉显色明显, 但对绿色棉纤维色泽显现影响不大; 添加氯化钴后, 棕色棉纤维色泽变淡, 而对绿色棉纤维色泽影响不大; 另外氯化钴还抑制愈伤组织的生成; 添加苯丙氨酸解氨酶抑制剂或4CL抑制剂后棕色棉和绿色棉纤维颜色变浅, 浓度越高, 颜色越淡; 水杨羟基肟酸、芸薹素唑、氟啶酮、氯化钴、苯丙氨酸解氨酶抑制剂或4-香豆酸辅酶A连接酶(4CL)抑制剂的添加均导致纤维长度、胚珠鲜重、纤维干重和胚珠干重等降低。本文筛选出参与调控彩色棉纤维发育和色素合成的植物生长调节剂, 为彩色棉纤维色泽改良提供一定的理论基础。
彩色棉; 纤维发育; 色素合成; 植物生长调节剂
彩色棉因其棉纤维具有天然色彩, 无需化学印染, 被称为理想的绿色、环保、健康纺织原料。但其产量低、纤维短、色素单调的问题严重制约其广泛种植。前人研究表明, 彩色棉中色素含量与纤维品质有密切关系。董合忠等[1]指出彩色棉中色素物质的存在有可能干扰和影响纤维的伸长、纤维素的合成与纤维素大分子的排列, 最终导致彩色棉纤维品质性状较差及纤维颜色不稳定。同时詹少华等[2]研究证明彩色棉纤维中的色素含量与单铃重和纤维长度呈显著负相关性。因此, 了解并明确彩色棉纤维色素的成分及其形成机理对改善彩色棉纤维品质有重大影响。棕色棉的纤维色素可能为酚类[3]、儿茶素[4-5]或黄酮类化合物[6]。张美玲[7]在棕色棉纤维中检测出的7种化合物以及在绿色棉纤维中检测出的12种化合物都是黄酮类物质。而绿色棉的纤维色素中除黄酮类化合物外, 可能还有木脂素类物质[8]或类似于芦丁的黄酮醇化合物[7]。汪淼等[9]对棕色棉纤维发育不同时期纤维的总黄酮、总酚、缩合单宁、PAL与棕色棉色素含量的相关分析结果表明, 缩合单宁可能是棕色棉色素合成的直接前体物质。Gong等[10]通过转录组研究发现, 棕色棉纤维色素的形成可能是缩合单宁和糖基化的花青素相互作用的结果。彩色棉的纤维发育受到光[11-13]、温度、糖[14]、激素、呼吸抑制剂[15]等多种因素的影响。棉胚珠纤维培养方法最早是由Beasley等[16]创立, 现已成为棉纤维发育研究的有效手段。Shi等[17]报道0.1 μmol L–1乙烯可以促进纤维细胞伸长。Ling等[18]采用不同浓度的ABA对开花当天的胚珠离体培养时发现1 μmol L–1ABA在早期发育阶段促进纤维生长。谭琨岭[19]使用十三吗琳来处理离体培养的胚珠, 可以抑制生长胚珠上的纤维的长度。Pang等[20]发现外源ATP合成酶抑制剂的加入使离体胚珠纤维细胞长度变短, ATP/ADP的比例显著降低。本文主要研究激素合成抑制剂(茉莉酸甲酯合成抑制剂水杨羟基肟酸、油菜素内酯合成抑制剂芸薹素唑、脱落酸抑制剂氟啶酮、乙烯合成抑制剂氯化钴)、类黄酮代谢抑制剂(苯丙氨酸解氨酶抑制剂、4CL专一性抑制剂)对彩色棉纤维发育和色素合成的影响, 另外还从蛋白质合成代谢角度, 选择蛋白质合成促进剂(尿素)和质体蛋白质合成抑制剂(氯霉素)来研究彩色棉纤维发育与蛋白质代谢的相互关系, 从中筛选出参与调控彩色棉纤维发育和色素合成的植物生长调节剂, 为彩色棉纤维色泽改良提供一定的理论依据。
1 材料与方法
1.1 试验材料
选用3个试材, 棕-61 (Z1-61, 棕色棉品系)、RT白絮(RT-White, 白色棉品系)和CC28 (绿色棉品系), 均由国家棉花种质资源中期库提供, 课题组每年自交保存。试验用的植物生长调节剂有吲哚乙酸(indole acetic acid, IAA)、赤霉素(gibberellin, GA3)、茉莉酸甲酯(methyl jasmona, MeJA)和油菜素内酯(brassinolide, BR), 购自阿拉丁(Aladdin Industrial Corporation)。茉莉酸甲酯抑制剂-水杨羟基肟酸(Salicylhydroxamic acid, SHAM)也购自阿拉丁, 芸薹素唑(Brassinazole, BRz)购自Tokyo Chemical Industry (TCI)。PAL抑制剂-对羟基苯甲酸和4CL抑制剂-3,4 (亚甲二氧)肉桂酸均购自北京百灵威科技有限公司, 尿素和氯霉素为国产分析纯, 胚珠离体培养所用试剂购自德国Amresco公司或美国Sigma公司。
1.2 试验方法
1.2.1 胚珠培养 于2014—2015年在中国农业科学院棉花研究所棉花生物学国家重点实验室(安阳)。参考叶春燕等[21]的方法培养胚珠, 将BT培养基[16]分装在100 mL三角瓶中, pH调至5.0, 经高压灭菌(121℃, 20 min)后备用。每瓶加50 mL培养基。每个处理分3组, 每组5瓶, 每瓶接种10~15枚胚珠。在32℃黑暗条件下培养30 d后观察胚珠纤维发育和显色状况。参考徐楚年等[22]的研究进行预试验, 所有处理均添加10.0 μmol L–1的IAA和5.0 μmol L–1的GA3。MeJA、SHAM、BR、BRz、PAL抑制剂、4CL抑制剂都是先配成母液过滤灭菌后备用。
1.2.2 试验设计 激素抑制剂分为茉莉酸甲酯抑制剂、油菜素内酯抑制剂、脱落酸抑制剂和乙烯抑制剂试验。含茉莉酸甲酯抑制剂(SHAM)、茉莉酸甲酯(MeJA)和品种的三因素随机区组设计; 油菜素内酯抑制剂(BRz)、油菜素内酯(BR)和品种的三因素随机区组设计; 脱落酸抑制剂(FLD)和品种的二因素随机区组设计; 乙烯抑制剂(CoCl2)、乙烯(ETH)和品种的三因素随机区组设计。
代谢抑制剂分为苯丙氨酸解氨酶(PAL)抑制剂和4-香豆酸辅酶A连接酶(4CL)抑制剂试验。含PAL抑制剂和品种的二因素随机区组设计; 4CL抑制剂和品种的二因素随机区组设计。
蛋白质合成促进剂和质体蛋白质合成抑制剂试验含蛋白质合成促进剂(尿素)与品种的二因素随机区组设计, 质体蛋白质合成抑制剂(氯霉素)与品种的二因素随机区组设计。
1.2.3 显色情况观察 观察30DPC (培养后的天数)的纤维显色状况, 并照相记录。用Photoshop提取图片前景色多个点的颜色值(RGB), 计算颜色系数P=R/(G+B), 其中, R、G、B分别为红、绿、蓝三基色单位量, 对每个图像随机获取4个P值, 求均值, 将纤维色泽数值化, 数值越大纤维颜色越深。
1.2.4 生理指标的测定 参考徐楚年等[21]的方法。随机取10枚30DPC的胚珠, 置载玻片上, 用高压水流将棉纤维冲直, 用针小心将重叠纤维分离并使其伸展, 直尺测量纤维长度。随机取10枚胚珠, 用滤纸将表面液体吸干, 剥离纤维后用精度为1 mg电子天平称量胚珠鲜重, 3个重复。于85℃将纤维和剥离纤维的胚珠烘至恒重。
1.2.5 统计分析 试验中每个处理的数据均以平均数表示, 采用SAS V9统计分析数据。主要采用新复极差法进行多重比较, 并对颜色系数作方差分析(见附表)。
2 结果与分析
2.1 茉莉酸甲酯合成抑制剂对彩色棉胚珠离体培养纤维发育的影响
由图1-A图可知, 不同浓度茉莉酸甲酯合成抑制剂水杨羟基肟酸处理下, 棕色棉和绿色棉纤维显色均不太明显, 水杨羟基肟酸浓度越高颜色越浅, 分别呈现从浅棕到近白、浅绿到近白的变化, 颜色系数P数值越来越小; 由图1-B图可知, 同等浓度茉莉酸甲酯处理下, 添加抑制剂水杨羟基肟酸后, 棕色棉显色明显变淡, 绿色棉所受影响不大。由表1看出, 纤维长度、胚珠鲜重、纤维干重、胚珠干重均随水杨羟基肟酸浓度的增加而降低, 浓度越高胚珠发育受毒害越严重, 当达到261.20 μmol L–1时, 胚珠死亡(数据未给出)。由表2可见在同等程度的茉莉酸甲酯水平下, 施加水杨羟基肟酸后, 纤维长度、胚珠鲜重、纤维干重和胚珠干重都有所降低。其中纤维长度、胚珠鲜重、胚珠干重降低幅度最为明显。
2.2 油菜素内酯合成抑制剂对彩色棉胚珠离体培养纤维发育的影响
由图2可见, 添加2.5 μmol L–1油菜素内酯抑制剂(BRz)后, 棕色棉纤维颜色加深, 而对绿色棉显色影响不大。在同等程度的油菜素内酯水平下, 施BRz后, 纤维长度、胚珠鲜重、纤维干重和胚珠干重明显降低(表3)。
A: 水杨羟基肟酸处理; B: 茉莉酸甲酯和水杨羟基肟酸处理。
A: SHAM treatment; B: MeJA and SHAM treatments.CK: 0 μmol L–1SHAM; S1: 3.26 μmol L–1SHAM; S2: 6.53 μmol L–1SHAM; S3: 32.65 μmol L–1SHAM; S4: 65.30 μmol L–1SHAM; S5: 130.60 μmol L–1SHAM;MS1: 0 μmol L–1MeJA+0 μmol L–1SHAM; MS2: 0 μmol L–1MeJA+20 μmol L–1SHAM; MS3: 0 μmol L–1MeJA+40 μmol L–1SHAM; MS4: 40 μmol L–1MeJA+0 μmol L–1SHAM; MS5: 40 μmol L–1MeJA+20 μmol L–1SHAM; MS6: 40 μmol L–1MeJA+40 μmol L–1SHAM.

表1 水杨羟基肟酸处理对彩色棉胚珠离体培养纤维发育的影响
标有不同字母的值在0.05水平差异显著。Values followed by different letters are significantly different at the 0.05 probability level.
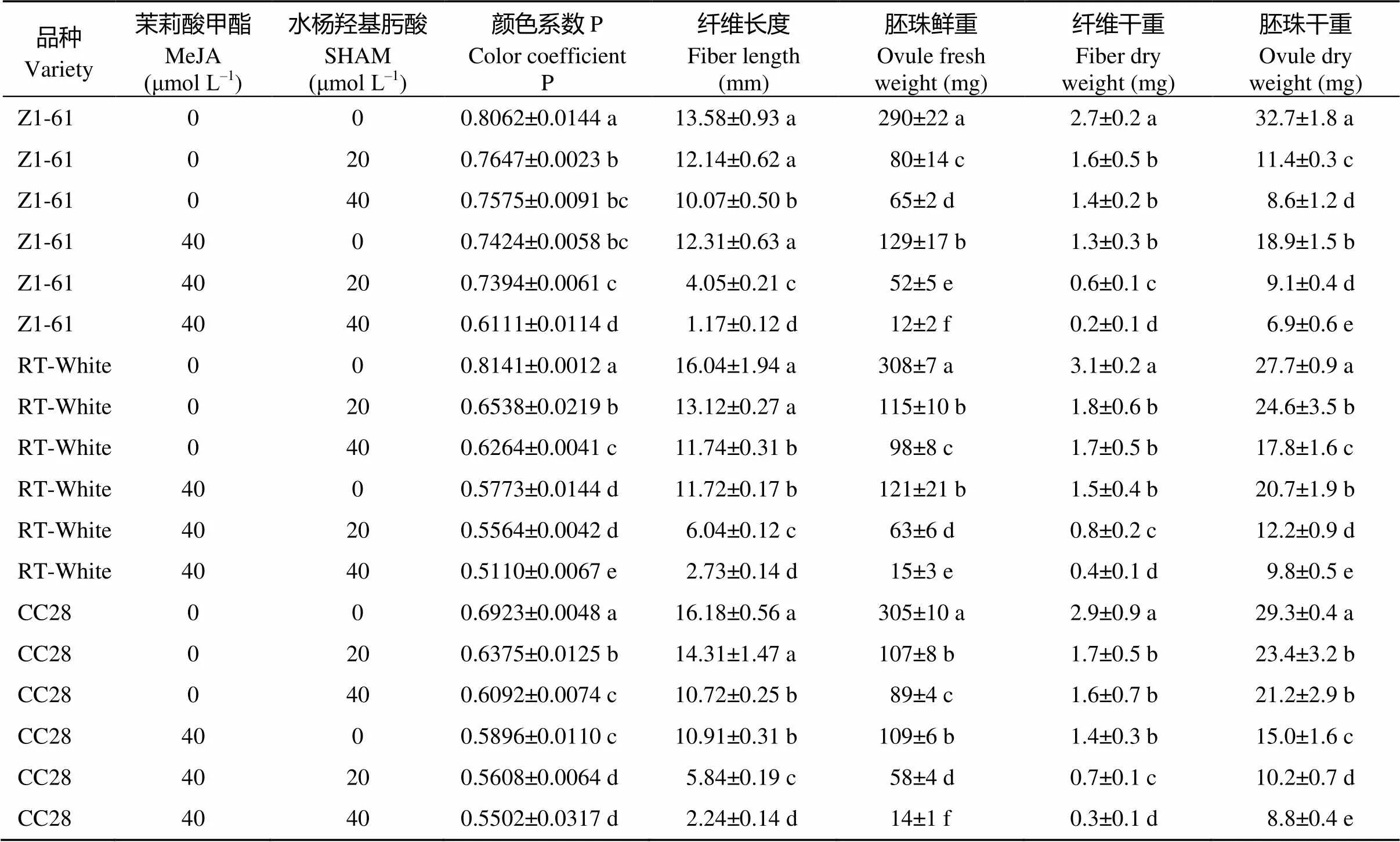
表2 茉莉酸甲酯抑制剂对彩色棉胚珠离体培养纤维发育的影响
标有不同字母的值在0.05水平差异显著。Values followed by different letters are significantly different at the 0.05 probability level.
Z1: 0 μmol L–1BR+0.0 μmol L–1BRz; Z2: 0 μmol L–1BR+2.5 μmol L–1BRz; Z3: 0 μmol L–1BR+5.0 μmol L–1BRz; Z4: 5 μmol L–1BR+0.0 μmol L–1BRz; Z5: 5 μmol L–1BR+2.5 μmol L–1BRz; Z6: 5 μmol L–1BR+5.0 μmol L–1BRz.
2.3 脱落酸合成抑制剂对彩色棉胚珠离体培养纤维发育的影响
由图3可见, 脱落酸合成抑制剂氟啶酮处理下, 胚珠发育和纤维色泽均受到影响。氟啶酮浓度越高, 越不利于胚珠发育, 纤维颜色变浅。根据表4可见, 当氟啶酮(FLD)浓度为1 μmol L–1时, 棉纤维长度达最大值, Z1-61、CC28分别比自身对照增加12.67%和1.98%, 差异显著(<0.05), 超过此浓度时, 棉纤维长度、胚珠鲜重等指标都明显降低。
2.4 乙烯合成抑制剂对彩色棉胚珠离体培养纤维发育的影响
由图4可知, 加入乙烯抑制剂后胚珠发育和纤维显色均受到影响。当只加5 μmol L–1ETH时, 产生愈伤组织, 但当同时加入乙烯和乙烯抑制剂氯化钴后, 就不再产生愈伤。当乙烯浓度相同的情况下, 氯化钴浓度越高, 纤维越短, 达到0.5 mmol L–1时纤维很短, 无法测量。胚珠鲜重、胚珠干重等指标也随浓度增加而降低(表5)。
2.5 类黄酮代谢抑制剂对彩色棉胚珠离体培养纤维发育的影响
图5表明, 添加PAL抑制剂和4CL抑制剂后棕色棉和绿色棉纤维颜色变浅, 浓度越高, 颜色越淡, 胚珠和纤维发育也受到抑制, 胚珠和纤维长度随着抑制剂浓度的增加而降低(表6和表7), 添加抑制剂后纤维变短, 基本不着生纤维或在胚珠表面有短绒。
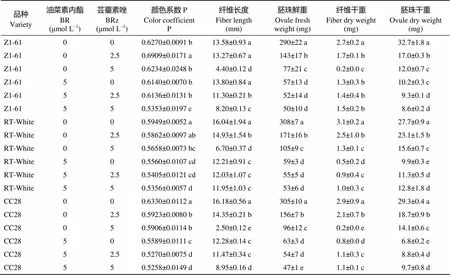
表3 BR与BRz处理对彩色棉胚珠离体培养纤维发育影响
标有不同字母的值在0.05水平差异显著。
Values followed by different letters are significantly different at the 0.05 probability level.

表4 氟啶酮处理对彩色棉胚珠离体培养纤维发育的影响
标有不同字母的值在0.05水平差异显著。
Values followed by different letters are significantly different at the 0.05 probability level.
CK: 0 μmol L–1FLD; F1: 1 μmol L–1FLD; F2: 5 μmol L–1FLD; F3: 10 μmol L–1FLD.
2.6 蛋白质合成促进剂对彩色棉胚珠离体培养纤维发育的影响
由图6-A可见, 只有当尿素浓度为5 g L–1时棕色纤维颜色变深, 且随着浓度的增加, 颜色逐渐变浅, 而绿色纤维色泽受尿素浓度影响不大。由表8可见, 当尿素浓度为5 g L–1时纤维最长, Z1-61、RT白絮和CC28均比自身对照分别增加22.22%、6.00%和3.80%, 差异显著。且纤维长度、胚珠鲜重、纤维干重和胚珠干重随着尿素浓度的增加而降低。
G1: 0 μmol L–1ETH+0 mmol L–1CoCl2; G2: 0 μmol L–1ETH+0.1 mmol L–1CoCl2; G3: 0 μmol L–1ETH+0.2 mmol L–1CoCl2; G4:0 μmol L–1ETH+0.5 mmol L–1CoCl2; G5:5 μmol L–1ETH+0 mmol L–1CoCl2; G6: 5 μmol L–1ETH+0.1 mmol L–1CoCl2; G7: 5 μmol L–1ETH+0.2 mmol L–1CoCl2; G8: 5 μmol L–1ETH+0.5 mmol L–1CoCl2.
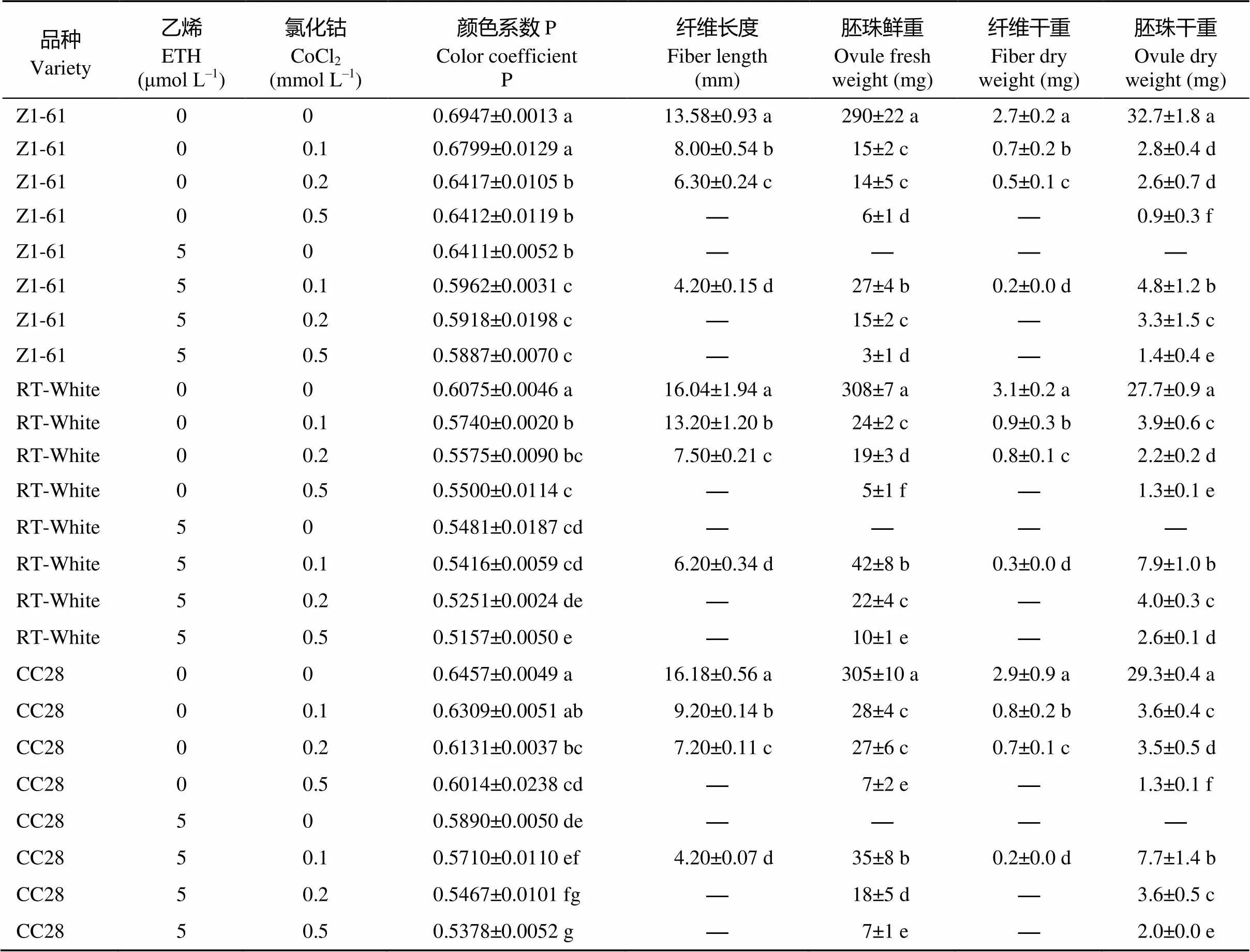
表5 乙烯抑制剂对彩色棉胚珠离体培养纤维发育的影响
标有不同字母的值在0.05水平差异显著。
Values followed by different letters are significantly different at the 0.05 probability level.
A: PAL抑制剂处理; B: 4CL抑制剂处理。
A: PAL inhibitor treatment; B: 4CL inhibitor treatment. CK: 0 μmol L–1PAL inhibitor; N1: 5 μmol L–1PAL inhibitor; N2: 15 μmol L–1PAL inhibitor; N3: 25 μmol L–1PAL inhibitor; N4: 50 μmol L–1PAL inhibitor; CK: 0 μmol L–14CL inhibitor; W1: 5 μmol L–14CL inhibitor; W2: 15 μmol L–14CL inhibitor; W3: 25 μmol L–14CL inhibitor; W4: 50 μmol L–14CL inhibitor.
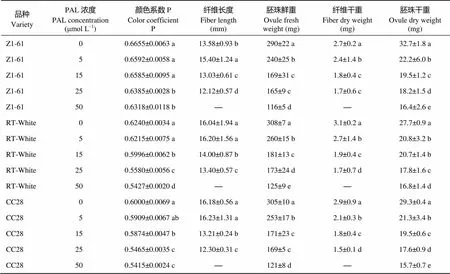
表6 PAL抑制剂处理对彩色棉胚珠离体培养纤维发育的影响
标有不同字母的值在0.05水平差异显著。
Values followed by different letters are significantly different at the 0.05 probability level.
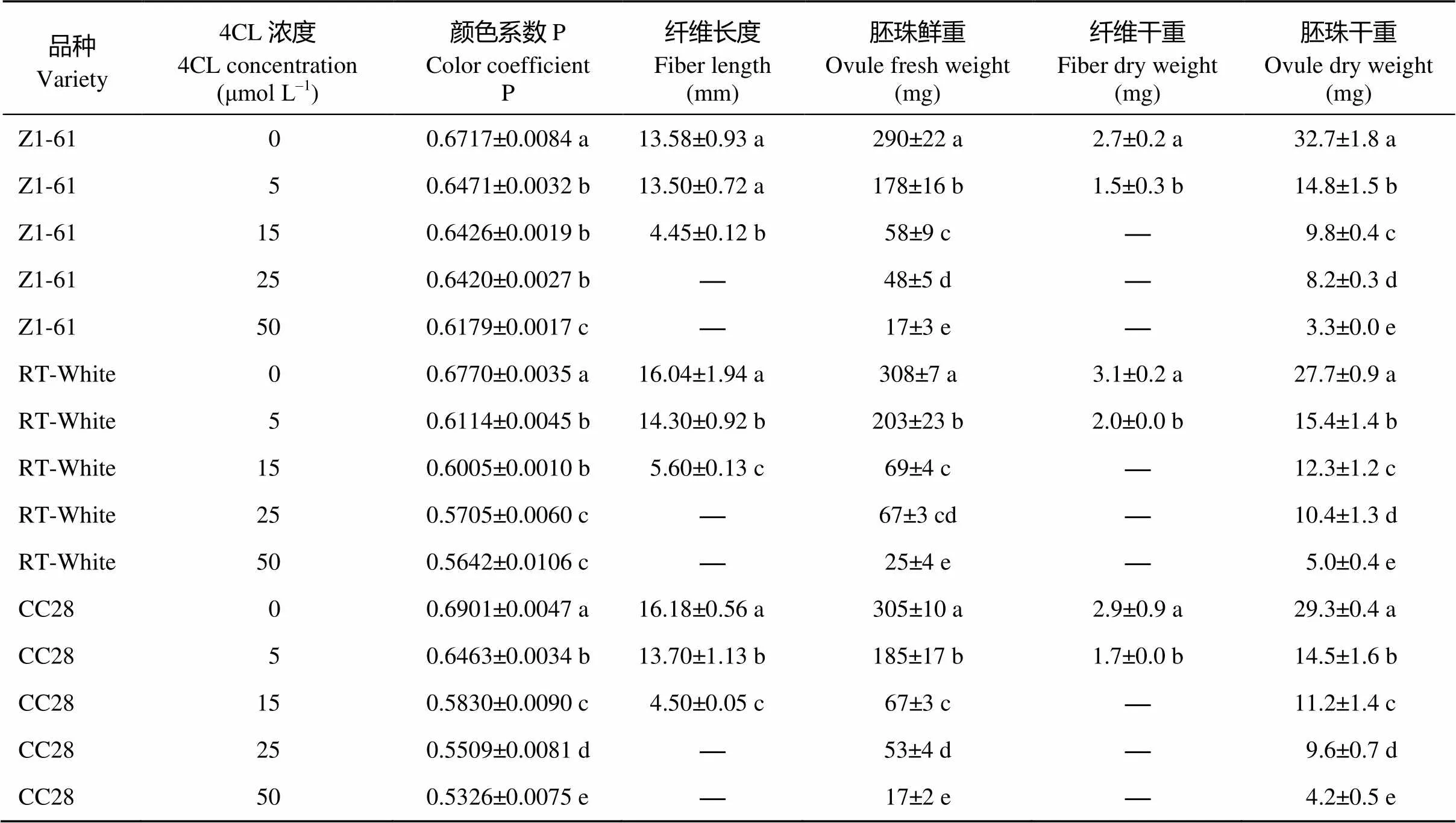
表7 4CL抑制剂对彩色棉胚珠培养纤维发育的影响
标有不同字母的值在0.05水平差异显著。
Values followed by different letters are significantly different at the 0.05 probability level.
2.7 质体蛋白质合成抑制剂对彩色棉胚珠离体培养纤维发育的影响
由图6-B可见, 当氯霉素浓度为1 mg L–1时, 棕色纤维颜色变深, 随着浓度的增加, 颜色逐渐变浅, 绿色纤维颜色基本无变化。由表9可知而纤维长度在1 mg L–1时达到最大值, 其中Z1-61、RT白絮和CC28纤维长度比自身对照分别增加24.08%、10.35%和5.81%, 差异显著(< 0.05)。随着氯霉素浓度增高, 纤维长度、胚珠鲜重、纤维干重和胚珠干重等指标均呈降低趋势。
A: 尿素处理; B: 氯霉素处理。A: urea treatment; B: chloramphenicol treatment.
CK: 0 g L–1urea; U1: 5 g L–1urea; U2: 10 g L–1urea; U3: 20 g L–1urea. CK: 0 mg L–1chloramphenicol; Chl1: 1 mg L–1chloramphenicol; Chl2: 5 mg L–1chloramphenicol; Chl3: 10 mg L–1chloramphenicol.

表8 尿素处理对彩色棉胚珠离体培养纤维发育的影响
标有不同字母的值在0.05水平差异显著。
Values followed by different letters are significantly different at the 0.05 probability level.

表9 氯霉素处理对彩色棉胚珠离体培养纤维发育的影响
标有不同字母的值在0.05水平差异显著。
Values followed by different letters are significantly different at the 0.05 probability level.
综上所述, 添加适宜浓度的油菜素内酯合成抑制剂(2.5 μmol L–1)、尿素(5 g L–1)、氯霉素(1 mg L–1)均有利于棕色棉纤维显色, 而对绿色棉纤维颜色无明显影响。其中在适宜浓度的尿素(5 g L–1)、氯霉素(1 mg L–1)培养条件下, 棉纤维长度均达到最大值。添加其他抑制剂均可造成棉纤维颜色变浅, 纤维长度、胚珠鲜重、纤维干重和胚珠干重等指标降低。
3 讨论
3.1 植物生长调节剂抑制剂对彩色棉胚珠离体培养纤维发育和纤维色素合成的影响
茉莉酸甲酯(MeJA)、油菜素内酯(BR)、脱落酸(ABA)和乙烯(ETH)都是广泛存在于植物体内的生长调节物质。国内外已经有许多关于茉莉酸及其衍生物作为外源诱导子应用于植物次生代谢的报道[23-24]。这是由于MeJA可以激活次生代谢产物合成途径, 导致功能基因或转录因子的过量表达, 而这些受到MeJA高度调节的功能基因或转录因子大都是途径上的关键酶基因, 过量表达的关键酶基因打破了目标产物合成途径上的瓶颈反应, 使得代谢更多地向目标产物合成的方向流动, 最终过量积累目标产物[25]。马杰等[26]研究表明MeJA处理可有效提高鲜切莴苣和鲜切甘蓝苯丙氨酸解氨酶(PAL)活性, 同时提高次生代谢产物如总酚、类黄酮以及木质素的含量, 证明茉莉酸甲酯作为外界信号分子可诱导并激活苯丙烷代谢途径。内源JAs产量的提高也会导致植物中相应代谢产物的积累, 与单纯加强代谢途径中单一或若干步骤的表达相比, JA生物合成途径的基因工程操作可能是一个更加有效的方法, 能够全面调控目标化合物的合成。谷晓策[27]通过过量表达茉莉酸甲酯生物合成途径中重要的关键酶-丙二烯氧化物环化酶(AOC)和茉莉酸羧甲基转运酶(JMT), 提高了丹参的次生代谢产物丹参酮的含量, 并且发现过量表达异源和内源基因能够产生同样的效果。植物中高水平的SHAM 可诱导香豆素[28]、类胡萝卜素[29]等多种羟基苯甲酸和羟基苯丙烯酸衍生物的合成。本研究通过添加茉莉酸甲酯合成抑制剂(SHAM)来调控MeJA的产量, 结果显示, 随着SHAM浓度的增加, 棕色棉颜色变浅, 胚珠鲜重、纤维干重和胚珠干重等都有所下降, 当SHAM浓度达到40 mg L–1时, 胚珠死亡。这从反方向证明MeJA在棕色棉纤维色素合成和纤维发育过程中的关键作用。JAs的信号转导途径在植物界中广泛存在, 并且MeJA合成途径上的基因被大量克隆, 这些基因的功能域非常保守。因此可以通过对茉莉酸合成途径上一个限速步骤的遗传改造, 提高内源MeJA合成, 以达相关次生代谢途径合成能力提高的目的, 从而改良彩色棉的色泽和纤维品质。
油菜素内酯可以在细胞水平上诱导植物发生一系列复杂的生理效应, 其最显著的作用是可以诱导细胞伸长和细胞分裂。黄婕[30]研究提出了BR促进次生代谢产物紫草宁合成的一种机制, 即BR调控紫草宁合成中重要酶类的酶活性, 调节紫草宁合成中前体物质的供给和分流, 最终促进紫草宁的合成。淦庆雷[31]进一步发现BR的这种促进作用是通过钙信使发生作用的, 与钙离子及钙调蛋白密切相关, 同时提出改变膜的通透性是BR改变离子通道促进紫草宁合成的另一种机制。刘松江等[32]研究发现高浓度BR影响茉莉酸信号转导而抑制纤维伸长发育。本研究则发现一定浓度的内源油菜素内酯抑制剂可有助于棕色棉显色, 而对纤维伸长发育起抑制作用。从反向印证了油菜素内酯在棕色棉纤维发育中的关键作用。
任杰和冷平[33]研究表明外源ABA能促进内源ABA的合成和乙烯的释放, 提高甜樱桃果实的成熟度和花青苷含量, 促进果实软化。方荣俊等[34]研究表明在一定浓度范围内, 乙烯对植物次生代谢产物的合成起促进作用, 低于或超过该浓度范围则起抑制作用。刘金等[35]研究表明乙烯启动并调控早熟苹果成熟期花青苷的积累, 可能是通过调控UFGT酶的活性。本研究表明脱落酸合成抑制剂(FLD)和乙烯抑制剂(CoCl2)处理均对胚珠和纤维发育不利。从反向证明脱落酸和乙烯可能对纤维次生代谢物质合成有促进作用。
3.2 类黄酮代谢抑制剂对彩色棉胚珠离体培养纤维发育的影响
有关黄酮类化合物的生物合成途径主要集中在以苯丙氨酸为前体的黄酮化合物的代谢途径。作为苯丙烷类代谢过程中的关键酶, 苯丙氨酸解氨酶(PAL)联系着植物初级代谢和次级代谢, 它催化苯丙氨酸生成反式肉桂酸, 是苯丙烷类代谢的限速酶。而4-香豆酸辅酶A连接酶(4CL)催化反式-4香豆酸生成香豆酰CoA, 随后进入类黄酮代谢过程。Srinivasan等[36]指出外加代谢抑制剂阻断法是研究次级代谢途径的一种可靠方法。目前关于类黄酮代谢抑制剂的研究较少。李贺勤等[37]采用PAL酶专一性抑制剂(AOA)和4CL酶专一性抑制剂(MDCA)处理野葛愈伤后发现, AOA处理显著抑制以苯丙氨酸为前体的异黄酮化合物的合成, MDCA处理导致其前体物质的积累。本研究中发现PAL抑制剂和4CL抑制剂的添加显著抑制棕色棉和绿色棉纤维伸长和色素合成, 证实了彩色棉色素成分中黄酮类物质的存在。
3.3 蛋白质合成促进剂和质体蛋白质合成抑制剂对彩色棉胚珠离体培养纤维发育的影响
梁颖等[38]用蛋白质合成促进剂-尿素和质体蛋白质合成抑制剂-氯霉素处理甘蓝型油菜植株发现, 尿素可以显著提高种皮蛋白质含量, 降低色素含量, 而氯霉素可降低种皮蛋白质含量, 使种皮色泽变深。而本文研究发现用5 g L–1尿素或1 mg L–1氯霉素处理时, 棕色纤维颜色变深, 纤维长度增加, 且浓度越高颜色越浅, 纤维长度、胚珠鲜重等指标均降低。说明适宜浓度的蛋白质含量可以促进彩色棉纤维伸长和色素合成。
4 结论
茉莉酸甲酯抑制剂从反向印证了茉莉酸甲酯在棕色棉纤维伸长和色素合成过程中的关键作用; 油菜素内酯抑制剂也从反向揭示出BR在棉胚珠发育和纤维伸长中的作用; 脱落酸合成抑制剂和乙烯抑制剂处理均对胚珠和纤维发育不利, 从反向证明脱落酸和乙烯可能对纤维次生代谢物质合成有促进作用; 苯丙氨酸解氨酶(PAL)专一性抑制剂和4-香豆酸辅酶A连接酶(4CL)抑制剂的添加显著抑制棕色棉和绿色棉纤维发育和色素合成, 证实了彩色棉色素成分中黄酮类物质的存在; 适宜浓度蛋白质含量促进彩色棉纤维伸长和色素合成。
References
[1] 董合忠, 李维江, 唐薇, 张冬梅. 彩色棉纤维发育与色素形成. 中国棉花, 2004, 31(2): 2–4 Dong H Z, Li W J, Tang W, Zhang D M. Pigment synthesis and cotton fiber development of color cotton., 2004, 31(2): 2–4 (in Chinese)
[2] 詹少华, 林毅, 蔡永萍, 文汉. 天然棕色棉色素分布规律及色素合成与纤维发育的关系. 棉花学报, 2006, 18(3): 170–174 Zhan S H, Lin Y, Cai Y P, Wen H. The pigment distribution regulation of the natural brown cotton and relations between pigment synthesis and cotton fiber development., 2006, 18(3): 170–174 (in Chinese with English abstract)
[3] 詹少华, 林毅, 蔡永萍, 李正鹏. 天然棕色棉纤维色素光谱学特性及其化学结构初步推断. 植物学通报, 2007, 24: 99–104 Zhan S H, Lin Y, Cai Y P, Li Z P. Preliminary deductions of the chemical structure of the pigment brown in cotton fiber., 2007, 24: 99−104 (in Chinese with English abstract)
[4] Ryser U, Meier H, Holloway P J. Identification and localization of suberin in the cell walls of green cotton fibres (L., var. green lint)., 1983, 117: 196–205
[5] 胡超, 杨园园, 郭宁, 蔡永萍, 林毅, 高俊山, 姜家生. 棕色棉与白色棉缩合单宁单体儿茶素动态变化的比较. 植物生理学报, 2011, 47: 685–690 Hu C, Yang Y Y, Guo N, Cai Y P, Lin Y, Gao J S, Jiang J S. Comparison of dynamic changes in condensed tannin monomer catechins between brown cotton and white cotton., 2011, 47: 685–690 (in Chinese with English abstract)
[6] 赵向前, 王学德. 天然彩色棉纤维色素成分的研究. 作物学报, 2005, 31: 456–462 Zhao X Q, Wang X D. Composition analysis of pigment in colored cotton fiber., 2005, 31: 456–462 (in Chinese with English abstract)
[7] 张美玲. 彩色棉纤维分化发育规律与色素成分研究. 山东农业大学博士学位论文, 山东泰安, 2013 Zhang M L. Exploration of Fiber Differentiation and Development and Pigment Component in Colored Cotton. PhD Dissertation of Shandong Agricultural University, Tai’an, China, 2013 (in Chinese with English abstract)
[8] Schmutz A, Buchala A J, Ryser U. Changing the dimensions of suberin lamellae of green.fibers with a specific inhibitor of the endoplasmic reticulum-associated fatty acid elongases., 1996, 110: 403–411
[9] 汪淼, 陈沙沙, 蔡永萍, 林毅, 孙旭, 郭宁, 高俊山, 姜家生. 光质对棕色棉纤维色素形成的影响. 棉花学报, 2013, 25: 329–333Wang M, Chen S S, Cai Y P, Lin Y, Sun X, Guo N, Gao J S, Jiang J S. Effect of light quality on pigment formation in brown cotton fiber., 2013, 25: 329–333 (in Chinese with English abstract)
[10] Gong W F, He S P, Tian J H, Sun J L, Pan Z E, Jia Y H, Sun G F, Du X M. Comparison of the transcriptome between two cotton lines of different fiber color and quality., 2014, 9: e112966
[11] Waghmare V N, Koranne K D. The present situation, problems and future potential of the colored cotton cultivation., 2000, 19: 6
[12] 王学德, 李悦有. 彩色棉纤维发育的特性研究. 浙江大学学报(农业与生命科学版), 2002, 28: 237–242 Wang X D, Li Y Y. Study on characteristics of colored cotton fiber development.(Agric Life Sci), 2002, 28: 237–242 (in Chinese with English abstract)
[13] 潘兆娥, 杜雄明, 孙君灵, 周忠丽, 庞保印. 遮光对彩色棉的色泽及纤维品质的影响. 棉花学报, 2006, 18: 264–268 Pan Z E, Du X M, Sun J L, Zhou Z L, Pang B Y. Influences of boll shading on fiber color and fiber quality of colored cotton., 2006, 18: 264–268 (in Chinese with English abstract)
[14] 袁淑娜. 彩色棉纤维发育特性以及基于细胞质雄性不育的彩色长绒棉育种研究. 浙江大学博士学位论文, 浙江杭州, 2009 Yuan S N. Studies on Characteristics of Colored Cotton Fiber Development and Breeding for Colored Cotton with Long Fiber Based on Cytoplasmic Male Sterility System. PhD Dissertation of Zhejiang University, Hangzhou, China, 2009 (in Chinese with English abstract)
[15] Yuan S N, Malik W, Hua S J, Bibi N, Wang X D.inhibition of pigmentation and fiber development in colored cotton.(Ser B), 2012, 13: 478–486
[16] Beasly C A, Ting I P. The effects of plant growth substances onfiber development from fertilized cotton ovules., 1973, 60: 130–l39
[17] Shi Y H, Zhu S W, Mao X Z, Feng J X, Qin Y M, Zhang L, Cheng J, Wei L P, Wang Z Y, Zhu Y X. Transcriptome profiling molecular biological and physiological studies reveal a major role for ethylene in cotton fiber cell elongation., 2006, 18: 651–664
[18] Ling F, Lü M, Ni Z Y, Hu W R, Wang J. Digital image analysis of expansion growth of cultured cotton ovules with fibers and their responses to ABA, 2011, 47: 369–374
[19] 谭琨岭. 菜油凿醇和谷菌醇对棉花纤维发育的影响. 西南大学硕士学位论文, 重庆, 2009 Tan K L. The Function of Campesterol and Sitosterol for the Cotton Fiber Development. MS Thesis of Southwest University, Chongqing, China, 2009 (in Chinese with English abstract)
[20] Pang Y, Wang H, Song W Q, Zhu Y X. The cotton ATP synthase δ1 subunit is required to maintain a higher ATP/ADP ratio that facilitates rapid fiber cell elongation.(Stuttg), 2010, 12: 903–909
[21] 叶春燕, 欧婷, 陈进红, 何秋伶, 祝水金. 培养基、胚龄和激素配比对棉花胚珠离体培养纤维生长发育的影响. 棉花学报, 2013, 25: 17–23 Ye C Y, Ou T, Chen J H, He Q L, Zhu S J. Effect of medium, ovule age, and hormone combinations on the fiber growth and development of cotton ovule culture., 2013, 25: 17–23 (in Chinese with English abstract)
[22] 徐楚年, 董合忠. 棉纤维发育与棉胚珠培养纤维. 北京: 中国农业大学出版社, 2006 Xu C N, Dong H Z. Fiber Growth and Development of Cotton Ovule Culture. Beijing: China Agricultural University Press, 2006 (in Chinese)
[23] Chen J Y, Wen P F, Kong W F. Effect of salicylic acid on phenylpropanoids and phenylalan in ammonialyase in harvested grapeberries., 2006, 40: 64–72
[24] Wolski E A, Henriouez M A, Adaml R. Induction of defense genes and secondary metabolites in saskatoons (Nutt.) in response to Entomosporium mespili using jasmonic acid and Canada milkvetch extracts., 2010, 68: 273–282
[25] Vom Endt D, Soarese Silva M, Kijne J W, Pasquali G, Memelink J. Identification of a bipartite jasmonate-responsive promoter element in the Catharanthus roseus ORCA3 transcription factor gene that interacts specifically with AT-Hook DNA-binding proteins., 2007, 144, 1680
[26] 马杰, 胡文忠, 毕阳, 姜爱丽, 萨仁高娃. 茉莉酸甲酯处理对鲜切莴苣和甘蓝苯丙烷代谢的影响. 食品工业科技, 2013, 34: 333–335 Ma J, Hu W Z, Bi Y, Jiang A L, Sarengaowa. Effect of MeJA treatments on benzene propane metabolism in tissues of fresh-cut lettuce and cabbage., 2013, 34: 333–335 (in Chinese with English abstract)
[27] 谷晓策. 基于改造茉莉酸甲酯生物合成途径的丹参次生代谢工程新策略. 第二军医大学硕士学位论文, 上海, 2011 Gu X C. Novel Stratage of Secondary Metabolic Engineering in-Based on the Reform of MeJA Biosynthetic Pathway. MS Thesis of Second Military Medical University, Shanghai, China, 2011 (in Chinese with English abstract)
[28] Elwanm W M, Elhamahmym A M. Improved productivity and quality associated with salicylic acid application in green house pepper., 2009, 122: 521–526
[29] Vitseva O, Varghese S, Freedman J E. Grape seed and skin extracts inhibit platelet function and release of reactive oxygen intermediates., 2005, 46: 445–451
[30] 黄婕. 油菜素内酯(BR)和IAA、BAP互作影响滇紫草细胞次生代谢及其生化机制研究. 南京大学硕士学位论文, 江苏南京, 2001 Huang J. BR and IAA, BAP Interactions Influence the Secondary Metabolism ofCell and Its Biochemical Mechanism Research. MS Thesis of Nanjing University, Nanjing, China, 2001 (in Chinese with English abstract)
[31] 淦庆雷. 油菜素内酯影响滇紫草培养细胞中天然产物合成的分子机制研究. 南京大学硕士学位论文, 江苏南京, 2004 Gan Q L. Molecular Mechanism for Biosynthesis of the Natural Products Affected by Brassinolide inCultured Cells. MS Thesis of Nanjing University, Nanjing, China, 2004 (in Chinese with English abstract)
[32] 刘松江, 龚文芳, 孙君灵, 庞保印, 杜雄明. 生长物质对彩色棉胚珠离体培养纤维发育的影响. 中国农业科学, 2015, 48: 2127–2142 Liu S J, Gong W F, Sun J L, Pang B Y, DU X M. Effects of growth substances on the fiber growth and development of color cotton ovule culture., 2015, 48: 2127–2142 (in Chinese with English abstract)
[33] 任杰, 冷平. ABA和乙烯与甜樱桃果实成熟的关系. 园艺学报, 2010, 37: 199–206 Ren J, Leng P. Role of Abscisic acid and ethylene in fruit maturation of sweet cherry., 2010, 37: 199–206 (in Chinese with English abstract)
[34] 方荣俊, 赵华, 廖永辉. 乙烯对植物次生代谢产物合成的双重调控效应. 植物学报, 2014, 49: 626–639 Fang R J, Zhao H, Liao Y H. The dual regulation effect of ethylene on plant secondary metabolites synthesis., 2014, 49: 626–639 (in Chinese with English abstract)
[35] 刘金, 魏景立, 刘美艳. 早熟苹果花青苷积累与其相关酶活性及乙烯生成之间的关系. 园艺学报, 2012, 39: 1235–1242 Liu J, Wei J L, Liu M Y. The relationships between the enzyme activity of anthocyanin biosynthesis, ethylene release and anthocyanin accumulation in fruits of precocious apple cultivars., 2012, 39: 1235–1242 (in Chinese with English abstract)
[36] Srinivasan V, Ciddi V, Bringi V. Metabolic inhibitors, elicitors, and precursors as tools for probing yield limitation in taxane production bycell cultures., 1996, 12: 457–465
[37] 李贺勤, 杨华, 张娟娟, 宛晓春, 方从兵. PAL和4CL酶专一性抑制剂处理对野葛异黄酮生物合成的影响. 热带作物学报, 2009, (1): 47–52 Li H Q, Yang H, Zhang J J, Wan X C, Fang C B. The influence of PAL and 4CL enzyme specific inhibitor treatment on kudzu isoflavone biosynthesis., 2009, (1): 47–52 (in Chinese with English abstract)
[38] 梁颖, 李加纳. 甘蓝型油菜种皮色泽形成与相关酶及蛋白质含量的影响. 中国农业科学, 2004, 37: 522–527 Liang Y, Li J N. Relationship of the color formation and related enzymes and protein content of the spermoderms in., 2004, 37: 522–527 (in Chinese with English abstract)
附表1 处理对彩色棉胚珠离体培养纤维颜色系数影响的方差分析结果
Supplementary table 1 Variance analysis for fiber color coefficient of ovule culturein colored cotton

处理Treatment变异来源Source of variation自由度df平方和SS均方MSF值F-valueP值P-value 水杨羟基肟酸SHAM品系Variety20.02700.0135101.60P < 0.0001 处理间Treatment50.09800.0196147.80P < 0.0001 品系×处理Variety× treatment100.00680.00075.10P < 0.0001 误差Residual540.00720.0001 茉莉酸甲酯MeJA品系Variety20.23320.1166787.20P < 0.0001 处理间Treatment50.31950.0639431.50P < 0.0001 品系×处理Variety× treatment100.06590.006644.47P < 0.0001 误差Residual540.00800.0001 BR与BRz品系Variety20.03930.0196126.80P < 0.0001 处理间Treatment50.07260.014593.83P < 0.0001 品系×处理Variety× treatment100.02350.002415.21P < 0.0001 误差Residual540.00840.0002 氟啶酮FLD品系Variety20.02440.012286.01P < 0.0001 处理间Treatment30.03320.011177.87P < 0.0001 品系×处理Variety× treatment60.03700.006243.48P < 0.0001 误差Residual360.00510.0001 乙烯抑制剂ETH inhibitor品系Variety20.10340.0517505.10P < 0.0001 处理间Treatment70.10230.0146142.80P < 0.0001 品系×处理Variety× treatment140.00470.00033.31P = 0.0004 误差Residual720.00740.0001 PAL抑制剂PAL inhibitor品系Variety20.06790.0339867.60P < 0.0001 处理间Treatment40.03210.0080205.40P < 0.0001 品系×处理Variety× treatment80.00410.000513.18P < 0.0001 误差Residual450.00180.0000 4CL抑制剂4CL inhibitor品系Variety20.02380.0119346.20P < 0.0001 处理间Treatment40.08840.0221644.10P < 0.0001 品系×处理Variety× treatment80.02150.002778.35P < 0.0001 误差Residual450.00150.0000 尿素Urea品系Variety20.18450.09231502.00P < 0.0001 处理间Treatment30.02340.0078126.90P < 0.0001 品系×处理Variety× treatment60.00480.000812.90P < 0.0001 误差Residual360.00220.0001 氯霉素Chloramphenicol品系Variety20.07680.0384264.50P < 0.0001 处理间Treatment30.00730.002416.74P < 0.0001 品系×处理Variety× treatment60.00410.00074.73P = 0.0012 误差Residual360.00520.0001
Effects of Plant Growth Regulators on Fiber Growth and Development in Colored Cotton Ovule Culture
ZHANG Xiao-Meng**, LIU Song-Jiang**, GONG Wen-Fang, SUN Jun-Ling, PANG Bao-Yin, and DU Xiong-Ming*
Institute of Cotton Research of Chinese Academy of Agricultural Sciences / State Key Laboratory of Cotton Biology, Anyang 455000, China
Naturally colored cotton is an ideal textile raw material for the environmental protection and human health. The ovule of cotton varieties Z1-61, Lyumian CC28, and RT-baixu (CK) was cultured in the media with different concentrations of plant growth regulators (MeJA, SHAM, BR, BRz, FLD, ETH, CoCl2, PAL inhibitor, 4CL inhibitor, Urea, and Chl). After 30 days, the fiber color, fiber length, ovule fresh weight, ovule dry weight and fiber dry weight were determined and analyzed with Duncan's new multiple range method. Under the treatments of salicylhydroxamic, phenylalanine ammonia solution enzyme inhibitor and 4CL inhibitor, the color of Z1-61 and Lyumian CC28 cotton fiber was light, and the higher the concentration of the Salicylhydroxamic acid, the lighter of the cotton fiber color. BRz (2.5 μmol L–1) was conducive to the pigment accumulation in brown cotton fiber, while did not have any significant effect on the pigment appearance of green cotton. Both FLD and CoCl2made the color of brown cotton fiber lighter, while CoCl2had little influence on the green color cotton fiber and inhibited the formation of callus.Moreover,salicylhydroxamic acid, BRz, FLD, CoCl2, phenylalanine ammonia solution enzyme inhibitor or 4CL inhibitor decreased the fiber length, ovule fresh weight, fiber dry weight and ovule dry weight. In addition, 5 g L–1urea or 1 mg L–1Chl were advantageous to the brown cotton fiber pigment synthesis. In conclusion, the growth regulators tested in this study revealed the correlations among pigments synthesis, hormone, flavonoid metabolism and protein metabolism, which would be useful for developing colored cotton cultivars.
Colored cotton; Fiber growth; Pigment synthesis; Plant growth regulators
10.3724/SP.J.1006.2017.00763
本研究由国家自然科学基金项目(31601353)资助。
This study was supported by the National Natural Science Foundation of China (31601353).
(Corresponding author): 杜雄明, E-mail: dxm630723@163.com**同等贡献(Contributed equally to this work)
张小萌, E-mail: 18738237057@163.com; 刘松江, E-mail: shj0805938@163.com
(收稿日期): 2016-07-14; Accepted(接受日期): 2017-01-21; Published online(网络出版日期):2017-02-17.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20170217.1146.038.html

