天山花楸化学成分的液质联用分析
郁长治 郭小娜
摘要[目的]采用高效液相色谱-电喷雾质谱联用技术识别天山花楸总黄酮类中的化学成分。[方法]反相C18色谱柱,以乙腈-0.3%甲酸为流动相,检测波长360 nm,梯度洗脱。利用紫检测器和电喷雾质谱负离子模式在线检测化学成分,扫描范围250~700 amu。通过此方法分析糖苷及其苷元。[结果]通过标准品对比及解析质谱,识别了7个化合物,分别为绿原酸、芦丁、金丝桃苷、槲皮素3-O-己糖苷、槲皮素3-O-己糖苷丙二酸复合物、山奈素3-O-己糖苷、山奈素3-O-己糖苷丙二酸复合物。[结论]HPLC/ESI-MS2技术可准确迅速识别天山花楸黄酮类化合物,方法稳定可靠。
关键词天山花楸;黄酮化合物;液质谱联用
中图分类号R284.1文献标识码A文章编号0517-6611(2017)05-0111-03
Abstract[Objective] To analyze and identify the chemical compositions form total flavonoids of Sorbus tianshanica Rupr by HPLCESIMS. [Method] The analysis was processed by means of a reversed phase C18 column and binary mobile phase system consisting of acetonitrile -0.3% methanoic acid records 360 um by ultraviolet detector. The electrospray ionization mass spectrometry under negative ion modes was used to detect the chemical constituents. The full scan of ions ranged from 250-700 amu. Glycosides and aglycones were analyzed. [Result] 7 compounds were identified by standard comparison and analytical mass spectrometry, including 3caffeoylquinic acid, rutin, hyperin, quercetin3Ohexoside, quercetin glycoside 3O hexose malonic acid compound, kaempferol hexoside 3Ohexoside, kaempferol glycosides 3O hexose malonic acid compound. [Conclusion] HPLCESIMS can accurately and quickly identify the compositions of flavonoids in S. tianshanica, the method is stable and reliable.
Key wordsSorbus tianshanica Rup;Flavonoids;HPLC/ESIMS
作者簡介郁长治(1985—),男,新疆乌鲁木齐人,药师,硕士,从事药物分析研究。*通讯作者,药师,硕士,从事药物分析及新剂型研究。
收稿日期2016-12-13
天山花楸(Sorbus tianschanica Rup)为花楸属蔷薇科植物[1],具有悠久的民间用药历史[2],具有改善心脑血液循环、降低血管阻力、依赖性地抑制心肌收缩和保护心肌缺血等[3]重要作用,在机体抗氧化[4-5]、镇咳平喘方面也有显著的效果。研究表明,天山花楸中主要化学成分有黄酮、甾醇、三萜等化合物[6]。目前,对天山花楸黄酮的测定方法主要有薄层色谱法、紫外分光光度法、毛细管电泳法和高效液相法[7-8],但这些方法无法对提取物中的未知化合物进行定性分析。近年来,多级质谱联用技术广泛应用于天然化合物的定性、定量分析[9],可以快速确定未知成分[10]。笔者采用HPLC/ESI-MS2技术对天山花楸总提取物进行了分析,为明确天山花楸化合物组成提供了试验基础和依据。
1材料与方法
1.1试材
天山花楸提取物(自制);芦丁、绿原酸、金丝桃苷、槲皮素、异鼠李素、山奈素标准品(中国药品生物制品检定所);乙腈、甲酸(色谱纯);高纯水。
1.2仪器
岛津LC-20AD高效液相色谱仪,色谱柱waters C18(4.6 mm×250 mm);质谱仪AB/applied Biosystem.API4000,Analyst 1.42数据处理系统。
1.3方法
1.3.1样品溶液制备。称取天山花楸1 000 g,经60%乙醇超声循环提取2次,浓缩后经AB-8大孔吸附树脂柱用60%乙醇洗脱,冷冻干燥得粉末74 g。称取天山花楸提取物10 mg,甲醇定容至25 mL容量瓶中,过0.22 μm微孔滤膜备用。标准品均用甲醇溶解,用0.22 μm滤膜过滤。
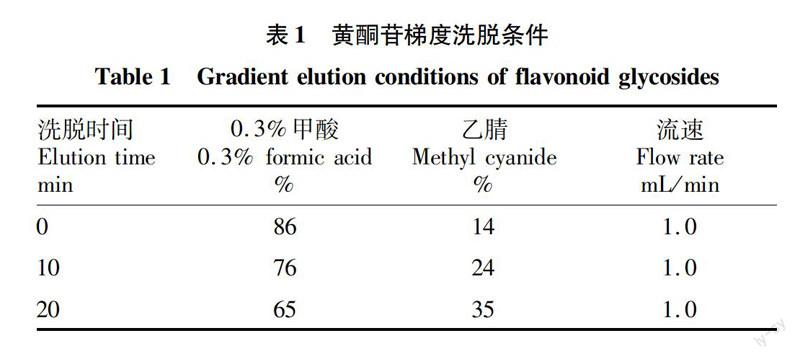
1.3.2色谱条件。梯度洗脱检测波长360 nm;柱温25 ℃;流速1.0 mL/min;进样量10 μL。梯度洗脱条件见表1。
1.3.3质谱条件。采用ESI负离子扫描,扫描范围为250~700 amu;碰撞气流速5 psi,气常流速20 psi,离子源电喷雾电压为-4 500 V,离子源温度650 ℃,雾化气电流GS1 50 psi 、GS2 60 psi,去簇电压DP为 -40 V、EP为-50 V,碰撞能量为-35 V,碰撞出口电压为-6 V。使用气体为N2。
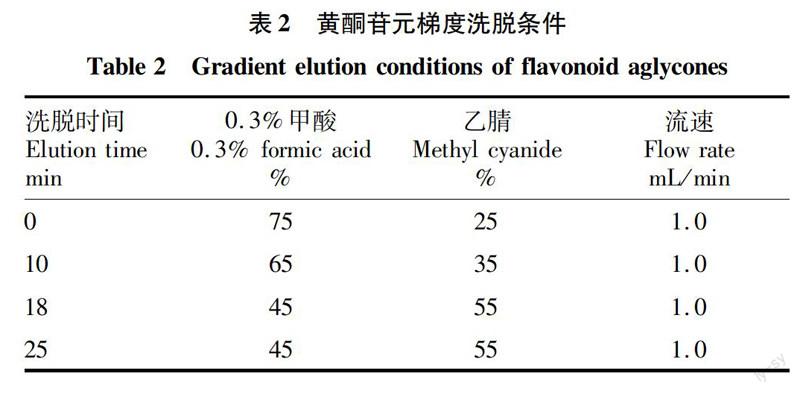
1.3.4苷元分析。
天山花楸提取物在酸性条件下加热水解。苷元经HPLC/ESI-MS2分析确定苷元类型。苷元的HPLC洗脱条件见表2。
2结果与分析
2.1苷元分析
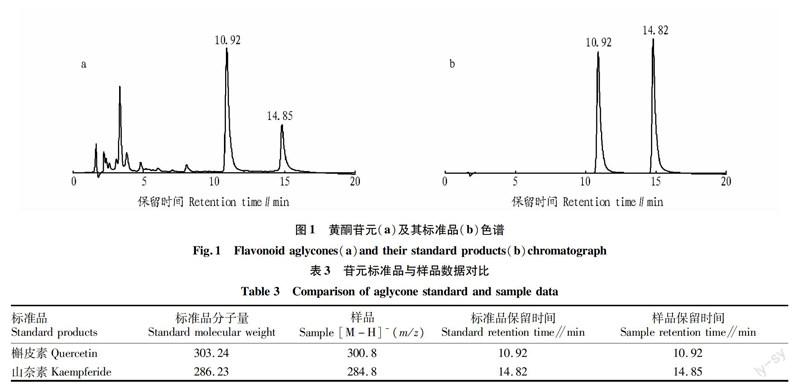
由苷元HPLC图(图1)中样品的保留时间可看出主要为2种苷元,通过HPLC/ESI-MS2并结合标准品比对(表3)可以确定2种苷元是槲皮素和山奈素。
2.2总离子流与色谱分析
天山花楸提取物HPLC色谱图与其总离子流色谱图吻合(图2)。因黄酮类化合物具有较多羟基,可形成稳定的氧负离子,所以采用负离子检测模式,使总离子流色谱图有较低的信噪比。
2.3质谱解析
2.3.1化合物1。准分子离子峰m/z为352.8[M-H]-,针对m/z 352.8进行二级质谱扫描,出现m/z 190.9、160.8碎片离子,发现其与绿原酸的[M-H]-离子碎片的分子量十分吻合。2个离子碎片分别是绿原酸酯键断裂后形成的阿魏酸m/z 190.9和奎宁酸m/z 160.8的离子碎片(表4)。最后通过标准品对比确定化合物1为绿原酸。
2.3.2
化合物2。准分子离子峰m/z为609.1[M-H]-,对m/z 609.1进行二级质谱扫描,出现m/z 300.0特征峰,并含有m/z 273.0、178.9、151.0特征碎片,可以认定这个是槲皮素离子,说明化合物2是以槲皮素为苷元的化合物。m/z 307.4离子碎片为槲皮素上的二糖结构(表4)。对比分子量、苷元与糖苷的组成发现,此化合物与芦丁裂解规律一致。最后通过芦丁对照品对比确定化合物2为芦丁。
2.3.3
化合物3。准分子离子峰m/z为462.9[M-H]-。针对m/z 462.9进行二级质谱扫描,出现m/z 300.8特征峰,并且含有m/z 272.9、179.0、150.9特征碎片,参考化合物2可以断定m/z 300.8是槲皮素离子;m/z 162.7离子碎片与六碳糖苷的分子量吻合(表4)。经对比分子量、苷元与糖苷的分子量与组成发现,此化合物与金丝桃苷的裂解规律十分吻合。最后通过金丝桃苷对照品对比,确定化合物3为金丝桃苷。
2.3.4化合物4。准分子离子峰m/z为463.1[M-H]-。针对m/z 463.1进行二级质谱扫描,得到m/z 300.0特征峰,并且含有m/z 273.0、179.0、150.8特征碎片,同化合物2可以断定m/z 300.0是槲皮素离子,说明化合物4是以槲皮素为苷元的化合物。m/z 155.0离子峰的出现说明槲皮素苷元是按照RDA途径I进行裂解,可以推断m/z 161这个糖基是连接在槲皮素碳3位上(表4)。所以此化合物可以认为是槲皮素3-O-己糖苷。
2.3.5化合物5。准分子离子峰m/z为549.0[M-H]-。针对m/z 549.0进行二级质谱扫描,同样得到了m/z 300.0的特征峰,并且含有m/z 271.0、179.0、150.6特征碎片,参考化合物2说明化合物5是以槲皮素为苷元的化合物;虽然未出现m/z 155.0、136.0等离子碎片,但按照槲皮素苷元与糖的连接特点可以认为糖的连接位置依然是槲皮素碳3位上。m/z 160.8为己糖离子。m/z 89.0为丙二酸的离子碎片,有文獻报道黄酮苷在进行质谱解析中会出现含有丙二酸的结构成分(表4)。所以此化合物推测是槲皮素3-O-己糖苷丙二酸复合物[11]。
2.3.6
化合物6。准分子离子峰m/z为447.0[M-H]-。针对m/z 447.0通过二级质谱扫描,得到m/z 283.8特征峰,并且找到了山奈素0、4位裂解的特征碎片m/z 177.8。由此可以断定m/z 283.8是山奈素离子,说明化合物6是以山奈素为苷元的化合物。m/z 160.8为己糖离子(表4)。所以此化合物可以认为是山奈素3-O-己糖苷[12]。
2.3.7
化合物7。准分子离子峰m/z为533.2[M-H]-。针对m/z 533.2通过二级质谱扫描,出现m/z 285.0、1790,同化合物6可以断定m/z 285.0是山奈素离子,该化合物是以山奈素为苷元的化合物。m/z 160.8为己糖离子,m/z 89.0为丙二酸(表4)。所以此化合物可以推测是山奈素3-O-己糖苷丙二酸复合物[13]。
3结论
运用HPLC/ESI-MS2对天山花楸粗提物中的化学成分进行了系统研究,对天山花楸提取物在负离子模式下的离子流图中的化学成分进行了分析。结果表明,天山花楸化学成分主要为黄酮类化合物。根据不同化合物在质谱中的相对分子量、质谱碎片结构信息及色谱保留规律并加以标准品比对,成功鉴定了天山花楸中7个化合物,分别为绿原酸、芦丁、金丝桃苷、槲皮素3-O-己糖苷、槲皮素3-O-己糖苷丙二酸复合物、山奈素3-O-己糖苷、山奈素3-O-己糖苷丙二酸复合物。
参考文献
[1] 国家中医药管理局《中华本草》编委会.中华本草:第4卷[M].上海:上海科学技术出版社,1999:292.
[2] 新疆自治区卫生厅.新疆自治区卫生标准[S].乌鲁木齐:新疆卫生出版社,1987:1410.
[3] 付伟,刘婷,杨彩玉,等.天山花椒叶总黄酮对大鼠心肌缺血/再灌注损伤的保护作用[J].中国药理学通报,2010,26(2):251-254.
[4] TERMENTZI A,KEFALAS P,KOKKALOU E.Antioxidant activities of various extracts and fractions of Sorbus domestica fruits at different maturity stages[J].Food chemistry,2006,98(4):599-608.
[5] NA M K,AN R B,MIN B S,et al.Antioxidant compounds from the stem bark of Sorbus commixta[J].Nat Prod Sci,2002,8(1):26-29.
[6] LI L,TANG H,WU T,et al.Chemical composition of Sorbus tianschanica leaves[J].Chem of Nat Compd,2010,46(5):811-812.
[7] 馬晓丽,常军民,李毓斌,等.毛细管电泳法测定天山花楸中的黄酮类化合物[J].中成药,2011,33(3):534-536.
[8] MA Y C,LUO M,SARAH W,et al.Qualitative and quantitative evaluation of epimedium and ginseng contained combinations using HPLC[J].Journal of Chinese pharmaceutical sciences,2003,12(1):6-10.
[9] TIAN H Z,WANG H,GUAN Y F.Separation and identification of isoflavonoida in Pueraria lobata extracts and its preparations by reversedphase capillary liquid chromatography coupled with electrospray ionization quadrupole time of flight mass spectrometry[J].Chinese journal of chromatography,2005,23(5):477-481.
[10] 肖崇厚.中药化学[M].上海:上海科学技术出版社,1998:265-323.
[11] KAMATA K,SEO S,NAKAJIMA J.Constituents from leaves of Apocynum venetum L.[J].J Nat Med,2008,62(2):160-163.
[12] NGUELEFACK T B,MBAKAM F H K,TAPONDJOU L A,et al.A dimeric triterpenoid glycoside and flavonoid glycosides with free radicalscavenging activity isolated from Rubus rigidus var.camerunensis[J].Arch Pharmacal Res,2011,34(4):543-550.
[13] WALD B,WRAY V,GALENSA R,et al.Malonated flavonol glycosides and 3,5dicaffeoylquinic acid from pears[J].Phytochemistry,1989,28(2):663-664.

