软枣猕猴桃原生质体酶解液配方筛选
付鹏跃 刘德江 申健 吕明医 梁雪莹 董实伟 程海涛


摘要[目的]筛选软枣猕猴桃原生质体最佳酶解液配方。[方法]以4种配方酶解液在相同条件下处理等量软枣猕猴桃叶片,比较最后收集的纯化原生质体量,筛选最佳酶解液配方。[结果]配方Ⅲ(1.0%纤维素酶、0.5%离析酶、0.3%果胶酶)和Ⅳ(1.0%纤维素酶、05%果胶酶)处理酶解效果要明显优于配方 Ⅰ(2.0%纤维素酶、05%离析酶)、Ⅱ(2.0%纤维素酶、0.3%果胶酶)。[结论]配方Ⅲ(1.0%纤维素酶、05%离析酶、0.3%果胶酶)为软枣猕猴桃原生质体最佳酶解液配方。
关键词软枣猕猴桃;原生质体;酶解;配方筛选
中图分类号S603.6文献标识码A文章编号0517-6611(2017)05-0133-02
Screening of Enzymatic Hydrolysate Formula of Actinidia arguta Protoplast
FU Pengyue,LIU Dejiang,SHEN Jian,CHENG Haitao* et al
(College of Life Sciences, Jiamusi University, Jiamusi, Heilongjiang 154007)
Abstract[Objective]To screen the best enzymatic hydrolysate formula of Actinidia arguta protoplast. [Method]The leaves of A. arguta were treated with four enzymatic hydrolysate formula under the same conditions. The purified protoplast was collected and compared to screen the optimal enzymatic hydrolysate formula. [Result] The amount of protoplast collected by the solution of formula Ⅲ (1.0% cellulase, 0.5% segregation enzyme and 0.3% pectinase) and formula Ⅳ(1.0% cellulase,0.5% pectinase)were significantly higher than the solution of formulaⅠ(2.0% cellulase, 05% segregation enzyme) and formula Ⅱ(2.0% cellulase, 0.3% pectinase).[Conclusion]Formula Ⅲ(1.0% cellulase, 0.5% segregation enzyme and 0.3% pectinase) is the best enzymatic hydrolysate formula for A. arguta protoplast.
Key wordsActinidia arguta;Protoplast;Enzymatic hydrolysis;Formula screening
基金項目黑龙江省大学生创新项目(201610222104)。
作者简介付鹏跃(1993—),男,黑龙江肇源人,本科生,专业:生物科学。*通讯作者,副教授,硕士,从事植物资源学与生态学研究。
收稿日期2016-12-28
软枣猕猴桃(Actinidia arguta)属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)多年生落叶木质藤本植物,俗名软枣子、猕猴梨、藤瓜,是猕猴桃属中在我国分布较为广泛的野生果树之一[1],其主要分布在我国黑龙江、吉林、辽宁、河北、山西、山东、河南、安徽、浙江、云南等省(区)以及朝鲜、日本等国家,多生长在山坡灌木林中、沟边、山顶杂木林中、山坡杂木林中。
我国对猕猴桃野生资源开展系统驯化和栽培有近50年的历史[2]。从20世纪60年代初开始进行软枣猕猴桃的选育,已选育出一批性状优良的品种,如中国农业科学院特产研究所选育的品种‘魁绿和‘丰绿,中国农业科学院郑州果树研究所选育的全红型品种‘天源红,四川省自然资源科学研究院选育的‘宝贝星等[3-7]。相较于美味猕猴桃和中华猕猴桃品种,软枣猕猴桃品种较少,无法满足产业对品种多样化的需求。加强软枣猕猴桃新品种的研究,选育优良品种,对促进我国软枣猕猴桃产业发展具有重要意义[8]。
原生质体(Protoplast)指通过质壁分离,能够和细胞壁分开的那部分细胞物质[9]。目前原生质体培养已经在中华猕猴桃、美味猕猴桃以及毛花猕猴桃3个种中获得成功,但对软枣猕猴桃原生质体培养的研究少见报道[10]。该研究以4种配方的酶解液处理软枣猕猴桃叶片,进行原生质体的酶解,旨在筛选出效果最为理想的酶解液配方。
1材料与方法
1.1材料
材料为软枣猕猴桃瓶装无菌苗叶片。
1.2仪器与试剂
1.2.1仪器。
JD500-3A分析天平(上海力衡仪器仪表有限公司);笔式pH计(杭州盈傲仪器有限公司);TD4台式低速离心机(上海本昂科学仪器有限公司)。
1.2.2试剂。
纤维素酶(Cellulase Onozuke R-10,北京明阳科华生物科技有限公司);离析酶(Macerozyme R-10,上海伟进生物科技有限公司);果胶酶(Pectolyas Y-23,常州市海拓实验仪器有限公司);甘露醇。
1.3方法
1.3.1CPW培养基配制。
按照文献[11]方法配制CPW培养基,具体配方如下:30 mg/L KH2PO4、100 mg/L KNO3、1 320 mg/L CaCl2·2H2O、250 mg/L MgSO4·7H2O。配制50 mL CPW培养基,调节pH为5.6~5.8,高温灭菌后放入冰箱中保存待用。
1.3.2酶解液的制备。
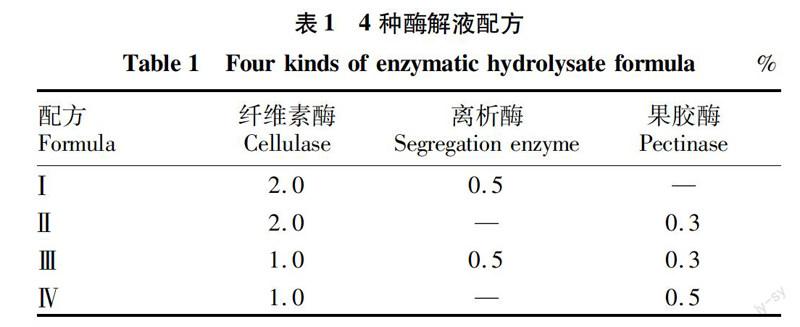
试验共设4种酶解液配方,具体配方见表1。取4个10 mL烧杯,在每个烧杯中倒入6 mL CPW培养基,再放入0.728 6 g甘露醇作为渗透压稳定剂,调节pH至5.6,按照各组比例将纤维素酶、离析酶、果胶酶分别放入烧杯中,用CPW培养基定容到10 mL后充分摇匀,分装到4个锥形瓶中进行标记。此次试验叶片与酶解液质量比为1〖DK〗∶20。
1.3.3酶解试验。
配制完酶解液后用分析天平称量4份05 g叶片,将叶片剪碎到0.25 cm2左右,分别放入各组酶解液中充分摇匀,使每个碎片都浸没在酶解液中。将锥形瓶放入低速摇床中进行黑暗处理,25 ℃,4~8 h。分别于1、4、8 h观察记录叶片样品外观与酶解液的变化情况。
1.3.4原生质体收集与称重。
将锥形瓶中的叶片通过300目钢筛进行过滤,收集到的滤液分装入10 mL离心管中离心(300~500 r/min)5 min。离心后弃上清液,加入6 mL CPW培养基,再次离心(300~500 r/min)5 min。弃上清液后,将经过离心纯化的各组原生质体称重。
2结果与分析
2.1酶解1 h后观察结果
由表2可知,处理1 h后,与配方 Ⅰ、Ⅱ、Ⅲ酶解情况相比,配方Ⅳ无明显变化,配方Ⅲ与Ⅳ中可以清楚看到已经有部分叶片酶解出现了原生质体。配方 Ⅰ、Ⅱ 中的叶片无明显改变,配方Ⅲ与Ⅳ中叶片已经有质壁分离的趋势,叶片颜色开始变浅(图1)。
锥形瓶中叶片颜色变浅,叶片变软,叶片边缘出现毛边,酶解液较为清澈。配方Ⅲ与Ⅳ锥形瓶中叶片颜色变浅,叶片变软,顶部有透明白膜,叶片有分离的趋势,酶解液较为浑浊(表2)。
2.3酶解8 h后观察结果
处理8 h后4种酶解液中叶片酶解情况见图2。经观察发现,配方 Ⅰ、Ⅱ 锥形瓶中叶片仍比较完整,具备一定形状,叶片顶部出现白膜,轻轻晃动白膜仍未脱离,叶片边缘有比较明显的毛边,酶解液比较浑浊,总体上来说酶解效果不理想(表2)。配方Ⅲ锥形瓶中叶片已无固定形状,酶解液变为深绿色,肉眼可见大量绿色沉淀。配方Ⅳ锥形瓶中叶片也已经为游离态,但仍可见叶片碎片。
3结论
猕猴桃果富含丰富的VC、矿物质和花青苷等营养物质[12],其主要营养成分位居水果的前列,且综合经济效益通常比一般水果高出3倍以上[13]。由于猕猴桃是新兴果树,对其遗传育种的研究时间不长,对软枣猕猴桃的研究更是有限,对原生质体分离工艺的筛选是对其进一步研究的基础。该试验以4种不同的酶解液配方筛选分离原生质体,试验结果表明,配方Ⅲ(1.0%纤维素酶、0.5%离析酶、0.3%果胶酶)和Ⅳ(1.0%纤维素酶、0.5%果胶酶)酶解效果要明显优于配方 Ⅰ (2.0%纤维素酶、0.5%离析酶)、Ⅱ (2.0%纤维素酶、0.3%果胶酶),但配方Ⅳ破碎较多。在供试酶解液中配方Ⅲ原生质体产量最多,破碎最少,所以配方Ⅲ应为软枣猕猴桃原生质体最佳酶解液配方。
参考文献
[1] 杨义明,赵淑兰,艾军,等.大果软枣猕猴桃优系‘8401选育初报 [J].北方园艺,2011(2):186-187.
[2] 陈兴涛,岁立云,刘晓敏,等.我国猕猴桃育种现状及发展趋势[J].四川农业科技,2016(8):48-49.
[3] 趙淑兰,袁福贵,马月申,等.软枣猕猴桃新品种魁绿[J].园艺学报,1994,21(2):207-208.
[4] 胡家金,熊兴耀,张秋明,等.美味猕猴桃原生质体培养及植株再生技术研究[J].湖南农业大学学报,1998,24(3):184-190.
[5] 赵淑兰.软枣猕猴桃新品种——“丰绿”[J].特产研究,1996(3):51-52.
[6] 齐秀娟,方金豹,韩礼星,等.全红型软枣猕猴桃品种‘天源红的选育[M]//黄宏文.猕猴桃研究进展(Ⅵ).北京:科学出版社,2011:49-50.
[7] 谢玥,王丽华,董官勇,等.软枣猕猴桃新品种‘宝贝星[J].园艺学报,2014,41(1):189-190.
[8] 秦红艳,杨义明,艾军,等.软枣猕猴桃新品种——‘佳绿的选育[J].果树学报,2015,32(4):733-735.
[9] 周玲艳,杨加伟,梁红.植物体细胞杂交技术及其在猕猴桃育种中的应用[J].仲恺农业工程学院学报,2009,22(3):59-64.
[10] 朱道圩,秦永华,郅玉宝,等.软枣猕猴桃原生质体培养与细胞团再生的初步研究[J].河南农业大学学报,2001,35(3):221-224.
[11] 李昊.黑果腺肋花楸与越橘的原生质体分离与融合研究[D].长春:吉林农业大学,2008:13.
[12] MONETTE P L.Micropropagation of kiwifruit using nonaxenic shoot tips[J].Plant cell,tissue and organ culture,1986,6(1):73-82.
[13] COLLINS B H,HORSK A,HOTTEN P M,et al.Kiwifruit protects against oxidative DNA damage in human cells and in vitro[J].Nutrition and cancer,2001,39(1):148-153.

