乙硫氨酯及其光降解产物对土壤微生物代谢活性的影响
王 哲,姜新舒,朱米家,姚 俊
(北京科技大学能源与环境工程学院,北京 100083)
乙硫氨酯及其光降解产物对土壤微生物代谢活性的影响
王 哲,姜新舒,朱米家,姚 俊*
(北京科技大学能源与环境工程学院,北京 100083)
利用高压汞灯对不同浓度的乙硫氨酯溶液进行光降解,采用微量热法探究乙硫氨酯及其光降解产物对土壤微生物代谢活性的影响。结果表明,利用高压汞灯光照乙硫氨酯2 h可高效降解乙硫氨酯,降解率可达85%以上。微量热实验表明乙硫氨酯的光降解产物对土壤微生物的毒性比其本身更大,因此,乙硫氨酯在环境中的降解行为及毒性值得关注。
乙硫氨酯;光降解;毒性;微量热
选矿药剂作为选矿过程中大量应用的化学药剂,包括捕收剂、起泡剂、抑制剂、絮凝剂等,其中的大多数药剂,如氰化物、砷化物、各类烷基黄药、醛酯等为有毒有害物质。这些物质随选矿废水的排放或通过尾矿库淋溶渗漏等形式进入环境,在水体、大气和土壤介质中迁移转化,甚至形成二次污染,严重威胁生态环境[1]。
近年来发展起来的微量热法是一种原位、实时、在线监测样品热力学与动力学的重要方法。热效应伴随着所有化学、物理和生命过程,通过微量热法可对这些热效应进行精确的测定、分析,表征其过程[2],如微量热法可对土壤微生物生物学特性进行准确表征。土壤是维持陆地生态系统良好运转的主要场所,但人类的采选冶活动使大量土壤受到选矿药剂污染[3-5]。研究环境中的选矿药剂及其降解后的物质对土壤微生物代谢活性的影响,有助于理解选矿药剂污染对土壤微生物的毒性。
乙硫氨酯(O-isopropyl-N-ethylthionocarbamate,IPETC)是一类重要的硫化矿捕收剂,捕收效率高并具有良好的选择性,被世界各国广泛应用。目前,针对乙硫氨酯合成方法以及工业应用的报道颇多,但对其光化学行为和毒性的研究尚属空白。Chen等[6]利用厌氧消化污泥在厌氧环境下降解乙硫氨酯,另外发现在好氧环境下乙硫氨酯很难被微生物降解[7]。但是,在这两篇文献中,乙硫氨酯及其降解产物的毒性都没有被提及。因此,作者在此研究乙硫氨酯及其光降解产物对土壤微生物代谢活性的影响。
1 实验
1.1 供试土样
实验土壤采集自北京科技大学校园,除去土壤中的石块、动植物残体等杂质后,过2 mm细筛。测定土壤的基本理化性质如下:pH=7.57,有机质0.73%(质量分数),速效磷60.0 mg·kg-1,速效钾120 mg·kg-1,全氮65.0 mg·kg-1[8]。
1.2 试剂与仪器
乙硫氨酯,工业级,铁岭选矿药剂有限公司。
UV-1800型紫外可见分光光度计,日本岛津公司;BL-GHX-V型光化学反应仪,上海比朗仪器有限公司;TAMⅢ型十二通道微量量热仪,美国TA仪器公司。
1.3 方法
1.3.1 乙硫氨酯标准曲线的绘制
分别称取 2 mg、4 mg、6 mg、8 mg、10 mg 乙硫氨酯置于5 mL小烧杯中,加水溶解,转移至100 mL容量瓶中定容并摇匀,得到浓度(mg·L-1)分别为20、40、60、80、100的乙硫氨酯标准溶液。使用紫外可见分光光度计测量上述标准溶液在 243 nm处的吸光度,设置空白对照,绘制标准曲线。
1.3.2 光降解实验
配制一组浓度(mg·L-1)分别为20、40、60、80、100的乙硫氨酯溶液,将不同浓度的溶液置于光化学反应仪中光照2 h,每隔30 min取样测定吸光度。根据标准曲线计算溶液中乙硫氨酯的浓度,进而计算降解率。
光照条件:500 W高压汞灯,30 ℃。
1.3.3 微量热实验
实验前,将土样在28 ℃及有氧条件下放置1 d以保持土壤微生物活性;将安瓿瓶清洗后置于110 ℃下灭菌30 min。取土样各1 g分别置于安瓿瓶中,分别加入0.2 mL混合营养液(含葡萄糖和硫酸铵各5.0 mg);再分别加入乙硫氨酯溶液(20 mg·L-1、40 mg·L-1、60 mg·L-1、80 mg·L-1、100 mg·L-1)和其经高压汞灯光照2 h后的溶液各0.2 mL,涡旋混合均匀;最后将密封的安瓿瓶放入微量量热仪中(温度设为28 ℃)。通过检测器监测微生物代谢过程中释放的热量并传输数据给计算机,绘制微量量热曲线,分析微量量热曲线的热力学参数,评价乙硫氨酯对土壤微生物代谢活性的影响[9]。
2 结果与讨论
2.1 乙硫氨酯的光降解(图1)

图1 不同浓度乙硫氨酯的光降解
由图1可知,初始浓度为20 mg·L-1、40 mg·L-1、60 mg·L-1、80 mg·L-1、100 mg·L-1的乙硫氨酯溶液经高压汞灯照射2 h后即可大部分降解,降解率分别为90.1%、84.0%、91.3%、87.0%和85.1%,说明高压汞灯可高效降解乙硫氨酯。
由图1还可知,随着时间的延长,乙硫氨酯的光降解具有减缓趋势,且初始浓度越低其减缓趋势越明显。有机物光降解随着时间的推移逐渐减缓的现象多有报道,这可能是由于光化学反应中产生的中间产物会与底物竞争光子,从而抑制乙硫氨酯进一步光降解[10]。理论上,这种影响将越来越占主导作用,因为中间产物逐渐积累会导致阻碍其降解的化合物浓度升高。此外,某些中间产物和光降解最终产物可能吸收光线,从而减弱用于降解乙硫氨酯的入射光线强度。在初始浓度较低的情况下,光化学反应进行一段时间后,其中间产物与最终产物会很快占据吸收光线的主导作用。而初始浓度较高时,这个主导作用将相对有所延迟,因此光降解减缓趋势相对不明显。
以ln(ct/c0)(ct、c0分别为t时刻和初始t0时乙硫氨酯浓度)对时间t作图,如图2所示。
图2所得直线斜率即为一级动力学速率常数K(min-1),对不同初始浓度的乙硫氨酯的光降解速率进行动力学拟合,发现其光降解符合一级动力学模型(ct=c0e-Kt),光降解动力学参数见表1。
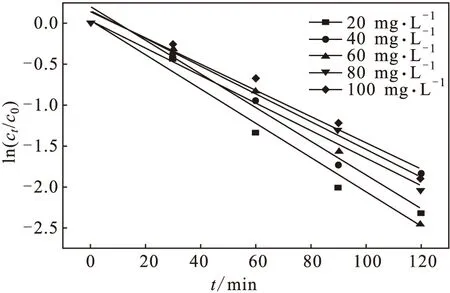
图2 不同浓度乙硫氨酯的光降解速率拟合曲线
由表1可知,初始浓度在20~100 mg·L-1时,乙硫氨酯的光降解一级动力学速率常数在0.0159~0.0207 min-1之间,说明初始浓度对其光降解的影响并不明显。乙硫氨酯作为一种常见的硫化矿捕收剂,其化学性质相对稳定。在本研究中,乙硫氨酯在高压汞灯照射下明显被降解,且其降解符合一级动力学模型,这为乙硫氨酯的光降解研究提供了很有参考价值的研究依据。
表1 乙硫氨酯的光降解动力学参数
Tab.1 The photodegradation kinetic parameters of IPETC

初始浓度 mg·L-1一级动力学拟合参数K/min-1R2200.02070.9766400.01680.9624600.02050.9675800.01700.97021000.01590.9714
2.2 乙硫氨酯及其光降解后溶液对土壤微生物代谢活性的影响
不同浓度乙硫氨酯及其光降解后溶液对土壤微生物代谢活性的影响见图3。

a.乙硫氨酯 b.乙硫氨酯光降解后溶液
从图3可知,土壤微生物的微量量热曲线都存在明显的微生物生长周期,即延迟期、对数期、稳定期和衰退期。
通过热力学方程lnPt=lnP0+kt计算获得微生物生长速率常数k。式中:Pt为t时刻的细菌总热功率,P0为时间t0时的细菌总热功率。微生物活性越强、生长越快,则k值越大[11-13]。其相应热力学参数见表2。
由表2可知,土壤微生物微量量热曲线的Pmax均随着乙硫氨酯及其降解产物浓度的增大而逐渐降低。这说明乙硫氨酯及其降解产物对土壤微生物的代谢活性有明显的抑制作用,浓度增大抑制作用更明显。降解前,tmax基本稳定在4 h左右。而QT与k并未呈现较好规律性,其值在一定范围内波动。这是因为,QT、tmax、k与土壤理化性质、土壤微生物量及受污染程度等因素有关。污染程度较小时,会刺激微生物生长,从而增大放热量;但当污染较为严重时,为抵抗外来污染物质的影响,微生物会消耗更多能量从而放出更大热量。QT、tmax、k未能与乙硫氨酯的加入浓度呈现出较好规律性,这是由于土壤微生物应对污染的复杂机制导致的。
对比乙硫氨酯及其光降解产物对土壤微生物代谢活性的影响可以发现,加入乙硫氨酯光降解后溶液的土壤微生物能量代谢的Pmax明显降低,tmax推迟。加入浓度为20 mg·L-1、40 mg·L-1、60 mg·L-1、80 mg·L-1、100 mg·L-1乙硫氨酯溶液的土壤微生物能量代谢的Pmax分别为136.09μW、130.72μW、129.71μW、124.47μW和100.95μW,而加入其相应降解后
表2 不同浓度乙硫氨酯及其光降解后溶液对土壤微生物的热力学参数
Tab.2 Thermodynamic parameters of soil microorganisms added with different concentrations of IPETC and its photodegradation products

cmg·L-1乙硫氨酯降解前QT/JPmax/μWtmax/hk/(1×10-3min-1) 乙硫氨酯降解后QT/JPmax/μWtmax/hk/(1×10-3min-1) 201536.207136.08744.500.2360501429.447103.161412.930.20946401362.622130.72054.450.216121321.50596.210313.250.25432601433.361129.70634.280.191301353.97985.594312.400.25080801378.015124.46533.740.298621322.95678.798113.790.273521001441.192100.95063.350.297071325.42474.547912.850.22573平均值1430.279124.38604.060.247831350.66294.988712.860.23819
注:QT为总发热量,Pmax为最大总热功率,tmax为最大总热功率时间。
溶液的土壤微生物能量代谢的Pmax分别为103.16μW、96.21μW、85.59μW、78.80μW和74.55μW;tmax在乙硫氨酯降解前为3.35~4.50 h,降解后推迟到12.40~13.79 h左右。QT、k平均值在乙硫氨酯降解前为1 430.28 J、0.248×10-3min-1,降解后为1 350.66 J、0.238×10-3min-1,整体上QT值降低,k略有降低。这些参数说明乙硫氨酯光降解后产物对土壤微生物代谢活性的抑制作用更为明显。据文献报道,许多有机污染物的降解产物对环境和人类的危害比其本身更大,二次污染物通常比一次污染物对环境存在更为严重的潜在威胁[14-15]。本研究中,乙硫氨酯的光降解产物对土壤微生物的毒性比其本身更大,说明乙硫氨酯在环境中的降解行为值得关注。
3 结论
高压汞灯可高效降解乙硫氨酯溶液,光照2 h后,浓度为20 mg·L-1、40 mg·L-1、60 mg·L-1、80 mg·L-1、100 mg·L-1的乙硫氨酯溶液的降解率分别为90.1%、84.0%、91.3%、87.0%和85.1%。对不同浓度的乙硫氨酯光降解速率进行动力学拟合,发现其光降解符合一级动力学模型。同时,采用微量热法研究乙硫氨酯及其光降解产物对土壤微生物代谢活性的影响,发现乙硫氨酯光降解后产物对土壤微生物代谢活性的抑制作用更为明显,说明乙硫氨酯的光降解产物对土壤微生物的毒性比其本身更大。因此,乙硫氨酯在环境中的降解行为及毒性值得关注。
[1] 吴国振.选矿药剂污染及其防治措施[J].甘肃冶金,2009,31(1):82-84.
[2] 冯有智,林先贵.微量热法在土壤微生物研究中的应用进展[J].土壤,2012,44(4):535-540.
[3] CHEN H,YAO J,WANG F,et al.Toxicity of perfluorooctanoic acid toPseudomonasputidain the aquatic environment[J].Journal of Hazardous Materials,2013,262(22):726-731.
[4] WANG F,YAO J,SI Y,et al.Short-time effect of heavy metals upon microbial community activity[J].Journal of Hazardous Materials,2010,173(1/2/3):510-516.
[5] YAO J,TIAN L,WANG Y,et al.Microcalorimetric study the toxic effect of hexavalent chromium on microbial activity of Wuhan brown sandy soil:aninvitroapproach[J].Ecotoxicology and Environmental Safety,2008,69(2):289-295.
[6] CHEN S,GONG W,MEI G,et al.Anaerobic biodegradation of ethylthionocarbamate by the mixed bacteria under various electron acceptor conditions[J].Bioresource Technology,2011,102(22):10772-10775.
[7] CHEN S,GONG W,MEI G,et al.Primary biodegradation of sulfide mineral flotation collectors[J].Minerals Engineering,2011,24(8):953-955.
[8] 罗园园,吴雪楠,刘文娟,等.镉累积效应对土壤微生物活性的影响[J].化学与生物工程,2016,33(7):23-27.
[9] 吴雪楠,孙菁菁,罗园园,等.草甘膦对土壤微生物能量代谢的影响[J].化学与生物工程,2016,33(4):18-21.
[10] JIANG X,WANG Z,ZHANG Y,et al.The mutual influence of speciation and combination of Cu and Pb on the photodegradation of dimethylo-phthalate[J].Chemosphere,2016,165:80-86.
[11] 姜新舒,姚俊.草甘膦对同源假单胞基因工程菌代谢活性的影响[J].中国环境科学,2015,35(10):3078-3084.
[12] CHEN H,YAO J,WANG F,et al.Toxicity of three phenolic compounds and their mixtures on the gram-positive bacteriaBacillussubtilisin the aquatic environment[J].Science of the Total Environment,2010,408(5):1043-1049.
[13] WANG F,YAO J,CHEN H,et al.Comparative toxicity of chlorpyrifos and its oxon derivatives to soil microbial activity by combined methods[J].Chemosphere,2010,78(3):319-326.
[14] 陈彩霞.选矿药剂二次污染对尾矿重金属释放与迁移的影响[J].分析试验室,2010(11):80-82.
[15] 王娉娉.矿山环境二次污染及深层次问题探究[D].北京:北京交通大学,2009.
Effect ofO-Isopropyl-N-ethylthionocarbamate(IPETC) and Its Photodegradation Products on Metabolic Activity of Soil Microorganisms
WANG Zhe,JIANG Xin-shu,ZHU Mi-jia,YAO Jun*
(SchoolofEnergyandEnvironmentalEngineering,UniversityofScienceandTechnologyBeijing,Beijing100083,China)
UsingahighpressuremercurylamptophotodegradedifferentconcentrationsofO-isopropyl-N-ethylthionocarbamate(IPETC)solutions,theeffectsofIPETCanditsphotodegradationproductsonthemetabolicactivityofsoilmicroorganismswereevaluatedbymicrocalorimetry.Theresultsindicatedthat,after2hirradiationbythehighpressuremercurylamp,IPETCcouldbeeffectivelydegraded,anditsdegradationratereachedabove85%.ThemicrocalorimetryexperimentshowedthephotodegradationproductsofIPETCcouldbemoretoxictosoilmicroorganismsthanIPETC.So,thedegradationbehaviourandtoxicityofIPETCintheenvironmentareworthattention.
O-isopropyl-N-ethylthionocarbamate;photodegradation;toxicity;microcalorimetry
2016-10-15
王哲(1990-),男,山东济宁人,硕士研究生,研究方向:环境毒理学,E-mail:976269876@qq.com;
姚俊,教授,E-mail:yaojun@ustb.edu.cn。
10.3969/j.issn.1672-5425.2017.03.011
Q935
A
1672-5425(2017)03-0045-04
王哲,姜新舒,朱米家,等.乙硫氨酯及其光降解产物对土壤微生物代谢活性的影响[J].化学与生物工程,2017,34(3):45-48.

