血小板通过炎症反应在盐敏感性高血压中的作用机制研究
毛红亚,刘云鹏,王子皓,姜晓亮,刘 星,杨志伟
(中国医学科学院北京协和医学院医学实验动物研究所,北京 100021)
研究报告
血小板通过炎症反应在盐敏感性高血压中的作用机制研究
毛红亚,刘云鹏,王子皓,姜晓亮,刘 星,杨志伟*
(中国医学科学院北京协和医学院医学实验动物研究所,北京 100021)
目的 探讨血小板在高盐诱导的盐敏感性高血压中的作用及分子机制。 方法 在体实验选用2月龄盐敏感性高血压大鼠(dahl salt-sensitive, Dahl SS)25只随机分为三组:给予低盐(0.12% NaCl,LS)、高盐(8%NaCl,HS)和血小板抑制剂(8%NaCl+血小板抑制剂,HS+bus)处理6周。尾袖法检测大鼠动脉血压,流式细胞术分析外周血血小板活化率、血小板内Ca2+浓度、血小板-白细胞聚集(platelet-leukocyte aggregation,PLA)和主动脉血管中免疫细胞的比例,ELISA方法检测血清炎症因子IL-6的表达。 体外实验分离SD大鼠血小板,分为正常盐组(0.9%NaCl)和高盐组(1.3%NaCl),检测血小板内Ca2+浓度和p-selectin表达的差异。 结果 与低盐组相比,高盐喂养的Dahl SS大鼠动脉血压明显升高,外周血血小板活化率、血小板-白细胞聚集的比例及主动脉血管免疫细胞的比例显著增多,血清炎症因子IL-6的水平明显增高;血小板抑制剂能够显著降低高盐引起的血压升高,抑制血小板活化,降低外周血PLA和主动脉血管免疫细胞的比例,并且减少外周血炎症因子IL-6的释放;体外分离纯化的大鼠血小板经高盐处理后,血小板内Ca2+浓度增加,血小板表面p-selectin表达增多(P< 0.05)。 结论 高盐通过活化血小板激活血管炎症参与了盐敏感性高血压的病理过程,其机制可能与高盐诱导血小板内Ca2+浓度增加有关。但是,高盐如何导致血小板活化,以及血小板活化后如何通过炎症反应导致高血压的发生发展的具体机制还需要进一步研究。
盐敏感性高血压;高盐;血小板;炎症
高血压是一种严重危害人类健康的多因素疾病,受环境、行为和基因等多种因素共同影响。目前高血压患者约占世界人口总数的26%,预计在2025年会增加到30%,且往往伴随动脉粥样硬化、脑卒中、慢性肾病等严重的靶器官损伤[1-3],已成为世界性的健康问题[4]。相对高盐摄入引起的血压增高被定义为“盐敏感性高血压(salt sensitive hypertension)”,其人数约占全部高血压总数的50%。高盐摄入是盐敏感性高血压的一个重要影响因素,也是脑卒中、动脉粥样硬化和心衰等众多心脑血管疾病的主要危险因素之一[5,6]。Meta数据分析表明,高盐摄入后,脑卒中和心血管疾病的发病率分别增加23%和14%[7]。众所周知,炎症反应是参与并促进盐敏感性高血压病理发展的一个重要环节。近年来的多项研究表明,血小板活化能够通过诱导炎症反应参与内皮功能损伤、血管硬化和血管炎症等血管病变,促进盐敏感性高血压以及多种心脑血管疾病的发生发展[8,9]。临床研究也表明,盐敏感性高血压患者体内存在血小板高度活化的现象[10]。本研究旨在前期研究基础上,进一步探索血小板在高盐诱导的盐敏感性高血压中的作用,以期为盐敏感性高血压的预防和治疗提供新的理论基础。
1 材料和方法
1.1 实验动物
SPF级雄性Dahl SS大鼠25只,体重190~200 g,8周龄,由北京维通利华实验动物中心提供[SCXK(京)2012-0001];Dahl SS大鼠由北京华阜康生物科技股份有限公司提供[SCXK(京)2014-0004],实验在中国医学科学院医学实验动物研究所中进行[SYXK(京)2014-0029],其中涉及动物实验方案的操作程序已得到实验动物使用与管理委员会(IACUC)的批准[ILAS-PG-2014-006]。
1.2 动物分组
Dahl SS大鼠随机分为低盐组(5只)、高盐组(10只)和血小板抑制剂组(10只),分别给予0.12%低盐和8%高盐饲料喂养6周,在高盐喂养的前4、2 d和开始高盐喂养当天及高盐喂养后每周腹腔注射血小板抑制剂白消安(25 mg/kg)[11, 12],每周检测大鼠鼠尾动脉血压。
1.3 主要试剂及抗体
白消安(Fluka, B2635-10G);乙二醇(Sigma, 202398-250G);anti-rat CD42a-PE(上海瑞齐生物科技有限公司,RSF-19836R-PE);anti-rat CD62p-FITC(上海瑞齐生物科技有限公司,RS-10770R-FITC);anti-rat CD45-percp/cy5.5(Biolegend, 202220);anti-rat T/B/NK cell cocktail(BD pharmingen, 558495);anti-rat Ly6G-FITC(上海瑞齐生物科技有限公司,RS-2576R-FITC);Fluo3-AM(Beyotime, S1056);红细胞裂解液(BD pharingen, 349202);胶原酶I(Sigma,C0130-5G);胶原酶XI(Sigma,C7657-100MG);透明质酸酶(Sigma,H3506-1G);脱氧核糖核苷酸(Sigma,D5025-150KU);Rat IL-6 ELISA Kit ( RayBio,ELR-IL6)。
1.4 实验方法
1.4.1 尾袖法检测Dahl SS大鼠动脉血压
利用无创血压仪BP2000 SERIESII Visitech Systems系统测量大鼠鼠尾动脉血压,大鼠固定放置于恒温板上,尾根部由血压感应器包裹,待大鼠稳定后检测大鼠尾部动脉血压。
1.4.2 流式细胞术检测外周血血小板表面p-selectin表达和血小板内Ca2+浓度
取大鼠腹主动脉血,加入CD42a-PE和CD62p-FITC分别指示血小板和活化的血小板,室温避光孵育30 min,1%多聚甲醛固定,使用流式细胞仪(BD FACSCantoTM)检测外周血血小板表面p-selectin表达代表血小板活化率;制备富血小板血浆(Platelet-rich plasma, PRP),加入Fluo3-AM(20 μmol/L)检测血小板内Ca2+浓度,室温避光孵育30 min,1%多聚甲醛固定,流式细胞仪上机检测。
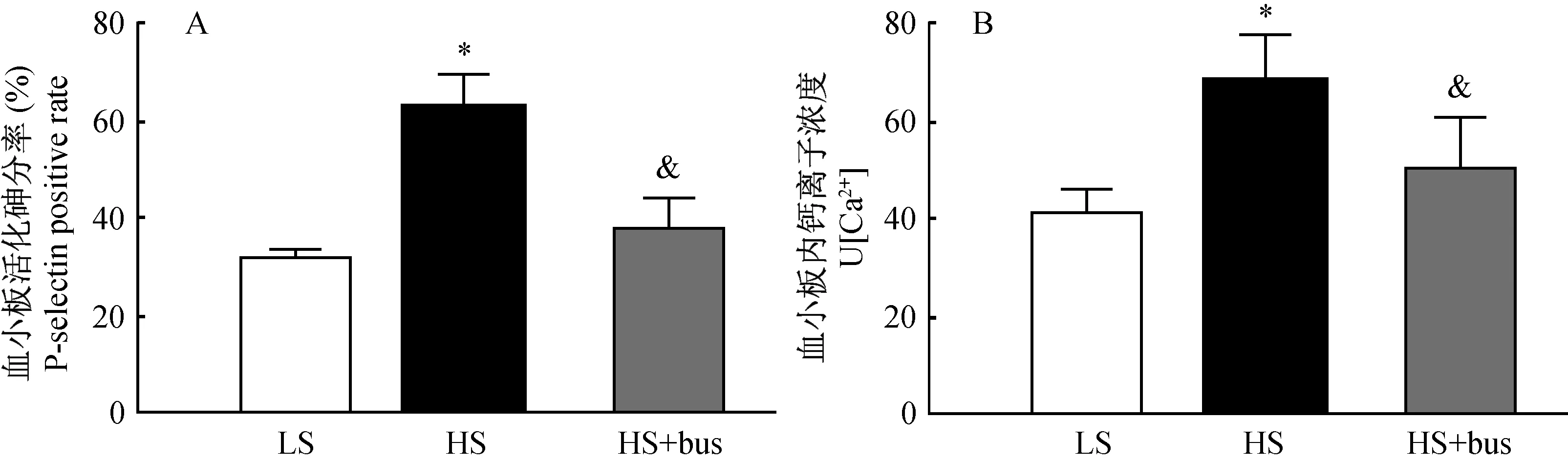
注:LS:低盐饮食;HS:高盐饮食;HS+bus:高盐饮食+血小板抑制剂;*P < 0.05 vs LS;&P < 0.05 vs HS。Note. LS: low-salt diet; HS: high-salt diet; HS: high-salt diet; HS+bus: high-salt diet + platelet inhibitor;*P < 0.05 vs low-salt diet; &P < 0.05 vs high-salt diet.图1 高盐对Dahl SS大鼠血小板p-selectin表达及Ca2+浓度的影响Fig.1 The effect of high salt on the platelet p-selectin expression and Ca2+ concentration in Dahl SS rat
1.4.3 流式细胞术检测外周血PLA
取大鼠腹主动脉血,加入流式抗体CD45-percp、CD42a-PE,混匀后室温避光孵育30 min,裂红4 min,1%多聚甲醛固定,检测外周血PLA的比例。
1.4.4 ELISA检测血清炎症因子IL-6的水平
分离大鼠抗凝血清,ELISA方法检测Dahl SS 大鼠血清炎症因子IL-6的水平,所有实验操作均严格按照试剂盒使用说明书进行。
1.4.5 流式细胞术检测主动脉血管所浸润的炎症细胞
剥离大鼠胸主动脉至髂主动脉的血管,剪碎消化至单个细胞悬液,加入流式抗体 CD45-percp、CD3-APC、Ly6G-FITC、CD45RA-FITC和CD161a-PE,混匀室温避光孵育30 min,检测动脉血管所浸润的炎症细胞的百分率。
1.4.6 流式细胞术检测血小板内Ca2+浓度和血小板表面p-selectin的表达
分离SD大鼠富血小板血浆,正常盐(0.9% NaCl)和高盐(1.3%NaCl)刺激血小板30 min。加入Fluo3-AM(20 μmol/L)检测血小板内Ca2+浓度;加入流式抗体 CD42a-PE 和CD62p-FITC检测血小板表面p-selectin的表达。
1.5 统计学方法
应用IBM SPSS Statistics 20.0统计软件进行分析,实验数据以平均值±标准误(±s)表示,两组间样本的比较采用t检验,多组间样本的比较采用One-Way ANOVA 统计分析方法,以P<0.05为差异有显著性。
2 结果
2.1 高盐喂养的Dahl SS大鼠血小板活化率和血小板内Ca2+浓度显著增加
流式细胞术检测大鼠血小板活化率以及Ca2+浓度,结果显示高盐(8%NaCl)喂养后,Dahl SS大鼠血小板活化率及Ca2+浓度较低盐喂养组(0.12% NaCl)显著增加(P< 0.05,图1A);血小板抑制剂(白消安)能够显著降低血小板活化率及Ca2+浓度(P< 0.05,图1B)。提示高盐能够激活血小板,可能在盐敏感性高血压的病理过程起重要作用。
2.2 血小板抑制剂降低高盐诱导的Dahl SS大鼠的血压
为证实血小板在盐敏感性高血压中的作用,我们给予Dahl SS大鼠腹腔注射白消安(25 mg/kg)。研究发现(图2),高盐组Dahl SS大鼠的血压明显高于低盐组(收缩压222.2±15.5 比 154.4±4.6,舒张压203±14.8比122.4±3.1,平均动脉压197.4±15比133.1±3.6,P< 0.05),血小板抑制剂可显著地抑制高盐诱导的血压升高(收缩压173.4±27 比 222.2±15.5,舒张压139.8±26.7比203±14.8,平均动脉压151±26.8比197.4±15,P< 0.05),表明血小板在高盐诱导的盐敏感性高血压中起重要作用。
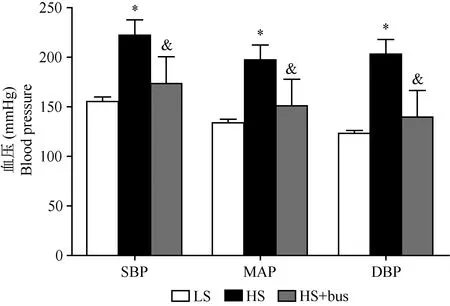
注: LS:低盐饮食;HS:高盐饮食;HS+bus:高盐饮食+血小板抑制剂;SBP:收缩压;MAP:平均动脉压;DBP:舒张压;*P < 0.05 vs LS;&P < 0.05 vs HS。Note. LS: low-salt diet; HS: high-salt diet; HS+bus: high-salt diet + platelet inhibitor; SBP: systolic blood pressure; MAP: mean arterial pressure; DBP: diastolic blood pressure;*P < 0.05 vs low-salt diet; &P < 0.05 vs high-salt diet.图2 血小板抑制剂对高盐诱导Dahl SS大鼠血压的影响Fig.2 Effects of platelet inhibitor on blood pressures in high-salt diet treated Dahl SS rat
2.3 血小板抑制剂降低高盐诱导的Dahl SS大鼠外周血中血小板-白细胞聚集(PLA)的比例
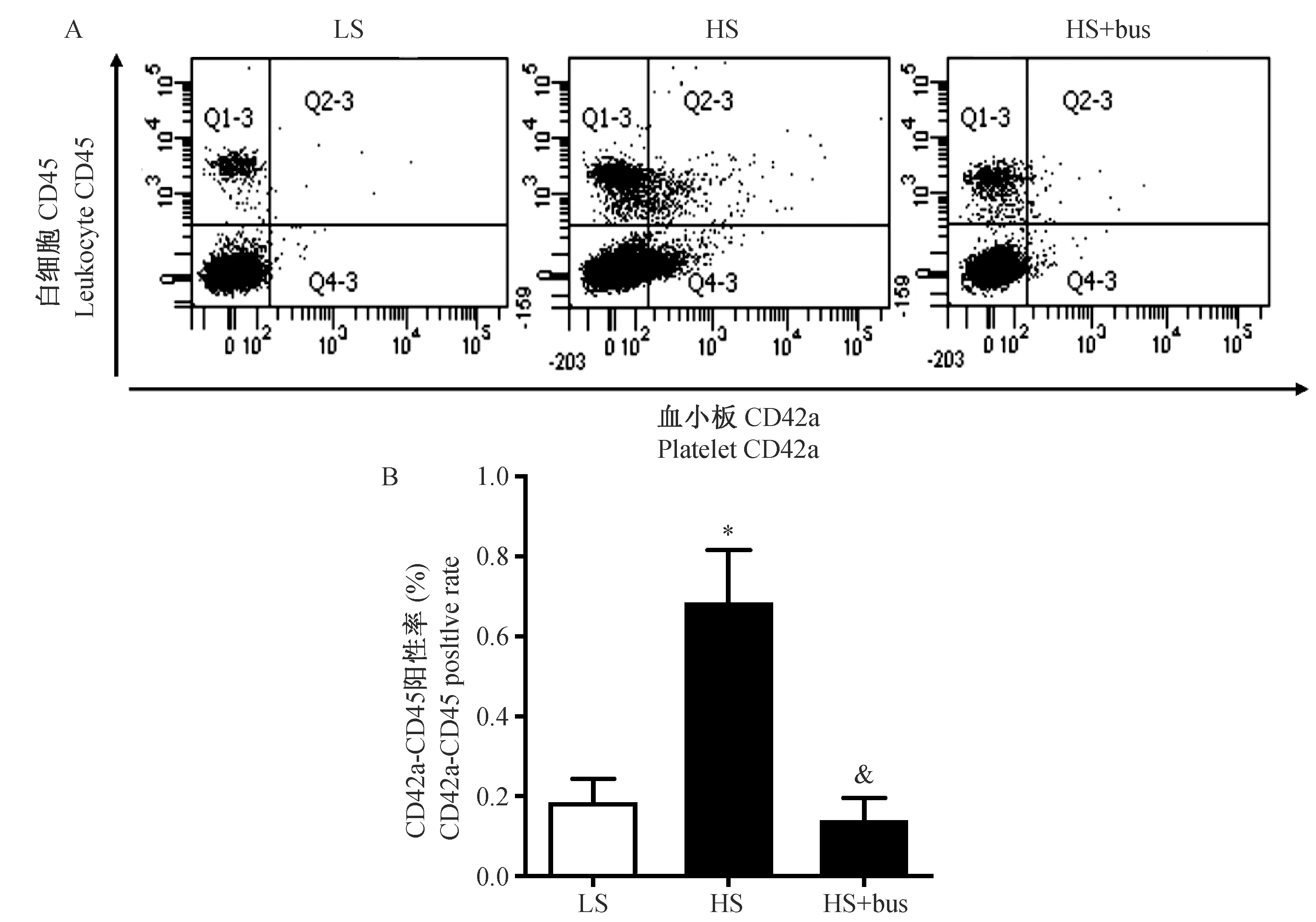
注:LS:低盐饮食;HS:高盐饮食;HS+bus:高盐饮食+血小板抑制剂;*P < 0.05 vs LS;&P < 0.05 vs HS。图3 血小板抑制剂对高盐诱导Dahl SS大鼠外周血PLA的影响Note. LS: low-salt diet; HS: high-salt diet; HS+bus: high-salt diet + platelet inhibitor;*P < 0.05 vs low-salt diet; &P < 0.05 vs high-salt diet.Fig.3 Effects of platelet inhibitor on peripheral platelet-leukocyte aggregation in high-salt diet treated Dahl SS rat
为探索高盐激活血小板参与盐敏感性高血压的病理机制,我们随后检测Dahl SS大鼠外周血中血小板-白细胞聚集(PLA)的变化。发现高盐组Dahl SS大鼠外周血PLA(0.73±0.33比0.16±0.2)的比例较低盐组明显升高;血小板抑制剂可明显的抑制高盐诱导的PLA(0.12±0.08比0.73±0.33)比例的增多(P< 0.05,图3A, B),表明高盐诱导血小板活化,以及血小板-白细胞聚集,从而激活白细胞促进炎症反应。
2.4 血小板抑制剂缓解高盐诱导Dahl SS大鼠主动脉血管的炎症浸润
已有研究显示,活化的血小板通过介导血小板-白细胞聚集,促进免疫细胞在血管内皮上的滚动、粘附和浸润,从而促进血管炎症反应。因此我们检测血管内皮的炎症浸润情况,发现,高盐喂养后,Dahl SS大鼠主动脉血管浸润的T淋巴细胞(34.7±2.9比22.2±3.1,图4A, E)、中性粒细胞(39.3±1.9比27.9±1.5,图4B, F)、B细胞(28.4±1.3比18.3±1.5,图4C, G)和NK细胞(20.4±1.6比13.8±1.0,图4D, H)的比例较低盐组显著增多(P<0.05);高盐喂养同时给予血小板抑制剂则明显降低Dahl SS大鼠主动脉血管浸润的T淋巴细胞(26.5±2.3比34.7±2.9)、中性粒细胞(31.4±2.8比39.3±1.9)、B细胞(24.9±9.8比28.4±1.3)和NK细胞(16.7±1.7比20.4±1.6)的比例(P< 0.05)。表明高盐通过血小板活化诱导了血管内皮炎症浸润。

注:LS:低盐饮食;HS:高盐饮食;HS+bus:高盐饮食+血小板抑制剂;*P < 0.05 vs LS;&P < 0.05 vs HS。图4 血小板抑制剂降低高盐诱导的Dahl SS大鼠血管免疫细胞浸润Note. LS: low-salt diet; HS: high-salt diet; HS+bus: high-salt diet + platelet inhibitor; *P < 0.05 vs low-salt diet; &P < 0.05 vs high-salt diet.Fig.4 Platelet inhibitor reduced the infiltration of immune cells into aortic walls induced by high salt in Dahl SS rat
2.5 血小板抑制剂降低高盐诱导Dahl SS大鼠血清炎症因子IL-6
活化的血小板能够通过促进白细胞聚集促使前炎症因子IL-1、IL-6等的表达和释放,因此我们分析血小板抑制剂对Dahl SS大鼠血清炎症因子IL-6的影响,发现(图5)高盐组大鼠IL-6的水平较低盐组明显升高(51.2±9.7比23.8±0.9,P< 0.05),血小板抑制剂可显著的降低高盐诱导的IL-6水平的升高(26.9±4.8比51.2±9.7,P< 0.05)。显示高盐通过血小板活化诱导了血管内皮及血清中的炎症反应过程,从而参与了盐敏感性高血压的病理过程。

注:0.9%NaCl:正常盐组;1.3%NaCl:*P< 0.05 vs 0.9%NaCl;图6 高盐对血小板Ca2+浓度和p-selectin表达的影响Note. 0.9%NaCl: normal salt group; 1.3%NaCl: high salt group; *P< 0.05 vs 0.9%NaCl.Fig.6 Effects of high salt on platelet Ca2+ concentration and p-selectin expression
2.6 高盐诱导血小板活化的机制
为进一步探索高盐诱导血小板参与盐敏感性高血压的可能机制,我们体外分离纯化SD大鼠的血小板,通过不同浓度盐刺激(0.4%、0.9%、1.3%、1.8% NaCl)检测血小板的活化及血小板内钙离子浓度。我们发现,随着盐浓度升高,血小板活化率呈上升趋势(图6A)后趋于平稳,因此我们选用1.3% NaCl为高盐组,0.9% NaCl为正常盐组。与正常盐组相比,高盐(1.3% NaCl)处理后血小板表面p-selectin表达明显增多(P< 0.05,图6B)。随后我们检测血小板内Ca2+浓度,发现高盐诱导后Ca2+浓度明显升高(P< 0.05,图6C),该结果与体内实验相吻合。因此我们推测,高盐可能通过升高血小板内Ca2+浓度活化血小板,从而诱导血管炎症浸润参与盐敏感性高血压的发生发展。
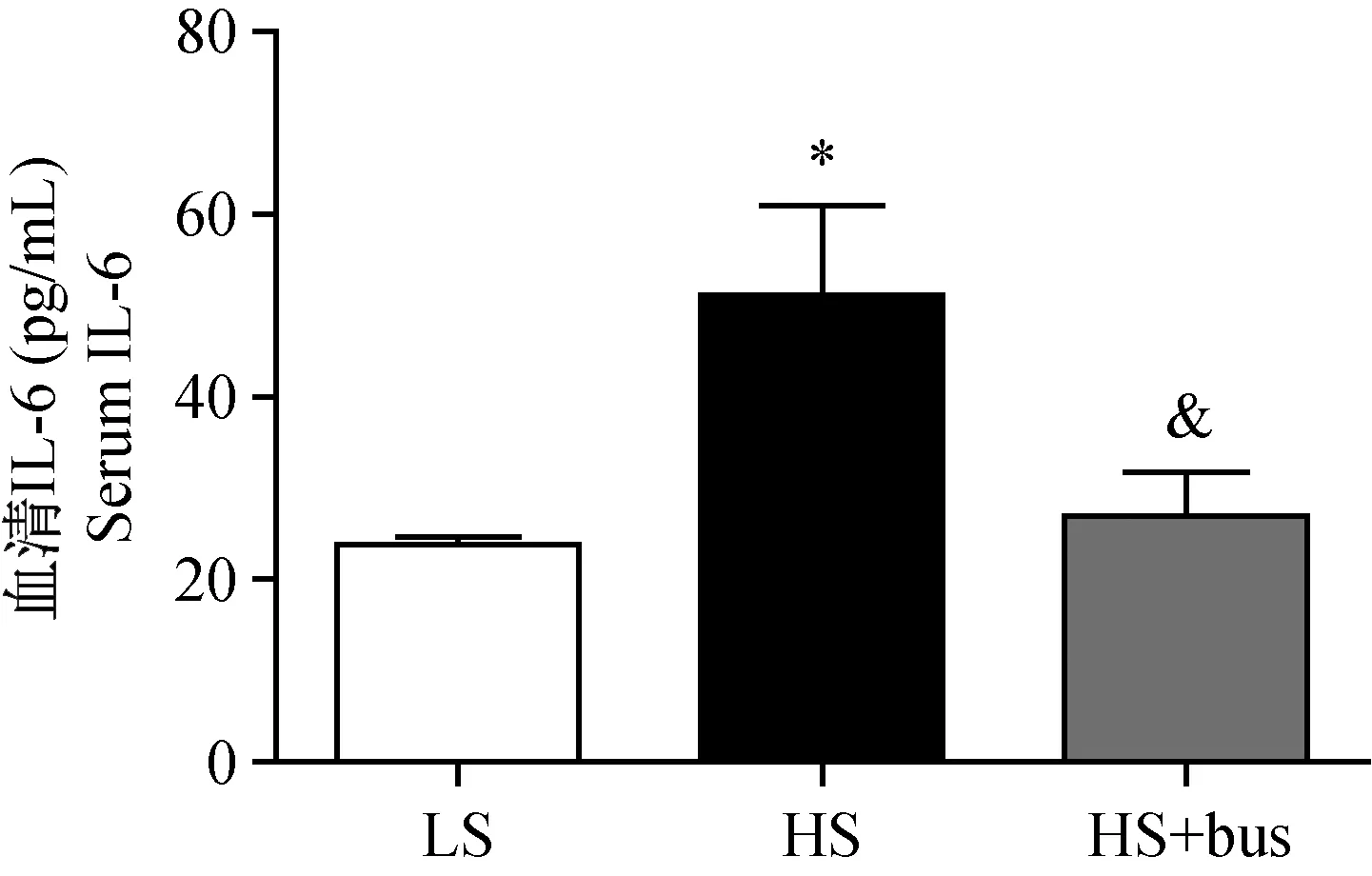
注:LS:低盐饮食;HS:高盐饮食;HS+bus:高盐饮食+血小板抑制剂;Serum IL-6:血清炎症因子IL-6水平;*P < 0.05 vs LS;&P < 0.05 vs HS。图5 血小板抑制剂对高盐诱导Dahl SS大鼠血清炎症因子IL-6的影响Note. LS: low-salt diet; HS: high-salt diet; HS+bus: high-salt diet + platelet inhibitor; Serum IL-6: the level of serum IL-6;*P < 0.05 vs low-salt diet; &P < 0.05 vs high-salt diet.Fig.5 Effect of platelet inhibitor on serum IL-6 induced by high salt in Dahl SS rat
3 讨论
高盐摄入是盐敏感性高血压的重要影响因素[4],其可通过增加氧化应激、活化RAS系统和诱导炎症反应等多种途径促进盐敏感性高血压的发展[13],进而引发动脉粥样硬化、脑卒中、慢性肾病和心脏病等多种心血管事件的发生[5, 14]。高盐饮食是世界范围内高血压相关心血管疾病发病率和死亡率不断增高的主要危险因素。高盐饮食也可诱导血管和肾脏等靶器官的炎症反应[13, 15],而炎症反应已被认为是参与盐敏感性高血压病理损伤的一个重要环节。高盐刺激能够增加外周血白细胞的数量并活化白细胞[16],导致高血压患者体内IL-1β、IL-6、TNF-α等炎症因子表达显著增高[17],从而促进盐敏感性高血压的发生发展。
血小板是由成熟的巨核细胞裂解产生的无细胞核的一种细胞成分,随着对血小板功能的不断认识,血小板功能已经不仅仅局限于凝血,更多研究认为血小板在免疫调节中具有重要作用。活化的血小板通过与多种免疫细胞相互作用完成信号转导。血小板能够诱导T淋巴细胞、B细胞和NK细胞的归巢、活化及募集[18],参与调节固有免疫反应和获得性免疫反应[19]。近年研究显示慢性炎症反应在盐敏感性高血压及心血管疾病发生中起重要作用。临床研究发现,高血压患者体内存在血小板过度活化的现象[20]。血小板局部产生的凝血因子FXI通过参与血管内皮损伤和炎症反应,促进高血压的发展[9]。PPARγ能够调节血小板活化,诱导血管炎症反应及高血压的发展[21]。血小板源性生长因子信号通路的过度活化能够促进心肌纤维化和炎症反应,加速盐敏感性高血压的发展[23]。另外活化的血小板还能够促进白细胞聚集促使前炎症因子IL-1、IL-6、IL-8和TNF-α的表达和释放,加速靶器官的损伤,与动脉粥样硬化、缺血性脑卒中、肾脏再灌注损伤、心脏病等心血管疾病的发生发展密切相关[8, 24]。我们通过研究发现,高盐喂养盐耐受性大鼠(Dahl 13BN)动脉血压不升高,血小板活化不明显(数据未发表),而高盐喂养的Dahl SS大鼠动脉血压显著升高,血小板活化率增加。流式细胞术检测结果显示,Dahl SS大鼠高盐喂养后外周血和主动脉血管浸润的T淋巴细胞、中性粒细胞、B细胞和NK细胞的比例明显增多,血清炎症因子IL-6水平明显增加,表明血小板参与高盐诱导的血管炎症及血压升高的过程。为证实血小板在其中的重要作用,我们通过抑制血小板,观察盐敏感性高血压的发生发展。
白消安是一种非免疫性血小板抑制剂[29, 30],通过抑制血小板聚集而影响血小板的活化过程[31],并且可以显著抑制血小板介导的免疫细胞的聚集和浸润。在大鼠、兔等动物实验中,白消安显著抑制血小板可达90%[26,27],已广泛用于多种心血管疾病病理机制研究。本研究显示血小板抑制剂的使用可明显降低高盐诱导的动脉血压的升高,减少外周血血小板的活化和血小板-白细胞聚集的形成,降低主动脉血管浸润的T淋巴细胞、中性粒细胞、B细胞和NK细胞的比例,降低血清中炎症因子IL-6的水平。表明血小板介导的炎症反应参与了盐敏感性高血压的病理过程,并在其中起着至关重要的作用。
多个研究显示血小板胞质内Ca2+浓度的变化是血小板活化的关键机制[32, 33]。血小板活化剂,如血栓素、胶原等,通过升高血小板内Ca2+浓度活化血小板。血小板内升高的Ca2+浓度可通过活化电压门控性Cl-通道Ano6,促进血小板ROS产生和血小板脱颗粒,导致血小板活化[34];Ca2+也可增加血小板ADP释放,活化血小板[35]。我们的体外实验发现,高盐诱导血小板内Ca2+浓度明显升高,血小板p-selectin表达明显增多,表明高盐可能通过升高血小板内Ca2+浓度活化血小板,可能是血小板参与盐敏感性高血压的病理机制之一。
本研究揭示了血小板在高盐诱导的盐敏感性高血压中的重要作用,并初步探索了血小板参与盐敏感性高血压的可能分子机制,以期为盐敏感性高血压的预防和治疗提供理论依据。
[1] 陈策,张京慧,潘磊,等. 老年人非杓型高血压与动脉粥样硬化的相关性探讨[J]. 中华老年医学杂志,2014,33(5):462-465.
[2] 王占芬,张学艳,任秉丽,等. 进展性脑卒中危险因素分析及与H型高血压的相关性研究[J]. 中国实用神经疾病杂志,2016,19(13):60-62.
[3] Viazzi F, Piscitelli P, Giorda C,etal. Association of kidney disease measures with risk of renal function worsening in patients with hypertension and type 2 diabetes[J].J Diabetes Complications,2017,31(2):419-426.
[4] Armando I, Villar VA, Jose PA. Genomics and Pharmacogenomics of Salt-sensitive Hypertension[J]. Curr Hypertens Rev,2015,11(1):49-56.
[5] Baldo MP, Rodrigues SL, Mill JG. High salt intake as a multifaceted cardiovascular disease: new support from cellular and molecular evidence[J]. Heart Fail Rev,2015,20(4):461-474.
[6] Liu YZ, Chen JK, Li ZP,etal. High-salt diet enhances hippocampal oxidative stress and cognitive impairment in mice[J]. Neurobiol Learn Mem,2014,114:10-15.
[7] Strazzullo P, D'Elia L, Kandala NB,etal. Salt intake, stroke, and cardiovascular disease: meta-analysis of prospective studies[J]. BMJ,2009,339:b4567.
[8] Rondina MT, Weyrich AS, Zimmerman GA. Platelets as cellular effectors of inflammation in vascular diseases[J]. Circ Res,2013,112(11):1506-1519.
[9] Kossmann S, Lagrange J, Jackel S,etal. Platelet-localized FXI promotes a vascular coagulation-inflammatory circuit in arterial hypertension[J]. Sci Transl Med,2017,9(375).
[10] Larrousse M, Bragulat E, Segarra M,etal. Increased levels of atherosclerosis markers in salt-sensitive hypertension[J]. Am J Hypertens,2006,19(1):87-93.
[11] Kornerup KN, Salmon GP, Pitchford SC,etal. Circulating platelet-neutrophil complexes are important for subsequent neutrophil activation and migration[J].J Appl Physiol,2010,109(3):758-767.
[12] Pitchford SC, Yano H, Lever R,etal. Platelets are essential for leukocyte recruitment in allergic inflammation[J]. J Allergy Clin Immunol,2003,112(1):109-118.
[13] Zhou MS, Schulman IH, Raij L. Vascular inflammation, insulin resistance, and endothelial dysfunction in salt-sensitive hypertension: role of nuclear factor kappa B activation[J]. J Hypertens,2010,28(3):527-535.
[14] Shimoura CG, Lincevicius GS, Nishi EE,etal. Increased Dietary Salt Changes Baroreceptor Sensitivity and Intrarenal Renin-Angiotensin System in Goldblatt Hypertension[J].Am J Hypertens,2017,30(1):28-36.
[15] Huang B, Cheng Y, Usa K,etal. Renal Tumor Necrosis Factor alpha Contributes to Hypertension in Dahl Salt-Sensitive Rats[J]. Sci Rep,2016,6:21960.
[16] Shen K, Delano FA, Zweifach BW,etal. Circulating leukocyte counts, activation, and degranulation in Dahl hypertensive rats[J]. Circ Res,1995,76(2):276-283.
[17] Hong S, Dimitrov S, Cheng T,etal. Beta-adrenergic receptor mediated inflammation control by monocytes is associated with blood pressure and risk factors for cardiovascular disease[J]. Brain Behav Immun,2015,50:31-38.
[18] Li N. Platelet-lymphocyte cross-talk[J]. J Leukoc Biol,2008,83(5):1069-1078.
[19] Totani L, Evangelista V. Platelet-leukocyte interactions in card-iovascular disease and beyond[J]. Arterioscler Thromb Vasc Biol,2010,30(12):2357-2361.
[20] Chou TC. New mechanisms of antiplatelet activity of nifedipine, an L-type calcium channel blocker[J]. Biomedicine (Taipei),2014,4:24.
[21] Rao F, Yang RQ, Chen XS,etal. PPARgamma ligands decrease hydrostatic pressure-induced platelet aggregation and proinflamm-atory activity[J]. PLoS One,2014,9(2):e89654.
[22] Helmke A, von Vietinghoff S. Extracellular vesicles as mediators of vascular inflammation in kidney disease[J]. World J Nephrol,2016,5(2):125-138.
[23] Fan B, Ma L, Li Q,etal. Correlation between platelet-derived growth factor signaling pathway and inflammation in desoxycort-icosterone-induced salt-sensitive hypertensive rats with myocardial fibrosis[J]. Int J Clin Exp Pathol,2013,6(11):2468-2475.
[24] Smith T, Dhunnoo G, Mohan I,etal. A pilot study showing an association between platelet hyperactivity and the severity of peripheral arterial disease[J]. Platelets,2007,18(4):245-248.
[25] Kral JB, Schrottmaier WC, Salzmann M,etal. Platelet Interaction with Innate Immune Cells[J]. Transfus Med Hemother,2016,43(2):78-88.
[26] Schmalbach B, Stepanow O, Jochens A,etal. Determinants of platelet-leukocyte aggregation and platelet activation in stroke[J]. Cerebrovasc Dis,2015,39(3-4):176-180.
[27] Godley RW, Hernandez-Vila E. Aspirin for Primary and Secondary Prevention of Cardiovascular Disease[J]. Tex Heart Inst J,2016,43(4):318-319.[28] Singbartl K, Forlow SB, Ley K. Platelet, but not endothelial, P-selectin is critical for neutrophil-mediated acute postischemic renal failure[J]. FASEB J,2001,15(13):2337-2344.
[29] Pitchford SC, Riffo-Vasquez Y, Sousa A,etal. Platelets are necessary for airway wall remodeling in a murine model of chronic allergic inflammation[J]. Blood,2004,103(2):639-647.
[30] Zarbock A, Singbartl K, Ley K. Complete reversal of acid-induced acute lung injury by blocking of platelet-neutrophil aggregation[J]. J Clin Invest,2006,116(12):3211-3219.
[31] Qiao J, Wu Y, Liu Y,etal. Busulfan Triggers Intrinsic Mitochondrial-Dependent Platelet Apoptosis Independent of Platelet Activation[J]. Biol Blood Marrow Transplant,2016,22(9):1565-1572.
[32] 吴鸿. 血小板活化过程中的钙离子信号[J]. 生理科学进展,2012,43(6):417-421.
[33] Davlouros P, Xanthopoulou I, Mparampoutis N,etal. Role of Calcium in Platelet Activation: Novel Insights and Pharmacological Implications[J]. Med Chem,2016,12(2):131-138.
[34] Liu G, Liu G, Chen H,etal. Involvement of Ca2+Activated Cl- Channel Ano6 in Platelet Activation and Apoptosis[J]. Cell Physiol Biochem,2015,37(5):1934-1944.
[35] Canobbio I, Guidetti GF, Oliviero B, et al. Amyloid beta-peptide-dependent activation of human platelets: essential role for Ca2+and ADP in aggregation and thrombus formation[J]. Biochem J,2014,462(3):513-523.
The study on the mechanism of platelet in the development of salt-sensitive hypertension via inflammation
MAO Hong-ya, LIU Yun-peng, WANG Zi-hao, JIANG Xiao-liang, LIU Xing, YANG Zhi-wei*
(Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences &eking Union Medical College, Beijing 100021, China)
Objective To investigate the role and mechanism of platelet in the development of salt-sensitive hypertension.Methods 25 Dahl salt-sensitive rats (Dahl SS) were divided into three groups: low-salt diet (0.12% NaCl, LS), high-salt diet (8%NaCl, HS) and high-salt diet + platelet inhibitor (8%NaCl+busulfan, HS+bus). Blood pressures were measured by tail-cuff method. After six weeks, animals were sacrificed. Platelet p-selectin expression, platelet cytosolic Ca2+concentration, platelet-leukocyte aggregation (PLA) in peripheral blood, and immune cells infiltrated on aortic walls were assessed by flow cytometry, and serum IL-6 level was tested by ELISA in vivo. Platelets purified from SD rats were treated with normal salt (0.9%NaCl) and high salt (1.3%NaCl), then the cytosolic Ca2+concentration and p-selectin expression of platelet were detected. Results We found that Dahl SS rats with high-salt diet, relative to low-salt diet, presented with high blood pressure and increased the ratio of platelet p-selectin expression, Ca2+concentration. IL-6 level and PLA in peripheral blood, and the number of infiltrated immune cells on aortic walls were also significantly elevated in high-salt diet group. The whole events were ameliorated by the platelet inhibitor busulfan. Cytosolic Ca2+concentration and p-selectin expression were also increased in purified platelets treated with high salt than those treated with low salt (P< 0.05). Conclusions Our findings suggest that high salt induced platelet activation with increased Ca2+concentration may play an important role in the development of salt-sensitive hypertension via vascular inflammation. However, the detailed mechanisms of platelet activation and development of high blood pressure via inflammation induced by high salt intake remain to be determined.
Salt-sensitive hypertension; High salt; Platelet; Inflammation
国家自然科学基金面上项目(81600387);国家自然基金青年项目(81600334);研究所基本业务费(DWS201604)。
毛红亚(1990-),女,硕士研究生,研究方向:高血压发病机制。E-mail: hongya820@sina.com
杨志伟(1969-),男,研究员。E-mail: yangzhiwei@cnilas.pumc.edu.cn
R-33
A
1671-7856(2017) 05-0023-08
10.3969.j.issn.1671-7856. 2017.05.008
2017-01-05

