小续命汤有效成分组对脑缺血/再灌注大鼠恢复早期脑线粒体的保护作用研究
杜肖+路畅+贺晓丽+杜冠华

[摘要] 观察小续命汤有效成分组对脑缺血/再灌注大鼠恢复早期脑线粒体的作用,研究其对脑缺血/再灌注大鼠恢复早期的神经保护作用机制。采取插线法制备大鼠大脑中动脉阻塞脑缺血模型,2 h后再灌注。应用Zea-Longa′s级标准评分法评价动物脑缺血程度,将模型成功大鼠随机分为模型组、小续命汤有效成分低、中、高剂量组和阳性药金纳多组,以假手术大鼠作为对照组。于给药5 d后梯度离心提取大鼠脑组织缺血周边区线粒体,通过Clark氧电极法检测线粒体呼吸功能,荧光探针法检测线粒体内ROS含量及线粒体膜电位,分光光度法检测线粒体琥珀酸脱氢酶活性和脑组织ATP含量。结果显示,小续命汤有效成分组能够显著改善脑缺血再灌注大鼠恢复早期脑线粒体的呼吸功能,提高线粒体琥珀酸脱氢酶的活性,降低线粒体ROS的含量,提高脑线粒体膜电位,促进脑组织ATP的合成。提示小续命汤有效成分组能够明显减轻脑缺血再灌注早期导致的脑组织能量代谢紊乱,改善脑线粒体结构和功能损伤,说明小续命汤有效成分组对脑线粒体的保护作用可能是其发挥神经保护的作用机制之一。
[关键词] 小续命汤有效成分组;脑缺血/再灌注;线粒体功能;氧化磷酸化;活性氧;膜电位
[Abstract] To observe the effect of active components group of Xiaoxuming decoction (XXMD) on brain mitochondria in cerebral ischemia/reperfusion rats during early recovery period,and study its protective mechanism for nerves in cerebral ischemia/reperfusion rats during early recovery period. Cerebral ischemia model of middle cerebral artery occlusion in rats was established by suture method,and reperfusion was conducted 2 h later. The degree of cerebral ischemia in rats was evaluated by using Zea-Longa′s standard grading method,and the model rats were randomly divided into model group,Xiaoxuming decoction active components low,medium and high dose groups and positive drug Ginaton group,with sham operated rats as control group. Gradient centrifugation was used to extract the mitochondria from rat brain after 5 days of drug administration. Then the mitochondrial respiratory function was measured by Clark oxygen electrode method;mitochondrial membrane potential and the mitochondrial reactive oxygen species(ROS) level were detected by fluorescence probe methods;and the activity of mitochondrial succinodehydrogenase (SDH) and the content of ATP in the ischemic region of MCAO rats were measured by spectrophotometric method. The results showed that as compared with the model group,XXMD could significantly improve mitochondrial respiratory activity,increase the activity of SDH,reduce the level of ROS,increase mitochondrial membrane potential and obviously promote the synthesis of ATP in brain tissues. The results indicated that XXMD active components group could alleviate the energy metabolism disorders,protect brain mitochondrial damage and improve mitochondrial function in MCAO rats,which may be the mechanism of its neuroprotection activity.
[Key words] active components group of Xiaoxuming decoction;cerebral ischemic/reperfusion;mitochondrial function;oxidative phosphorylation;reactive oxygen species;membrane potential
腦卒中是引起我国居民死亡的首要因素,包括缺血性脑卒中(脑梗死)和出血性脑卒中2种,其中缺血性脑卒中所占比例约为60%~80%[1-2]。研究发现,脑缺血再灌注损伤与线粒体功能障碍密切相关,脑缺血后多种病理因素共同作用致使线粒体发生损伤[3-4],而损坏的线粒体又会成为加剧缺血再灌注损伤的继发性关键因素[5-6]。因此寻找干预手段,改善脑缺血再灌注后脑线粒体结构和功能障碍,对于缺血性卒中的防治具有重要意义。
小续命汤有效成分组是根据中药复方小续命汤适应症脑缺血的发病机制,通过相关体外筛选模型优化确定的小续命汤抗脑缺血的有效药理活性组分[7]。近年来,随着对小续命汤有效成分组化学成分研究工作的开展,其药效物质基础日益明确。运用液质联用技术对小续命汤有效成分组进行分析,鉴定出了包括黄芩苷、芍药苷、甘草素、升麻苷、黄芩素、白杨素等15种主要成分[8],其中黄酮类和色原酮类化合物分别为其主要入血和入脑成分[9]。前期研究结果显示,小续命汤有效成分组对慢性脑缺血(2VO)大鼠和急性脑缺血再灌注(MCAO)大鼠均具有明显的神经保护作用[10-12],抑制慢性脑缺血导致的氧化应激损伤[11],显著改善急性脑缺血大鼠的神经症状障碍[12],但其是否通过保护脑线粒体途径对MCAO大鼠起保护作用目前尚不明確。因此本研究将从改善脑线粒体功能的角度探讨小续命汤有效成分组对MCAO大鼠的保护作用,进一步深入了解小续命汤有效成分组对缺血性脑卒中的作用机制。
1 材料
1.1 动物 Sprague-Dawley大鼠,雄性,体重230~250 g,北京华阜康生物科技股份有限公司提供,许可证号SCXK(京)2014-0004。
1.2 药物及试剂 小续命汤有效成分组(XXMD)由中国医学科学院药物研究所筛选中心提供;金纳多(银杏叶提取物片EGb 761)由德国威玛舒培博士药厂生产(批号9420516);羧甲基纤维素钠(sodium carboxymethylcellulose,CMC-Na)购于广东汕头市西陇化工厂;考马斯亮蓝蛋白定量试剂盒购于普利莱基因技术有限公司;ATP测定试剂盒购于南京建成生物工程研究所;琥珀酸脱氢酶(SDH)测试盒和活性氧检测试剂盒购于碧云天生物技术公司。
1.3 仪器 Sorvall ST-16R高速冷冻台式离心机(德国Thermo公司);Spectra Max M5酶标仪(美国Molecular Devices公司);AL104电子分析天平(上海梅特勒-托利多仪器有限公司);Delta320 pH计(上海梅特勒-托利多仪器有限公司);HHS型数显式电热恒温水浴锅(上海博迅实业有限公司医疗设备厂);Infinite M1000Pro多功能酶标仪(瑞士Tecan公司)。
2 方法
2.1 动物模型制备及分组 大鼠经适应性饲养后,禁食给水12 h,采用插线法制备大鼠MCAO模型,假手术组大鼠术中不插入线栓。依据Zea-Longa′s级标准评分法[13]对大鼠神经功能缺损进行评分,取评分介于1~3分视为造模成功,评分过高及评分为0的动物弃之不用。给药剂量和给药时间参照前期研究的结果[12],将造模成功大鼠按照体重随机分为:模型组、小续命汤有效成分组低、中、高剂量组(XXMD-L,75 mg·kg-1;XXMD-M,150 mg·kg-1;XXMD-H,300 mg·kg-1)以及阳性药金纳多组(EGb 761,150 mg·kg-1),以假手术组大鼠作为对照组。术后24 h时首次给药,后每日1 次灌胃给药,连续给药5 d。小续命汤有效成分组和金纳多均采用0.5%羧甲基纤维素钠配制。假手术组与模型组大鼠灌胃给予等体积溶剂为对照。
2.2 脑线粒体的提取 脑线粒体的提取方法参照前期研究[14]。给药5 d时,采用梯度离心法提取大鼠缺血周边区脑组织线粒体。大鼠断头取脑,冰上分离缺血周边脑组织,剪碎后移入玻璃匀浆器中,按照10 mL·g-1脑组织加入预冷线粒体分离缓冲液(250 mmol·L-1glucose,10 mmol·L-1 Tris-HCl,1 mmol·L-1EDTA,0.2%BSA),手动轻柔匀浆10次。匀浆液以700×g离心10 min,取上清以1万×g离心10 min,所得沉淀即为线粒体。将线粒体用分离缓冲液重悬洗涤1次,1万×g离心10 min,得到较纯净的线粒体。应用分离缓冲液重悬制备线粒体悬液,Bradford法测定线粒体蛋白浓度。
2.3 脑线粒体呼吸功能的测定 取新鲜制备的线粒体悬液,采用Clark氧电极法检测大鼠脑线粒体的呼吸功能[15]。将线粒体呼吸介质(225 mmol·L-1glucose,5 mmol·L-1KH2PO4,10 mmol·L-1Tris,10 mmol·L-1KCl,0.2 mmol·L-1EDTA,100 mg·L-1BSA)加入1 mL反应池中孵育2 min,以空气饱和,加入新鲜线粒体蛋白1 mg,1~2 min后,测定NADH呼吸链或FADH2呼吸链活性,依次加入10 μL外源反应底物(10 mmol·L-1谷氨酸钠和5 mmol·L-1苹果酸1∶1的混合物或10 mmol·L-1琥珀酸钠)和5 μL 250 mmol·L-1ADP。根据氧耗曲线计算线粒体各项氧化磷酸化参数:磷氧比值(P/O),3态呼吸速率(V3),4态呼吸速率(V4),呼吸控制指数(RCR)及氧化磷酸化效率(OPR)。
2.4 脑线粒体活性氧(ROS)含量的测定 采用荧光探针2,7-二氯乙酰荧光素(DCFH-DA)检测大鼠缺血侧脑组织线粒体内的ROS含量。ROS能够将DCFH氧化成二氯荧光素(DCF),且DCF的生成速率与ROS含量呈正相关[16]。将线粒体悬液与10 μmol·L-1的DCFH-DA混匀于37 ℃条件下孵育60 min,488 nm激发波长,525 nm发射波长条件下测定荧光强度,具体操作按照试剂盒说明书进行。
2.5 脑线粒体膜电位的测定 采用线粒体选择特异性荧光探针Rhodamine 123检测线粒体膜电位[17]。在膜电位反应缓冲液(150 mmol·L-1glucose,5 mmol·L-1MgCl2,5 mmol·L-1succinate,2.7 mmol·L-1rotenone,5 mmol·L-1KH2PO4,20 mmol·L-1hepes,pH 7.4)中加入终浓度为1 μmol·L-1的Rhodamine 123,在37 ℃,488 nm激发波长,530 nm发射波长条件下测定基础荧光值。加入50 μL(0.2 mg)线粒体蛋白混匀后,测定10 min内Rhodamine 123被线粒体俘获后的荧光值,根据Nernst方程计算线粒体膜电位。
2.6 脑线粒体琥珀酸脱氢酶活性的测定 琥珀酸脱氢酶属于细胞色素氧化酶,是反映线粒体功能的标志酶之一,其活性能够反映线粒体三羧酸循环的程度。于-80 ℃取出冻存的脑线粒体悬液,置于冰水浴中融化。采用超声法破碎线粒体。应用分光光度法检测缺血再灌注大鼠缺血侧脑线粒体内琥珀酸脱氢酶(SDH)的活性。具体操作按照试剂盒说明书进行。
2.7 脑组织ATP含量的测定 按文献方法[18],借助大鼠模具,取缺血侧大脑在距额叶前端3~9 mm处进行冠状切片,中间脑组织在距离矢状缝2 mm处做矢状切片并弃去,剩余脑组织即为缺血核心区和半暗带区。称取脑组织,按质量-体积=1∶9(g·L-1)比例加入相应预冷生理盐水,冰浴研磨制备10%脑匀浆,3 000 r·min-1离心10 min,取上清液于沸水浴中煮沸10 min,混匀抽提1 min,3 500 r·min-1离心10 min,取上清液用磷钼酸比色法测定ATP含量。具体操作按照ATP含量测试盒说明书进行。
2.8 统计方法 计量实验数据均以±s表示,采用SPSS 17.0 统计软件对各组数据进行分析处理。组间均值比较采用单因素方差分析(ANOVA),组间数据的多重比较采用LSD法,并结合Dunnett′s T检验,P<0.05表示差异存在统计学意义。
3 结果
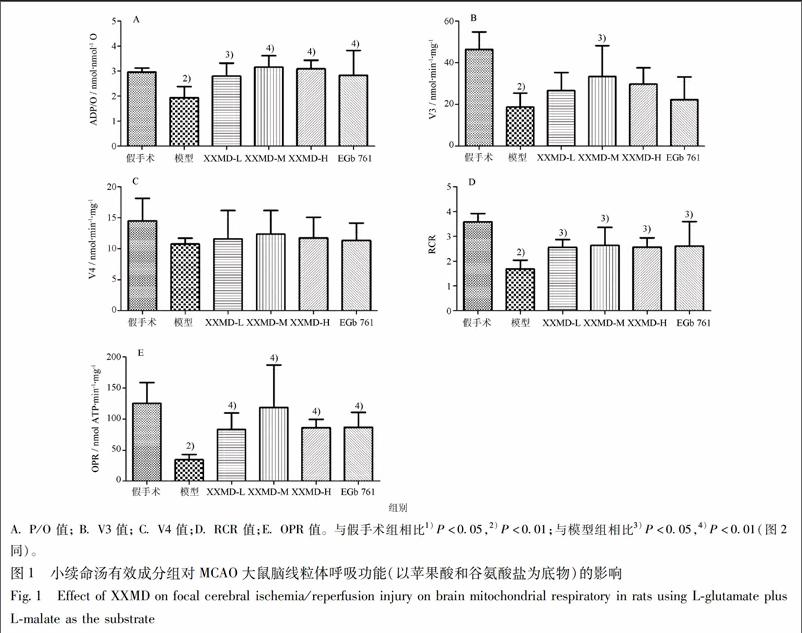
3.1 小续命汤有效成分组对MCAO大鼠脑线粒体呼吸功能的影响 线粒体呼吸功能反映线粒体氧化速率和线粒体氧化磷酸化效率,线粒体P/O越接近理论值,表明其氧化磷酸化效率越高,生成ATP的能力也越强;RCR比值越大,表明线粒体结构越完整。与假手术组相比,在NADH呼吸链启动的条件下,模型组大鼠脑线粒体P/O,V3,RCR和OPR均显著降低(P<0.05,P<0.01),说明脑缺血再灌注后大鼠脑线粒体呼吸效率下降,氧化磷酸化功能降低;与模型组相比,XXMD组和阳性药EGb 761组可明显改善线粒体呼吸功能各项指标,显著提高P/O,RCR和OPR值 (P<0.05,P<0.01),见图1。
在FADH2呼吸链启动的条件下,与假手术组相比,模型组大鼠脑线粒体的P/O,V3,RCR和OPR均显著降低(P<0.05,P<0.01),说明脑缺血再灌注后大鼠脑线粒体呼吸效率下降,氧化磷酸化功能
降低;与模型组相比,XXMD组和阳性药EGb 761组大鼠脑线粒体P/O和OPR均显著提高(P<0.05,P<0.01),从而改善线粒体的氧化磷酸化功能,见图2。以上结果说明线粒体的功能损伤不仅涉及复合酶体I,而且涉及整个呼吸链,见图2。
3.2 小续命汤有效成分组对MCAO大鼠脑组织线粒体内ROS含量的影响 DCF的荧光强度与ROS的水平呈正相关,可以反映细胞内ROS的水平。与假手术组相比,模型组大鼠缺血核心区和半暗带区脑组织线粒体内DCF荧光值明显增加,证实线粒体内ROS含量显著升高(P<0.01);与模型组相比,XXMD组和阳性药EGb 761组相应脑组织线粒体内ROS含量明显降低(P<0.05,P<0.01),见图3。
3.3 小续命汤有效成分组对MCAO大鼠脑线粒体膜电位的影响 线粒体膜电位是反映线粒体功能的重要指标,膜电位改变影响质子泵功能,进而影响ATP的生成。Rhodamine 123的线粒体俘获率与膜电位呈正比。与假手术组相比,模型组大鼠脑组织线粒体膜电位显著降低(P<0.01);与模型组相比,XXMD低、中剂量组和阳性药EGb 761组均能明显提高大鼠脑组织线粒体膜电位(P<0.05),见图4。
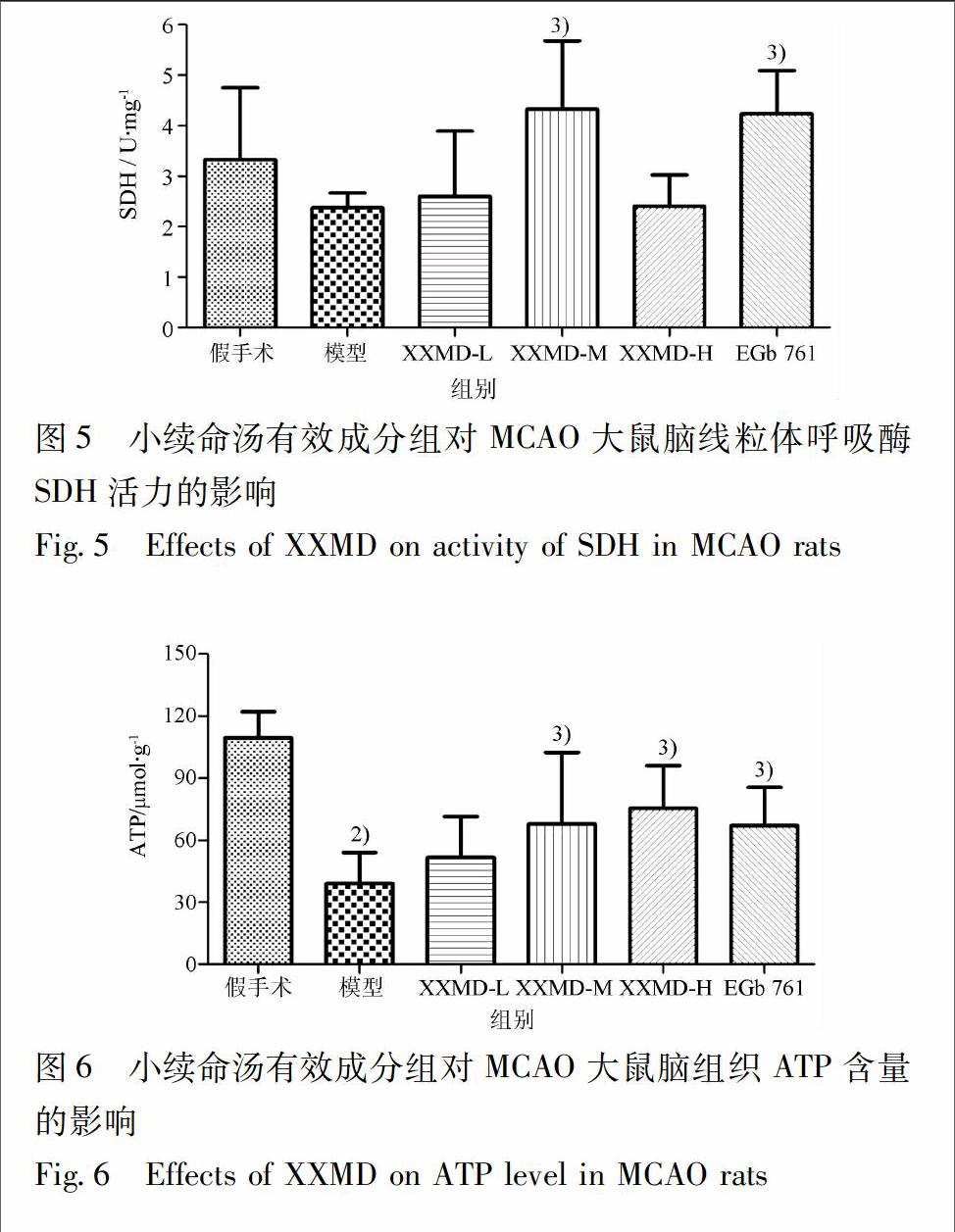
3.4 小续命汤有效成分组对MCAO大鼠腦线粒体琥珀酸脱氢酶活力的影响 SDH是参与三羧酸循环的关键酶,在氧化磷酸化和电子传递过程中起着枢纽作用,其活性能够反映线粒体功能完整性。与假手术组相比,模型组大鼠脑组织线粒体中SDH活力发生了一定程度的降低,但差异无统计意义;与模型组相比,XXMD中剂量组和阳性药EGb 761组相应脑线粒体中SDH活力显著提高(P<0.05),见图5。
与假手术组相比1)P<0.05,2)P<0.01;与模型组相比3)P<0.05,4)P<0.01(图4~6同)。
3.5 小续命汤有效成分组对MCAO大鼠脑组织ATP含量的影响 ATP含量可以直观反映细胞能量代谢水平和能量系统功能恢复情况。与假手术组相比,模型组大鼠缺血核心区和半暗带区脑组织ATP含量显著降低(P<0.01);与模型组相比,XXMD中、高剂量组和阳性药EGb 761组相应脑组织中ATP含量明显升高(P<0.05),见图6。
4 讨论
脑组织仅能通过葡萄糖供能的能量供应特点,使其成为了最易产生能量耗竭进而发生缺血/再灌注损伤的器官[6,19-20]。脑缺血发生时,缺血、缺氧可以造成线粒体结构的破坏,并通过影响线粒体代谢关键酶,包括氧化磷酸化相关酶:NADH脱氢酶和COX;三羧酸循环相关酶:丙酮酸脱氢酶β和二氢硫辛酸转乙酰化酶及脂肪酸和氨基酸代谢相关酶的表达影响线粒体的能量供应,造成ATP合成下降[14,21]。脑缺血和脑缺血/再灌注还可以降低线粒体的呼吸功能,使线粒体P/O减低,3态呼吸下降,无效4态呼吸增加并减弱线粒体OPR,降低氧利用速度[22-23]。本研究结果显示,脑缺血再灌注5 d时,线粒体氧化磷酸功能仍严重受损,表现为MCAO大鼠脑线粒体的P/O,V3,RCR和OPR显著降低,ATP合成明显减少,而XXMD和EGb 761可以通过提高MCAO大鼠脑线粒体P/O,RCR,OPR和SDH的活力改善MCAO大鼠恢复早期脑线粒体的氧化磷酸化效率,提高线粒体呼吸酶的活性,增加ATP的合成,从而缓解缺血脑组织能量耗竭,减轻能量耗竭对神经元细胞的损伤,起到脑缺血保护作用。
脑再灌注时期,由恢复供氧引起的氧化应激反应是引发再灌注损伤的核心环节,而线粒体则是其中最关键的环节[24]。氧化应激对线粒体的损伤是脑缺血再灌注损伤病理进程中的重要环节,脑缺血/再灌注在极短时间内即可损伤线粒体,并对线粒体存在长时间的持续性氧化应激损伤,最终造成线粒体的永久性破坏[25-26]。氧化应激由ROS所介导,伴随有氧化-抗氧化物质失衡,在脑缺血再灌注损伤中发挥着重要的作用。脑缺血/再灌注后ROS大量生成,ROS损伤线粒体蛋白质和 mtDNA 等生物大分子,并通过直接和间接途径调控MPTP开放,导致线粒体膜通透性增加,引起线粒体膜电位下降,释放凋亡相关蛋白,启动线粒体凋亡通路[25]。而脑缺血/再灌注后,过高的氧化应激水平和钙超载可以引起MPTP持续性开放,导致大量水分子进入线粒体,引起线粒体肿胀并造成线粒体崩解,并进一步触发线粒体凋亡,最终引起细胞死亡[27]。本课题组前期研究结果显示,XXMD治疗给药可以显著改善MCAO大鼠的神经症状障碍,降低给药5 d时MCAO大鼠脑梗死体积百分比,其脑保护作用机制与改善MCAO大鼠氧化应激水平,调节缺血脑组织氧化-抗氧化平衡有关[12]。本研究结果进一步发现,脑缺血再灌注5 d时MCAO大鼠缺血脑组织线粒体内ROS含量仍显著高于假手术组、膜电位也存在显著下降,而XXMD和EGb 761则可显著降低MCAO大鼠脑线粒体ROS含量,提高线粒体的膜电位,从线粒体角度确证了XXMD对MCAO大鼠氧化应激水平的改善作用,并对其机制做出了进一步的补充。
综上所述,本研究证实了XXMD可以减轻MCAO大鼠恢复早期的线粒体结构损伤和功能异常,表现为改善线粒体氧化磷酸化水平,提高线粒体呼吸酶活性,减少ROS的生成,抑制线粒体膜电位的下降,促进ATP的生成。提示XXMD能够明显改善脑缺血/再灌注大鼠恢复早期的线粒体功能紊乱,说明XXMD对MCAO大鼠恢复早期发挥神经保护的作用机制与其对线粒体的改善作用相关。在此基础上,将从线粒体凋亡和线粒体自噬等调控线粒体稳态平衡的角度,进一步探讨XXMD对MCAO大鼠恢复早期的神经保护作用机制。
[参考文献]
[1] 国家卫生计生委脑卒中筛查与防治工程委员会. 脑卒中筛查与防治技术规范[J]. 中国医学前沿杂志电子版,2013,5(9):44.
[2] 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中国医学前沿杂志电子版,2010,2(4):16.
[3] 安泳潼,夏玉叶,闵旸. 缺血性脑卒中的发病机制及其治疗[J].世界临床药物,2010,31(1):35.
[4] Liu K,Sun Y,Gu Z,et al. Mitophagy in ischaemia/reperfusion induced cerebral injury[J]. Neurochem Res,2013,38(7):1295.
[5] Vosler P S,Graham S H,Wechsler L R,et al. Mitochondrial targets for stroke: focusing basic science research toward development of clinically translatable therapeutics[J]. Stroke,2009,40(9): 3149.
[6] Calo L,Dong Y,Kumar R,et al. Mitochondria dynamics: an emerging paradigm in ischemia-reperfusion injury[J]. Curr Pharm Des,2013,19(39):6848.
[7] 王月华,秦海林,贺晓丽,等.中药复方小续命汤组分活性评价及抗脑缺血有效成分组制备[J].中国中药杂志,2011,36(15):2140.
[8] Wang Y L,Ding C G,Du K H,et al. Identification of active compounds and their metabolites by high-performance liquid chromatography/electrospray ionization Fourier transform ion cyclotron resonance mass spectrometry from Xiao-xu-ming decoction (XXMD)[J]. Rapid Commun Mass Spectrom,2009,23(17):2724.
[9] Wang C H,Jia Z X,Wang Z,et al. Pharmacokinetics of 21 active components in focal cerebral ischemic rats after oral administration of the active fraction of Xiao-Xu-Ming decoction[J]. J Pharm Biomed Anal,2016,122:110.
[10] 王月華,贺晓丽,杨海光,等.小续命汤有效成分组对局灶性脑缺血大鼠的作用[J].中国药学杂志,2012,47(3):194.
[11] 贺晓丽,王月华,秦海林,等.小续命汤有效成分对慢性脑缺血大鼠氧化应激损伤及细胞凋亡的影响[J].中华神经医学杂志,2012,11(12):1214.
[12] 路畅,杜肖,贺晓丽,等.小续命汤有效成分组对局灶性脑缺血/再灌注大鼠恢复早期的神经保护作用研究[J].中国药理学通报,2016,32(7):938.
[13] Longa E Z,Weisntein P R,Carisoin S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1): 84.
[14] 賀晓丽,毕明刚,杜冠华.慢性脑缺血大鼠脑组织线粒体蛋白质组与能量代谢相关性研究[J].中国药理学通报,2012,28(9):1200.
[15] Chávez J C,Pichiule P,Boero J,et al. Reduced mitochondrial respiration in mouse cerebral cortex during chronic hypoxia[J]. Neurosci Lett,1995,193(3):169.
[16] Xiao M,Chun F,Guo P. Atorvastatin attenuates homocysteine-induced apop tosis in human umbilical vein endothelial cells via inhibiting NADPH oxidase-related oxidative stress-triggered p38MAPK signaling[J]. Acta Pharmacol Sin,2009,30(10):1392.
[17] Emaus R K,Grunwald R,Lemasters J J. Rhodamine 123 as a probe of transmembrane potential in isolated rat-liver mitochondria: spectral and metabolic properties[J]. Biochim Biophys Acta,1986,850(850):436.
[18] Ashwal S,Tone B,Tian H R,et al. Core and penumbral nitric oxide synthase activity during cerebral ischemia and reperfusion[J]. Stroke,1998,29(5): 1037.
[19] Sas K,Robotka H,Toldi J,et al. Mitochondria,metabolic disturbances,oxidative stress and the kynurenine system,with focus on neurodegenerative disorders[J]. J Neurosci,2007,257(1/2):221.
[20] Broussalis E,Trinka E,Killer M,et al. Current therapies in ischemic stroke. Part B. Future candidates in stroke therapy and experimental studies[J]. Drug Discov Today,2012,17(13/14):671.
[21] Lan R,Zhang Y,Xiang J,et al. Xiao-xu-ming decoction preserves mitochondrial integrity and reduces apoptosis after focal cerebral ischemia and reperfusion via the mitochondrial p53 pathway[J]. J Ethnopharmacol,2014,151(1): 307.
[22] 王月华,贺晓丽,李晓秀,等. 小续命汤有效成分组对慢性脑缺血大鼠脑线粒体的保护作用[J]. 中西医结合学报,2012,10(5):569.
[23] Schapira A H V. Mitochondrial dysfunction in neurodegenerative diseases[J]. Neurochem Res,2008,110(12):87.
[24] 杨晴,李新宇.全脑缺血/再灌注致线粒体损伤的研究进展[J].医学综述,2011,17(11):1619.
[25] 李强,翟宇,张婷,等.脑缺血再灌注后线粒体氧化应激损伤的动态变化[J].中国临床神经科学,2014,22(3):241.
[26] Sims N R,Muyderman H. Mitochondria,oxidative metabolism and cell death in stroke[J]. Biochim Biophys Acta,2010,1802(1): 80.
[27] Chen S D,Yang D I,Lin T K,et al. Roles of oxidative stress,apoptosis,PGC-1α and mitochondrial biogenesis in cerebral ischemia[J]. Int J Mol Sci,2011,12(10):7199.
[责任编辑 张宁宁]

