水在中学化学实验中的多种角色
程秀兰+�おお�


1作溶剂
水具有良好的溶解性能,这是基于水分子的2种特性:①水分子具有其他分子不具备的高度配位能力,即它以同样的方式对电子对接受体(阳离子,路易斯酸)及电子对给予体(阴离子,路易斯碱)具有配位能力。在第一种情况下,水分子的阴性氧原子是电子对给予体;第二种情况下,水分子的阳性氢原子是电子对接受体。因此,在溶解过程中,释放出高的水合作用能,它能补偿许多物质的晶格能(固体时)或汽化能(液体时)。②根据水分子的偶极矩,水在所有溶剂中具有最高的介电常数(ε=81),因此水中所有离子间的吸引力是真空中的1/80。
水的溶解性可用于:①配制溶液及稀释溶液;②测定固体的溶解度;③做喷泉实验。
2作反应试剂
2.1作氧化剂
活泼金属钠与水的反应、电解饱和食盐水、金属铝与氢氧化钠溶液的反应等,在这些反应中水作为氧化剂,起还原作用。
2.2作还原剂
在氟气与水的反应中水作為还原剂,起氧化作用。
2.3既作氧化剂又作还原剂
在电解水的反应中,水既作为氧化剂又作为还原剂,故水既起还原作用又起氧化作用。
2.4既不作氧化剂又不作还原剂
过氧化钠与水的反应、强酸弱碱盐的水解、强碱弱酸盐的水解、弱酸弱碱盐的水解、酯类水解、蛋白质水解、糖类水解、卤代烃在碱性水溶液中的水解等,在这些反应中水既不作为氧化剂又不作为还原剂。
3作催化剂
有些物质在干燥条件下不易发生反应,当混有少量的水蒸气后反应极易进行。例如,硫化氢与二氧化硫的反应、过氧化钠与二氧化碳的反应、“滴水生烟”实验等。在以上反应中,水是催化剂,加快了反应速率。
4介质作用
高锰酸钾是一种强的氧化剂,它可以氧化许多物质,但反应的介质不同,还原产物也不同。高锰酸钾在酸性、碱性(碱的浓度较大)和中性介质中与亚硫酸盐作用,分别被还原成Mn2+、MnO42-和MnO2。在这些反应中,水起的是介质作用。
5作配位体
在“硫酸四氨合铜(Ⅱ)的制备和性质”实验中,称取一定量的硫酸铜晶体,用水溶解,并逐滴加入浓氨水,开始生成浅蓝色碱式硫酸铜沉淀[Cu2(OH)2SO4]。滴加浓氨水,搅拌至沉淀全部溶解,变为深蓝色溶液。反应的化学方程式为:
Cu2SO4+4NH3+H2O=Cu2(NH3)4SO4·H2O。在Cu2(NH3)4SO4·H2O中,水在其中起配位作用。
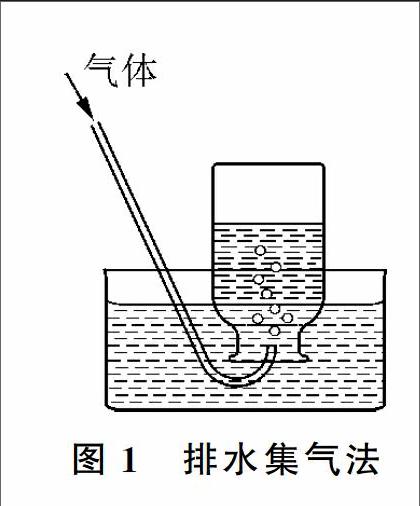
6排水集气
在气体的制取实验中,对那些
难溶于水
(即极性小或非极性)的气体分子
(如氧气、氢气、氮气、一氧化氮、乙炔等),往往是采用排水集气法收集(如图1所示)。若气体在水中有一定的溶解度,则可在水中加入相应的盐形成饱和溶液来降低其溶解度,如用排饱和食盐水的方法收集氯气、用排饱和碳酸氢钠溶液的方法收集二氧化碳。需要特别注意的是,当固体与固体混合加热制取气体时,用排水法收集完气体后,要先撤导管后撤酒精灯,以免因水倒吸而引起试管炸裂。
7作洗气剂
在气体的制取实验中需
要获得纯净的气体,而实验室中制取的目标气体中往往混有杂质。对于混合气体中易溶于水的杂质气体可用水进行洗气。例如,实验室制取的H2中常因反应物盐酸的挥发而使H2中混有HCl气体杂质。此时,可将这种混合气体通入装有水的洗气瓶(如图2所示),把其中的杂质气体HCl除掉。
8检测气体通入的速率
[BFQ][JP+1]除了可用水作洗气剂,除去混合气体中易溶于水的气体物质外,同时也可利用图2中的装置,通过观察气泡逸出的速率来检测气体通入的速率。[BF][JP]
9排水量气
气体的量取是某些定量实验的关键性操作。可利用水来测量产生的难溶于水的气体的体积。这种量取气体的装置有2种:一是可利用量筒排水法收集气体,直接在量筒中读出气体的体积(如图3所示);二是利用量筒收集排出的水,此时水的体积即为该温度、压强下所产生的气体体积(如图4所示)。读取液体体积时要注意以下2点:①调节容器,使容器、量筒内的液面相平;②视线要与液面的凹面最低点相切。若气体能溶于水,可在集气瓶内水面上加一层有机溶剂,如苯、四氯化碳或油等。
10储存气体
对那些水溶性不大或不溶于水的气体可通过气压原理控制水进出储气装置,从而实现气体从制气装置流进储气装置,并从储气装置中流出的目的。这是实验室中储气装置的使用原理。如图5(a)所示,甲瓶内充满溶液,当气体通入甲瓶时将溶液压入乙瓶,关闭活塞,便可将气体保存起来。使用的时候,打开活塞,乙瓶中的溶液回落到甲瓶中,将气体赶出。图5(b)也是常见的气体储气装置。若气体能溶于水,可在集气瓶内水面上加一层有机溶剂,如苯、四氯化碳或油等。
11作检漏剂
根据化学实验的一般要求,对那些需要控制液体反应物体积的定量实验或者是使用有活塞(或开关)结构的仪器和装置,为了减少实验误差,实验前必须用水检验所用仪器(如容量瓶、酸式或碱式滴定管等)是否漏液。
另外,在装置的气密性检查中,也常用水来检验气体发生装置的气密性。这种气密性的检验就是利用装置体系内压强与大气压所存在的压力差来实现的,这种压力差通过导管使导管内流动着的水形成一段水柱(水柱的存在就证明了装置体系内外存在压力差)。
12作检验剂和分离剂
相似相溶原理指出,极性分子易溶于极性溶剂中,非极性(或弱极性)分子易溶于非极性(或弱极性)溶剂中。据此原理,可用水(极性分子)为溶剂来检验其他溶剂分子的极性。同理,也可用水检验气体的极性。
检验分液实验中哪层是水层,哪层是油层(有机层)时可用水来检验。即取少量上层或下层液体与水混合,若溶液分层说明所取液体是油层(有机层),反之为水层。
通常情况下,不溶于水的液态物质其密度有的大于水,有的小于水,其混合物可用水进行分离。如把制取硝基苯的液体倒入水中,液体分为3层。上层是苯,中间是溶有硝酸和硫酸的水层,底层为硝基苯,用分液漏斗进行分液可得到不同的物质。同理也可以水为试剂鉴别溴苯、苯、乙醇3种物质。
除此以外,还可利用物质与水反应产生的某些特殊效应来鉴别某些物质。如:利用物质的水溶性差异,可用水鉴别BaSO4和NaCl固体;利用物质溶于水产生的热效应,可用水鉴别CaO、NH4NO3和NaCl固体;利用物质溶于水溶液中某些离子所呈现的颜色差异,可用水鉴别CuSO4和NaCl固體。
13作冷凝(或冷却)剂
对那些受热易气化,沸点低于100 ℃,常温下为液态的物质常用水冷却其蒸气。如石油的分馏实验,需要用水冷却馏出物或挥发物,这种冷却往往是通过冷凝管中流动着的水来实现的。有时为冷却实验体系,也常用水作冷却剂,如结晶实验等。
14作洗涤剂
在过滤操作中,对过滤器上的沉淀要进行洗涤,以除去混合物中易溶于水的固体杂质。这种洗涤操作就是用水(蒸馏水)来完成的。方法是:在过滤器中倒入蒸馏水,直至蒸馏水浸没其中的沉淀,待过滤器中的水滤去之后,再重复几次这样的操作。例如除去硫酸钡沉淀中的氯化钠等,可根据二者水溶性的不同,用水进行洗涤。
15作加热剂
把要加热的物质放在水中,通过给水加热达到给物质加热的效果。一般都是把要反应的物质放在试管中,再把试管放在装有水的烧杯中,再在烧杯中插一根温度计控制反应温度。水浴加热的优点是受热均匀,避免了直接加热造成的加热过度剧烈与温度的不可控制,可以平稳地加热,缺点是加热温度最高只能达到100 ℃。
16吸收尾气
对于水溶性较大的有害气体,在化学实验中可以用水作为其尾气吸收剂。如实验室制取氨气、氯化氢时可以将尾气通入水中。为防止倒吸,通常不能将导管直接插入液面下方,可做如图6所示的处理。
17作水封
在化学实验室中,有些化学药品在空气中易变质或挥发出有害物质污染环境,如果这类物质不与水发生反应且密度比水大,则可用水来保存,以减少药品的损失或污染。例如,白磷、液溴、水银、二硫化碳等药品的保存,通常是向药品中加少量蒸馏水,通过用水覆盖药品而隔绝空气,防止药品氧化变质或减少挥发。
在苯的取代反应中制取的溴苯和硝化反应中制取的硝基苯,往往在实验后向产物中加入少量水进行封存,然后让学生观察。封存的目的是为了减少反应产物的挥发,防止其污染空气。在新制取的溴苯和硝基苯中倒入水封存,也可以使产物中残存的Br2和NO2溶解在水中,减小有颜色的杂质对反应产物颜色的干扰。
18作粘附剂
例如,在过滤实验中,用水润湿滤纸,使滤纸紧贴漏斗,以赶走滤纸与漏斗间的气泡。在NH4Cl与Ba(OH)2·8H2O反应的实验中,把烧杯放在用水湿润过的玻璃片上面,由于反应吸热使水结冰,从而使烧杯与玻璃片粘附在一起。
19连接玻璃管
在化学实验中连接玻璃管和乳胶管(或橡皮管、橡胶塞等)时,由于干燥的玻璃管与乳胶管间的摩擦力较大,不易将乳胶管套到玻璃管上。因此,在进行这一操作时,可以先将玻璃管在水里蘸一下,使玻璃管润湿,再稍用力就很容易把乳胶管套上了。
总之,以上水的诸多应用主要是利用水的物理性质(如极性、比热、沸点、密度、润湿性等)、相关化学性质及物质与水作用产生的某些特殊效应,结合化学仪器的构造特点和物理学的气压原理的创造性成果。了解这些作用有利于全面了解水的用途,有利于把分散的知识条理化,同时也能培养学生的实验探究与创新意识,提高学生的实验素养。

