亮蓝嵴联合血清胃蛋白酶原对胃粘膜肠上皮化生的诊断价值
汪杰+谢文瑞+吴礼浩+蔡洁毅+何兴祥
[摘要] 目的 探討亮蓝嵴(light blue crest LBC)联合血清胃蛋白酶原(serum pepsinogen sPG)对胃粘膜肠上皮化生的诊断价值。方法 采用回顾性研究方法对2015年6月—2016年9月在该院门诊及住院已行NBI-ME检查的142例并确诊为慢性胃炎的患者进行检查,根据窄带成像放大内镜(narrow band imaging-magnifying endoscopy NBI-ME)检查是否观察到LBC及血清胃蛋白酶原I(serum pepsinogen I sPGI)是否下降,分为4组,分别为LBC(+)-sPG(+),LBC(+)-sPG(-),LBC(-)-sPG(+),LBC(-)-sPG(-)。以病理标准评估上述4组肠上皮化生的活检预测率,比较LBC联合sPG与单独用LBC预测肠上皮化生阳性率的差异性。结果 经LBC(+)-sPG(+)检出胃粘膜肠上皮化生率显著高于LBC(+)-sPG(-)组(96.36% vs 31.25%,P<0.05),LBC(+)-sPG(+)组肠上皮化生的检出率显著高于LBC(+)组(96.36% VS 81.69%,P<0.05);经LBC(+)-sPG(-)组检出胃粘膜肠上皮化率显著高于LBC(-)-sPG(+)组(31.25% vs 12.90%,P<0.05);LBC(-)-sPG(+)组与LBC(-)-sPG(-)组检出率差异无统计学意义(12.90% vs 7.50%,P>0.05)。结论 亮蓝嵴联合血清胃蛋白酶原可提高胃粘膜肠上皮化生的检出率,可作为一种联合检查手段向临床推广。
[关键词] 亮蓝嵴;血清胃蛋白酶原;肠上皮化生
[中图分类号] R4 [文献标识码] A [文章编号] 1674-0742(2017)05(a)-0012-04
[Abstract] Objective To access light blue crest(LBC) combined with serum pepsinogen(sPG) diagnosis value in gastric mucosa intestinal metaplasia.Methods With retrospective study we analyse the 142 cases of patients diagnosed with chronic gastritis by NBI-ME from June 2015 to September 2016 in our hospital,who were in the outpatient and hospitalized, according to the narrow band imaging with magnifying endoscopy (NBI-ME) to check whether the observed LBC and serum pepsinogen I (serum pepsinogen I sPGI) has declined,divided into four groups,separately marked as LBC(+)-sPG(+),LBC(+)-sPG(-),LBC(-)-sPG(+),LBC(-)-sPG(-).To estimate the biopsy predictive rate of intestinal metaplasia in the four groups by pathological standard,we compare the differences between LBC combined with sPG and LBC alone which are predictive the positive rate of intestinal metaplasia.Results The biopsy rate of gastric mucosa intestinal metaplasia for the group of LBC(+)-sPG(+) is significant higher than the the group of LBC(+)-sPG(-)(96.36% vs 31.25%,P<0.05),The biopsy rate of gastric mucosa infestinal metaplasia for the group of LBC(+)-sPG(+) is signifcant higher than the gooup of LBC(+) (96.36% vs 81.69%,P<0.05)the biopsy rate of gastric mucosa intestinal metaplasia for the group of LBC(+)-sPG(-) is significant higher than the the group of LBC(-)-sPG(+)(31.25% vs 12.90%,P<0.05),the biopsy rate of gastric mucosa intestinal metaplasia for group of LBC(-)-sPG(+) and the group of LBC(-)-sPG(-) are not statistically significant differences(12.90% vs 7.50%,P>0.05).Conclusion Light blue crest combined with serum pepsinogen can improve the detection rates of gastric intestinal metaplasia,and can be used as a joint test for spreading clinic.
[Key words] Light blue crest;Serum pepsinogen;Intestinal dysplasia
在全世界,胃癌已成为发病率居第五和致死率居第三的常见恶性肿瘤[1]。胃粘膜肠上皮化生是胃癌进展的重要环节,更有Shimoyama等[2]研究认为,在日本肠上皮化生是肠型胃癌发病的唯一因素。因此,提高胃粘膜肠上皮化生的检出率对预防早期胃癌尤为关键。在传统普通白光内镜基础上,NBI-ME在检测胃肠粘膜化生具有很好的敏感性和特异性,尤其是亮蓝嵴(light blue crest LBC)的出现,使其成为一项可依赖的技术[3]。然而,目前没有一项利用LBC明确诊断IM的数据[4]。另外,在日本和韩国的内镜领军者主要依靠序贯NBI检测来提高进对肠上皮化生的诊断,而在其他地区不能有效普及推广。血清胃蛋白酶原(serum pepsinogen sPG)与慢性萎缩性胃炎有密切关系。然而,LBC联合sPG少有文献报道。因此,该文方便收集2015年6月—2016年9月在该院门诊及住院已行NBI-ME检查的142例患者,探讨LBC联合sPG对胃粘膜肠上皮化生的检出率是否提高,现报道如下。
1 资料与方法
1.1 一般资料
回顾性研究2015年6月—2016年9月在该院门诊及住院已行NBI-ME检查患者142例,该类患者既往有确诊为慢性胃炎需要进行复诊,其诊断标准参照2012年制定的中国慢性胃炎共识意见,排除标准:2周内应用抑酸剂、胃粘膜保护剂、抗生素、非甾体类抗炎药,残胃、进展期胃癌、慢性肝病、凝血功能异常,合并有糖尿病。根据NBI-ME检查是否发现LBC分为LBC阳性组及LBC阴性组,记为LBC(+)及LBC(-),并且两组均为71例。所有患者在胃镜检查前均抽血查sPGI,根據sPGI是否下降分为sPGI下降组及sPGI正常组,记为sPG(+),sPG(-)。因此,根据LBC及sPG分为4组,即LBC(+)-sPG(+);LBC(+)-sPG(-);LBC(-)-sPG(+);LBC(-)-sPG(-)。
1.2 术前检查
所有患者于胃镜检查前3 d进行抽血。检查前禁食12 h后抽取外周血4 mL,检查项目包括PGI、PGII 、PGI/PGII,检查方法采用酶联免疫吸附法,该试剂盒采购于美国R&D公司,操作步骤按其盒内说明书进行。所有患者进行无痛胃镜检查,检查前1 d晚8:00开始禁食,检测前30 min口服卫朗进行去泡和润滑,并签署无痛胃镜检查同意书。
1.3 胃镜检查
采用Olympus GIF-H260Z电子放大染色胃镜,电子处理器型号为CV-260sL,光源照明型号为CLV-260SL,光学可放大80倍。胃镜前端均统一安装黑色遮光软帽,方便固定和调节焦距。所有检查者均由一名经验丰富内镜医生完成,先行常规普通白光胃镜检查,如检查部位有粘液及泡沫附着,可行稀释的糜蛋白酶冲洗处理。检查中按照2005年巴黎会议提出的大体分型观察并记录表面形态,即粘膜表面微血管(microvascular architecture MV)和微结构(microsurface structure MS),有可疑病灶进行NBI检查,如发现有上皮细胞表面/脑回样结构嵴部的纤细、蓝白色线样结构,即亮蓝嵴,并行ME观察,在LBC处行活检;如未能观察到该结构,于胃窦小弯侧距幽门2 cm处及胃体上段小弯侧距贲门8 cm处各取活检一块,其他部位活检根据病变情况进行。
1.4 病理组织学检查
活检标本用 10%福尔马林固定,进行石蜡包埋,切片处理后行H-E染色和Giemsa染色。由两名固定的病理医生进行诊断,且两人均不知胃镜检查结果。
1.5 统计方法
采用SPSS 23.0统计学软件进行统计分析和处理。计量资料采用(x±s)表示,多组间定量资料的比较采用t检验,两组间定性资料的比较采用χ2检验,P<0.05为差异有统计学意义。多组间定性资料的比较采用χ2检验,P采用 Bonferroni 校正,<0.008 3为差异有统计学意义。
2 结果
2.1 一般情况
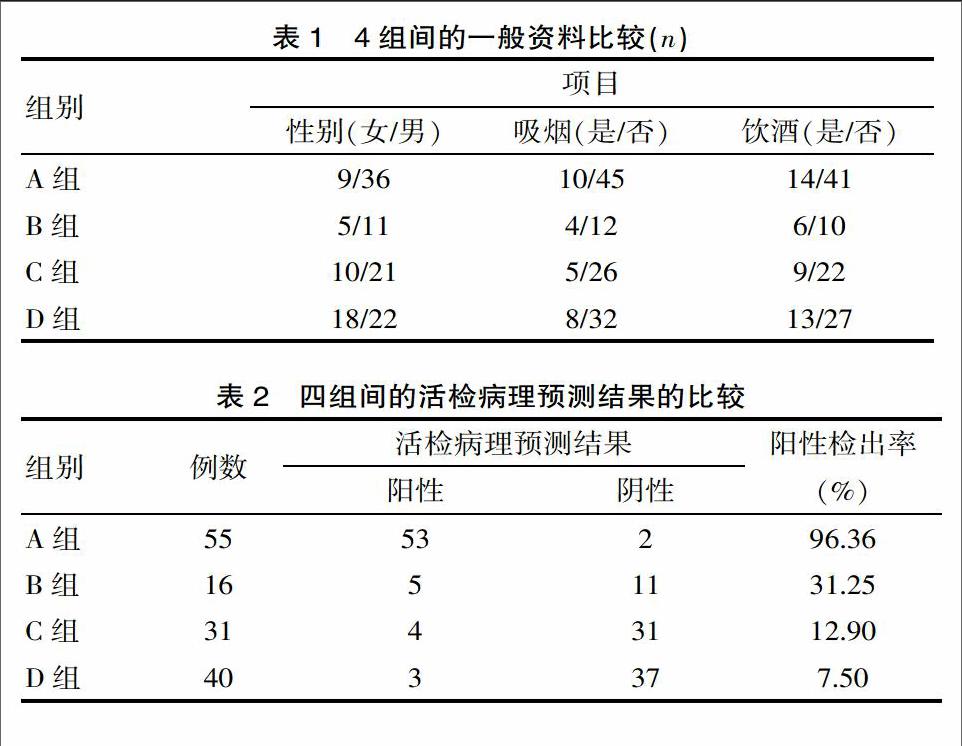
4组患者人数分别LBC(+)及LBC(-)各71例;sPG(+)86例,所占比例为60.56%,sPG(-)为56例,所占比例为39.44%。其中LBC(+)-sPG(+)55例,LBC(+)-sPG(-)16例,LBC(-)-sPG(+)31例,LBC(-)-sPG(-)40例。LBC(+)-sPG(+)组与LBC(+)-sPG(-)组中sPG值分别为(45.362±10.371),(47.534±9.743),(P>0.05); LBC(+)-sPG(+)组与LBC(+)-sPG(-)组中sPG值分别为(106.436±21.015),(108.713±20.187),(P>0.05)。A组、B组、C组、D组年龄分别为(63.927±10.392),(60.688±13.420),(60.839±11.651),(59.250±13.486)岁,进行t检验,差异无统计学意义(P>0.05)。4组资料包括性别、是否吸烟、是否饮酒进行总体比较(P>0.05),详见表1。注:A组为LBC(+)-sPG(+),B组为LBC(+)-sPG(-),C组为LBC(-)-sPG(+),D组为LBC(-)-sPG(-)。
2.2 4组在肠上皮化生检出率的比较
A组检出肠上皮化生53例,检出率为96.36%,B组检出5例,检出率为31.25%,C组检出肠上皮化生4例,检出率为12.90%,D组检出肠上皮化生3例,检出率为7.50%。4组之间总体比较,提示两两组间比较差异有统计学意义(P<0.05)。两两组之间比较可分为A组与B组,A组与C组,A组与D组,B组与C组,B组与D组,C组与D组之间6组进行比较,A组与其余3组两两比较,提示差异有统计学意义(P<0.008 3); B组与C、D组之间进行两两比较差异有统计学意义(P<0.0083)。C组与D组之间进行比较,差异无统计学意义(P>0.008 3)。详见表2。
2.3 LBC(+)-sPG(+)组与LBC(+)组在肠上皮化生检出率的比较
LBC(+)-sPG(+)组共55例,检出肠上皮化生53例,检出率为96.36%,LBC(+)组共71例,检出肠上皮化生58例,检出率为81.69%,提示差异有统计学意义(P<0.05)。
2.4 LBC(+)及sPG(+)在肠上皮化的的敏感性、特异性、阳性预测值及阴性预测值
LBC(+)及LBC(-)均71例,病理阳性65例,阴性77例,sPG(+)共86例,sPG(-)共56例,LBC(+)敏感性、特异性、阳性预测值、阴性预测值分别为89.23%,83.12%,81.69%,90.14%;sPG(+)敏感性、特异性、阳性预测值、阴性预测值分为87.69%,62.34%,66.30%,85.71%。
3 讨论
该研究发现LBC阳性且sPG下降较单纯LBC阳性在胃粘膜肠上皮化生的检出率要明显提高,提示亮蓝嵴联合血清胃蛋白酶原作为一种检测方法,可提高胃粘膜肠上皮化生的检出率。
窄带成像内镜具有滤光特点,可以滤过除中心波长分别为415 nm的蓝色光和540 nm的绿色光外的色光,可以很好显示浅层的表面微血管(MV)和表面微结构(MS),而检查用放大内镜具有像数放大80倍的特点,可以更进一步发现微小病灶。有学者于2005年最早发现LBC结构,并提出其出现的次数与免疫染色CD10高度表达及上皮细胞阿辛蓝(Alcian Blue)染色阳性相关。Yao K[5]推测,LBC的出现是由于肠上皮细胞刷状缘上的微绒毛对短波段窄光的反射的一种现象。因此,LBC可以作为肠上皮化生的标志物[6],具有高度的敏感性和准确性。Liu R等[7]对164例慢性胃炎患者行NBI-ME檢查,诊断为胃粘膜肠上皮化生的敏感性为87.32%,阳性预测值为95.39%,阴性预测值为90.91%,该研究中LBC中诊断胃粘膜肠上皮化生的敏感性、特异性、阳性预测值及阴性预测值分别为89.23%,83.12%,81.69%,90.14%,两项数据研究高度一致,进一步说明了LBC在胃粘膜肠上皮化生的诊断价值。
胃蛋白酶原是胃蛋白酶的前体,除绝大多数进入胃腔外,约有1%可在血清中检测出[8]。当胃粘膜出现萎缩时,PGI和PGI/PGII下降,萎缩加重时,检测值会进一步减少,因此,PGI和PGI/PGII可作为胃粘膜萎缩和肠上皮化生的预测指标[9-10]。该研究中sPG(+)敏感性、特异性、阳性预测值、阴性预测值分为87.69%,62.34%,66.30%,85.71%,提示sPG(+)有较好的诊断肠上皮化生的价值。然而,Yao K等[11]认为,LBC在诊断IM特异性常高,但灵敏度一般,需要大样本多中心评估。An Jin等[12]发现,在内镜视野下LBC>10%诊断为IM时其敏感性和准确性分别仅为72.10%、89.50%,Kang H 等[13]指出,通过ME-NBI观察LBC预测小凹型肠上皮化生的准确率为75.00%,而腺瘤型肠上皮化生则为56.00%,为进一步提高IM诊断的准确率需结合其他检测方法。近年有文献报道[14],LBC联合嵴/绒毛样结构诊断IM的敏感性为95.20%,特异性为98.70%,同时伴有sPG检测降低,提示LBC与sPG可能有联合诊断IM的意义。该研究中发现,LBC(+)-sPG(+),LBC(+)-sPG(-)活检阳性预测率均较LBC(-)-sPG(+),LBC(-)-sPG(-)有显著统计学差别,提示发现LBC阳性较sPG降低更具有诊断肠上皮化生的价值。LBC(+)-sPG(-)活检预测值为31.25%,且LBC(+)-sPG(+)较LBC(+)-sPG(-)及LBC(+)活检阳性预测值均有明显统计学差别。因此,NBI-ME检查即使发现LBC阳性,仍有多点活检意义,否则有漏检出肠上皮化生的可能。
综上所述,对于有症状的消化道患者,如患者不能接受胃镜检查,可以行sPG检查,如发现有异常,再对可疑病灶行NBI-ME检查可有效提高肠上皮化生的检出率,可作为一种联合检测手段向临床推广。
[参考文献]
[1] Wang K, Liang Q, Li X, et al. MDGA2 is a novel tumour suppressor cooperating with DMAP1 in gastric cancer and is associated with disease outcome[J]. Gut, 2016, 65(10):1619-1631.
[2] Shimoyama T, Fukuda S, Tanaka M, et al. Evaluation of the applicability of the gastric carcinoma risk index for intestinal type cancer in Japanese patients infected with Helicobacter pylori[J]. Virchows Archiv, 2000, 436(6):585-587.
[3] Nonaka T, Inamori M, Honda Y, et al. Can magnifying endoscopy with narrow-band imaging discriminate between carcinomas and low grade adenomas in gastric superficial elevated lesions[J].Endosc Int Open,2016,4(11):E1203-E1210.
[4] Wang L, Huang W, Du J, et al. Diagnostic yield of the light blue crest sign in gastric intestinal metaplasia: a meta-analysis.[J]. Plos One, 2014, 9(3):e92874.
[5] Yao K. Zoom Gastroscopy[J]. Springer Berlin, 2014.
[6] Ok KS, Kim GH, Park DY,et al. Magnifying Endoscopy with Narrow Band Imaging of Early Gastric Cancer: Correlation with Histopathology and Mucin Phenotype[J].Gut & Liver, 2016, 10(4):532-541.
[7] Liu R, Zhang G, Gao D, et al. Diagnostic value of magnifying chromoendoscopy for gastrointestinal metaplasia and early cancerization[J]. Clinical Focus, 2015.
[8] Huang YK, Yu JC, Kang WM, et al.Significance of Serum Pepsinogens as a Biomarker for Gastric Cancer and Atrophic Gastritis Screening: A Systematic Review and Meta-Analysis[J]. Plos One, 2015, 10(11):e0142080.
[9] Zhang XM, Li JX, Zhang GY,et al.The value of serum pepsinogen levels for the diagnosis of gastric diseases in Chinese Han people in midsouth China[J].BMC Gastroenterology, 2014, 14(1):9006.
[10] Eun B S, Hoon L J, Soo P Y, et al. Decrease of serum total ghrelin in extensive atrophic gastritis:comparison with pepsinogens in histological reference[J].Scandinavian Journal of Gastroenterology, 2016, 51(2):137-144.
[11] Yao K, Doyama H, Gotoda T, et al. Diagnostic performance and limitations of magnifying narrow-band imaging in screening endoscopy of early gastric cancer: a prospective multicenter feasibility study[J]. Gastric Cancer, 2014, 17(4):669-679.
[12] An J, Song G, Gwang K, et al. Marginal turbid band and light blue crest, signs observed in magnifying narrow-band imaging endoscopy, are indicative of gastric intestinal metaplasia[J]. BMC Gastroenterology, 2012, 12(1):169.
[13] Kang HM, Kim GH, Park DY, et al. Magnifying endoscopy of gastric epithelial dysplasia based on the morphologic characteristics[J]. World Journal of Gastroenterology, 2014, 20(42):15771-15779.
[14] Okubo M, Tahara T, Shibata T, et al. Light blue crest and ridge/villous patterns in the uninvolved gastric antrum by magnifying NBI endoscopy correlate with serum pepsinogen and gastric cancer occurrence[J]. Hepato-gastroenterology, 2014, 61(130):525-528.
(收稿日期:2017-02-04)

