戈舍瑞林对前列腺增生模型大鼠血管生长因子和免疫功能的影响
奚 炜,徐 帮,张永华,赵 倩,陈进兵(1.三峡大学人民医院药学部,湖北宜昌 443000;.宜昌市第一人民医院药剂科,湖北宜昌 443000)
戈舍瑞林对前列腺增生模型大鼠血管生长因子和免疫功能的影响
奚 炜1*,徐 帮2,张永华2,赵 倩2,陈进兵2(1.三峡大学人民医院药学部,湖北宜昌 443000;2.宜昌市第一人民医院药剂科,湖北宜昌 443000)
目的:研究戈舍瑞林对前列腺增生模型大鼠血管生长因子及免疫功能的影响。方法:取大鼠建立前列腺增生模型,然后随机分为模型组和戈舍瑞林低、中、高剂量组(0.4、0.8、1.2mg/kg),另取正常大鼠作为正常对照组,每组10只。正常对照组和模型组大鼠ig生理盐水,戈舍瑞林各剂量组大鼠ig相应剂量的药物,每日1次,连续25 d。检测各组大鼠前列腺体积、湿质量、前列腺指数和前列腺组织中血管内皮生长因子(VEGF)、转化生长因子β1(TGF-β1)、成纤维细胞生长因子(FGF)、CD4、CD8的阳性细胞面积。结果:与正常对照组比较,模型组大鼠前列腺体积、湿质量、前列腺指数和VEGF、TGF-β1、FGF、CD4、CD8阳性细胞面积均增加(P<0.05)。与模型组比较,戈舍瑞林各剂量组大鼠上述指标均改善(P<0.05),且中、高剂量组较低剂量组改善效果更明显(P<0.05),中、高剂量组间差异无统计学意义(P>0.05)。结论:戈舍瑞林可改善大鼠的前列腺增生,减少前列腺组织中VEGF表达并调节免疫功能。
前列腺增生;戈舍瑞林;大鼠;血管内皮生长因子;免疫功能
前列腺增生(Benign prostatic hyperplasia)是临床上常见的男性疾病,多发生于老年男性且近年来的发病率呈升高趋势。BPH的发病机制尚未完全明确,近来的研究证实,前列腺组织内微血管密度增加是造成前列腺增生的重要因素[1]。血管内皮生长因子(VEGF)、转化生长因子β1(TGF-β1)、成纤维细胞生长因子(FGF)在前列腺增生发展过程中发挥着重要的作用,前列腺组织中高表达的VEGF、TGF-β1、FGF有利于前列腺组织的增生,是造成BPH的重要致病因子[2-3]。抑制前列腺组织中的血管新生是临床治疗前列腺增生的重要靶点。戈舍瑞林是一类促黄体生成素释放激素(Luteinzing hormone-releasing hormone,LHRH)的类似物,对睾酮的分泌具有抑制作用[4]。本文通过动物实验的方法,探讨戈舍瑞林对前列腺增生模型大鼠血管生长因子和免疫功能的影响,为临床前列腺增生的治疗提供依据。
1 材料
1.1 仪器
YB502动物天平(上海沪粤明科学仪器有限公司)。
1.2 药品与试剂
丙酸睾丸酮注射液(上海通用药业股份有限公司,批号:H31020524,规格:1m L∶25mg);戈舍瑞林缓释植入剂(英国AstraZeneca公司,批号:J20122205;规格:每支10.8mg);VEGF、TGF-β1、FGF、CD4、CD8抗体(美国Santa Cruz公司);SP免疫组化染色试剂盒(上海研卉生物科技有限公司)。
1.3 动物
SD大鼠50只,SPF级,♂,体质量220~280 g,购于武汉大学动物实验中心,许可证号:SCXK(鄂)2015-1012。大鼠饲养在SPF级的动物房中,自由进食进水。本次研究报请医院动物伦理委员会批准。
2 方法
2.1 前列腺增生模型的建立
对大鼠采用颈部ih丙酸睾丸酮注射液3mg/kg,连续25 d建模。随机抽取1只断颈处死,解剖腹腔,见前列腺体积明显增大、质地硬实且有弹性、血管明显增粗,病理检查可见前列腺呈低柱状突起,腔内见多数乳头状增生,腹腔有深红色浓厚分泌物,腺体周围组织增生3~5层,间质增生明显,则表明造模成功。
2.2 分组与给药
将建模成功的大鼠按随机数字表法分为模型组和戈舍瑞林低、中、高剂量组(0.4、0.8、1.2mg/kg),另取正常大鼠作为正常对照组,每组10只。正常对照组大鼠不作任何处理;戈舍瑞林各剂量组大鼠ig相应剂量的戈舍瑞,每日1次,给药中剂量按临床常用剂量换算;模型组大鼠ig生理盐水(15m L/kg),每日1次,均连续25 d。
2.3 指标检测方法
末次给药后24 h,称量各组大鼠体质量并处死,解剖观察并测定前列腺体积、色泽、质地、湿质量,计算前列腺指数,前列腺指数=前列腺湿质量(mg)/体质量(g)。
前列腺称质量后,分为两份,一份用10%多聚甲醛固定并制作石蜡切片,另一份采用SP免疫组化试剂盒说明书操作检测其中VEGF、TGF-β1、FGFCD4、CD8阳性细胞面积。
2.4 统计学方法
3 结果
3.1 前列腺指标检测结果
正常对照组大鼠前列腺组织色泽鲜艳,质地柔软;模型组大鼠前列腺组织颜色紫暗,局部充血,质地较软,或可触及到小节;戈舍瑞林各剂量组大鼠前列腺组织色泽、质地介于对照组与模型组之间。与正常对照组比较,模型组大鼠前列腺体积、湿质量、前列腺指数均增加(P<0.05)。5组大鼠间前列腺体积、湿质量、前列腺指数差异有统计学意义(P<0.05或P<0.01)。与模型组比较,戈舍瑞林各剂量组大鼠前列腺体积、湿质量、前列腺指数均降低(P<0.05)。与戈舍瑞林低剂量组比较,戈舍瑞林中、高剂量组大鼠前列腺体积、湿质量、前列腺指数均降低(P<0.05),中、高剂量组间差异无统计学意义(P>0.05)。各组大鼠前列腺体积、湿质量、前列腺指数的测定结果见表1。
表1 各组大鼠前列腺体积、湿质量、前列腺指数的测定结果(±s,n=10)Tab 1 Determ ination results of prostate volume,wet weight,prostatic index of rats in each group(±s,n=10)
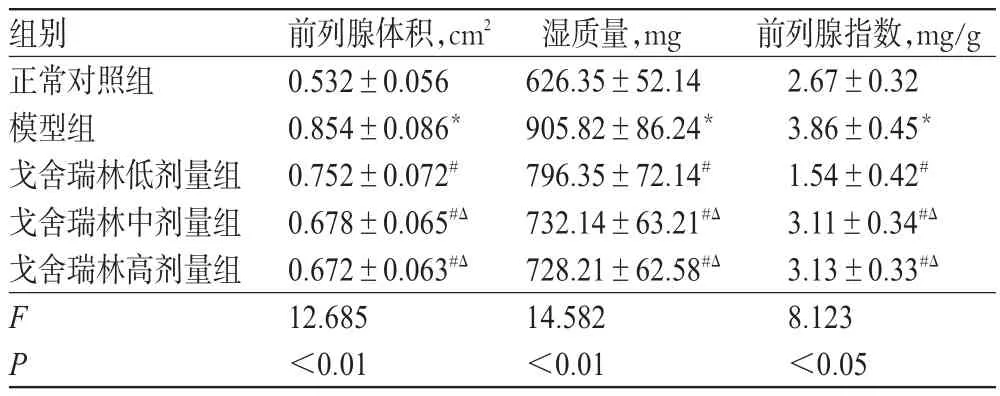
表1 各组大鼠前列腺体积、湿质量、前列腺指数的测定结果(±s,n=10)Tab 1 Determ ination results of prostate volume,wet weight,prostatic index of rats in each group(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与戈舍瑞林低剂量组比较,ΔP<0.05Note:vs.normal control group,*P<0.05;vs.model group,#P<0.05;vs.goserelin low-dosegroup,ΔP<0.05
前列腺指数,mg/g 2.67±0.32 3.86±0.45*1.54±0.42#3.11±0.34#Δ3.13±0.33#Δ8.123<0.05组别正常对照组模型组戈舍瑞林低剂量组戈舍瑞林中剂量组戈舍瑞林高剂量组FP前列腺体积,cm20.532±0.056 0.854±0.086*0.752±0.072#0.678±0.065#Δ0.672±0.063#Δ12.685<0.01湿质量,mg 626.35±52.14 905.82±86.24*796.35±72.14#732.14±63.21#Δ728.21±62.58#Δ14.582<0.01
3.2 VEGF、TGF-β1、FGF阳性细胞面积检测结果
5组大鼠前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积差异有统计学意义(P<0.05)。与正常对照组比较,模型组大鼠前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积均增加(P<0.05)。与模型组比较,戈舍瑞林各剂量组大鼠前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积均减小(P<0.05)。与戈舍瑞林低剂量组比较,戈舍瑞林中、高剂量组大鼠前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积均减小(P<0.05),中、高剂量组间差异无统计学意义(P>0.05)。各组大鼠前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积测定结果见表2。
表2 各组大鼠前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积测定结果(±s,n=10,cm2)Tab 2 Determ ination results of positive cell area of VEGF,TGF-β1and FGF in prostate tissue of rats in each group(±s,n=10,cm2)
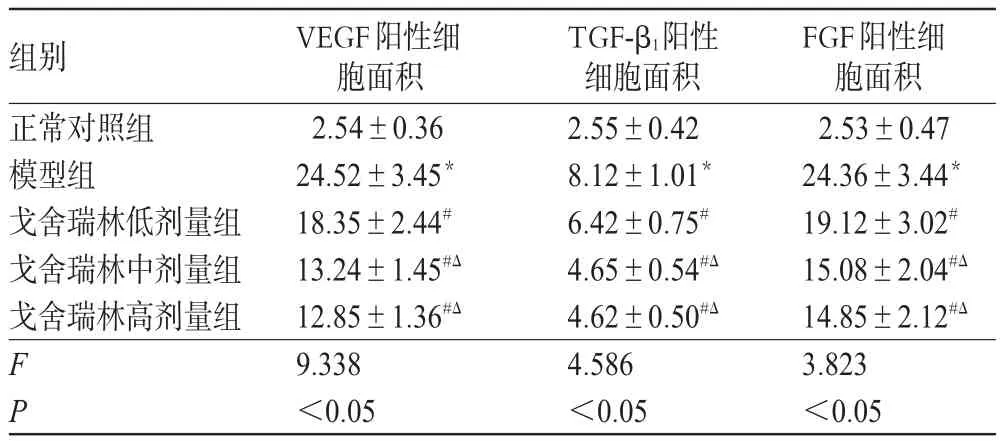
表2 各组大鼠前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积测定结果(±s,n=10,cm2)Tab 2 Determ ination results of positive cell area of VEGF,TGF-β1and FGF in prostate tissue of rats in each group(±s,n=10,cm2)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与戈舍瑞林低剂量组比较,ΔP<0.05Note:vs.normal control group,*P<0.05;vs.model group,#P<0.05;vs.goserelin low-dosegroup,ΔP<0.05
FGF阳性细胞面积2.53±0.47 24.36±3.44*19.12±3.02#15.08±2.04#Δ14.85±2.12#Δ3.823<0.05组别正常对照组模型组戈舍瑞林低剂量组戈舍瑞林中剂量组戈舍瑞林高剂量组FP VEGF阳性细胞面积2.54±0.36 24.52±3.45*18.35±2.44#13.24±1.45#Δ12.85±1.36#Δ9.338<0.05 TGF-β1阳性细胞面积2.55±0.42 8.12±1.01*6.42±0.75#4.65±0.54#Δ4.62±0.50#Δ4.586<0.05
3.3 免疫功能指标检测结果
5组大鼠前列腺组织中CD4、CD8的表达量差异有统计学意义(P<0.01)。与正常对照组比较,模型组大鼠前列腺组织中CD4、CD8的阳性细胞面积均增强大(P<0.05)。与模型组比较,戈舍瑞林各剂量组大鼠前列腺组织中CD4、CD8的阳性细胞面积均减小(P<0.05)。与戈舍瑞林低剂量组比较,戈舍瑞林中、高剂量组大鼠前列腺组织中CD4、CD8的阳性细胞面积均减小(P<0.05),中、高剂量组间差异无统计学意义(P>0.05)。各组大鼠前列腺组织中CD4、CD8的阳性细胞面积测定结果见表3。
表3 各组大鼠前列腺组织中CD4、CD8的阳性细胞面积测定结果(±s,n=10,cm2)Tab 3 Determ ination of positive cell area of CD4 and CD8 in prostate tissue of rats in each group(±s,n=10,cm2)
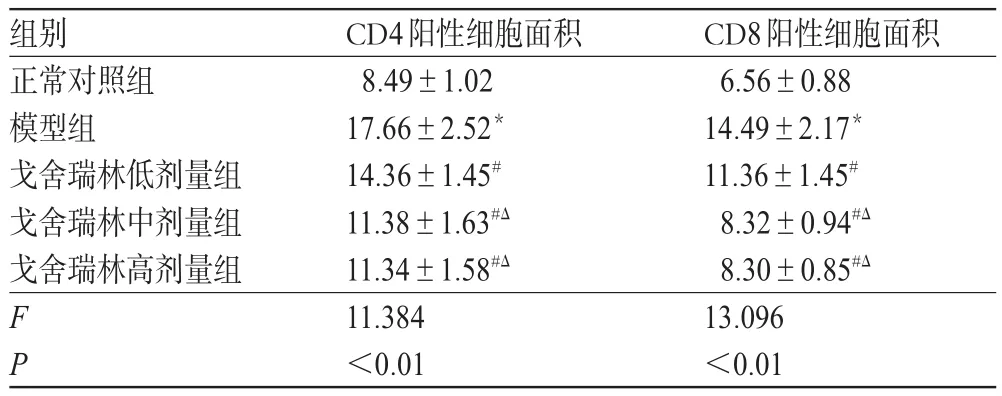
表3 各组大鼠前列腺组织中CD4、CD8的阳性细胞面积测定结果(±s,n=10,cm2)Tab 3 Determ ination of positive cell area of CD4 and CD8 in prostate tissue of rats in each group(±s,n=10,cm2)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与戈舍瑞林低剂量组比较,ΔP<0.05Note:vs.normal control group,*P<0.05;vs.model group,#P<0.05;vs.goserelin low-dosegroup,ΔP<0.05
CD8阳性细胞面积6.56±0.88 14.49±2.17*11.36±1.45#8.32±0.94#Δ8.30±0.85#Δ13.096<0.01组别正常对照组模型组戈舍瑞林低剂量组戈舍瑞林中剂量组戈舍瑞林高剂量组FP CD4阳性细胞面积8.49±1.02 17.66±2.52*14.36±1.45#11.38±1.63#Δ11.34±1.58#Δ11.384<0.01
4 讨论
前列腺增生的发病机制尚未完全明确,前列腺组织内微血管密度增加被视作前列腺组织增生的重要环节,拮抗前列腺组织内的血管新生是临床治疗前列腺增生的新靶点。戈舍瑞林是LHRH的类似物,多用于子宫内膜异位症、乳腺癌等妇科疾病的治疗[5]。外源性给予戈舍瑞林能够模拟内源性LHRH的作用且其生物学活性远超过体内合成的LHRH[6]。该药物作用于下丘脑-垂体-性腺轴来抑制黄体生成素和卵泡刺激素的生成,卵泡雌激素能够刺激睾丸产生睾酮,因此戈舍瑞林降低血清中睾酮的含量[7]。已有研究报道,戈舍瑞林用于前列腺癌患者的去势治疗能够降低血清中睾酮和前列腺特异抗原(PSA)的含量[8]。黄洪等[9]的研究证实,戈舍瑞林对增生的前列腺组织中VEGF的生成具有抑制效应。
本研究采用戈舍瑞林治疗前列腺增生,旨在发挥该药物对睾酮分泌的抑制效应,进而抑制前列腺组织的增生。通过对大鼠前列腺组织体积、色泽、质地、湿质量等观察发现,模型组大鼠的前列腺组织体积、湿质量、前列腺指数均明显高于正常对照组,说明ih丙酸睾丸酮能够诱导大鼠的前列腺发生增生和质量增加。进一步分析表明,戈舍瑞林各剂量组大鼠的前列腺组织体积、湿质量、前列腺指数均明显低于模型组,提示戈舍瑞林能够抑制前列腺组织的增生。
VEGF具有明确的促血管和淋巴管新生作用,TGF-β1、FGF可通过自分泌或旁分泌促进腺间质细胞与上皮细胞的增殖,前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积能够反映血管新生和淋巴管新生的情况[10]。本研究中,模型组大鼠前列腺组织中VEGF、TGF-β1、FGF阳性细胞面积显著大于正常对照组,戈舍瑞林各剂量组大鼠前列腺组织中VEGF阳性细胞面积显著小于模型组。国外学者也有类似的文献报道[11],提示戈舍瑞林对前列腺组织中血管新生有抑制效应。
免疫性炎症被证实与前列腺增生的病情发展密切相关,增生的前列腺组织中有大量炎症细胞的浸润,但却未证实有感染的临床症状或细菌学证据[12]。前列腺增生组织中炎症细胞的浸润以淋巴细胞为主,表现为免疫性炎症的特征[13]。CD4和CD8是T淋巴细胞表面的重要标志物。本研究中,模型组大鼠前列腺组织中CD4、CD8阳性细胞面积显著大于正常对照组,戈舍瑞林各剂量组大鼠前列腺组织中CD4、CD8阳性细胞面积显著小于模型组,说明在前列腺增生的动物模型中,前列腺组织高表达CD4和CD8,而戈舍瑞林可降低前列腺组织中CD4和CD8的表达。这提示戈舍瑞林对前列腺组织中的免疫功能具有调节作用。
进一步分析戈舍瑞林不同剂量对前列腺增生血管内皮生长因子及免疫功能的影响时发现,戈舍瑞林药效作用与初始刺激与维持浓度有关,但并未呈良好的量效关系,当达到一定剂量时,干预效果并无明显差异。张枢等[14]也有类似的文献报道。
本文研究表明,戈舍瑞林能够抑制前列腺增生模型大鼠的病情发展,减少前列腺组织中血管生长因子的表达并调节免疫反应,对前列腺增生的治疗具有积极作用。需要指出的是,人类前列腺增生发病原因影响因素很多,而前列腺增生模型大鼠发病原因相对确定,加之本文观察指标相对较少,缺乏对基质、性激素水平等比较,所得结论是相对的,还有待于今后展开更多的基础研究与临床研究去求证。
[1] 辛玉宏,赖建生,赵国平,等.前列腺增生症中血管内皮生长因子c的表达与血清前列腺特异抗原的相关性[J].现代泌尿外科杂志,2014,19(3):186-189.
[2] IiiColado-Velazquez J,Mailloux-Salinas P,etal.Effect of serenoa repens on oxidative stress,inflammatory and grow th factors in obese w istar rats w ith benign prostatic hyperplasia[J].PhytotherRes,2015,29(10):1525-1531.
[3] 祝存海,叶昶,王进恩,等.良性前列腺增生的药物治疗研究[J].海南医学院学报,2013,19(4):499-500、503.
[4] 宁俊红,吴志刚,张若梅,等.子宫内膜异位症术后应用戈舍瑞林与孕三烯酮的疗效比较[J].中国药房,2014,25(44):4161-4162.
[5] 徐庆春,张永海,李湖,等.戈舍瑞林对减少经尿道前列腺切除术中出血的机制研究[J].现代泌尿外科杂志,2011,16(4):332-335.
[6] 潘家骅,陈海戈,陈奇,等.术前短期醋酸戈舍瑞林注射结合等离子前列腺电切治疗高危BPH的临床研究[J].微创泌尿外科杂志,2012,1(1):92-94.
[7]SakaiM,ElhilaliM,Papadopoulos V.The GnRH antagonist degarelix directly inhibits benign prostate hyperplasia cellgrow th[J].Horm Metab Res,2015,47(12):925-931.
[8] SakaiM,M artinez-A rguelles DB,Patterson NH,etal. In search of themolecularmechanismsmediating the inhibitory effect of the GnRH antagonist degarelix on human prostate cell grow th[J].PLoS One,2015,doi:10. 1371/journal.pone.0120670.
[9] 黄洪,徐庆春,张源锋,等.戈舍瑞林对前列腺组织微血管密度及血管内皮生长因子影响的基础研究[J].河北医学,2015,21(6):891-894.
[10] 李伟,张华东,李自强,等.VEGF、HIF-1α在不同前列腺病变组织中的表达及临床意义[J].解放军医药杂志,2012,24(5):11-13.
[11] Kervancioglu E,Kosan M,Erinanc H,et al.Predictive values of vascular endothelialgrow th factor andm icrovessel-density levels in initial biopsy for prostate cancer[J]. Kaohsiung JMed Sci,2015,32(2):74-79.
[12]Abo EI-Enen M,Taw ifik A,EI-Abd AS,etal.Goserelin acetate before transurethral resection of moderately enlarged benign prostatic hyperplasia:prospective randomised-controlled clinical trial[J].Arab JUrol,2016,14(1):59-65.
[13] 吴宗林,袁亚,耿和,等.免疫性炎症与前列腺体积及雄激素受体表达的关系[J].现代泌尿外科杂志,2011,11(16):3059-3061.
[14] 张枢,韩江彬,冷广意,等.戈舍瑞林缓释剂在大鼠体内的药代动力学及药效动力学[J].中国药理学与毒理学杂志,2014,28(3):398-402.
(编辑:邹丽娟)
Effects of Goserelin on Vascular Grow th Factor and Immune Function of Ratsw ith Prostatic Hyperplasia
XIWei1,XU Bang2,ZHANG Yonghua2,ZHAO Qian2,CHEN Jinbing2(1.Dept.of Pharmacy,People’s Hospital of China Three Gorges University,Hubei Yichang 443000,China;2.Dept.of Pharmacy,Yichang First People’s Hospital,HubeiYichang 443000,China)
OBJECTIVE:To study the effects of goserelin on vascular grow th factor and immune function of ratsw ith prostatic hyperplasia.METHODS:Rats were selected to establish prostatic hyperplasiamodel and random ly divided intomodel group,goserelin low-dose,medium-dose and high-dose groups(0.4,0.8,1.2 mg/kg);normal rats were selected as normal control group,w ith 10 rats in each group.Normal control group and model group were given normal saline intragastrically,and goserelin groups were given relevant dose of drugs intragastrically,once a day,for consecutive 25 days.The prostate volume,wetweight,prostatic index of rats were detected as well as positive cell area of VEGF,TGF-β1,FGF,CD4 and CD8 in prostate tissue.RESULTS:Compared w ith normal control group,prostate volume,wet weight,prostatic index,positive cell area of VEGF,TGF-β1,FGF,CD4 and CD8 were all increased in model group(P<0.05).Compared w ith model group,the above indexes of goserelin groups were all improved(P<0.05),especially those in medium-dose and high-dose groups were better than in low-dose group(P<0.05);there was no statistical significance between medium-dose group and high-dose group(P>0.05).CONCLUSIONS:Goserelin can relieve prostatic hyperplasia of rats,reduce the expression of VEGF in prostate tissue and regulate immune function.
Prostatic hyperplasia;Goserelin;Rat;Vascular endothelial grow th factor;Immune function
R965
A
1001-0408(2017)16-2205-04
2016-08-07
2017-05-20)
*副主任医师,硕士。研究方向:医院药学、药动学。电话:0717-6221372。E-mail:2958488469@qq.com
DOI10.6039/j.issn.1001-0408.2017.16.12

