调肝理脾化积方联合高强度聚焦超声治疗局部晚期胰腺癌临床研究
李娜,张青,刘声,赵文硕
调肝理脾化积方联合高强度聚焦超声治疗局部晚期胰腺癌临床研究
李娜,张青,刘声,赵文硕
首都医科大学附属北京中医医院,北京 100010
目的 探讨调肝理脾化积方联合高强度聚焦超声(HIFU)对局部晚期胰腺癌患者临床疗效。方法 采用随机、平行对照,选取局部晚期胰腺癌患者60例,采用随机数字表法分为治疗组和对照组各30例。治疗组予调肝理脾化积方,每日1剂,每日2次,口服,28 d为1个疗程,共6个疗程;同时予HIFU,每次30~60 min,隔日1次,每周2~3次,将肿瘤完全覆盖2遍。对照组予吉西他滨1000 mg/m2,静脉滴注,第1、8日,21~28 d为1个周期,共6个周期。观察2组临床受益反应、生活质量QOL-C30评分、生存情况、无进展生存期(PFS),检测CA199、CEA水平。结果 治疗1、3、6个月临床受益率,治疗组分别为64.29%、63.16%、50.00%,对照组分别为48.15%、40.00%、44.44%,治疗1、3个月2组比较差异有统计学意义(<0.05)。治疗1、3、6个月,2组同一时点QOL-C30评分比较差异有统计学意义(<0.05)。治疗1~6个月,2组CA199呈下降趋势,差异无统计学意义(>0.05)。治疗组同一时点CEA水平均低于对照组(除治疗2、6个月),差异有统计学意义(<0.05)。治疗3、6、12个月,治疗组生存率分别为82.14%、46.42%、32.14%,对照组分别为96.67%、59.32%、37.04%,2组比较差异无统计学意义(>0.05)。1年时治疗组生存时间为(253.90±18.06)d,对照组为(246.77±17.31)d,2组比较差异无统计学意义(>0.05)。治疗组PFS为(136.73±16.22)d,对照组为(145.77±19.74)d,2组比较差异无统计学意义(=0.801)。结论 调肝理脾化积方联合聚焦超声治疗局部晚期胰腺癌具有一定临床效果,可提高患者生活质量。
局部晚期胰腺癌;高强度聚焦超声;无进展生存期;生存率;临床受益反应
胰腺癌是常见的恶性肿瘤,占我国全部恶性肿瘤的2.4%[1]。近年来,胰腺癌的发病率呈增长趋势,5年生存率仅为1%~9%[2]。胰腺癌主要表现为恶性程度高、发展快、预后差、手术切除率低、放化疗不敏感、生存时间短、生活质量差的特点,目前尚无有效的治疗手段。因此,寻求能够提高患者生活质量、延长生存期、优于目前标准的放化疗的治疗模式具有重要意义。近年来,高强度聚焦超声(HIFU)作为一种非侵入性治疗实体肿瘤新技术得到广泛的实验和临床支持[3],HIFU在减轻晚期胰腺癌患者疼痛、提高生活质量和延长生存期等方面能发挥了一定作用[4]。笔者采用调肝理脾化积方联合HIFU对局部晚期胰腺癌患者进行治疗,观察临床受益反应、肿瘤控制情况、生存期等情况,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年5月-2015年12月本院局部晚期胰腺癌患者60例,采用随机数字表法分为治疗组和对照组各30例。治疗组男性15例,女性15例,年龄36~70岁,中位年龄64.9岁;肿瘤部位:胰头癌18例、胰体尾癌12例;病理类型:导管细胞癌14例、腺泡细胞癌8例、鳞腺癌8例。对照组男性20例,女性10例,年龄37~70岁,中位年龄63.8岁;肿瘤部位:胰头癌16例、胰体尾癌14例;病理类型:导管细胞癌15例、腺泡细胞癌8例、鳞腺癌7例。2组患者年龄、性别、KPS评分、肿瘤生长部位、病理类型分级等比较差异无统计学意义(>0.05),具有可比性。治疗组、对照组分别失访2、3例。本研究经本院伦理委员会审核批准。
1.2 西医诊断标准
参照《临床肿瘤内科手册》[5]制定局部晚期胰腺癌诊断标准。症见中上腹部隐痛或不适,放射至腰背部,或梗阻性黄疸,或进行性消瘦,上腹部包块等;腹部影像学检查见胰腺实性占位,或手术探查发现胰腺肿块;伴或不伴血清CA199、CEA等肿瘤标志物升高。具有以下≥2项影像学支持:①超声提示胰腺有低密度区,胰管扩张,胆总管和胆囊肿大;②CT提示胰腺局部肿大和占位性病变;③MRI提示病变区体积、信号异常,胰管或胆总管狭窄、扩张或有占位性病变;④磁共振胰胆管造影提示胰管或胆总管扩张或有占位性病变;⑤逆行胰胆管造影提示胰管或胆管下端截然中断,断端变钝呈鼠尾征,管壁僵硬不规则或有胆管牵拉征,双管征。
1.3 中医辨证标准
参照《中药新药临床研究指导原则(试行)》[6]肝郁脾虚证辨证标准。肝郁证主要症状:①精神抑郁、烦躁;②胁肋胀痛或乳房、少腹胀痛;③咽部有梗塞感;④脉弦。肝郁证次要症状:①口苦咽干;②失眠;③嗳气反酸,舌质紫,月经色黯有块。脾虚证主要症状:①四肢倦怠、乏力;②纳差;③腹胀;④便溏。脾虚证次要症状:①清瘦;②萎黄;③轻度浮肿;④胃脘痛;⑤恶心呕吐;⑥舌质淡或胖嫩。具有肝郁主要症状2项及以上,脾虚主要症状1项及以上,及肝郁、脾虚次要症状2项及以上即可辨证。
1.4 纳入标准
①有明确病理诊断或符合上述西医诊断标准;②中医辨证属肝郁脾虚者;③有可测量肿瘤病灶,且手术不能切除,肿瘤局限于胰腺及周围淋巴结,或有区域(或远处)淋巴结转移,未出现远处其他脏器转移;④年龄18~75岁;⑤KPS评分≥60分;⑥近1个月未接受放化疗;⑦签署知情同意书。
1.5 排除标准
①合并心、肝、肾严重损害或骨髓功能异常;②病危或临终患者,或明显恶液质;③有HIFU治疗禁忌症,如肿瘤显示不清、在超声通道上不能避开重要脏器等;④不能合作者。
1.6 治疗方法
治疗组予调肝理脾化积方(柴胡10 g,白芍15 g,法半夏10 g,茯苓15 g,枳壳10 g,厚朴10 g,藤梨根30 g,金钱草20 g,土鳖虫6 g,炙鳖甲20 g,半枝莲20 g,蛇莓15 g。乏力重加黄芪30 g、麸炒白术15 g,食欲不振加木香10 g、砂仁10 g、焦三仙30 g,疼痛加蒲黄10 g、五灵脂10 g、延胡索20 g,便秘加熟大黄10 g,黄疸加茵陈蒿30 g、炒栀子10 g,腹胀伴水肿加大腹皮、水红花子、泽泻各15 g),每日1剂,每次200 mL,早晚分服。28 d为1个疗程,共6个疗程。同时采用HIFUNIT 9000型超声聚焦肿瘤消融机(上海交通大学联合爱申科技发展股份有限公司)进行HIFU治疗。每次30~60 min,隔日1次,每周2~3次。对于不能一次治疗完成的肿物采取同一定位点衔接层面覆盖分次治疗。对治疗肿瘤完全覆盖2遍。完成对病灶的聚焦超声治疗,并服用中药至出现疾病进展为止,各种原因未能全程服药者,服药时间至少1个月。
对照组予吉西他滨1000 mg/m2,静脉滴注,第1、8日,21~28 d为1个周期,共6个周期。化疗应用至肿瘤进展或患者出现严重的不良反应终止化疗。
1.7 观察指标
1.7.1 近期疗效指标 ①临床受益反应:比较治疗后1、3、6个月疼痛评分、KPS评分和体质量变化计算临床受益率。参照吉西他滨的临床受益反应(CBR)标准[7]。主要指标:①疼痛。采用数字疼痛分级法(NRS),比基线减少≥50%持续4周以上为阳性,任何比基线的恶化持续4周以上即为阴性,除此以外的其他情况为稳定。②KPS评分。较基线提高≥20%并持续4周以上为阳性,任何恶化≥20%持续4周以上为阴性,所有其他情况为稳定。次要指标:体质量。增加≥7%持续4周以上为阳性,其他任何情况为非阳性。阳性:2个主要指标均为阳性;主要指标1个阳性,1个稳定;2个主要指标稳定,次要指标阳性。阴性:2个主要指标均恶化;2个主要指标均稳定,次要指标非阳性。②EORTC生命质量测定量表(QOL-C30)评分:观察治疗后1、3、6个月QOL-C30[8]。③肿瘤标志物:每月采用化学发光法检测患者CEA、CA199等。
1.7.2 远期疗效指标 ①主要终点:无进展生存期(PFS),每2个月复查肿瘤病灶影像直至疾病进展;②次要终点:3、6、12月生存情况,随访至死亡,随访满1年仍未结束者按1年计算。
1.8 统计学方法
采用SPSS10.0统计软件进行分析。计量资料以±表示,组间比较采用检验;等级资料比较采用秩和检验;计数资料组间比较采用卡方检验。<0.05表示差异有统计学意义。
2 结果
2.1 2组临床受益反应比较
2组治疗后1、3个月,临床受益率治疗组明显高于对照组,差异有统计学意义(<0.05),见表1。2.2 2组EORTC生命质量测定量表评分比较
2组治疗1、3、6个月,2组同一时点QOL-C30评分比较差异有统计学意义(<0.05),见表2。
2.3 2组CA199、CEA水平比较
2组CA199呈下降趋势,差异无统计学意义(>0.05)。CEA数值上下浮动,在1、3、4、5、6个月时治疗组相同时点均低于对照组,除治疗2、6个月外差异有统计学意义(<0.05),见表3。

表1 2组局部晚期胰腺癌患者不同时点临床受益反应比较
注:与对照组比较,*<0.05
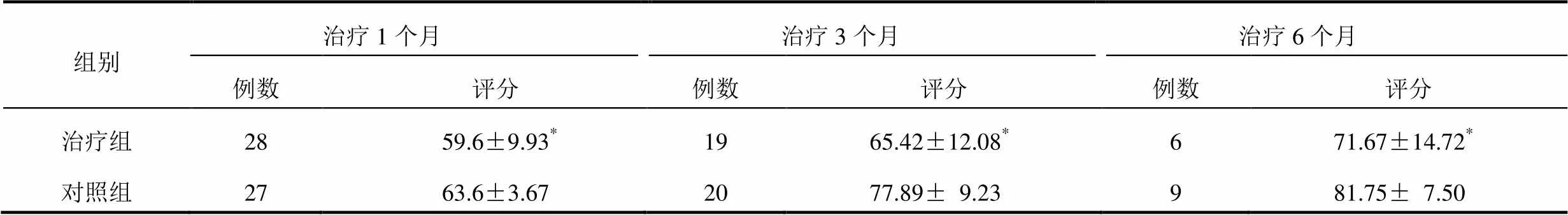
表2 2组局部晚期胰腺癌患者不同时点QOL-C30评分比较(±s)
注:与对照组比较,*<0.05
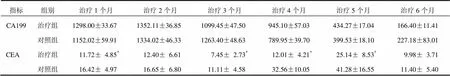
表3 CA199、CEA水平2组局部晚期胰腺癌患者不同时点比较(±s,ng/mL)
注:与对照组同一时点比较,*<0.05
2.4 2组远期疗效指标比较
2.4.1 2组生存情况比较 治疗3、6、12个月,治疗组生存率分别为82.14%(23/28)、46.42%(13/28)、(9/28)32.14%,对照组分别为96.67%(26/27)、59.32%(16/27)、37.04%(10/27)。2组比较差异无统计学意义(>0.05)。1年时生存时间,治疗组为(253.90±18.06)d,平均(219.00±27.91)d,对照组为(246.77±17.31)d,平均(220.00±25.96)d。2组比较差异无统计学意义(>0.05)。
2.4.2 2组无进展生存期比较 治疗组PFS为(136.73±16.22)d,对照组为(145.77±19.74)d。2组比较差异无统计学意义(=0.801),见图1。
3 讨论
胰腺癌的恶性程度极高,由于解剖位置特殊,症状缺乏特异性,具有发现晚、病程短、转移早、预后差的特点。目前治疗上首选手术,但80%的患者确诊时为中晚期,能够进行根治性手术者仅10%~15%,中位生存期为诊断后5~6个月[9],5年生存率低于5%[10],介入治疗及单纯放化疗效果均不理想[11]。
传统化疗未能显著延长胰腺癌患者生存期,临床受益率较小[12]。且化疗会引起消化道反应、骨髓抑制、肝肾功损害等不良反应及继发耐药,使胰腺癌的化学治疗疗效有限,远期生存获益较少。因此,有效缓解患者症状、改善生活质量是治疗胰腺癌的主要目的。
HIFU是一种非侵入性肿瘤治疗方法,其原理是利用超声波的可穿透性和可聚焦性,将体外电声换能器产生的多束超声波聚焦于体内肿瘤病变组织,在焦点处形成高能密度区,产生瞬间高温效应[13],使靶区组织产生不可逆转的凝固性坏死,从而杀灭肿瘤细胞,且对周围组织无影响[14]。HIFU对局部肿瘤的控制具有微创特点。
通过对胰腺癌的中医证候组合分析,我们发现肝郁脾虚毒聚是局部晚期胰腺癌最常见的证型。国家级名老中医郁仁存认为,胰腺在中医归属于中焦,胰腺癌多由脾气亏虚,土虚木乘所致,脾失运化而痰湿内生,继而痰阻血瘀,痰瘀互结而成瘤[15]。调肝理脾化积方以大柴胡汤为基础方,其中柴胡和解少阳,芍药助柴胡清肝胆之热,枳实、大黄内泻热结并治腹中实痛,法半夏和胃降浊以止呕逆,茯苓健脾,炙鳖甲、土鳖虫破瘀血、消痞块,再结合藤梨根、半枝莲、蛇莓清热解毒抗癌,诸药合用,共奏调肝理脾化积之功。
本研究将HIFU与中医药治疗有机结合,体现低毒有效的肿瘤绿色治疗理念。结果显示,调肝理脾化积方联合HIFU治疗组局部晚期胰腺癌的临床受益反应明显高于对照组,患者的PFS和生存率与对照组比较差异无统计学意义。HIFU治疗安全有效,联合中药与化疗比较,在同等疗效下,可使患者近期生活质量提高。随着治疗方式的不断改进,技术精进及中药更加个体化,中药调肝理脾化积方联合HIFU治疗局部晚期胰腺癌会取得更好的疗效。
[1] 李慧超,王宁,郑荣寿.中国2010年胰腺癌发病和死亡分析[J].中国肿瘤,2015,24(3):163-168.
[2] 路军章,曹秀堂,王莉莉.中医药治疗中晚期胰腺癌Meta分析[J].中华中医药杂志,2014,29(2):441-443.
[3] 姬艳红,李全禄,杨瑛.高强度聚焦超声在医学领域中应用的新进展[J].中国医学物理学杂志,2008,25(4):759-761.
[4] 赵文硕,杨中,张青.超声聚焦治疗胰腺癌60例的临床观察[J].中国医药导刊,2012,14(11):1841-1842.
[5] 石远凯,孙燕.临床肿瘤内科手册[M].5版.北京:人民卫生出版社, 2015:526-539.
[6] 郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:139-143.
[7] BURRIS H A, MOORE M J, ANDERSEN J, et al. Improvements in survival and clinical benefit with gemcitabine as first-time therapy for patients with advanced pancreas cancer:a randomized trial[J]. J Clin Oncol,1997,15(6):2403-2413.
[8] AARONSON N K, AHMEDXAI S. The european organixation for research and treatment of cencer QLQ-C30: A qualityof life instrument for use in international conocal trials in oncology[J]. Joureal of the National Cancer Institute,1993,85(5):365-367.
[9] BARON T H, KOZAREK R A. Preoperative biliary stents in pancreatic cancer-proceed with caution[J]. N Engl J Med,2010,362(2):170- 172.
[10] SIEGEL R, MA J, ZOU Z, et al. Cancer statistics,2014[J]. CA: A Cancer Journal for Clinicians,2014,64(1):9-29.
[11] THOTA R, PAUFF J M, BERLIN J D. Treatment of metastatic pancreatic adenocarcinoma:a review[J]. Oncology (Williston Park),2014,28(1):70-74.
[12] COLUCCI G, LABIANCA R, DI C F, et al. Randomized phase Ⅲ trial of gemcitabine plus cisplatin compared with single-agent gemcitabine as first-line treatment of patients with advanced pancreatic cancer:the GIP-1 study[J]. J Clin Oncol,2010,28(10):1645-1651.
[13] 胡斌,吕伟,王丹,等.高强度聚焦超声治疗对缓解胰腺癌疼痛的疗效观察[J].肝胆胰外科杂志,2014,26(2):105-108.
[14] PEEK M C, AHMED M, NAPOLI A, et al. Systematic review of high-intensity focused ultrasound ablation in the treatment of breast cancer[J]. Br J Surg,2015,102(8):873-882.
[15] 李婵,富琦,赵文硕,等.中晚期胰腺癌中医证候要素分布规律初探[J].北京中医药,2011,30(12):891-893.
Clinical Study onPrescription Combined with High Intensity Focused Ultrasound for Treatment of Locally Advanced Pancreatic Cancer
LI Na, ZHANG Qing, LIU Sheng, ZHAO Wen-shuo
Objective To investigate the effects ofPrescription combined with high intensity focused ultrasound (HIFU) for the treatment of locally advanced pancreatic cancer. Methods Randomized, parallel controlled study was designed to select 60 patients with locally advanced pancreatic cancer, which were divided into treatment group and control group by random number table method, 30 cases in each group. The treatment group was givenPrescription, one dose per day, twice a day, orally, 28 d as a treatment course, 6 courses in total; at the same time, HIFU was given to the treatment group, 30–60 min each time, once every other day, 2–3 times each week, and the tumor was completely covered for 2 times. The control group was given gemcitabine 1000 mg/m2, intravenous infusion, 1st, 8th d, 21–28 d for a cycle, a total of 6 cycles. The clinical benefit response, QOL-C30 score, survival status, progression-free survival (PFS), CA199 and CEA levels were observed. Results Clinical benefit rates of treatment group and control group were: the treatment group 1, 3, 6 months clinical benefit rate was 64.29%, 63.16%, and 50.00%, respectively; control group clinical benefit rate was 48.15%, 40.00%, and 44.44%, respectively, with statistical significance (<0.05). The difference of QOL-C30 score between the two groups at the same time was statistically significant (<0.05). During the treatment 1 to 6 months, CA199 in the two groups showed a downward trend, without statistical significance (>0.05). CEA levels in the treatment group were lower than those in the control group at the same time with statistical significance (<0.05), except for 2 and 6 months. The survival rates of treatment of 3, 6, and 12 months in the treatment group were 82.14%, 46.42% and 32.14%, respectively, and were 96.67%, 59.32% and 37.04%, respectively in the control group, without statistical significance (>0.05). The survival time of the treatment group was (253.90±18.06)d in the control group and (246.77±17.31)d in the control group, without statistical significance (>0.05). PFS was (136.73±16.22)d in the treatment group and (145.77±19.74)d in the control group, without statistical significance (>0.05).ConclusionPrescription combined with HIFU for the treatment of locally advanced pancreatic cancer has certain clinical efficacy, which can improve patients’ life quality.
locally advanced pancreatic cancer; high intensity focused ultrasound; progression-free survival; survival rate; clinical benefit response
10.3969/j.issn.1005-5304.2017.07.006
R273.59
A
1005-5304(2017)07-0023-05
首都市民健康项目(Z141100002114028);北京市卫生系统高层次卫生技术人才培养计划(2015-3-115)
赵文硕,E-mail:wenshuozhao1970@sina.com
(2016-11-02)
(2016-12-12;编辑:季巍巍)

