肾衰饮对慢性肾功能衰竭大鼠ATF6/CHOP通路的作用研究*
刘 烨 马晓燕
(辽宁中医药大学,辽宁 沈阳 110032)
·研究报告·
肾衰饮对慢性肾功能衰竭大鼠ATF6/CHOP通路的作用研究*
刘 烨 马晓燕△
(辽宁中医药大学,辽宁 沈阳 110032)
目的 观察肾衰饮对慢性肾功能衰竭大鼠肾脏ATF6/CHOP通路的影响,探析肾衰饮延缓慢性肾功能衰竭的作用机制。方法 52只SD大鼠,按体质量分层随机抽取10只为正常组,其他大鼠采用腺嘌呤灌胃法模型3周。造模成功后随机分为模型组、肾衰饮组和尿毒清组。肾衰饮组和尿毒清组分别给予肾衰饮煎剂和尿毒清颗粒连续灌胃4周。全自动生化分析仪检测血肌酐、尿素氮含量,HE染色观察各组大鼠肾组织病理变化,Western Blot技术检测大鼠肾脏ATF6、CHOP、Bcl-2、Bax、Caspase-3蛋白表达情况。结果 与正常组比较,模型组Scr、BUN水平显著升高(P<0.01);与模型组比较,肾衰饮组和尿毒清组大鼠Scr、BUN水平均显著降低(P<0.01)。HE染色提示:肾衰饮及尿毒清能够改善模型组大鼠肾脏病理学改变。Western Blot结果提示:与正常组比较,模型组大鼠肾脏ATF6、CHOP、Caspase-3蛋白表达水平显著升高(P<0.01),Bcl-2/Bax水平显著降低(P<0.01);与模型组比较,肾衰饮组大鼠ATF6、CHOP、Caspase-3蛋白表达水平显著降低(P<0.05或P<0.01),Bcl-2/Bax水平显著升高(P<0.01)。结论 肾衰饮可能通过影响ATF6/CHOP通路,减少肾组织细胞凋亡,保护受损肾脏功能。
慢性肾功能衰竭 肾衰饮 内质网应激 ATF6 CHOP 凋亡
【Key words】Chronic renal insufficiency;Shenshuaiyin Decoction;Endoplasmic reticulum stress;ATF6;CHOP;Apoptosis
随着我国人口平均年龄的增加及老龄化的到来,慢性肾功能衰竭(CRF)严重威胁着人们健康和生活质量。CRF是各种慢性肾脏疾病发展的最终阶段。对于患者而言,本病治疗将进行肾移植或终生接受透析,价格昂贵,且不适用于疾病的早、中期阶段。因此,积极防治慢性肾脏疾病,延缓肾功能衰竭进程具有重要意义。
肾间质纤维化是各种肾脏疾病发展到终末期的共同途径和主要病理基础,炎症和凋亡是其重要的病理变化[1-2]。内质网应激(ERS)是启动炎症反应和细胞凋亡的中心环节,肾脏细胞内质网发达,具有发生ERS的条件和基础。对ERS进行干预调节,对于挽救残存的肾脏细胞,保护肾脏功能具有重要影响。
课题组前期实验研究证实,肾衰饮能够减轻肾组织损伤,改善肾功能[3-4],但对于其作用机制的探究尚不全面。本实验以肾衰大鼠为实验对象,以ERS为切入点,探究肾衰饮对肾衰竭大鼠肾脏功能的保护作用,为阐明肾衰饮防治肾衰的作用及机制提供实验依据。现报告如下。
1 材料与方法
1.1 实验动物 SPF级健康SD雄性大鼠52只,体质量(180±20)g,购买于辽宁长生生物技术有限公司,许可证号:SCXK(辽)2010-0001。饲养于辽宁中医药大学实验动物中心,自由摄食与饮水。温度(22±1)℃,湿度(50±5)%。适应性饲养7 d。
1.2 试药与仪器 腺嘌呤25 g/瓶(Amresco,美国);尿毒清5 g/袋(广州康臣药业有限公司);肾衰饮购自辽宁省中医院中药局(组成:黄芪40 g,太子参20 g,水红花子15 g,夏枯草20 g,砂仁10 g,白术15 g,菟丝子15 g,土茯苓30 g,白茅根30 g,藿香15 g,大黄10 g,法半夏10 g,丹参15 g,水蛭5 g,莪术10 g,鳖甲20 g。辽宁省中医院中药局);肌酐(Scr)测定试剂盒(货号:C013-2。南京建成生物工程研究所);尿素氮(BUN)测定试剂盒 (货号:C011-2,南京建成生物工程研究所);ATF6抗体(货号:bs1287R。中国博奥森)、CHOP抗体(货号:2958。美国CST)、Bcl-2抗体 (货号:bs-20163R。中国博奥森)、Bax(货号:bs-0127M。中国博奥森)、Caspase-3抗体 (货号:9662。美国CST);β-actin(货号:J2114。美国santa)羊抗兔过氧化物酶标记IgG(货号:CW0103。中国康维)、羊抗小鼠过氧化物酶标记IgG(货号:CW0102。中国康维)。仪器设备:TriStar2 LB 942型多功能酶标仪(伯托公司,德国),组织破碎机(德国,IKA),低速冷冻离心机(Thermo,美国),干式恒温器酶标仪Multiskan FC型(Thermo,美国),垂直板电泳装置(Bio-Rad,美国),Trans-Blot SD半干转印(Bio-Rad,美国)。
1.3 分组与造模 按体质量分层随机抽取10只为正常组,剩余42只大鼠进行造模:腺嘌呤悬浊液200 mg/(kg·d)连续灌胃3周[5][正常组予8 mL/(kg·d)0.9%氯化钠溶液灌胃]。第4周时模型组随机抓取6只大鼠,正常组取2只进行肾功能检测及肾脏病理观察。造模成功后,将所有造模大鼠随机分为模型组、肾衰饮组与尿毒清组,各12只。尿毒清组予尿毒清颗粒2.25 g/kg灌胃治疗;肾衰饮组大鼠给予毫升药液含生药量为3.36 g的肾衰饮煎剂33.3 g/kg灌胃治疗;模型组和正常组予0.9%氯化钠溶液8 mL/kg灌胃。连续给药4周后,所有大鼠取材,进行各指标监测。造模及治疗期间大鼠死亡情况:模型组3只,尿毒清组2只,肾衰饮组2只。死亡原因考虑为灌胃手法不当,灌胃液体误入气管所致。
1.4 标本采集与检测 肾功能检测采用全自动生化分析仪检测各组大鼠血清Scr及BUN含量比较。形态学检测肾组织逐步进行4%多聚甲醛固定、乙醇梯度脱水、二甲苯透明、石蜡包埋、厚度为4~5 μm切片。切片进行HE染色,最后用光学显微镜观察各组肾脏组织的病理变化并拍照。Western blot检测,称量0.1 g肾脏组织,加1 mL裂解液研磨提,匀浆液1200 r/min 10 min,4℃离心取上清。采用BCA法检测蛋白浓度,蛋白100℃变性5 min,每孔60 μg蛋白电泳,经转膜、封闭后,一抗孵育 ATF6(1∶300)、CHOP(1∶1000)、Bcl-2(1∶1000)、Bax(1∶1000)、Caspase-3(1∶1000)、β-actin(1∶800)室温孵育1 h后4℃过夜,次日二抗孵育1 h后加ECL发光液曝光,目的蛋白分别与β-actin条带的光密度比值后,再各组比较。
1.5 统计学处理 应用SPSS17.0统计软件处理,计量资料以 (±s)表示,采用单因素方差分析结合Turkeys test比较各组间差异。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血清Scr、BUN水平的比较 见表1。与正常组比较,模型组Scr、BUN含量显著升高(P<0.01);与模型组比较,肾衰饮组及尿毒清组Scr、BUN含量显著降低(P<0.01),且肾衰饮组下调更明显。
表1 各组大鼠血清Scr、BUN含量比较(±s)

表1 各组大鼠血清Scr、BUN含量比较(±s)
与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同。
组 别 n 肌酐(μmol/L) 尿素氮(mmol/L)正常组 8 40.75±7.00 3.82±1.4模型组 9 84.15±10.93**10.00±1.69**肾衰饮组 10 54.85±4.74△△7.17±1.23△△尿毒清组 10 59.03±4.75△△8.02±1.17△△
2.2 各组大鼠肾脏组织形态学变化 见图1。正常组大鼠肾脏形态正常,无炎性细胞浸润。与正常组相比,模型组肾脏皮质,肾小球结构形态大小异常,血管球萎缩肾球囊变大比例失调,肾小管变性坏死、萎缩,大量炎性细胞浸润。肾衰饮组与尿毒清组对模型均有一定的改善作用,尿毒清组肾小球结构形态大小接近正常,血管球充盈,肾球囊腔大小比例基本正常,肾小管的管壁薄均匀管腔大小正常,肿胀有所减轻,少量炎性细胞浸润;肾衰饮组肾小球结构形态大小接近正常,血管球充盈,肾球囊腔比例基本正常,肾小管的管壁薄厚管腔大小基本正常,肿胀基本消失,偶见少量炎性细胞浸润。

图1 各组大鼠肾脏组织(HE染色,200倍)
2.3 各组大鼠肾脏组织ATF6/CHOP通路蛋白表达水平比较 见表2。与正常组比较,模型组大鼠肾脏ATF6、CHOP、Caspase-3蛋白表达水平显著升高 (P<0.01),Bcl-2/Bax水平显著降低(P<0.01);与模型组比较,肾衰饮组大鼠ATF6、CHOP、Caspase-3蛋白表达水平显著降低(P<0.05或P<0.01),Bcl-2/Bax水平显著升高(P<0.01);尿毒清组ATF6、CHOP、Caspase-3蛋白表达水平显著降低 (P<0.01),Bcl-2/Bax水平显著升高(P<0.01)。
表2 大鼠肾脏ATF6/CHOP通路蛋白表达水平比较(±s)
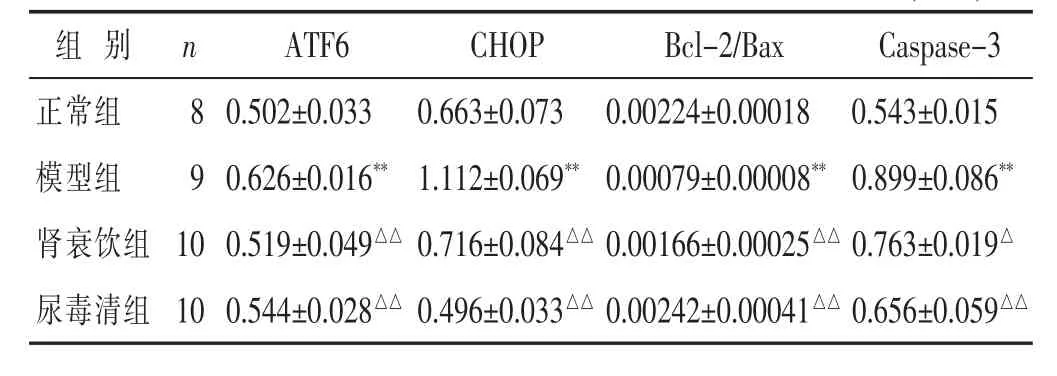
表2 大鼠肾脏ATF6/CHOP通路蛋白表达水平比较(±s)
组别 n ATF6CHOP Bcl-2/Bax Caspase-3正常组 8 0.502±0.033模型组 9 0.626±0.016**肾衰饮组 10 0.519±0.049△△0.663±0.073 1.112±0.069**0.716±0.084△△0.00224±0.00018 0.543±0.015 0.00079±0.00008**0.899±0.086**0.00166±0.00025△△0.763±0.019△尿毒清组 10 0.544±0.028△△0.496±0.033△△0.00242±0.00041△△0.656±0.059△△
3 讨 论
CRF是各种慢性肾脏疾病肾功能恶化的结果,严重影响着人民的生活质量。中医学对于CRF早中期的治疗有着独特的优势。笔者以中医理论为依据,对CRF发病机制深入研究,认为内生之毒是导致CRF的关键[6],并提出以“补肾健脾,祛湿化浊、涤痰活血、清热解毒”的治疗原则[7],自拟经验方肾衰饮,攻补兼施,集抗毒、解毒、排毒三法于一方,多途径祛毒外出,同时,祛邪不忘扶正,重视调理脾胃升降[8]。一些前期实验研究已经证实,肾衰饮对减少蛋白尿,抑制肾纤维化的发生、发展具有很好的效果。
本实验研究实验发现,肾衰饮能够降低CRF大鼠血清中Scr和BUN水平,改善模型组大鼠肾脏组织的病理状态,对受损的肾脏组织功能起到了保护作用。Western Blot结果提示肾衰饮对CRF大鼠肾脏的保护作用可能是通过减轻肾组织ERS,减少肾脏细胞凋亡实现的。
肾小管上皮细胞过度凋亡可能是肾功能恶化的重要机制之一[9]。ERS是近年来发现的一种启动凋亡的新途径,ERS是内质网生理功能紊乱时出现的一种亚细胞病理状态,持续过度的ERS会引起细胞的凋亡[10]。内质网是新生蛋白折叠的地方,只有正常折叠的蛋白才能够运送至高尔基体,当外界环境发生改变,出现炎症、氧化应激等刺激时,内质网功能紊乱,未折叠蛋白就会在内质网中积聚并引发未折叠蛋白反应(UPR),细胞启动UPR恢复内环境稳态,从而保护发生ERS的细胞[11]。ERS发生时,UPR可激活3种转录因子,ATF6是其中之一。ERS发生时,ATF6会从内质网膜转位到高尔基体中被激活,转而进入细胞核,与内质网应激元件结合后诱导应激反应基因的表达[12]。本文研究发现,模型组大鼠ATF6蛋白表达显著升高,说明CRF大鼠存在ERS,肾衰饮能够下调模型组高表达的ATF6,说明肾衰饮可能通过该途径减轻CRF大鼠肾脏ERS。
当ERS持续存在时,活化的ATF6能够诱导CHOP[13]。CHOP又称生长停滞及DNA损伤诱导蛋白153[14]。在正常情况下,CHOP主要存在于细胞浆中且表达量很低[15],而细胞处于应激状态时,ATF6可以上调CHOP表达,CHOP的主要作用是在UPR过程中通过编码蛋白质促进细胞凋亡[16]。在我们实验研究中发现,模型组大鼠肾脏组织中CHOP蛋白高表达,且凋亡相关蛋白Caspase-3表达升高,Bcl-2/Bax比值降低,说明CHOP可能激活Caspase级联反应诱导细胞凋亡,同时降低Bcl-2的表达,下调了细胞的抗凋亡能力。与模型组相比较,肾衰饮组CHOP与Caspase-3蛋白表达显著下降,Bcl-2/Bax比值升高,提示我们肾衰饮可能通过ATF6/CHOP途径减轻ERS反应,减少肾脏细胞凋亡。
本实验研究发现,肾衰饮能够延缓CRF大鼠肾脏病理形态学进展,改善受损肾功能,其机制可能是通过影响ATF6/CHOP途径实现的。
[1] Vidt DG.Inflammation in renal disease[J].The American Journal of Cardiology,2006,97(2),20-27.
[2] Hughes J.Apoptosis in tubulointerstitial renal disease[J]. Nephrology Dialysis Transplantation,2000,15(suppl 6),55-57.
[3] 马晓燕,崔峥,闫渊.肾衰饮对肾纤维化大鼠TGF-β_1/ Smad信号通路的作用研究[J].中国中西医结合肾病杂志,2015,16(12):1059-1062.
[4] 马晓燕,闫渊,崔峥.肾衰饮对TGF-β1诱导的下游因子CTGF及FN的调控作用[J].中华中医药学刊,2015,33(7):1543-1545.
[5] Yokozaw a T,Zheng PD,Qura H,et al.Animal model of adenine-induced chronic renal failure in rats[J].Nephron,1986,44(3):230-234.
[6] 马晓燕,刘月,王艳结.慢性肾衰竭之“毒邪”[J].吉林中医药,2014,34(10):1038-1040.
[7] 刘烨.马晓燕教授从肾虚毒邪论治慢性肾功能衰竭经验总结[D].沈阳:辽宁中医药大学,2008.
[8] 马晓燕,许静芳.从脾胃升降理论探讨慢性肾衰的辩治思路[J].辽宁中医杂志,2010,37(1):82-83.
[9] 吴小玮,何娅妮,丁涵露,等.慢性肾病患者肾小管上皮细胞内质网应激与细胞凋亡的关系[J].第三军医大学学报,2008,30(11):1010.
[10]Hiderou Yoshida.ER stress and diseases[J].FEBS Journal,2007,274(3):630.
[11]Schrder M,Kaufman RJ.ER stress and the unfolded protein response[J].Mutat Res,2005,569(1-2):29-63.
[12]Chiang WC,Hiramatsu N,Messah C,et al.Selective activation of ATF6 and PERK endoplamic reticulum stress signaling pathways prevent mutant rhodopsin accumulation[J].Invest Ophthalmol Vis Sci,2012,53(11):7159-7166.
[13]Oyadomari S,Mori M.Role of CHOP/GADD153in endoplasmic reticulum stress[J].Cell Death Differ,2004,11:381-389.
[14]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death Differ,2004,11(4):381389.
[15]Ron D,Habener JF.CHOP,a novel developmentally regulated nuclear protein that dimerizes with transcription factors C/EBP and LAP and functions as a dominant-negative inhibitor of gene transcription[J].Genes Dev,1992,6(3):439-453.
[16]Mccullough KD,Martindale JL,Klotz LO,et al.Gadd153 sensitizescellsto endoplasmic reticulum stressby down regulating Bcl2 and perturbing the cellular redox state[J]. Mol Cell Biol,2001,21(4):1249-1259.
Effects of Shenshuaiyin Decoction on ATF6/CHOP Pathway in Kidney Tissues of Chronic Renal FailureRats
LIU Ye,MA Xiaoyan. Liaoning University of Traditional Chinese Medicine,Liaoning,Shenyang 110032,China.
Objective:To discuss the pharmacology mechanism of Shenshuaiyin Decoction delaying the kidney failure by observing the effect of Shenshuaiyin Decoction on ATF6/CHOP pathway in kidney tissues of chronic renal failure rats.Methods:From 52 SD rats,8 rats were randomly selected as the normal group.The other rats were taken as renal failure models by adenine gavage method for 3 weeks.After successful modeling,the modeled rats were randomly divided into model group,Shenshuaiyin Decoction group and Niaoduqing group.The Shenshuaiyin Decoction group and Niaoduqing group rats were given Shenshuaiyin Decoction and Niaoduqing gavage for 4 weeks.SCr and BUN were tested using the automatic biochemical analyzer.The renal pathological changes in rats of each group were observed by HE staining method.ATF6,CHOP,Bcl-2,Bax and Caspase-3 protein expression were tested with Western blot methods.Results:Compared with the normal group,the Scr and BUN level in the model group increased significantly(P<0.01).Compared with the model group,the Scr and BUN level in Shenshuaiyin Decoction group and Niaoduqing group decreased significantly(P<0.01).HE staining results showed that Shenshuaiyin Decoction and Niaoduqing could improve the renal pathological changes in rats of the model group.Western blot results showed that compared with the normal group,the expression level of ATF6,CHOP,Caspase3 increased significantly(P<0.01)and the expression levels of Bcl-2/Bax decreased significantly(P<0.01)in the model group.Compared with the model group,the expression level of ATF6,CHOP,Caspase-3 decreased significantly(P<0.05 or P<0.01)and the expression levels of Bcl-2/Bax increased significantly(P<0.01)in Shenshuaiyin Decoction group.Conclusion:Shenshuaiyin Decoction plays an important biological role in reducing renal tissue cell apoptosis and improving the impaired renal function via regulating ATF6/CHOP pathway of chronic renal failure rats.
R285.5
A
1004-745X(2017)05-0768-04
10.3969/j.issn.1004-745X.2017.05.005
2017-02-24)
国家自然科学基金青年基金项目(81373527);沈阳科学技术计划项目(F13-220-9-18)
△通信作者(电子邮箱:aaaxyma@hotmail.com)

