不同大豆品种大豆皂苷组成分析
岳爱琴 王卫东 徐海军 王 敏 郭春绒 赵晋忠 杜维俊
(山西农业大学农学院1,太谷 030801)(山西农业大学文理学院2,太谷 030801)
不同大豆品种大豆皂苷组成分析
岳爱琴1王卫东2徐海军2王 敏1郭春绒2赵晋忠2杜维俊1
(山西农业大学农学院1,太谷 030801)(山西农业大学文理学院2,太谷 030801)
为明确山西大豆资源胚和子叶中大豆皂苷含量的分布情况,筛选特异资源在育种中应用,本研究以71份山西大豆种质资源为材料,采用高效液相色谱-电喷雾离子化串联质谱联用技术(HPLC-ESI-MS/MS)分析不同材料中大豆皂苷组成和含量的差异。结果表明:参试材料胚和子叶中大豆皂苷含量变异范围分别为17.02~83.51 mg/g和6.53~50.11 mg/g。A类、DDMP类、B类和E类皂苷均与总皂苷含量呈极显著正相关。小粒型大豆材料胚中B类和E类皂苷含量、子叶总皂苷和DDMP类皂苷含量显著高于中粒和大粒型材料。野生、半野生大豆材料胚中B类、E类大豆皂苷含量显著高于栽培品种;野生大豆子叶总皂苷、DDMP类皂苷含量显著高于半野生和栽培大豆。
大豆 皂苷 HPLC-ESI-MS/MS 百粒重
大豆皂苷是大豆种子生长过程中形成的主要次生代谢产物之一。大豆皂苷属于三萜类齐墩果酸型皂苷,主要分为A类、DDMP(2, 3-dihydro-2, 5-dihydroxy-6- methyl -4H-pyran-4-one)类、B类和E类皂苷4类[1-2](表1)。A类皂苷是大豆皂醇A在C-3和C-22位结合2个糖链组成,其中C-22位糖链末端糖基乙酰化,大豆皂醇B在C-3位和C-22位分别结合1个糖链和DDMP基团形成DDMP类皂苷,而DDMP类皂苷C-22位失去DDMP基团形成B类皂苷,E类皂苷是B类皂苷C-22位发生氧化形成的[3-4]。研究表明,A类皂苷末端糖基乙酰化导致大豆及其制品具有苦味和涩味[5],而DDMP类、B类和E类皂苷具有降低胆固醇、抑制结肠癌细胞的增殖、抗血脂氧化、抗炎以及抗HIV病毒等多种对人体有益的生理功能[6-10]。DDMP类、B类和E类大豆皂苷在植物中还可引起植物的防御反应,使植物体具有抗菌、抗病毒和抗虫等抗性[11-13]。因此,开展大豆皂苷遗传改良,降低A类皂苷的合成积累,提高DDMP类、B类和E类皂苷含量,是提高大豆品质及市场价值的一条经济有效途径。

表1 大豆种子中大豆皂苷的种类
大豆皂苷组成和含量变异丰富的大豆资源以及大豆特异种质资源的发掘,有利于今后开展大豆皂苷品质的遗传改良。目前,日本、韩国和美国等国家针对大豆种质资源的大豆皂苷进行了检测[14-17]。Kim等[16]对来源于中国、美国、韩国3个国家大豆材料的大豆皂苷元A和B含量进行测定,发现我国大豆皂苷元含量位居首位,并且存在较大的变异范围。然而我国对大豆皂苷的研究主要在医药和提取分离领域[18-20],关于大豆皂苷组成和含量的研究较少[21]。此外,当前研究者主要是对大豆整个籽粒的皂苷含量进行测定,将胚和子叶分别进行测定的报道较少。为此本研究利用HPLC-ESI-MS/MS对山西大豆种质资源胚和子叶中大豆皂苷组成和含量分别进行测定,明确皂苷各组成含量的变异范围和规律,鉴定大豆皂苷组成和含量特异的种质资源,以用于改良大豆皂苷品质的育种与研究,为今后大豆功能产品的开发提供借鉴。
1 材料与方法
1.1 材料与仪器
由山西农业大学大豆育种室提供的71份大豆材料作为研究对象,其中7份野生大豆,20份半野生大豆,44份栽培大豆。供试大豆材料于2015年种植于山西农业大学实验农场,按小区种植,成熟后收获种子,风干,保存用于检测大豆皂苷。Aa、Ab、Ba、Bb标准品:日本常磐植物化学研究所。
TSQ Quantum Ultra液质联用仪:赛默飞世尔科技有限公司;震动球磨仪GT200:北京格瑞曼仪器设备有限公司。
1.2 试验方法
1.2.1 大豆皂苷的提取
取0.1 g胚粉和子叶粉于离心管中,加入1 mL提取液(70%甲醇+0.01%乙酸),超声振荡10 min后室温浸提24 h,取上清液用2倍体积的正己烷萃取脱脂,0.22 μm滤膜过滤,4 ℃冰箱保存备用。
1.2.2 HPLC-ESI-MS/MS分析大豆皂苷组分
1.2.2.1 色谱条件
色谱柱:Hypersil Gold(150 mm×2.1 mm,5 μm粒径)。流动相A:0.025%(V/V)乙酸的乙腈溶液;流动相B:0.025%(V/V)乙酸的水溶液。梯度洗脱程序:0~12.5 min,13%~30%B;12.5~17.5 min,30%~40%B;17.5~23.5 min,40%B;23.5~27.5 min,40%~60%B;27.5~30 min,60%~100%B;30~35 min,100%B;36 min,13%B;平衡柱子6 min;运行时间42 min;流速200 μL/min;喷雾电压:3 500 V;鞘气压力30;辅气压力5;毛细管温度:350 ℃;进样量:10 μL。
1.2.2.2 标准曲线的制备
用微量电子天平精确称取大豆皂苷标准品Aa、Ab、Ba、Bb各5 mg,用甲醇溶解并定容至5 mL,配成1 000 μg/mL的储备液。将各储备液逐级稀释为100、200、400、800、1 000 μg/mL的标准溶液。以质量浓度为横坐标,以峰面积为纵坐标做标准曲线。Aa、Ab、Ba、Bb的标准曲线方程分别为YAa=34.244X+672.00、YAb=6.815X+125.53、YBa=21.926X-98.328、YBb=16.581X-231.15。
1.2.2.3 样品中大豆皂苷各组分的分析测定
每个样品运行42 min之后,调为选择性离子抽提模式,抽提36种大豆皂苷组分的谱图,根据质荷比定性。根据Aa、Ab标准曲线计算样品中A类皂苷各组分的含量,Ba、Bb标准曲线计算样品中DDMP类、B类、E类皂苷各组分含量。样品中A类、DDMP类、B类、E类皂苷含量为其各组分含量之和。
1.2.3 数据分析
应用Excel及SPSS17.0对胚和子叶中大豆皂苷含量进行统计分析。
2 结果与分析
2.1 大豆皂苷总含量分析
用HPLC-ESI-MS/MS对山西71份大豆材料胚和子叶中大豆皂苷含量进行分析,发现不同品种之间大豆皂苷总含量差异较大,所有参试品种胚和子叶中总皂苷含量平均值分别为37.24和13.04 mg/g,其含量变异范围分别为17.02~83.51 mg/g和6.53~50.11 mg/g(表2)。半野生材料WS258胚中总皂苷含量最高,栽培种强丰一号子叶总皂苷含量最高。所有参试材料中,胚中大豆皂苷总含量为子叶中的1.42~7.16倍。
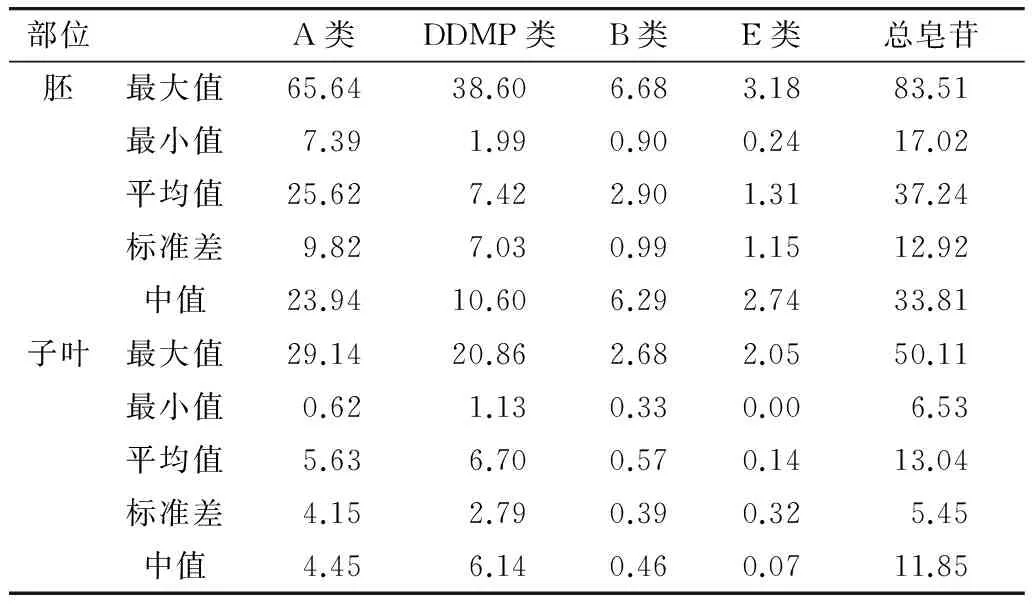
表2 大豆胚和子叶中皂苷含量分析/mg/g
2.2 大豆皂苷各组分含量分析
不同大豆材料胚和子叶A类、DDMP类、B类和E类皂苷含量也存在较大的变异。其中胚和子叶A类皂苷的变异范围分别为7.39~65.64 mg/g、0.62~29.14 mg/g,DDMP类皂苷的变异范围分别为1.99~38.60 mg/g、1.13~20.86 mg/g。B类和E类皂苷含量相对较低,但品种之间仍然存在较大的变异幅度(表2)。说明在大豆种质资源中可以筛选出低A类皂苷含量,高DDMP类、B类和E类皂苷含量的特用种质,从而有利于开展大豆皂苷的优质育种工作。胚和子叶中A类皂苷含量之比为4.6∶1,DDMP类、B类和E类皂苷含量总和在胚和子叶中的比值为1.5∶1。A类皂苷在胚和子叶中分别占总皂苷含量的68.78%、43.17%。DDMP类皂苷胚和子叶中分别占总皂苷含量19.92%、51.38%。
2.3 大豆皂苷含量的相关分析
分析大豆胚和子叶中各类皂苷含量及其与总含量的相关性,发现胚和子叶中,A类、DDMP类、B类和E类皂苷均与总皂苷含量呈极显著正相关。其中胚和子叶中A类皂苷与总皂苷相关系数均达到0.8以上;胚和子叶中A类皂苷与DDMP类皂苷相关性均不显著;胚中DDMP类皂苷与B类、E类皂苷相关性均不显著,而子叶中呈极显著相关(表3、表4)。
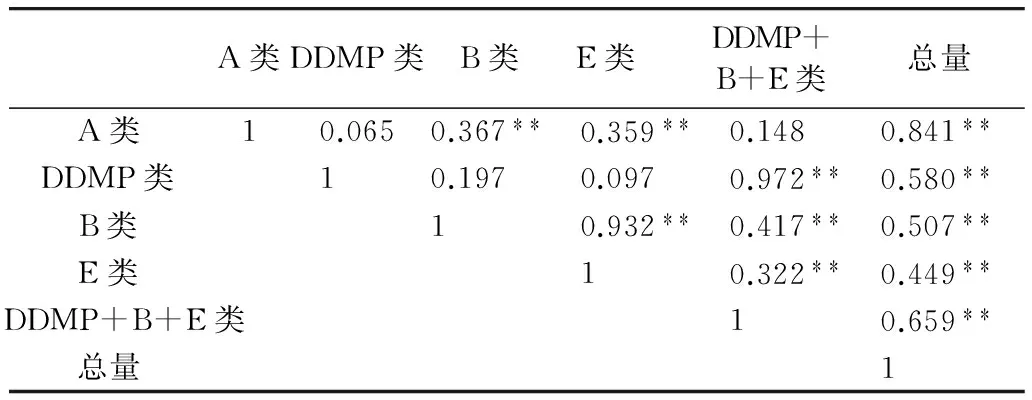
表3 大豆胚中各类皂苷含量与总量的相关分析
注:﹡表示差异达显著水平(P<0.05);﹡﹡表示差异达极显著水平(P<0.01);下同。

表4 大豆子叶中各类皂苷含量与总量的相关分析
2.4 不同粒重类型大豆材料中皂苷含量的比较分析
根据百粒重大小将参试材料分为小粒(<13 g)、中粒(13~24 g)和大粒(>24 g)3种类型。对不同类型胚和子叶大豆皂苷含量进行统计分析,发现小粒型大豆材料胚中B类、E类大豆皂苷含量平均值分别高达3.51、1.71 mg/g,显著高于中粒和大粒型材料,不同粒重大豆材料胚DDMP类皂苷和总皂苷含量差异不显著(表5)。而小粒型材料子叶总皂苷、DDMP类皂苷含量平均值分别高达15.10、8.21 mg/g,显著高于中粒型和大粒型品种。不同粒重大豆材料胚和子叶A类皂苷含量均无显著差异(表6)。
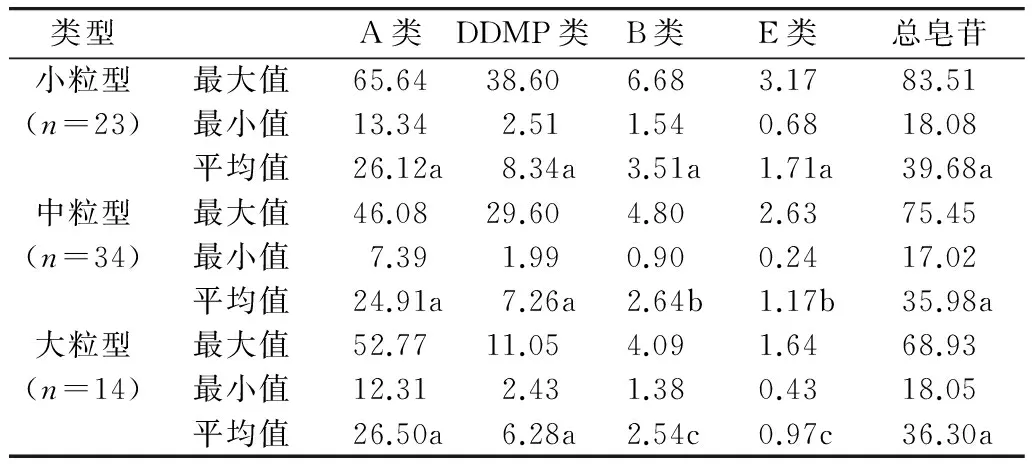
表5 不同粒重类型胚大豆皂苷含量比较分析/mg/g
注:不同小写字母表示同列之间的显著性差异(P<0.05),下同。

表6 不同粒重类型大豆材料子叶中皂苷含量比较分析/mg/g
2.5 野生、半野生、栽培大豆材料大豆皂苷含量的比较分析
对野生、半野生、栽培大豆材料子叶和胚中的大豆皂苷含量进行统计分析,发现野生、半野生大豆材料胚中B类、E类大豆皂苷含量显著高于大豆栽培品种,而A类、DDMP类和总皂苷含量差异不显著。野生大豆材料子叶中总皂苷、DDMP类皂苷含量平均值分别高达18.81、12.21 mg/g,显著高于半野生和栽培大豆(表7、表8)。说明野生大豆材料是大豆皂苷含量遗传改良的优质种质资源。
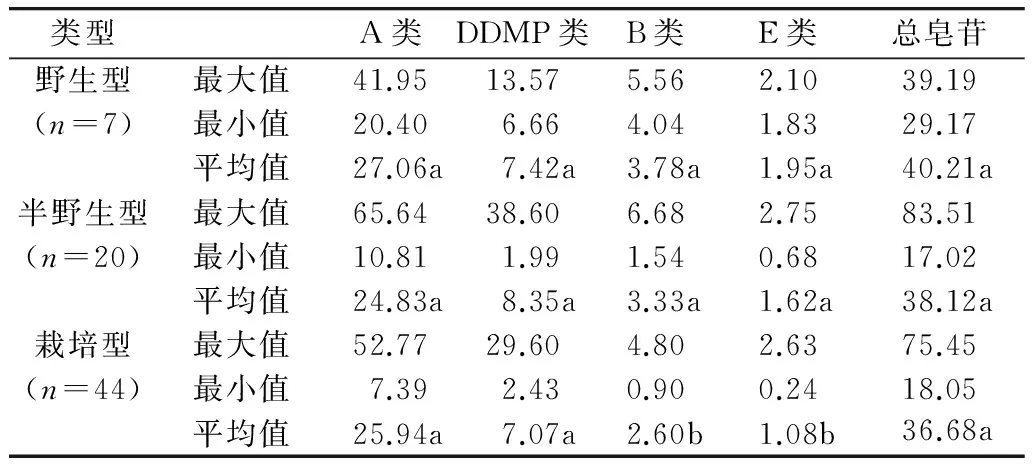
表7 野生、半野生和栽培大豆胚中大豆皂苷含量比较分析/mg/g
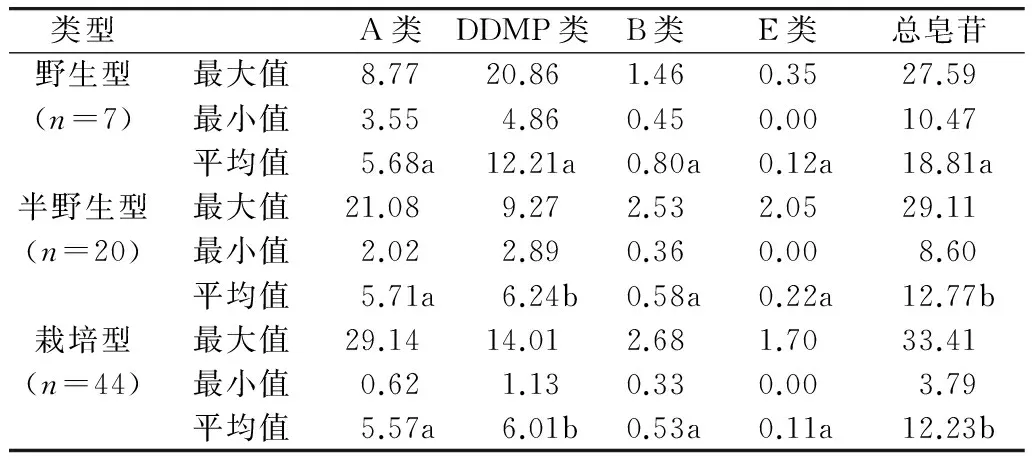
表8 野生、半野生和栽培大豆子叶中大豆皂苷含量比较分析/mg/g
3 讨论
本研究采用HPLC-ESI-MS/MS分析山西大豆材料胚和子叶中大豆皂苷含量,变异范围分别为17.02~83.51 mg/g和6.53~50.11 mg/g,平均值分别为37.24和13.04 mg/g 。皂苷组成和含量丰富的遗传变异,有利于今后开展大豆皂苷品质育种工作。由于A类皂苷可引起大豆及其制品具有苦涩味[5],而DDMP类、B类和E类皂苷具有多种对人体有益的生理功能[6-10],因此富含DDMP类、B类和E类皂苷材料的利用价值高于富含A类皂苷的材料。本试验条件下,胚和子叶A类皂苷的变异范围分别为7.39~65.64 mg/g、0.62~29.14 mg/g,DDMP类皂苷的变异范围分别为1.99~38.60 mg/g、1.13~20.86 mg/g。说明在大豆种质资源中可以筛选出低A类皂苷含量,高DDMP类、B类和E类皂苷含量的特用种质,从而有利于开展大豆皂苷的优质育种工作。
本研究表明胚和子叶中大豆皂苷组成和含量不同,胚中大豆皂苷总含量是子叶中的1.42~7.16倍。胚中A类皂苷占总皂苷含量的68.78%,DDMP类、B类和E类皂苷含量仅占31.22%;子叶中A类皂苷占总皂苷含量的43.15%,而DDMP类、B类和E类皂苷所占比例达56.85%。Kim等[16]研究表明,不同籽粒大小大豆皂醇A和B含量不同。Jang等[17]研究表明,小粒型整个籽粒大豆皂苷总含量高于中粒和大粒型大豆材料。本研究发现不同籽粒大小大豆材料胚中B类、E类大豆皂苷差异显著,DDMP类和总皂苷含量差异不显著;而子叶总皂苷和DDMP类皂苷含量差异显著。这可能是由于胚和子叶中大豆皂苷具有不同积累和调控途径,但关于胚和子叶中大豆皂苷积累机制还有待于进一步研究。
4 结论
通过研究发现,山西大豆材料胚和子叶中大豆皂苷组成和含量存在较大的变异范围,可以为大豆皂苷含量的改良提供优质材料。A类、DDMP类、B类和E类皂苷含量均与总皂苷含量呈极显著正相关。不同百粒重和生态类型大豆材料子叶中总皂苷含量差异显著,胚中差异不显著。小粒型大豆材料子叶总皂苷含量显著高于中粒和大粒型材料,野生大豆子叶总皂苷含量显著高于半野生和栽培大豆,而胚总皂苷含量差异不显著。
[1]Kudou S, Tonomura M, Tsukamoto C, et al. Isolation and structural elucidation of the major genuine soybean saponin[J]. Bioscience Biotechnology and Biochemistry, 1992, 56: 142-143
[2]Shiraiwa M, Harada K, Okubo K. Composition and content of saponins in soybean seed according to variety, cultivation year and maturity[J]. Agricultural and Biological Chemistry, 1991, 55: 323-331
[3]Price K R, Fenwick G R, Jurzysta M. Soysapogenols separation, analysis and interconversions[J]. Journal of the Science of Food and Agriculture, 1986, 37: 1027-1034
[4]Yoshiki Y, Kudou S, Okubo K. Relationship between chemical structures and biological activities of triterpenoids saponins from soybean (review) [J]. Bioscience Biotechnology and Biochemistry, 1998, 62: 2291-2299
[5]Okubo K, Iijima M, Kobayashi Y, et al. Components responsible for the undesirable taste of soybean seeds[J]. Bioscience Biotechnology and Biochemistry, 1992, 56: 99-103
[6]Duffus C M, Duffus J H, D’Mello J P F. Toxic substances in crop plants[M]. England: Woodhead Publishing, 1991: 285-327
[7]Ellington A A, Berhow M, Singletary K W. Induction of macroautophagy in human colon cancer cells by soybean B-group triterpenoid saponins[J]. Carcinogenesis, 2005, 26: 159-167
[8]Ellington A A, Berhow M A, Singletary K W. Inhibition of Akt signaling and enhanced ERK1/2 activity are involved in induction of macroautophagy by triterpenoid B-group soyasaponins in colon cancer cells[J]. Carcinogenesis, 2006, 27: 298-306
[9]Ishii Y, Tanizawa H. Effects of soyasaponins on lipid peroxidation through the secretion of thyroid hormones[J]. Biological and Pharmaceutical Bulletin, 2006, 29: 1759-1763
[10]Zha L Y, Mao L M, Lu X C, et al. Anti-inflammatory effect of soyasaponins through suppressing nitric oxide production in LPS-stimulated RAW 264.7 cells by attenuation of NF-jB-mediated nitric oxide synthase expression[J]. Bioorganic and Medicinal Chemistry Letters, 2011, 21: 2415-2418
[11]Osbourn A. Saponins and plant defence-A soap story[J]. Trends in Plant Science, 1996(1): 4-9
[12]Papadopoulou K, Melton R E, Leggett M, et al. Compromised disease resistance in saponin deficient plants[J]. Proceedings of the National Academy of Sciences of United States of America, 1999, 96: 12923-12928
[13]Kuzina V, Ekstrøm C T, Andersen S B, et al. Identification of defense compounds in Barbarea vulgaris against the herbivore phyllotreta nemorum by an ecometabolomic approach[J]. Plant Physiology, 2009, 151: 1977-1990
[14]Hubert J, Berger M, Daydé J. Use of a simplified HPLC-UV analysis for soyasaponin B. determination: study of saponin and isoflavone variability in soybean cultivars and soy-based health food products[J]. Journal of Agricultural and Food Chemistry, 2005, 53: 3923-3930
[15]Tsukamoto C, Kikuchi A, Harada K, et al. Genetic and chemical polymorphisms of saponins in soybean seed[J]. Phytochemistry, 1993, 34: 1351-1356
[16]Kim E H, Ro H M, Kim S L, et al. Analysis of isoflavone, phenolic, soyasapogenol, and tocopherol compounds in soybean [Glycinemax(L.) Merrill]germplasms of different seed weights and origins[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 6045-6055
[17]Jang E K, Piao X M, Hwang T Y, et al. Variation of saponin content in Korean native soybean landraces reintroduced from USA to Korea[J]. Korean Journal of Crop Science, 2012, 57(3): 286-295
[18]黄玉艾, 严明霞, 赵大云. 高速逆流色谱结合制备型高效液相色谱法分离制备大豆皂苷单体[J]. 食品科学, 2013, 34: 27-32 Huang Y A, Yan M X, Zhao D Y. Large-scale isolation and preparation of soybean saponin by high-speed countercurrent chromatography combined with preparative HPLC [J]. Food Science, 2013, 34: 27-32
[19]Zhao D Y, Yan M X, Huang Y, et al. Efficient protocol for isolation and purification of different soyasaponins from soy hypocotyls[J]. Journal of Separation Science, 2012, 35: 3281-3292
[20]Qiao N, Liu Q, Meng H,et al. Haemolytic activity and adjuvant effect of soyasaponins and some of their derivatives on the immune responses to ovalbumin in mice[J]. International immunopharmacology, 2014, 18: 333-339
[21]Huang S S, Han Y P, Li C S, et al. Identification of QTLs associated with total soyasaponin content in soybean (Glycinemax(L.) Merr.) [J]. Journal of Integrative Agriculture, 2012(11): 1976-1984.
Analysis of Soyasaponin Compounds in Different Soybean Varieties
Yue Aiqin1Wang Weidong2Xu Haijun2Wang Min1Guo Chunrong2Zhao Jinzhong2Du Weijun1
(College of Agronomy, Shanxi Agricultural University1, Taigu 030801)(College of Arts and Science, Shanxi Agricultural University2, Taigu 030801)
To understand soyasaponins content distribution in hypocotyls and cotyledons of soybean seeds in Shanxi, and to isolate specific resources in breeding application, we analyzed soyasaponins content in 71 varieties from Shanxi using high-performance liquid chromatography(HPLC)-electrospray ionization(ESI)-mass spectrometer(MS)/ MS. Results indicated that, the total content of soyasaponins among the soybeans varied from 17.02 to 83.51 mg/g in hypocotyls, from 6.53 to 50.11 mg/g in cotyledons. Group A, DDMP, B and E had a high positive correlation with the total soyasaponins content. Among the different-sized soybean seeds, the average Group B and E content of the hypocotyls, the total soyasaponins and Group DDMP content of the cotyledons in small seeds were higher than that in medium or large seeds. The hypocotyls of wild and semi-wild soybeans had higher concentration of average Group B and E soyasaponins than cultivated soybean, and the cotyledons of wild soybeans had higher total soyasaponins and Group DDMP content than that of semi-wild and cultivated soybeans.
soybean, soyasaponin, HPLC-ESI-MS/MS, hundred-grain weight
时间:2017-01-24
山西省科技攻关项目(20120311005-3),山西省高等学校科技创新项目(2015148),山西省自然科学基金(201601D011076)
2016-03-13
岳爱琴,女,1975年出生,副教授,大豆品质育种
杜维俊,女,1968年出生,教授,野生大豆资源鉴定、分子评价和种质创新
S565.1
A
1003-0174(2017)05-0038-05
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20170124.1049.002.html

