木犀草素抗肿瘤作用研究进展
冯旭琴 胡兴胜 张磊
摘要:木犀草素是一种天然黄酮类化合物,存在于多种植物中,木犀草素具有抗炎、抗氧化、抗菌、保护神经,抗肿瘤等多种药理作用;可在多靶点、多途径、多环节抗肿瘤。其机制包括预防肿瘤形成,抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,抑制肿瘤转移,抑制肿瘤血管生成以及增敏抗癌药物活性等。本文将就木犀草素的抗肿瘤作用进展作如下综述。
关键词:木犀草素;肿瘤;预防;治疗;综述
中图分类号:R273 文献标志码:A 文章编号:1007-2349(2017)03-0079-04
1木犀草素的理化性质
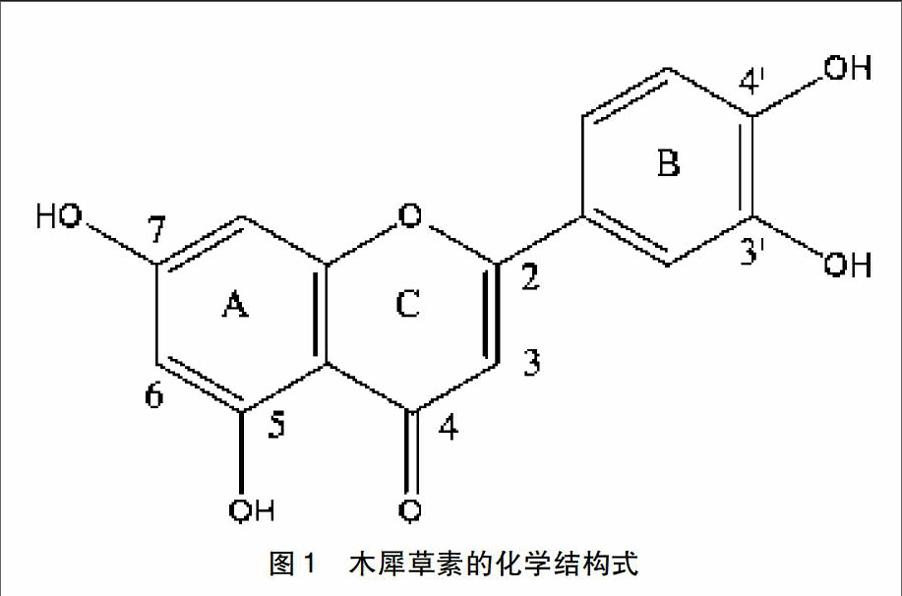
木犀草素的化学名为3,4,5,7-四羟基黄酮(图1),分子式为C15H10O6,具有C6-C3-C6结构,含有(A,B)两个苯环,含氧的C环,和C2-C3双键,具有弱酸性。酚羟基和C2-C3双键与木犀草素的生物化学性质及生物活性密切相关。木犀草素的酚羟基苷化后,水溶性增加,部分木犀草素在通过肠道黏膜时被转化为葡萄糖醛酸,它能够与铁、镁、钙、铜、铝等金属离子生成带色络合物。木犀草纯品为黄色结晶状粉末,微溶于水,溶于碱液,具有热稳定性,在植物中以糖苷及糖苷配基的形式存在。
2肿瘤预防作用
流行病学研究显示每天食用含低剂量(1mg/day)木犀草素的食物能降低一些肿瘤发生的风险。体内、外研究显示木犀草素通过使细胞免受致癌物的刺激、抑制促癌调控机制,对肿瘤的发生起化学预防作用。
2.1稳定DNA 体细胞突变理论认为肿瘤的形成是因为原癌基因、抑癌基因与稳定癌基因DNA突变。Taj等发现木犀草素具有预防长期喂食炸鱼及羊肉的老鼠骨髓细胞染色体畸变的作用。Choi等发现木犀草素使诱变剂黄曲霉素B1(AFB1)的致畸变率下降了70%。
2.2抗炎作用 肿瘤形成需要炎性因子刺激,并且在肿瘤形成过程中也会产生炎症,抗炎治疗是控制一些癌前病变发展为癌的有效手段。现已明确非甾体抗炎药可降低一些肿瘤的发生风险(如结肠癌及乳腺癌),也可降低这些肿瘤的死亡风险。木犀草素是最有效的抗炎性黄酮类化化合物之一,其干扰p38 MAPK、ERK1/2的磷酸化显著抑制TNF-α诱导的IL-8产生,也可抑制脂多糖诱导的TNF-α和IL-6释放,同时诱导一氧化氮表达。Ueda等比较紫苏叶子提取物及其提取物之一木犀草素对7,12-二甲基苯蒽(DMBA)与12-0一十四烷酰佛波醇-13-醋酸酯(TPA)诱导小鼠皮肤乳头状瘤的肿瘤预防作用,结果显示木犀草素的作用强于总提取物。因TPA可诱导一些炎性因子如:IL-1α,IL-1β,IL-6,IFN-g与TNF-α产生,故作者推测木犀草素通过抗炎作用抗肿瘤生成,但需要进一步验证。这些结果表明木犀草素的抗炎作用对预防肿瘤具有重要作用。
2.3抗氧化作用 活性氧(ROS)包括超氧化物、过氧化氢、羟基、单态氧与过氧化自由基。非细胞毒水平的超氧化物与过氧化氢就可诱导DAN突变,发挥致癌作用,导致细胞增殖、凋亡抵抗、血管生成与肿瘤的侵袭与转移。因此,上调ROS清除酶,如超氧化物岐化酶(sOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)等的水平可逆转肿瘤细胞的恶性转化。Samy等应用木犀草素與环磷酰胺联合处理DMBA诱导乳腺癌发生的雌性大鼠,发现联合用药较单用环磷酰胺的抗肿瘤效应增强,且毒副作用降低。在诱导乳腺癌组小鼠肝脏、肾脏、乳腺的SOD、CAT与GPx的水平及活性降低了50-80%,联合用药后这些酶又恢复平衡。同样,Manju等发现灌服木犀草素后的大鼠血浆及肝脏的抗氧化水平(GSH,PPx,GST,GR,SOD,CAT,Vitamin C,Vitamin A与β-carotene)增高,表明木犀草素可通过调节脂质过氧化反应抗氧化,从而预防DMH诱导的结肠癌发生。目前认为木犀草素的抗氧化作用是其肿瘤预防的关键机制。
2.4抗激素生成及激素受体 乳腺癌、前列腺癌等恶性肿瘤的发生、发展呈激素依赖性。木犀草素具有抗雌激素与雄激素的作用。Chiu等发现木犀草素明显抑制前列腺癌细胞LNCaP的增殖及诱导细胞凋亡。木犀草素抑制细胞内及自分泌的PSA水平,也可抑制ARmRNA及蛋白的表达,同时可抑制小鼠肿瘤细胞生长。木犀草素下调AR可抑制LNCaP肿瘤细胞增殖及诱导凋亡,因此木犀草素具有预防及抗前列腺癌的作用。因前列腺癌细胞的增殖需要胰岛素样生长因子1受体(IGF-1R)的激活,Fang等发现木犀草素在体内外通过抑制IGF-1R/AKT信号通路抑制前列腺癌细胞增殖,诱导肿瘤细胞凋亡。
3肿瘤治疗作用
3.1抑制侵袭与转移 侵袭与转移是肿瘤发展的关键环节,近90%的肿瘤相关性死亡发生于具有转移的患者。木犀草素可通过抑制一些与肿瘤侵袭、粘附相关的蛋白如MMPs、FAK抑制肿瘤的转移与侵袭。
肝癌生长因子HGF与络氨酸激酶受体结合促使肝癌细胞转移与侵袭。Lee等发现木犀草素具有抑制HGF诱导的HepG2细胞转移与侵袭的作用,木犀草素抑制HGF诱导的细胞分裂与细胞骨架(如丝状伪足与板状伪足)的改变,同时也可抑制c-Met、膜受体HGF及ERK1/2与AKT的磷酸化,但对HGF激活的JNK1/2无抑制作用。Cheng等发现木犀草素通过下调Cdc42表达及P13K/AKT的活性抑制多形性胶质瘤细胞U87-MG及198 g的迁移与侵袭。
3.2抑制拓扑异构酶的作用 NDA拓扑异构酶抑制剂有效地诱导肿瘤细胞凋亡。木犀草素能抑制及破坏拓扑异构酶I及II,使用特异性抗体检测完整细胞中拓扑异构酶与药物的结合,发现木犀草素能破坏白血病细胞拓扑异构酶II,抑制拓扑异构酶I的催化活性。木犀草素通过形成木犀草素-拓扑异构酶Ⅱ-DNA复合物,抑制细胞核拓扑异构酶II活性并剪切DNA,从而诱导细胞凋亡。Yamashita N等研究发现木犀草素通过稳定拓扑异构酶I-DNA剪切体复合物抑制大鼠肝脏的拓扑异构酶I的催化活性。木犀草素抑制拓扑异构酶I与II,从而抑制细胞复制及DNA修复,促进细胞凋亡性死亡。因拓扑异构酶I及II是多种常用于治疗肿瘤的药物的靶点(如依托泊苷,拓扑替康,伊立替康),故木犀草素对肿瘤具有潜在在治疗价值。
3.3抑制肿瘤细胞增殖诱导凋亡 木犀草素可通过线粒体凋亡通路、内质网应激及死亡受体凋亡通路等多种途径诱导多种肿瘤细胞发生凋亡。
线粒体通过释放凋亡因子:细胞色素C、ATF1、核酸内切酶G,调节caspase的表达促进凋亡。BCL-2家族(包括抗凋亡蛋白Bcl-2、Bcl-xl及凋亡诱导因子Bax、Bak)可调控这些因子的表达。经木犀草素处理后的白血病细胞HL-60线粒体膜电位降低,细胞色素c从线粒体释放进细胞质中增加,促进caspase-9、caspase-3、PARP及DFF-45的剪切体表达。肝癌细胞HepG2经木犀草素处理后,线粒体细胞色素C释放增加,Bax、Bak表达增加,JNK通路激活,促进肿瘤细胞凋亡。这表明木犀草素能通过线粒体凋亡通路及JNK信号通路促进肿瘤细胞死亡。木犀草素通过抑制DNA拓补异构酶诱导DNA破坏与激活P53,从而激活内源性凋亡通路。Horinaka M等发现木犀草素可能通过调控Bad及p53的活性持续激活JNK,促进细胞凋亡。JNK調控p53诱导促凋亡蛋白Bax表达。JNK的激活引起Bax/Bak比例增加,诱导内源性凋亡途径。Chang J等研究表明木犀草素处理后的肿瘤细胞通过与AKT竞争受体,使其磷酸化被抑制,促进凋亡蛋白caspase-3、PARP表达,促进细胞死亡,而相同浓度的木犀草素对正常上皮细胞无明显杀伤作用。经木犀草素处理的肝癌细胞株PLC/PRF/5,G0/G1期细胞增加,S1、G2/M期细胞减少,caspase-3活性增强,z-VAD-fmk预处理后caspase-3活性被抑制,Bax/Bcl-xl比例增加。Fang J等发现在前列腺癌中,木犀草素通过对IGF/1R/AKT通路的抑制,抑制其增殖促进凋亡。
P38信号通路的激活以p38的磷酸化为特征,p38磷酸化与p53磷酸化均可使cyclin D1降解,瞬时的p38、p53磷酸化导致的瞬时的cyclin D1降解表明木犀草素通过激活p38信号通路导致MCF-7/MitoR细胞细胞周期捕获。而NCI-ADR/RES细胞株具有高水平的持续磷酸化的p38与p53,cyc-lin D1在这种细胞株降解很慢,这表明p38通路在这种细胞株中是处于持续激活状态,或许有利于细胞增殖,木犀草素通过促进cyclin D1降解抵抗这种促增殖作用。
NF-KB信号通路在肿瘤细胞中常处于持续激活状态,NCI-ADR/RES与MCF-7/MitoR细胞中磷酸化p65的表达增加,经木犀草素处理后p65降解增加,表明木犀草素能抑制NF-KB信号通路。ROS的产生有利于MMP降解,使线粒体诱导的凋亡途径的激活。这表明木犀草素诱导的DNA破坏是一个独立发生的过程或许与ROS的产生无直接关系。这种DNA损伤反应通过磷酸化ATR或/和Chk2激活MCF-7/Mi-toR中的p53,导致G1/S关卡激活介导p21抑制cdc2。以上涉及的包括NF-KB的激活,抗凋亡蛋白的降解,DNA破坏共同促进细胞周期捕获及凋亡。
木犀草素诱导凋亡机制包括:诱导活性氧的产生,促进DNA破坏,激活ATR-Chk2-p53信号通路,抑制NF-KB信号通路,激活P38通路,调控Bcl-2家族的平衡。尽管木犀草素诱导凋亡的机制多种多样,但总的来说是通过促进凋亡抑制生存信号通路以扰乱肿瘤细胞的生存与死亡平衡。
3.4抑制血管生成 血管生成促进实体瘤的形成,肿瘤细胞分泌的各种细胞因子能刺激血管生成。Sagli等发现木犀草素通过抑制P13K途径抑制异种移植的裸鼠模型的肿瘤生长及血管生成,下调血管内皮因子VEGF在体内诱导的血管生成。
3.5增敏抗癌药物的抗肿瘤效应 目前抗肿瘤治疗是以放疗、化疗、靶向治疗等为主的综合治疗,研究显示木犀草素具有增敏抗癌药物的作用。
Smac通过激活自分泌的TNF-α诱导外源性凋亡通路。在内源性凋亡通路中Smac从线粒体释放到基质,抑制抗凋亡蛋白(1AP)表达,促进肿瘤细胞凋亡,但同时可激活NFK-B。NF-KB可促使抗凋亡蛋白Bcl-XL与MnSOD的表达,保护肿瘤细胞免于凋亡。木犀草素与SMC3(Smac类似物)在肺癌或肝癌细胞中联合应用,可有效地抑制NF-KB信号通路,明显敏化依赖于TNF-α的凋亡通路,具有协同杀伤肿瘤细胞作用,且ROS可能参与调控木犀草素的增敏作用。
木犀草素能增敏TRAIL诱导的凋亡,其机制包括增强XI-AP泛素化,促进蛋白酶体降解。HER2过表达可诱导肿瘤细胞多药耐药,木犀草素可通过抑制HER2表达,促进其降解,敏化肿瘤细胞对药物的反应。这些结果表明木犀草素具有增加抗癌药物对肿瘤细胞毒性及逆转多药耐药的作用。
4其他
木犀草素诱导拓扑异构酶Ⅱ表达促进DNA损伤发挥对正常细胞的毒性作用。尽管上述机制具有抗肿瘤细胞作用,但非毒性水平的DNA破坏长期积累具有细胞毒性。临床研究显示拓扑异构酶毒性的化疗药物可加白血病风险。故有必要进行体内实验评估长应用木犀草素药物的积累毒性。
5结语
木犀草素及其糖苷作为一种食用黄酮广泛存在于植物界,可用于预防及治疗疾病。木犀草素几乎能干扰癌变的所有方面,它能通过诱导细胞凋亡,抑制肿瘤细胞增殖,抑制肿瘤血管生成,提高放化疗疗效等途径来治疗肿瘤。同时木犀草素可选择性杀伤癌变细胞,是一种很有前途的抗癌治疗剂,但其积累毒性应引起对安全性的考虑。
随着对木犀草素研究的深入,虽然其抗肿瘤作用明确,但作用机理研究还不透彻。因此,有必要进一步探索木犀草素的抗肿瘤作用及与放、化疗等治疗方式联合应用的疗效、机制,为临床应用提供理论依据。
(收稿日期:2016-11-01)