虫草素对高糖介导大鼠肾小管上皮细胞p38MAPK通路及TGF—β1表达的影响
梁泽智++黄洁平

[摘要]目的 探讨虫草素(Cordycepin)对高糖介导大鼠肾小管上皮细胞p38MAPK通路及TGF-β1表达的影响。方法 体外培养大鼠近端肾小管上皮细胞株(NRK52E细胞株),分为正常对照组(NG组)、高糖组(HG组)、高糖+虫草素组(HG+C组)。应用定量RT-PCR测定NRK52E p38MAPK及TGF-β1 mRNA的表达;采用Western印迹方法检测不同时间点p-p38MAPK、TGF-β1蛋白的表达水平。结果 与NG组比较,HG组NRK52E细胞的p38MAPK、TGF-β1 mRNA表达增多(P<0.01);p-p38MAPK蛋白、TGF-β1蛋白表达与mRNA表达趋势一致(P<0.05);而虫草素可以显著抑制高糖介导的NRK52E细胞p38MAPK的活化及TGF-β1的表达。结论 虫草素可以抑制高糖介导大鼠肾小管上皮细胞p38MAPK活化及TGF-β1表达。
[关键词]p38MAPK;虫草素;TGF-β1;葡萄糖
[中图分类号] R285.5 [文献标识码] A [文章编号] 1674-4721(2017)06(b)-0004-04
[Abstract]Objective To investigate effect of cordycepin on p38MAPK pathway and TGF-β1 express in NRK52E cells stimulated by high glucose.Methods NRK52E cells were cultured in the mediun with normal glucose concentration (group NG),high glucose concentration (group HG) and high glucose concentration+cordycepin (group HG+C).The expression of p38MAPK and TGF-β1 mRNA was measured by quantitative RT-PCR;the expression level of p-p38MAPK and TGF-β1 protein was detected by Western blot.Results The p38MAPK and TGF-β1 mRNA in NRK52E cells were highly expressed in group HG compared with group NG (P<0.01);the tendency of p-p38MAPK and TGF-β1 protein expressed was accordance with expression of mRNA.However,cordycepin can significantly inhibit the activation of p38MAPK pathway and TGF-β1 express in NRK52E cells stimulated by high glucose.Conclusion Cordycepin can significantly inhibit the activation of p38MAPK pathway and TGF-β1 express in NRK52E cells stimulated by high glucose.
[Key words]P38MAPK;Cordycepin;TGF-β1;Glucose
糖尿病腎病(diabetc nephropathy,DN)是导致终末期肾病(end-stage renal disease,ESRD)最常见的原因之一[1],小管间质纤维化是其重要的临床表现[2]。多种因素参与了糖尿病肾病的发生及发展[3],包括高糖、细胞通路的激活[4]等。p38丝裂原活化蛋白激酶(p38MAPK)是MAPK家族的一个亚族,可被高糖等因素激活,激活后可通过上调TGF-β/Smad等多条信号转导途径[5]最终导致了肾小球的纤维化[6]。TGF-β1是公认的致纤维化因子,在肾纤维化过程中发挥重要作用。研究发现,TGF-β1和p38MAPK存在相互串话[7],共同导致了肾脏的纤维化。虫草素是中国名贵草药冬虫夏草的主要成分之一,在肾脏中具有重要保护作用,但是机制尚未明确,本实验通过体外培养NRK52E细胞,观察虫草素对高糖介导的NRK52E细胞p38MAPK通路及TGF-β1表达的影响,探讨虫草素对肾脏保护作用的机制。
1材料与方法
1.1材料
1.1.1试剂 NRK52E细胞(肾小管上皮细胞,中山大学余学清教授惠赠),虫草素(Sigma公司,货号:C3394-10MG),葡萄糖(Sigma公司,货号:G7021-100G),TRizol试剂(Invitrogen公司,货号:15596026),逆转录试剂盒(SuperScriptRⅢ First-Strand Synthesis System for RT-PCR kits,Invitrogen公司),PCR扩增试剂盒(SYBRRSelect Master Mix,Invitrogen公司),胎牛血清(美国Gibco BRL,货号:16000-044),兔抗大鼠p-p38MAPK多克隆抗体(英国New England Biolabs),小鼠抗大鼠TGF-β1单克隆抗体(美国Abcam)等。
1.1.2仪器设备 恒温CO2细胞培养箱:美国Thermo公司;倒置荧光显微镜:美国AXJOVERT公司;PCR扩增仪PCT-200:美国Thermo公司;荧光定量PCR仪:Applied Biosystems;超微量分光光度计 NANODROP-2000:美国Thermo公司;显微镜及成像系统:OLYMPUS BX51;凝胶成像系统:法国BIO-UISON100;超声波细胞粉碎仪:SCIENTZ公司;定量酶标仪:美国MRX2;电泳仪:美国Bio-RAD公司。
1.2方法
1.2.1细胞培养及分组 用低糖DEME完全培养基(含10%胎牛血清)培养细胞,待细胞贴壁60%~80%,改用无血清培养基进行同步培养,将细胞按照设计进行分组并加入不同浓度葡萄糖:正常对照组(5.5 mmol/L)、高糖组(30 mmol/L)、高糖+虫草素组(30 mmol/L,虫草素浓度10 μg/ml),高糖+虫草素组使用虫草素进行预先干预2 h。
1.2.2 qRT-PCR 待细胞培养足够时间,收集细胞,提取细胞的总RNA。然后对RNA进行OD值及浓度测定。取1 μg的总RNA按照试剂盒说明书的方法进行合成cDNA,然后再对逆转录产物进行扩增。采用primer 5.0软件设计目的基因引物序列,由北京华大基因公司合成,所得引物用DEPC水稀释后放于-20℃备用,各基因引物序列见表1。反应体系:SYBR 10 μl;Forward 0.16 μl;Reverse 0.16 μl;ddH2O 4.68 μl;cDNA 5 μl;反应条件及步骤:①预变性:采取95℃进行2 min;②变性:95℃的温度进行15 s;③退火:58℃进行30 s;④延伸:72℃延伸30 s;⑤循环:总共经过40个循环,再充分延伸10 min。将所合成的指标(p38MAPK、TGF-β1)与内参(GAPDH)的Ct值采取取对数的方式进行比较,其比值表示待测指标的mRNA的相对表达量。
1.2.3 Western blot 按设计分组培养细胞并加入不同的刺激,15 min、30 min、60 min、12 h、24 h、48 h后,收集细胞,提取细胞总蛋白,进行超声破碎,接着采用BCA定量法对蛋白进行测定其浓度。采用8% SDS-PAGE分离胶上样,电泳时先采用80 V,待样品蛋白到达分离胶后,改成120 V,继之在340 mA下转膜2.5~3 h,使用5%脱脂牛奶封闭2 h,一抗采用浓度为:(p-p38MAPK,1∶3000;TGF-β1,1∶2000)过夜,使用脱脂牛奶洗涤加二抗(1∶5000~1∶10 000),暗室曝光、显影,最后进行灰度分析。
1.3统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2结果
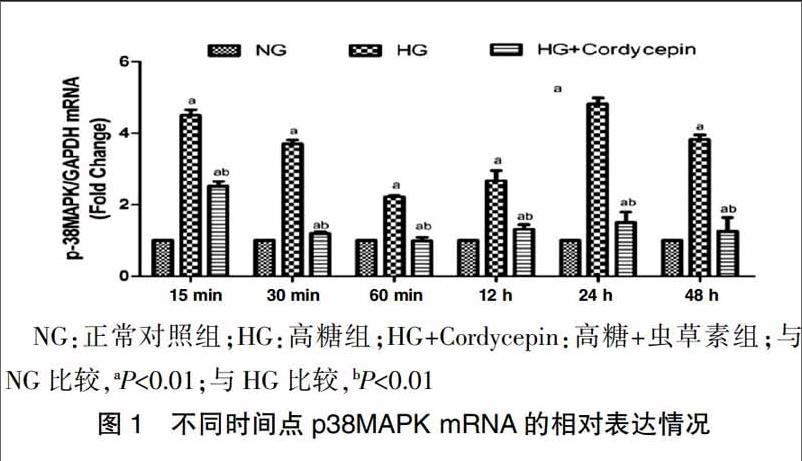
2.1不同时间点NRK52E细胞的p38MAPK mRNA表达情况
高糖刺激后,不同时间点的p38MAPK mRNA的表达明显升高,并且在15 min、24 h两个时间段出现高峰;高糖+虫草素组的p38MAPK mRNA表达较高糖组明显降低,较正常对照组升高(P<0.01)(图1)。
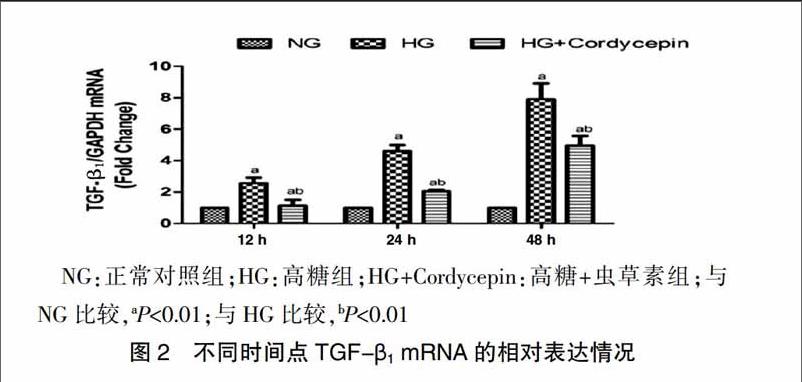
2.2不同时间点NRK52E細胞的TGF-β1 mRNA表达情况
在高糖的刺激下,不同时间点的TGF-β1 mRNA的表达明显升高,并且在呈时间依赖性增加;高糖+虫草素组的TGF-β1 mRNA较高糖组明显降低,较正常对照组升高(P<0.01)(图2)。
2.3不同时间点p38MAPK蛋白的表达情况
在高糖的刺激下,不同时间点的p-p38MAPK蛋白的表达明显升高,并且在15 min、24 h两个时间段出现高峰;高糖+虫草素组的p-p38MAPK蛋白表达较高糖组明显降低,较正常对照组升高(P<0.01)(图3)。
2.4不同时间点NRK52E细胞的TGF-β1蛋白表达情况
在高糖的刺激下,不同时间点的TGF-β1蛋白的表达呈时间依赖性地升高;高糖+虫草素组的TGF-β1蛋白表达较高糖组明显降低,较正常对照组明显升高(P<0.01)(图4)。
3讨论
糖尿病肾病是以肾小球系膜细胞增殖、肥大以及细胞外基质过度积聚,最终导致肾脏纤维化。多种因素及细胞通路参与糖尿病肾病肾脏纤维化的发生及发展,包括TGF-β/Smad通路、p38MAPK通路[8]等。
TGF-β是公认的导致肾脏细胞外基质(ECM)沉积和纤维化的最重要的因子,在糖尿病肾病患者的发展中起着核心作用[9]。Zeisberg等[10]研究发现,TGF-β1刺激后,人近端肾小管上皮细胞失去上皮细胞表型E-cadherin,获得了肌成纤维细胞的表型α-SMA,并导致了细胞外基质成分产生增加。有研究表明,在糖尿病肾病中,TGF-β可以通过激活TGF-β依赖的Smad信号通路,也可以激活非TGF-β依赖的信号通路,如p38MAPK,最终促进ECM的合成、EMT的发生[11-12],最终引发肾间质纤维化。
p38MAPK是各种细胞外信号刺激细胞内信号传递的共同通路,它可以被多种因素激活。Lv等[13]发现,高糖能够导致肾小管上皮细胞p38MAPK通路的激活,参与了EMT的发生;在糖尿病肾病中,p38MAPK 的活化可以直接调节α-SMA蛋白的合成[14],同时间接的活化Smad通路,参与了TGF-β1诱导的肾小管上皮细胞EMT的发生[15]。Tzeng等[16]用乙醇提取的金银花可以抑制p38 MAPK的活化延缓了STZ诱导的糖尿病肾病的发生及发展。
冬虫夏草是我国传统的名贵中草药,具有“益肺肾﹑补精髓”之功效。虫草素是从其分离出来的单体,是一种核苷类似物。周巧玲等[17-18]的研究发现,冬虫夏草可下调糖尿病肾病肾组织TGF-β1、CTGF及Ⅳ型胶原的表达,减轻糖尿病肾病肾纤维化。除此外虫草素还可以抑制嘌呤合成,诱导凋亡,引起细胞周期阻滞、减少炎症介质释放等药理作用[19-20]。
本实验研究显示,高糖介导下,不同时间点的p38MAPK、TGF-β1 mRNA及蛋白表达均明显增高,虫草素干预后,高糖介导下的p38MAPK、TGF-β1 mRNA及其蛋白高表达均明显下调,提示虫草素可以抑制高糖介导大鼠肾小管上皮细胞p38MAPK通路活化及TGF-β1表达。因此,本研究推测,虫草素可能通过抑制p38MAPK通路活化从而下调TGF-β/Smad信号转导,减轻糖尿病肾病肾脏纤维化。本研究组下一步将检测虫草素对p38MAPK、TGF-β/Smad通路活化后下游相关蛋白的表达的影响,明确虫草素对糖尿病肾病防治机制,为糖尿病肾病的治疗提供新的认识和理论依据。
[參考文献]
[1]Nazir N,Siddiqui K,Al-Qasim S,et al.Meta-analysis of diabetic nephropathy associated genetic variants in inflammation and angiogenesis involved in different biochemical pathways[J].BMC Med Genet,2014,15(1):103.
[2]Sasai Y,Iwakawa K,Yanagida K,et al.Advanced glycation endproducts stimulate renal epithelial cells to release chem-okines that recruit macrophages,leading to renal fibrosis[J].Biosci Biotechnol Biochem,2012,76(9):1741-1745.
[3]Goldberg R,Rubinstein AM,Gil N,et al.Role of heparanase-driven inflammatory cascade in pathogenesis of diabetic nephropathy[J].Diabetes,2014,63(12):4302-4313.
[4]Marketou NP,Chrousos GP,Kanaka-Gantenbein C.Diabetic nephropathy in type 1 diabetes:a review of early natural history,pathogenesis and diagnosis[J].Diabetes Metab Res Rev,2016.
[5]Rane MJ,Song Y,Jin S,et al.Interplay between Akt and p38 MAPK pathways in the regulation of renal tubular cell apoptosis associated with diabetic nephropathy[J].Am J Physiol Renal Physiol,2010,298(1):F49-F61.
[6]Li X,Liu W,Wang Q,et al.Emodin suppresses cell proliferation and fibronectin expression via p38MAPK pathway in rat mesangial cells cultured under high glucose[J].Mol Cell Endocrinol,2009,307(1):157-162.
[7]Xu Q,Tan Y,Zhang K,et al.Crosstalk between p38 and Smad3 through TGF-β1 in JEG-3 choriocarcinoma cells[J].Int J Oncol,2013,43(4):1187-1193.
[8]Kanasaki K,Taduri G,Koya D.Diabetic nephropathy:the role of inflammation in fibroblast activation and kidney fibrosis[J].Front Endocrinol,2013,4(1):7.
[9]Chung ACK,Lan HY.Molecular mechanisms of TGF-β signaling in renal fibrosis[J].Curr Pathobiol Rep,2013,1(4):291-299.
[10]Zeisberg M,Hanai J,Sugimoto H,et al.BMP-7 counteracts TGF-β1–induced epithelial-to-mesenchymal transition and reverses chronic renal injury[J].Nat Med,2003,9(7):964-968.
[11]Lan HY.Diverse roles of TGF-beta/Smads in renal fibrosis and inflammation[J].Int J Biol Sci,2011,7(7):1056-1067.
[12]Meng XM,Chung ACK,Lan HY.Role of the TGF-β/BMP-7/Smad pathways in renal diseases[J].Clin Sci (Lond),2013, 124(4):243-254.
[13]Lv ZM,Wang Q,Wan Q,et al.The role of the p38 MAPK signaling pathway in high glucose-induced epithelial-mesenchymal transition of cultured human renal tubular epithelial cells[J].PLoS One,2011,6(7):e22806.
[14]Lan HY.Transforming growth factor-β/Smad signalling in diabetic nephropathy[J].Clin Exp Pharmacol Physiol,2012, 39(8):731-738.
[15]Rhyu DY,Yang Y,Ha H,et al.Role of reactive oxygen species in TGF-β1-induced mitogen-activated protein kinase activation and epithelial-mesenchymal transition in renal tubular epithelial cells[J].J Am Soc Nephrol,2005,16(3):667-675.
[16]Tzeng TF,Liou SS,Chang CJ,et al.The ethanol extract of Lonicera japonica (Japanese honeysuckle) attenuates diabetic nephropathy by inhibiting p-38 MAPK activity in streptozotocin-induced diabetic rats[J].Planta Med,2014,80(2/3):121-129.
[17]周巧玲,劉抗寒,王衍慧,等.冬虫夏草对糖尿病肾病模型鼠肾组织转化生长因子B1,结缔组织生长因子表达的影响[J].肾脏病与透析肾移植杂志,2006,15(5):443-446.
[18]叶太生,周必发,张莹雯.百令胶囊对大鼠肾小球系膜细胞增殖,Ⅳ型胶原及TGF-β1 mRNA表达的影响[J].中国中西医结合肾病杂志,2010,11(1):41-43.
[19]Baik JS,Kwon HY,Kim KS.Cordycepin induces apoptosis in human neuroblastoma SK-N-BE (2)-C and melanoma SK-MEL-2 cells[J].Indian J Biochem Biophys,2012,49(2):86-91.
[20]Cui J,Culbertson R,Mao Z,et al.A novel therapeutic treatment utilizing cordycepin and cladribine synergy to decrease adverse treatment effects in various cancer cell lines[J].JESS,2013,2:20-24.
(收稿日期:2017-04-25 本文编辑:任 念)

