IL-4, IL-6和TNF-α对脐带血来源的间充质干细胞成骨分化的作用
刘佳 罗映红 龙昱 刘小云
1. 长沙医学院基础医学院,湖南 长沙 410219 2. 长沙医学院附属第一医院,湖南 长沙 410219
外伤、肿瘤切除术后的较大骨缺损如果依赖自然修复,进程缓慢,效果不良。Vacanti等[1]率先提出以组织工程技术构建骨来进行补缺,开辟了生物材料修补的新途径。组织工程可使用的种子细胞有多种,脐血来源的间充质干细胞是其中上佳选择。从取材的角度,相对于骨髓来源,人脐血获取容易得多,避免了穿刺取骨髓的痛苦,不会给产妇和胎儿造成伤害,且避免了伦理问题;另外,人脐血细胞更接近胚胎干细胞,其免疫原性不强,降低了排异风险,提高了效果[2]。但是促使脐带血来源的间充质干细胞成骨分化的因素尚未完全明确。有研究表明,干细胞所处的微环境对细胞分化起着正向或者负向调节作用,骨损伤过程的局部为炎性微环境,炎性细胞因子是否对干细胞成骨分化存在促进或抑制作用,因此本实验选择细胞因子IL-4、IL-6和TNF-α,研究其对间充质干细胞成骨分化的影响。
1 材料和方法
1.1 材料
选自37~40周自然分娩的产妇捐献者,新生儿分娩离开母体后正常断离脐带,消毒脐带断端,脐静脉穿刺,抽吸出脐带及胎盘内的血液,采集脐血量约为15~50 mL,在无菌玻璃瓶中与肝素(40 U/mL)混匀抗凝;采集后12 h内分离脐血干细胞。捐献者为长沙医学院第一附属医院产妇,采集脐血均征得产妇及其家属同意和医学伦理委员会批准(批准文号:20160023),并经检测排除传染性疾病及遗传疾病。
1.2 实验用主要试剂
DMEM培养基(美国Gibco公司);胎牛血清(杭州四季青公司);人重组IL-4, IL-6和TNF-α(美国R&D Systems公司);地塞米松、β-甘油磷酸钠、维生素C、FITC标记鼠抗人抗体、胰蛋白酶、Percoll分离液(美国Sigma公司);ALP检测试剂盒(南京建成公司);其他试剂为分析纯。
1.3 脐带血采集,分离、干细胞鉴定
获取干细胞主要参考邵帅研究组的实验方法进行[3]:取15~25 mL抗凝脐血,加入等体积PBS振摇混匀,每次取液体10 mL,置于20 mL预配好Percoll分离液上层,以2 000 r/min离心20 min;吸取中间白色细胞层,PBS冲洗后离心去上清,吸取离心管底细胞,加入含10%胎牛血清的DMEM培养液缓慢吹打均匀,计数后调整细胞浓度接种于细胞培养瓶中,置于37 ℃、5%CO2培养箱中培养。分别在培养3 d、6d后换培养液,去掉未贴壁细胞。当细胞生长融合约90%时,加入0.25%胰蛋白酶溶液室温下消化2 min,按照1∶2比例传代培养,显微镜下观察细胞生长状态。
细胞表面标志物的检测:取对数生长期的第3代脐血培养细胞,胰蛋白酶消化细胞,离心后弃上清,加PBS调整细胞浓度1×109/L,并将其分装为每管0.2 mL,分别加入FITC标记鼠抗人CD29、CD34、CD44 0.01 mL混匀,对照组加入FITC 0.01 mL,在4 ℃避光孵育30 min,离心去上清后PBS清洗2遍,以0.5 mL的PBS重悬细胞,用流式细胞仪检测细胞表面标记。
1.4 成骨分化培养
1.4.1基础成骨诱导组:取生长旺盛的第3代脐血间充质干细胞,以胰蛋白酶消化后计数,以105/孔的细胞数接种于细胞培养6孔板中进行成骨分化诱导。加入基础成骨诱导剂(含10%胎牛血清的DMEM+0.01 μmol/L地塞米松+10 mmol/Lβ-甘油磷酸钠+0.1 mmol/L抗坏血酸)进行培养。空白对照组为不加成骨诱导剂的细胞,以完全培养液(含10%胎牛血清的DMEM)常规培养。基础成骨诱导组和空白对照组均设3平行孔,每3 d换培养液1次,倒置显微镜下观察间充质干细胞的生长情况。
1.4.2细胞因子诱导组:间充质干细胞加入基础成骨诱导剂进行培养,培养后融合达80%时,用胰蛋白酶消化后以5×105/mL细胞密度接种于24孔板中,贴壁后换液时,分别加入细胞因子IL-4, IL-6和TNF-α至终浓度为10 ng/mL,之后每次更换培养液时维持相应细胞因子的浓度。另设不加细胞因子的细胞为阴性对照组。每组设6平行孔。
1.5 检测成骨分化的程度
细胞碱性磷酸酶(alkaline phosphatase,ALP)活性检测:将细胞在诱导3 d和9d时弃去培养液,PBS洗涤3次后每孔加入0.2%TritonX-100 400 μL破裂细胞,1 h后收集液体,离心取上清10 μL,置于96孔板,按照ALP测定试剂盒说明进行操作,用酶标仪测定520 nm吸光度值(OD值),以公式:ALP活力(金氏单位/100 mL)=(OD测定-OD空白)÷(OD标准-OD空白)×0.1 mg/mL×100 mL(1个金氏单位为100 mL样品在37 ℃与基质作用15 min产生1 mg酚),计算ALP活力并比较。
钙结节染色:在6孔板中以细胞因子诱导18 d后吸弃培养基,PBS清洗2次,95%乙醇固定细胞后PBS洗涤2次,加0.5%茜素红染色剂孵育30 min,弃去茜素红,PBS清洗2遍,室温下干燥,高倍镜下随机选取10个视野观察钙结节形态,并统计钙结节数。
1.6 统计学处理

2 结果
2.1 脐带血干细胞形态观察和表面标志物测定
Percoll分离液分离脐血,得到的中间白色层细胞在接种后48~72 h内贴壁,开始细胞生长缓慢,形态不均一,呈现梭形和小圆形等多种形态;经过2~3次换培养液,基本去除了不贴壁的细胞;2周后生长较快,形成较均一的长多边形细胞,当融合达到80%左右时可见细胞呈漩涡状,细胞面积随着时间延长逐渐延展(图1)。采用流式细胞仪测定细胞表面抗原分子,CD29(99.5%)和CD44(98.7%)均高表达; CD34(1.1%)基本不表达(图2);提示细胞为较纯的间充质干细胞。
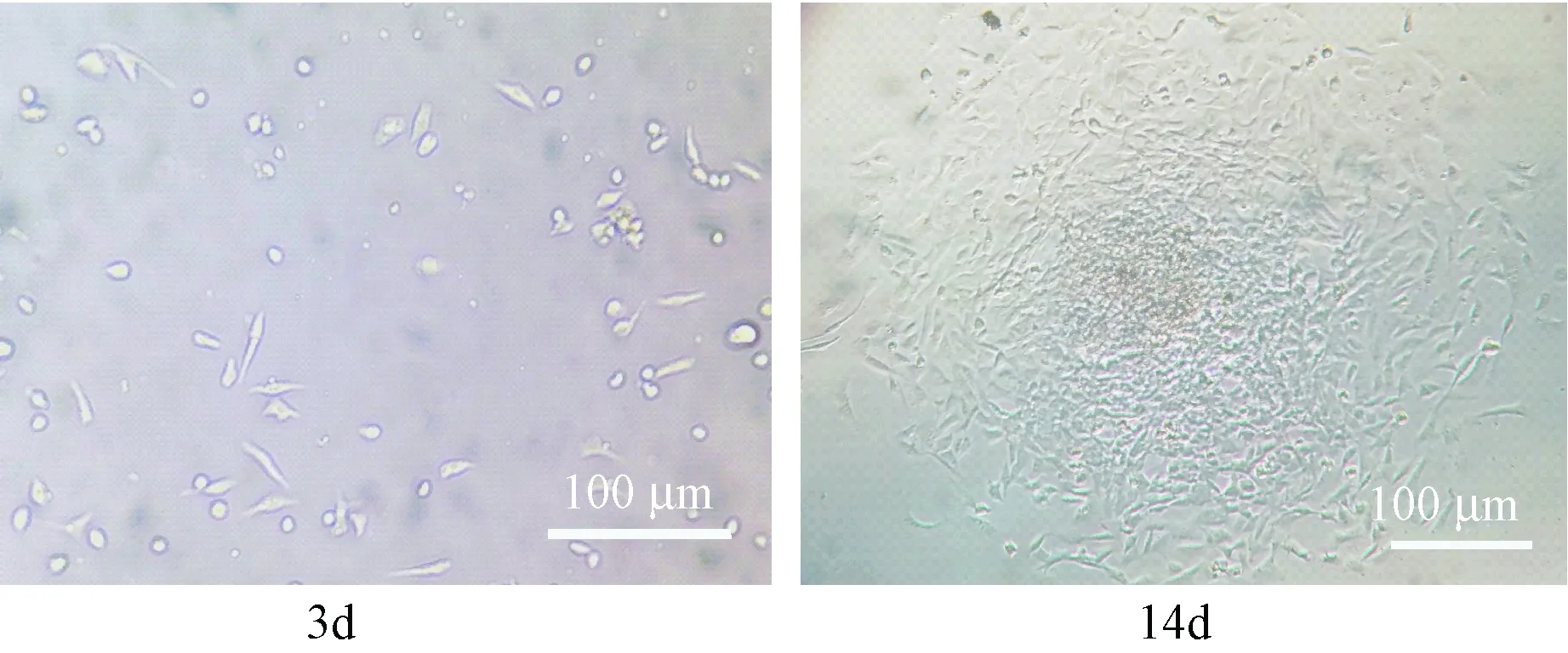
图1 脐带血干细胞原代培养(×400)Fig.1 Primary culture of human umbilical cord blood mesenchymal stem cells (×400)

图2 干细胞表面标志表达量测定Fig.2 Expression levels of stem cell surface markers
2.2 基础成骨诱导分化
基础成骨诱导组和空白对照组在倒置显微镜下观察,细胞形态相似,生长速度也未见明显区别。
2.3 细胞因子作用后ALP活性测定结果
诱导3 d时,IL-6、TNF-α组的ALP活力高于阴性对照组(P<0.05);诱导9 d时,IL-4、IL-6实验组ALP活性均显著高于阴性对照组(P<0.01)。结果显示,随着诱导培养时间的延长,实验组和对照组均呈现逐渐升高的趋势;对照组ALP活性增长不快(1.71倍),细胞因子IL-4、IL-6刺激后各实验组细胞内ALP活力显著增强,诱导9 d时,其中IL-6组的ALP活力为诱导3 d时的活力的9.51倍;TNF-α组ALP活力在短时间(3 d)内有增加,但是TNF-α作用时间达到9 d时,ALP活力反倒未提升了,提示TNF-α对成骨分化的促进作用有效期短。见表1。
2.4 茜素红染色结果
实验组细胞经细胞因子诱导成骨18 d后,以茜素红染色,可见被染成红色的钙结节,结节形态无规则、大小不一;其中IL-6组钙结节数目最多,高倍镜视野下可见(11.2±1.75)个结节;TNF-α组钙结节为(4.5±1.90)个,且钙质含量不高、结节染色较浅;IL-4组高倍镜视野结节数目(6.4±1.78)个,但普遍面积较小;阴性对照组偶见钙结节,结节数为(0.6±0.84),且面积小(图3)。各细胞因子实验组钙结节数都比阴性对照显著(n=10,P<0.01)。



分组作用时间ALP活力(king’sU)作用时间ALP活力(king’sU)阴性对照组3d265 5±33 59d453 2±20 4 IL-4组301 8±18 9911 6±24 1∗∗ IL⁃6组496 0±68 8∗4714 7±31 6∗∗ TNF⁃α组387 2±21 2∗527 2±40 5
注:与阴性对照组比较,*P<0.05,**P<0.01

图3 细胞因子成骨诱导后茜素红染色(×400)Fig.3 Alizarin red staining of MSCs induced by IL-4, IL-6, or TNF-α (×400)
3 讨论
脐带等结构在女性生产后,常作为医疗废弃物处置,这极为可惜,因为脐血有很多具有多向分化能力的干细胞,除了造血干细胞,间充质干细胞也可在体内外分化为成骨细胞、软骨细胞和脂肪细胞。脐血间充质干细胞的分离和培养方法,本课题组采用的是国内同行研究人员类似的方式,实验不需要高精仪器来完成,方法较为简易,培养中可逐步去掉非贴壁细胞的血细胞和造血干细胞。鉴定间充质干细胞则需要检测其特异性的表面标志物,例如CD29、CD44、CD90或CD105等间充质干细胞标志物是否表达,同时满足造血干细胞特异性标志物CD34不表达。本组实验中培养的第3代细胞,以流式细胞仪进行表面标志物测定,确定细胞以间充质干细胞为主,血细胞极少;细胞分离量虽有限,但足以用于实验研究。
许多胞外成分可引导间充质干细胞向成骨细胞分化,如骨形成蛋白2[4]、成纤维细胞生长因子、转化生长因子β、胰岛素样生长因子[5]、力生长因子[6]等,但较常用的方法为地塞米松、β-甘油磷酸钠、抗坏血酸共同促间充质干细胞成骨分化。其中地塞米松可以促进间充质干细胞碱性磷酸酶活性增强,早期促基质合成,后期促钙化;β-甘油磷酸钠迅速水解生成磷酸根离子,可作为碱性磷酸酶的底物,促进钙盐沉积;抗坏血酸可以促进细胞合成胶原,形成钙化。本实验除了采用经典的基础成骨诱导剂(抗坏血酸+β-甘油磷酸钠+地塞米松),还加入了新的成分——炎性细胞因子如TNF-α、IL-4、IL-6等,为了探索更有效的的成骨分化诱导因素。
在骨损伤修复的初始阶段,炎性相关细胞因子被释放在损伤部位,短时间内对周围的各类细胞都有着促进增殖、加速修复的作用,有研究表明,IL-10等细胞因子可抑制破骨细胞活性、加速成骨[7],但是也有研究者提出IL-6促进破骨细胞增殖和活性[8]。成骨细胞和破骨细胞都是已经分化的细胞,而各类细胞因子是否影响原始的多能间充质干细胞分化成为成骨细胞、对骨修复进行支持,这是有争议的。本实验显示,细胞因子TNF-α,IL-6和IL-4在人类脐血来源间充质干细胞的成骨分化中的促进作用。浓度10ng/mL的TNF-α作用3 d,IL-6,IL-4在作用9 d后显著增加了ALP活力,三种细胞因子诱导18 d后则显著增加钙结节的形成,在基础成骨诱导剂的作用上更进一步促进成骨。其中尤其是IL-6,显著的增强了ALP活力,在骨结节的形成上也能看出其作用显著。总之,所选细胞因子短时间(18 d)内都有提高成骨分化的作用,但是TNF-α只在极短时间内(3 d)起作用,估计主要是一过性促进成骨的作用;本实验结果与陈林等[9]的TNF-α对成骨分化的影响受作用时间、作用浓度的影响,较为相同。比较三种细胞因子,IL-6起效快、有效时间较长、效果显著,可能是合适的间充质干细胞成骨分化诱导因子,这也与Angela等[10]结果较为一致。

