亚低温下不同外源氮对山定子根系氮代谢活性的影响
李玲++陆晓晨++马怀宇++吕德国

摘要:试验以山定子(Malus baccata Borkh.)实生苗为试验材料,研究根域亚低温下不同外源氮(NO3-和NH4+)对山定子根系活力、根系氮代谢关键酶活性以及根系抗氧化酶活性的影响。结果表明,亚低温条件下,添加外源氮可在一定时间内提高山定子的根系活力;提高了山定子根系硝酸还原酶(NR)和谷氨酸合酶(GOGAT)活性,但降低了谷氨酰胺合成酶(GS)活性,谷氨酸脱氢酶(GDH)活性整体呈上升趋势。不同氮源对山定子根系氮代谢酶活性影响不同,NH4+处理的山定子根系GS活性和GDH活性高于NO3-处理。亚低温条件下,添加外源氮提高了根系过氧化物酶(POD)和过氧化氢酶(CAT)活性,但降低了超氧化物歧化酶(SOD)活性。因此,施加外源氮可缓解根域亚低温对植株生长的伤害。同时研究表明,两种外源氮对山定子根系响应亚低温具有不同的影响,为苹果生产中合理施用氮肥提供了理论基础。
关键词:亚低温;外源氮;山定子(Malus baccata Borkh.);根系;氮代谢;抗氧化酶
中图分类号:S661.9;Q945.13 文献标识码:A 文章编号:0439-8114(2017)13-2471-05
DOI:10.14088/j.cnki.issn0439-8114.2017.13.018
Effects of Different Exogenous Nitrogen on Nitrogen Metabolism of Malus baccata Borkh. Roots Under Mild Hypothermia
LI Ling1,LU Xiao-chen2,MA Huai-yu2,L?譈 De-guo2
(1.Xingcheng Secondary Vocational and Technical College, Xingcheng 125100, Liaoning, China;
2.College of Horticulture, Shenyang Agricultural University, Shenyang 110866, China)
Abstract: The seedlings of Malus baccata Borkh. were used as materials to study the efficiency of exogenous nitrogen on root vigor, nitrogen metabolism, and activities of antioxidant enzymes in roots under mild hypothermia. The results showed that, under mild hypothermia exogenous nitrogen increased root vigor within a certain time, increased the activities of the nitrate reductase and glutamate synthase, but reduced glutamine synthetase activity, while glutamate dehydrogenase activity showed an upward trend as a whole. In addition, different kinds of nitrogen showed different effects on enzyme activities of root nitrogen metabolism. The activities of glutamine synthetase and glutamate dehydrogenase by NH4+ treatment were higher than that by NO3- treatment. Under mild hypothermia, exogenous nitrogen significantly enhanced the activities of POD and CAT, but had negative effects on SOD activity. Therefore, exogenous nitrogen can alleviate the damage caused by mild hypothermia stress on the root zone. The results showed that two kinds of exogenous nitrogen had different effects on the response of mild hypothermia, which provided the theoretical basis for rational application of nitrogen fertilizer in apple production.
Key words: mild hypothermia; exogenous nitrogen; Malus baccata Borkh.; root; nitrogen metabolism; antioxidant enzyme
目前,随着中国苹果抗寒育种研究的不断进步,寒富苹果已经成为具有代表性的抗寒大果型品种,并在沈阳等苹果产区广泛栽植。但是沈阳地区早春气温回升较快,而土温回升相对滞后,导致植株根系处于亚低温状态,影响生长季初期植株的生长发育。
氮代谢是植物的基礎生理过程之一,是春季树体恢复生长、萌芽、展叶、开花等生长发育过程的重要物质基础。王海宁等[1]研究了不同苹果砧木对硝态氮和铵态氮的吸收利用,结果表明,苹果砧木是喜硝态氮植物,对硝态氮的利用率及征调能力均高于铵态氮。植物的氮代谢过程中,有一系列的相关酶参与反应,其中硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合酶(GOGAT)及谷氨酸脱氢酶(GDH)为氮代谢途径中的关键酶。氮代谢对环境温度比较敏感,尤其是低温。关于低温胁迫的研究表明,根系GS活性在逐渐降温和迅速降温条件下均有显著的提高,其中迅速降温处理GS活性较高,根系GDH活性呈现下降的趋势,GOGAT活性较低,可能是由于逐渐降温使根系有较长时间的反应过程,对氮代谢功能伤害较小,为迅速降温条件下根系应激反应更强烈提供了证据[2]。研究表明,外源施加不同形态的氮素可以提高植株叶绿素含量、根系活力及氮代谢关键酶活性,以缓解低温对植株的伤害[3]。另有研究表明[4],在逆境条件下植物的抗氧化酶系统均可清除体内产生的活性氧等物质。其中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)在活性氧的清除方面发挥重要的作用,保持体内活性氧代谢的平衡,从而对细胞膜结构起到保护作用,在一定程度上增加植株对逆境胁迫的抵抗能力。上述各项酶活力能够较好地反映植物的抗逆性强弱,但其在不同处理下的变化存在差异[5,6]。刘国英等[7]研究发现,亚低温条件下,不同硝铵配比对番茄幼苗抗氧化酶活性有一定的影响,当NO3--N/NH4+-N比例为75/25时最有利于提高番茄植株的抗寒性。
为此,试验以北方地区常用苹果砧木山定子为试验材料,研究亚低温条件下不同外源氮对植物氮代谢及活性氧清除系统调节的生理特征,以期为苹果生产中氮肥的合理施用以及对亚低温条件下根系功能的改善提供理论依据。
1 材料与方法
1.1 试验材料
试验于2015年4月在沈阳农业大学果树栽培与生理生态试验基地进行,以当年生山定子(Malus baccata Borkh.)实生苗为试验材料,种子经层积催芽后播于穴盘中,常规管理,待幼苗长出4~5片真叶后移苗至黑色塑料营养钵(上口直径10 cm×高10 cm)中,待山定子实生苗长至15片真叶时,挑选生长一致的转入人工气候箱进行试验处理。
1.2 试验处理
1.2.1 亚低温处理 根系置于5 ℃的条件下后,将整株植株放入培养箱中,培养箱温度为18 ℃(昼)/ 8 ℃(夜),光照14 h,以整株植株都生长在18 ℃(昼)/8 ℃(夜)中的幼苗作为对照,分别于处理后0、2、4、6、8、10、12、14、16 d进行取样,试验5次重复。
1.2.2 加氮处理 在亚低温处理前,根系分别浇灌2 mmol/L的KNO3和2 mmol/L的NH4Cl溶液。
1.3 测定方法
1.3.1 根系氮代谢关键酶活性的测定 根系活力采用TTC法测定[8];硝酸还原酶(NR)采用磺胺比色法测定[9]。
按参考文献[10]的方法提取根系中的粗酶液,取根系样品0.2 g,加入2 mL提取缓冲液,冰浴研磨,转移于离心管中离心,上清液即为粗酶提取液,粗酶液用于谷氨酰胺合成酶、谷氨酸合酶、谷氨酸脱氢酶活性的测定。
GS活性参考文献[9]的方法测定;NADH-GOGAT活性采用参考文献[11]的方法测定,以在30 ℃条件下反应混合液每分钟减少1 μmol的NADH为一个酶活性单位,总NADH-GOGAT活性计算以每分钟每毫克酶液催化NADH减少的微摩尔数表示;NADH-GDH活性参考参考文献[12]的方法测定,GDH活性以每分钟在30℃下氧化1 μmol的NADH为1个酶活单位。
1.3.2 根系抗氧化酶活性的测定 SOD活性测定参考文献[13]的方法,以抑制氮蓝四唑(NBT)光氧化还原50%的酶量为1个活力单位(U);POD活性采用愈创木酚法测定,以每分钟OD值变化0.1为一个酶活单位(U);CAT活性采用文献[14]的方法测定,以每分钟OD值降低0.043 6的酶量为1个活力单位(U)。
2 结果与分析
2.1 外源氮对亚低温下山定子根系活力的影响
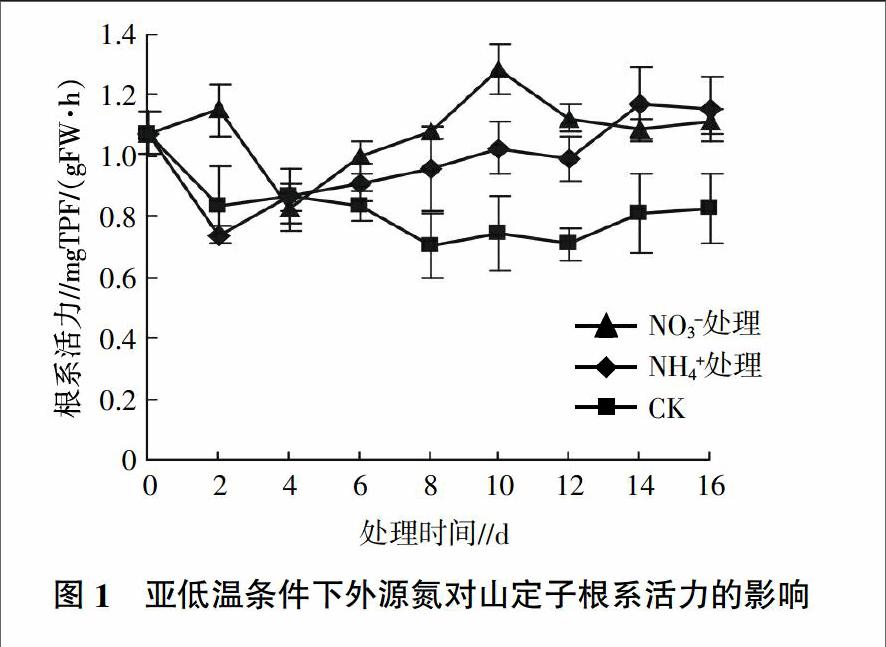
由图1可见,对照的根系活力在处理的前2 d快速下降,此后保持在较低的水平。添加NO3-处理和添加NH4+处理的根系活力在前4 d表现出相反的变化趋势,前者的根系活力先升高后降低,后者的根系活力先下降后升高。4 d后两个处理的根系活力呈上升的趋势并且始终高于对照。添加NO3-处理的根系活力在第10 天达到最大值,并且明显高于NH4+处理,为对照的1.72倍,之后根系活力逐渐降低。NH4+处理的根系活力4 d后呈上升的趋势,但在4~12 d一直低于NO3-处理,12 d后出现一个快速升高的阶段,在14 d后略高于NO3-处理。
2.2 外源氮对亚低温下山定子根系氮代谢关键酶活性的影响
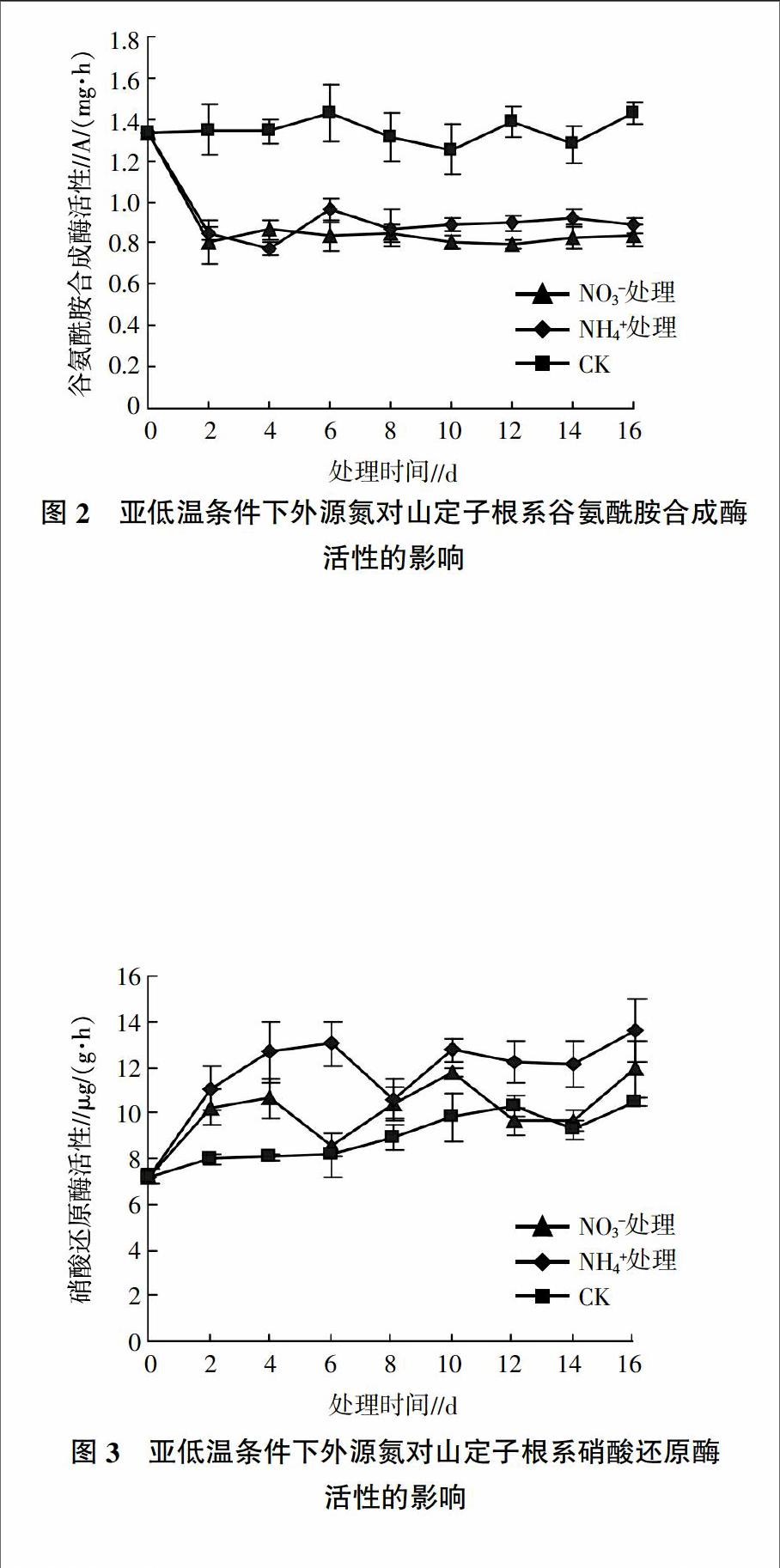
2.2.1 外源氮对亚低温下山定子根系谷氨酰胺合成酶活性的影响 由图2可见,对照中GS活性一直保持在较高水平。与对照相比,添加氮素处理后,根系GS活性在处理的前2 d大幅度降低,此后稳定在较低水平。添加NO3-和NH4+处理的GS活性水平在第2~16天一直相近。至处理结束,添加NO3-和NH4+处理的GS活性均显著低于对照,分别为对照的58.73%、62.03%。
2.2.2 外源氮对亚低温下山定子根系硝酸还原酶活性的影响 由图3可见,处理过程中,对照的NR活性不断增强,但低于添加氮素处理的植株。添加NO3-处理的NR活性在前4 d呈现上升的趋势,此后开始降低,在第6天酶活性降到低谷后又呈升高的趋势,而添加NH4+处理的NR活性则在前6 d呈现上升的趋势,此后开始下降,在第8天酶活性降到低谷后又呈上升的趋势。至处理的第10天添加NO3-和NH4+处理的NR活性达到峰值,分别为对照的1.2倍和1.3倍,10 d后NO3-处理的NR活性迅速下降,至第14天达到低谷后又有所升高,NH4+处理的NR活性在10 d后趋于稳定。处理期间,添加NH4+处理的NR活性始终高于添加NO3-处理的NR活性。
2.2.3 外源氮对亚低温下山定子根系谷氨酸合酶活性影响 由图4可见,对照中GOGAT的活性一直保持在较低水平。与对照相比,添加不同形态氮素后,NH4+處理的根系GOGAT活性始终显著高于对照和NO3-处理,添加NO3-处理的根系GOGAT活性在处理的0~10 d低于对照,处理10 d后酶活力迅速上升并且显著高于对照。添加NO3-处理后,根系GOGAT活性在处理的0~6 d缓慢下降,到第6天下降到最小值,比对照降低了53.32%,处理6~10 d根系GOGAT活性趋于稳定,10 d后GOGAT活性迅速升高,到处理的12 d时升高到最大值,为对照的3.04倍。添加NH4+处理后,根系GOGAT活性表现出迅速升高的趋势,到处理的第8天达到最大值,为对照的4.57倍。
2.2.4 外源氮对亚低温下山定子根系谷氨酸脱氢酶活性的影响 由图5可见,添加NH4+后山定子根系GDH活性始终高于对照和NO3-处理,NH4+处理的根系GDH活性呈现出先升高后降低的变化趋势,到处理的第10天达到最大值,为对照的1.61倍,处理10 d后根系GDH活性逐渐下降到对照水平。添加NO3-处理的根系GDH活性呈现出先下降后上升的变化趋势。NO3-处理根系GDH活性在处理0~4 d表现为下降趋势,至第4天下降到最小值,比对照降低了47.87%,处理4~10 d中根系GDH活性迅速上升,在第10天上升到最大值,为对照的1.32倍。至第16天NO3-和NH4+处理与对照三者间差异不大。
2.3 外源氮对亚低温下山定子根系抗氧化酶活性的影响
2.3.1 外源氮对亚低温下山定子根系过氧化物酶活性的影响 由图6可知,亚低温条件下添加不同形态的氮素后,根系POD活性均高于对照。添加NO3-处理后,0~6 d根系POD活性表现为上升的变化趋势,处理的第8天活性出现降低后又有所上升,处理14~16 d根系POD活性表现出明显的增加趋势。添加NH4+处理后,0~2 d根系POD活性呈现出上升的变化趋势,第2~4天活力有所降低,4 d后根系POD活性缓慢增加,第8天后根系POD活性增加幅度加大,至第12天达到最高值,约为对照的2倍,14 d后根系POD活性迅速降低,逐渐接近对照值。处理期间,除第4、6、16天外,其余根系POD活性都表现为NO3-处理低于NH4+处理。
2.3.2 外源氮對亚低温下山定子根系超氧化物歧化酶活性的影响 由图7可知,在亚低温条件下添加不同形态的氮素后,根系SOD活性均低于对照。添加NO3-处理后,根系SOD活性在处理的0~2 d表现为下降的变化趋势,第2~14天SOD活性的变化趋势基本保持水平,从第14天开始略有上升。添加NH4+处理后,根系SOD活力一直表现为下降的趋势,直至处理的第14天达到最小值,比对照降低了5.57%,14 d后根系SOD活性上升至与NO3-处理相近。在整个处理期间,NH4+处理的根系SOD活性在0~10 d一直高于NO3-处理,但12 d后则下降至低于NO3-处理。
2.3.3 外源氮对亚低温下山定子根系过氧化氢酶的影响 由图8可知,亚低温条件下添加不同形态的氮素后,根系CAT活性基本都高于对照。添加NO3-处理后,根系CAT活性在2~4 d处理中迅速升高,第4天达到最大值,为对照的2.05倍,4~6 d CAT活性降低,6 d后根系CAT活性虽有所上升,但变化趋势比较平缓,14 d后活性出现下降变化。添加NH4+处理后,根系CAT活性在处理的2~4 d也表现出迅速上升的变化趋势,4~8 d活性有所降低,处理8 d后根系CAT活性又迅速增加,至第10天达到最大值,处理10 d后根系CAT活性变化趋势基本稳定。在整个处理期间,0~10 d中根系CAT活力表现为NO3-处理高于NH4+处理,处理10 d后表现为NO3-处理低于NH4+处理。
3 小结与讨论
在逆境条件下,根系是首先遭受伤害的器官,根系活力反映了根系代谢能力的强弱,直接影响植株的生长和抗逆性。本试验中,在亚低温条件下添加不同形态氮素后对根系活力有一定的影响,两处理的根系活力皆比对照高,表明在亚低温下添加外源氮素能在一定程度上提高根系的代谢活力,促进了根系对氮素的同化,从而来抵抗低温环境的胁迫。并且在亚低温条件下,添加NO3-处理的根系活力高于添加NH4+处理的根系活力,原因可能是由于植物吸收利用NO3-需要先消耗能量将其还原进而加以同化[15],而NH4+可直接被同化利用,所以添加NO3-处理的根系活力有所增加。
氮代谢是植物生长发育中的重要代谢过程,植物可利用的氮素形态主要有NO3--N和NH4+-N两种形式,并且都为主动吸收过程。其中硝酸还原酶、谷氨酰胺合成酶、谷氨酸合酶以及谷氨酸脱氢酶为氮素同化过程中的关键酶。NR在氮素同化过程中可以将NO3-还原,生成NH4+后进一步进行同化[16]。对于亚低温条件下添加不同形态氮素的处理来说,处理后根系NR活性均处于上升的变化趋势,两个处理之间添加NO3-处理的NR活性大于NH4+处理。有研究表明,NR活性与其底物的含量密切相关,是硝酸盐还原过程中的关键酶,硝态氮还原能力的强弱及植物吸收和积累硝态氮的能力与其活性的高低直接相关[17]。推测出现此种结果可能是由于外源添加NO3--N提高了根系周围的NO3-离子浓度,进而诱导了NR活性的升高。
GS/GOGAT系统是高等植物氨同化过程中的主要途径[18],通过这一途径产生的谷氨酰胺和谷氨酸是合成其他代谢产物的前体物质。GDH是铵同化过程中的另一种关键酶,虽然其作用尚有争议,但初步研究表明,GDH有两种作用,在外源氮含量过高时进行NH4+的同化,而在一定条件下又可分解谷氨酸来为TCA循环提供碳骨架[19],并且有研究指出GDH可能在植物逆境条件下对缓解铵毒害有重要作用[20]。添加不同形态氮素对根系铵同化过程中的酶活性也存在一定的影响,NH4+处理的GS活性高于NO3-处理,有研究表明,铵态氮较硝态氮对GS活性的促进作用更为明显[21,22],与本研究结果一致。本试验结果表明,亚低温条件下添加不同形态氮素后,根系GDH活性表现为上升的变化趋势,并且GDH活性一直表现为NH4+处理大于NO3-处理,可能是由于NH4+的大量积累诱导了酶活性的增加,从而来解除NH4+对根系的不良影响。
亚低温条件下,添加不同形态氮素后明显降低了根系SOD活性,尤其是对处理后期酶活性的抑制作用加强,说明添加氮素后不仅没有缓解亚低温对SOD活性的抑制作用,还加剧了处理后期(第8天后)酶活性的抑制程度,且NH4+对酶活性的抑制作用较强(处理第12天后),这可能是NH4+-N处理后期加重亚低温胁迫对SOD的抑制作用。但氮素处理明显提高了CAT、POD活性,尤其是在处理的中后期NH4+处理的促进效应强于NO3-。由此看来,亚低温下抗氧化酶对NO3--N和NH4+-N处理的响应各异,他们之间的互作机理还需进一步的研究。
参考文献:
[1] 王海宁,葛顺峰,姜远茂,等.苹果砧木生长及吸收利用硝态氮和铵态氮特性比较[J].园艺学报,2012,39(2):343-348.
[2] 王 英,吕德国,秦嗣军,等.低温对不同供氮水平下山定子幼苗根系氮代谢的影响[J].果树学报,2009,26(6):769-773.
[3] 董宝珠,李宏光,杨红武,等.不同氮素形态及配比营养液对烟苗生长及生理特性的影响[J].作物学报,2015,29(1):26-36.
[4] SHEN W Y,NADA K,TACHIBANA S. Effect of cold treatment on enzymic and nonenzymic antioxidant activities in leaves of chilling-tolerant and chilling sensitive cucumber(Cucumis sativus L.) cultivars[J].J Japan Soc Hort Sci,1999,68(5):967-973.
[5] 周艳虹,喻景权,钱琼秋,等.低温弱光对黄瓜幼苗生长及抗氧化酶活性的影响[J].应用生态学报,2003,14(6):921-924.
[6] 胡文海,喻景权.低温弱光对番茄叶片光合作用和叶绿素荧光参数的影响[J].园藝学报,2001,28(1):41-46.
[7] 刘国英,李建明,杜清洁,等.亚低温与硝铵配比对番茄幼苗渗透调节物质及抗氧化酶活性的影响[J].西北农林科技大学学报,2015,43(1):98-105.
[8] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[9] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[10] ZHANG C F,PENG S B,PENG X X,et al. Response of glutamine synthetase isoforms to nitrogen sources in rice(Oryza sativa L.) roots[J]. Plant Science,1997,125(2):163-170.
[11] SINGH P,SRIVASTAVA H. Increase in glutamate synthase (NADH) activity in maize seedlings in response to nitrate and ammonium nitrogen[J].Plant Physiology,1986,66(3):413-416.
[12] LOULAKAKIS K A,ROUBELAKIS-ANGELADIS K A. Intracellular localization and properties of NADH-glutamate dehydrogenase form Vitis vinfera L.: purilication and characterization of the major leaf isoenzyme[J]. Journal of Experimental Botany,1990,41(10):1223-1230.
[13] 王爱国,罗广华,邵从本.大豆种子超氧化物歧化酶的研究[J]. 植物生理学报,1983,9(1):78-83.
[14] 杨兰芳,庞 静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性[J].现代农业科技,2009(20):364-366.
[15] HYV?魻NEN R,?魡GREN G I,LINDER S. The likely impact of elevated[CO2], nitrogen deposition, increased temperature and management on carbon sequestration in temperate and boreal forest ecosystems:A literature review[J].New Phytologist,2007, 173(3):463-480.
[16] 李合生.现代植物生理学[M].北京:高等教育出版社,2002.
[17] VIDAL E A,GUTI?魪RREZ R A. A systems view of nitrogen nutrient and metabolite responses in Arabidopsis[J].Curr Opin Plant Biol,2008,11(5):521-529.
[18] LEA P J,MIFLIN B J. Alternative route for nitrogen assimilation in higher plants[J]. Nature,1974,251(5476):614-616.
[19] MELO-OLIVEIRA R,CUNHA-OLICEIRA I,CORUZZI G M. Arahidopsis mutant analysis and gene regulation define a nonredundant role for glutamate dehydrogenase in nitrogen assimilation[J]. Prox Natl Acad Sci USA,1996,93(10):4718-4723.
[20] SRIVASTAVA H S,SINGH R P. Role and regulation of L-glutamate dehydrogenase activity in higher plants[J].Phytochemistrv,1987,26(3):597-610.
[21] THEODORE K R,NORMAN T. Carbon nitrogen and nutirient interactions in(Beta Vulgaris L.) as influenced by nitrogen source NO3- versus NH4+[J]. Plant Physiology,1995,107(2): 575-584.
[22] GISELA M. Glut amine syhthetase oligomers and isoforms in sugat beet[J]. Plant,1990,181(1):10-17.

