不同时机转染基因对下颌骨牵引区细胞周期蛋白表达的影响研究*
尹 康,胡纯兵,周 滨,吴国平△,赵利平
(1.西南医科大学附属医院外科,四川泸州 646000;2.济宁医学院附属医院烧伤整形科,山东济宁 272029;3.南京医科大学附属友谊整形外科医院,南京 210029)
不同时机转染基因对下颌骨牵引区细胞周期蛋白表达的影响研究*
尹 康1,胡纯兵2,周 滨2,吴国平2△,赵利平3▲
(1.西南医科大学附属医院外科,四川泸州 646000;2.济宁医学院附属医院烧伤整形科,山东济宁 272029;3.南京医科大学附属友谊整形外科医院,南京 210029)
目的 通过观察不同时机转染基因对下颌骨牵引区细胞周期蛋白表达的影响,探讨基因治疗促进牵引成骨的分子机制及最佳时机。方法 48只新西兰大白兔建立双侧下颌骨牵引成骨模型后均分为A、B、C、D组。A、B、C组分别于术后即刻、术后第4天、术后第14天在牵引区转染重组质粒pIRES-hBMP2-hVEGF165,并局部给予电穿孔刺激。4组动物均在术后第4天,以1 mm/d的速度持续牵引10 d后进入固定期。于固定期第7、14、28、56天各组分别处死动物3只,通过免疫组织化学染色检查牵引区新生骨组织cyclin A、D1、E的表达。结果 在固定期第7、14天时,A、B、C组牵引间隙cyclin A、D1、E的表达较强,在第7天时表达最强烈,并且A、B、C组均较D组表达强;第28、56天时各组表达均较弱。在第7天时,B组表达较A、C、D组强(P<0.05),A、C组间表达差异无统计学意义(P>0.05),但均较D组强(P<0.05);在第14天时,B、C组表达较A、D组强(P<0.05),B、C组间及A、D组间表达差异无统计学意义(P>0.05)。结论 cyclin A、D1、E的高表达能促进牵引区细胞分裂、增殖和分化,进而加快牵引区新骨形成,牵引期是基因治疗干预下颌骨牵引成骨的最佳时机。
转染时机;电穿孔;基因疗法;牵引成骨;细胞周期蛋白
目前,牵引成骨技术被广泛应用于颅颌面外科[1],但如何减少因疗程长所致的并发症(创面感染、牵引器松动、骨不连及延迟愈合等)是学术界关注的焦点[2]。笔者通过在下颌骨牵引区不同时间点转染基因,并观察其对牵引区新生组织细胞周期蛋白表达的影响,研究基因转染促下颌骨牵引区新骨形成的最佳时机。
1 材料与方法
1.1 主要材料与仪器 实验动物及饲养由西南医科大学实验动物中心提供(实验动物许可证号SYXK、川2008-065),重组质粒pIRES-hBMP2-hVEGF165(-8 ℃保存)由本课题组构建[3]。
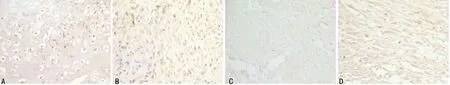
A:A组;B:B组;C:C组;D:D组
图1 固定期第7天时cyclin E的表达情况(SP×400)
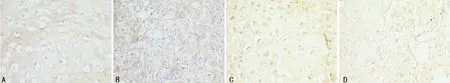
A:A组;B:B组;C:C组;D:D组
图2 固定期第14天时cyclin E的表达情况(SP×400)
基因脉冲导入仪(LN-301型,天津理工大学研制);下颌骨牵引器CBX0105-10(兔专用,宁波慈北口腔器械公司);生物素标记羊抗鼠IgG,兔抗cyclin A、D1、E抗体,SP、DAB 显色试剂盒(武汉博士德生物技术公司);多功能真彩色病理图像分析系统(CMIAS-2001A,北京麦克奥迪图像技术有限公司)。
1.2 方法
1.2.1 实验动物模型与基因导入 将48只新西兰大白兔(体质量2.5~3.0 kg,雌雄不限)实验前3 d连续监测体温、呼吸及脉搏,个体间差异无统计学意义(P>0.05)。在西南医科大学外科手术学技能中心完成,动物手术动物处置符合医学伦理学标准。参照本课题组前期研究[4]建立兔双侧下颌骨牵引成骨动物模型后,随机摸球法将动物均分为A组(潜伏期给药组)、B组(牵引期给药组)、C组(固定期给药组)、D组(对照组)。4组都经过3 d潜伏期后进入牵引期(即于术后第4天),开始以1 mm/d的速度连续牵引10 d后进入固定期。A、B、C组分别于术后即刻、术后第4天(牵引开始时)、术后第14天(牵引结束时)在牵引区局部注射2 μg(0.1 μg/μL)重组质粒pIRES-hBMP2-hVEGF165,待扩散10 min后,4组动物在牵引间隙部位均给以相同电穿孔刺激1次(电脉冲参数:平均脉宽2 ms、电压300 V、频率0.2 Hz、6个单脉冲、3个脉冲后更换正负极)。
1.2.2 标本制作与切片 于固定期第7、14、28、56天各组分别处死(空气栓塞法)实验动物3只,收获牵引区组织,经生理盐水洗涤后立刻浸于多聚甲醛(40 g/L、4 ℃、pH 7.4)中固定24 h,以20%EDTA2Na脱钙(3~5 d更换脱钙液1次,2~3周)满意后,用梯度乙醇脱水,再用二甲苯透明,石蜡包埋,制成切片(5 μm)。
1.2.3 免疫组织化学染色(SP法) 石蜡切片脱蜡、脱水,3%H2O237 ℃孵育10 min,0.01 mol/L PBS(pH 7.2)冲洗3次,每次5分钟;置于0.01 mol/L枸橼酸缓冲液(pH 6.0)中,用微波抗原修复10 min;自然冷却后,再用0.01 mol/L PBS冲洗3次,每次5分钟;滴加PBS(0.01 mol/L)稀释的10%山羊血清进行封闭,室温(37 ℃)孵育20 min;倾去血清后,直接加一抗(0.01 mol/L PBS稀释,1∶50至1∶100),37 ℃孵育1 h后,4 ℃过夜;0.01 mol/L PBS冲洗3次,每次5分钟,滴加生物素标记二抗(0.01 mol/L PBS稀释,1∶100),37 ℃孵育1 h;PBS(0.01 mol/L)洗3次,每次5分钟,加辣根过氧化物酶标记的链霉素卵白素工作液(SP,0.01 mol/L PBS稀释,1∶100),37 ℃孵育1 h;0.01 mol/L PBS冲洗3次,每次5分钟,DAB显色,镜下观察控制显色效果;苏木素浅染色,脱水,透明,封片。对照设置:以PBS(0.01 mol/L)代替一抗作阴性对照,其余步骤同上。结果判定:胞核呈黄色或浅蓝色,胞浆呈棕黄色为阳性结果。
1.2.4 图像分析及定量方法 采用CMIAS-2001A多功能真彩色病理图像分析系统进行图像分析及定量,在光镜10×40倍视野下,每个样本随机选取5个视野,检测阳性表达蛋白的积分光密度(IOD)值和平均光密度(MOD)。
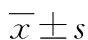
2 结 果
2.1 实验动物数量分析 实验动物均耐受全部实验过程并进行结果分析。
2.2 各组cyclins表达 在牵引区组织的细胞质和细胞核中均可见cyclin A、D1、E的表达。固定期第7天时,cyclin A、D1、E表达最强烈,主要在肉芽组织中的炎细胞、成纤维细胞及骨周围结缔组织中表达,cyclin A、D1、E表达B组较A、C、D组强,差异有统计学意义(P<0.01);A、C组表达较D组强(P<0.01),A、C组间差异无统计学意义(P>0.05)。第14天时,cyclin A、D1、E表达强度较第7天时有所减弱,主要在牵引间隙间充质细胞、成纤维细胞和骨细胞、成骨细胞和新生骨小梁中呈强阳性表达,B、C组表达较A、D组强(P<0.05),B组与C组间、A组与D组间表达差异无统计学意义(P>0.05)。第28天时,主要在骨小梁表面的成骨细胞、骨细胞和骨周围结缔组织及成纤维细胞中表达,各组表达均较固定期第14天时进一步减弱。B、C组仍呈阳性表达,较A、C组表达强烈。第56天时,有少许在成纤维细胞及骨周围结缔组织、骨小梁表面的成骨细胞、骨细胞中表达,各组表达均较弱或无表达。各组cyclin A、D1、E表达较弱且组间差异无统计学意义(P>0.05)。见图1~4,表1~3。

A:A组;B:B组;C:C组;D:D组
图3 固定期第28天时cyclin D1的表达情况(SP×400)
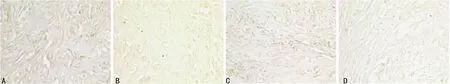
A:A组;B:B组;C:C组;D:D组
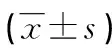
图4 固定期第56天时cyclin A的表达情况(SP×400)
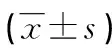
表2 各组cyclin D1的IOD、MOD比较
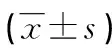
表3 各组cyclin A的IOD、MOD比较
3 讨 论
随着牵引成骨在颅颌面外科的广泛应用,学者们通过基因治疗途径来促进牵引区新骨的形成以减少创面感染、牵引器松动、骨不连及延迟愈合等术后并发症。目前一致认为:(1)生长因子表达顺序、分泌水平和时相的影响因素不仅有力学,还有因子间的网络调节,它们是一组有序、有规律作用的因子[5];牵张成骨过程的调节涉及多种生长因子,主要包括碱性成纤维细胞生长因子(bFGF)、胰岛素样生长因子(IGF)、转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)、骨形成蛋白(BMPs)、血小板源性生长因子(PDGF)。(2)多种组织干细胞作为种子细胞在多种因子修饰下分化并促进牵引区新骨形成,其中主要种子细胞有人牙髓干细胞(SHED)、间质干细胞(MSCs)、脂肪源干细胞(ADSCs)[6-7]。课题组前期实验通过不同时间点在下颌骨牵引区转染基因后观察牵引区新骨X线、骨密度、组织学检测及形态计量分析证明牵引期行基因转染更能促进新骨生成[8-9],但其分子机制尚不清楚。
本实验结果显示:固定期第7天时,B组的表达较A、C及D组强,A、C组间无显著差异,但均较D组强;固定期第14天时,B、C组表达较A、D组强,B、C组间及A、D组间无显著差异;固定期第28、56天时,表达均较弱。可见牵引期转染组牵引区细胞周期蛋白的表达明显增强且时限延长,提示基因转染时机与表达水平密切相关,机械牵张力可增加转染基因的表达而引起细胞周期蛋白表达增强,进而加速新骨形成。其机制可能是牵引间隙新骨形成过程包括血管的再生、成骨细胞的增殖及分化、胶原纤维的形成和基质的钙化等过程[10],而细胞周期的调控决定细胞的增殖与分化。cyclin A为S期周期蛋白,可能调控G1/S期转化;cyclin D1它是生长因子的感应器及细胞周期的启动因子;cyclin E在G1/S期与CDK2结合,促进细胞进入S期;具有催化功能的细胞周期依赖性蛋白激酶(CDKs)和具有调节功能的cyclins是在细胞周期进程中主要的两类调节因子[11-12],二者所形成的复合体是细胞周期调控的核心机制[13];当处于静止期G0细胞可因生长因子、激素等刺激后,可产生多种cyclins并诱导相应CDK的表达,最终促使细胞分裂、增殖[14]。牵引期转染,在牵张力的刺激下,骨组织通过一系列复杂的细胞内外信号传导后,局部转染基因诱导成骨细胞和间充质细胞首先改变形状,并有协同促进各种细胞生长因子合成、分泌作用及cyclinA、D1、E的表达[15],使牵引区产生高浓度的生长因子网络系统,促进成骨细胞、骨细胞、基质细胞、内皮细胞及成纤维细胞等细胞的分裂、增殖,从而促进牵引间隙新骨、新生血管的形成。在潜伏期和固定期行基因转染,虽在局部可形成高浓度的生长因子网络系统,但由于牵引间隙细胞无机械应力作用,生长因子的生成会受到影响。另外,潜伏期质粒其转染率可能受牵引间隙存在大量的渗血所稀释或冲走,以及炎症介质释放的影响。本实验研究表明在牵引期进行基因治疗能增强牵引区细胞周期蛋白的表达并延长其时限,促新骨生成。
[1]McCarthy JG,Schreiber J,Karp N,et al.Lengthening the human mandible by gradual distraction[J].Plast Reconstr Surg,1992,89(1):1-8.
[2]Master DL,Hanson PR,Gosain AK.Complications of mandibular distraction osteogenesis[J].J Craniofac Surg,2010,21(5):1565-1570.
[3]吴国平,腾利,归来,等.人骨形成蛋白2和血管内皮细胞生长165D在人骨髓间充质干细胞中的共表达[J].中国组织工程研究与临床康复,2007,11(3):587-591.
[4]吴国平,李盛华,黎德平,等.电穿孔介导的基因治疗兔下颌骨牵引成骨模型的建立[J].中华整形外科杂志,2009,25(4):284-287.
[5]Wu GP,Zhou B,Hu CB,et al.Gene expression of osteogenic factors following gene therapy in mandibular lengthening[J].J Craniofac Surg,2015,26(2):378-381.
[6]Sun JJ,Zheng XH.New bone formation enhanced by ADSCs overexpressing hRunx2 during mandibular distraction osteogenesis in osteoporotic rabbits[J].J Orthop Res,2014,32(5):709-720.
[7]Alkaisi A,Ismail AR.Transplantation of human dental pulp stem cells:enhance bone consolidation in mandibular distraction osteogenesis[J].J Oral Maxillofac Surg,2013,71(10):e1-13.
[8]吴国平,黎德平,胡纯兵,等.电穿孔介导的基因治疗对兔下颌骨牵引区新生骨骨密度与强度的影响[J].中华整形外科杂志,2010,26(3):207-211.
[9]Wu GP,Hu CB,He XC,et al.Effect of gene transfecting at different times on mandibular distraction osteogenesis[J].J Craniofac Surg,2013,24(1):232-236.
[10]Reina-Romo E,Gmez-Benito MJ,Sampietro-Fuentes A,et al.Three-dimensional simulation of mandibular distraction osteogenesis:mechanobiological analysis[J].Ann Biomed Eng,2011,39(1):35-43.
[11]Nurs P.Ordering S phase and M Phase in the cell cycle[J].Cell,1994(4):547-550.
[12]Mirgan DO.Principles of CDK regulation [J].Nature,1995,374(6518):131-134.
[13]Lian JB,Stein GS.Development of the osteoblast phenotype:molecular mechanisms mediating osteoblast growth and differentiation[J].Iowa Orthop J,1995,15:118.
[14]Zhang Q,Yin H,Liu P,et al.Essential role of HDL on endothelial progenitor cell proliferation with PI3K/Akt/cyclin D1 as the signal pathway[J].Exp Biol Med,2010,235(9):1082-1092.
[15]Steinbrech DS,Mehrara BJ,Rowe NM,et al.Gene expression of TGF-beta,TGF-beta receptor,and extracellular matrix proteins during membranous bone healing in rats [J].Plast Reconstr Surg,2000,105(6):2028-2038.
Effect of gene transfecting at different time on expression of cyclins in mandibular distraction area*
YinKang1,HuChunbing2,ZhouBing2,WuGuoping2△,ZhaoLiping3▲
(1.DepartmentofSurgery,AffiliatedHospitalofSouthwestMedicalUniversity,Luzhou,Sichuan646000,China;2.DepartmentofBurnandPlasticSurgery,AffiliatedHospitalofJiningMedicalUniversity,Jining,Shandong272029,China; 3.AffiliatedFriendshipPlasticSurgeryHospital,NanjingMedicalUniversity,Nanjing,Jiangsu210029,China)
Objective To investigate the optimal time and molecular mechanism of gene therapy for promoting distraction osteogenesis by observing the effect of gene transfecting at different time on expression of cyclins in mandibular distraction area.Methods Forty eight New-Zealand rabbits were employed.After accomplishing bilateral mandibular distraction osteogenesis model,the rabbits were randomly divided into the group A,B,C and D.The group A,B and C were transfected by recombinant plasmids pIRES-hBMP2-hVEGF165 2 μg(0.1 μg/μL)at the distraction area instantly after operation,on postoperative 4,14 d and given local electroporation stimulation.The four groups entered the consolidation stage after 10 d continuous traction at a rate of 1 mm/d on postoperative 4 d.Three rabbits in each group were respectively sacrificed on 7,14,28,56 d of the consolidation stage.The expression of cyclin A,D1,and E of fresh bone tissue in distraction area were detected by immunohistochemical staining.Results Cyclin A,D1,and E were strongly expressed in the traction gap on 7,14 d of consolidation stage found,which was strongest on 7 d,moreover the group A,B and C were stronger than the group D.The expression in each group was weakened on 28,56 d.The expression on 7 d in the group B was stronger than that in the4 group A,C and D(P<0.05),the expression had no statistical difference between the group A and C(P>0.05),but all were stronger than the group D(P<0.05);the expression in the group B and C on 14 d was stronger than that in the group A and D,but the expression had no statistical difference between the group B and C and between the group A and D(P>0.05).Conclusion The high expression of cyclin A,D1 and E can promote the cellular division,proliferation and differentiation in distraction area,thus accelerates the new bone formation in the distraction area,prompting that the distraction period is the best time for distraction osteogenesis under gene therapeutic intervention.
transfection time;electroporation;gene therapy;distraction osteogenesis;cyclins
国家自然科学基金资助项目(30600653);四川省卫生厅科研课题(12226)。 作者简介:尹康(1974-),硕士,主要从事外科手术技能及整形美容方面的研究。△
,E-mail:drgpwu@yahoo.com.cn。▲通信作者,E-mail:zlping86@163.com。
� 著·
10.3969/j.issn.1671-8348.2017.20.001
R622.9
A
1671-8348(2017)20-2737-04
2017-02-03
2017-04-08)

