土壤真菌组成对黄土高原梯田种植类型的响应
肖 礼,黄懿梅,赵俊峰,周俊英,郭泽慧,刘 洋
土壤真菌组成对黄土高原梯田种植类型的响应
肖 礼,黄懿梅*,赵俊峰,周俊英,郭泽慧,刘 洋
(西北农林科技大学资源环境学院,农业部西北植物营养与农业环境重点实验室,陕西杨凌712100)
以黄土丘陵沟壑区的梯田化模范县——庄浪县堡子沟流域的3种种植类型(玉米、苹果、苹果与土豆间作)梯田的土壤真菌为对象,运用IlluminaHiSeq高通量测序技术对表层土壤(0~20cm)中真菌rRNA基因的ITS1可变区进行研究,分析了土壤真菌的多样性、群落组成和相对丰度,同时结合土壤基本理化性质探讨了不同种植类型下影响真菌群落组成的因素.结果表明:(1)3种种植类型土壤真菌OTU数在688~862间变化,分属于13个门,87个纲,164个目,Chao1、ACE、Shannon、Simpson指数表现为间作地和苹果地大于玉米地;(2)土壤优势真菌为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota),子囊菌门的相对丰度在间作地最高,主要受土壤全氮和速效钾的影响,而接合菌门的相对丰度在苹果地最高,受土壤容重的影响较大,有机碳含量对担子菌门的影响较大;(3)不同种植类型梯田之间土壤真菌群落物种多样性相似,但真菌门、纲、种的相对丰度不同,种植类型间因有机肥的施用不同而通过土壤理化性质的变化影响土壤真菌的群落组成,有机肥的施用可提高当地梯田的土壤肥力.
梯田;种植类型;高通量测序;土壤真菌
梯田是控制黄土高原水土流失行之有效的措施[1-2],自建设以来,发挥着较好的减沙作用与水土保持效益[3-4],同时,梯田又是黄土高原重要的粮食生产基础,其土壤质量及其在农业领域的适用性对作物的生产变得越来越重要[5].随着社会与经济的发展,黄土高原梯田近年来的种植模式逐渐由普通农作物(如玉米、小麦等)向经济类作物转变(如苹果园等),而种植类型的变化对黄土高原梯田土壤质量的影响尚不清楚.
土壤微生物被认为是最敏感的土壤质量生物学指标.土壤真菌作为土壤微生物的重要组成部分,在土壤营养元素循环、有机质的形成和分解、土壤肥力的提高和保持、生态环境的改善等方面有非常重要的作用[6].土壤真菌是生态系统健康的指示物,与细菌相比,真菌能更好地降解复杂化合物[7].此外真菌还能与作物共生形成菌根, 对促进植物生长、维持农业生态系统的稳定具有重要意义[8].研究表明,影响土壤微生物群落结构的重要因素是土壤环境因子[9]和植物多样性[10],而多元化种植系统通过促进可持续发展和农业系统的应变能力,可以影响土壤微生物栖息环境[11].因此,梯田种植类型的变化势必影响到土壤微生物群落结构的变化.尽管土壤微生物在土壤的物质转化和肥力表征中起着重要的作用,但是由于受研究方法的限制,对不同生境条件下土壤微生物群落结构的认识还非常有限.
高通量测序技术作为二代测序方法,无需构建克隆,耗时少,通量高,能够准确全面地反映土壤微生物群落分布特征,已经被用于草地生态系统土壤微生物多样性研究[12-13].在黄土高原, Zeng 等[14]、刘洋等[15]和Zhang等[16]采用高通量测序技术研究了细菌群落结构随植被带的变化特征和植物群落自然演替对农田土壤细菌群落结构的影响.而关于土壤真菌群落结构的研究,目前主要运用传统平板稀释计数法和T-RFLP[17]研究不同覆盖方式[18]和不同耕作措施[19]对土壤微生物的影响[20],然而微生物传统培养不能准确全面地反映土壤微生物多样性特征[21],DGGE分析方法也只能检测到占整个群落细菌数量约1%的类群[22-23],这些方法对于不同种植类型土壤中的真菌群落组成和多样性特征了解不够全面.
为此,本研究在黄土高原选择3种典型种植类型的梯田土壤(玉米地、苹果、苹果与土豆间作地),运用IlluminaHiSeq高通量测序技术测定土壤真菌的群落组成和多样性,揭示不同种植类型下梯田土壤真菌群落组成和多样性特征以及它们与土壤理化性质之间的关系,为丰富土壤微生物多样性的认识、科学评价不同种植类型梯田土壤的肥力质量和生态环境效应以及黄土高原梯田生产建设提供理论依据.
1 材料与方法
1.1 研究区域概况
2015年9月在甘肃省庄浪县堡子沟流域(105°46¢15²~106°23¢45²E,35°03¢23²~35°28¢26²N),调查当地的种植类型及施肥状况,选择3种当地的典型种植类型:玉米、苹果和间作(苹果和土豆)类型作为研究对象,每种类型梯田设置3个野外重复(样地基本信息见图1),在每块样地中,根据S型布点法选7个样点,每个点用土钻采集0~20cm的土壤样品,将7个点的土样混合均匀后作为该样地的代表性样品,同时记录梯田的长度、宽度、经纬度以及海拔.采集的土壤去除根系,一部分风干过筛测定土壤基本理化性质,一部分冷冻保存在-20℃的冰箱,用来测定土壤NH4+-N和NO3--N.同时取一部分冷冻保存在-80℃(液氮),用于ITS1(Internal Transcribed Spacer-1)高通量测序分析.3种种植类型都有覆膜处理,具体施肥及种植年限信息见表1.
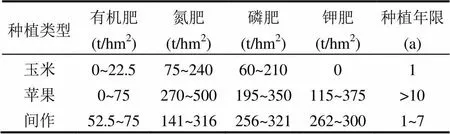
表1 施肥及种植年限信息
1.2 土壤样品分析
1.2.1 土壤基本理化性质的测定 土壤容重采用环刀法,土壤pH、有机碳(SOC)、全氮(TN)、铵态氮(NH4+-N)、硝态氮(NO3--N)、速效钾(AK)、速效磷(AP)的指标测定均参照《土壤农化分析》[24]的方法进行测定.
1.2.2 土壤真菌多样性的测定 土壤真菌ITS1的测序工作由北京诺禾致源生物信息科技有限公司进行.采用CTAB(HexadecylTrimethyl Ammonium Bromide)方法对样本的基因组DNA 进行提取.利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样品于离心管中,用无菌水稀释样品至1ng/μl.选择ITS1可变区,以稀释的基因组DNA为模板,使用ITS5-1737F和ITS2-2043R (10.1016/j.soilbio.2013.05.025)引物和高效高保真酶进行PCR,确保扩增效率和准确性.PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物.使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用HiSeq2500PE250进行上机测序,每个样品3个重复.然后对所有样品的全部序列进行聚类,以97%的相似度将序列聚类成为OTUs(Operational Taxonomic Units),然后对OTUs的代表序列进行物种注释(比对数据库为Ribosomal Database Project:Release 11.1 http://rdp.cme.msu.edu/和Unit数据库https://unite.ut.ee/),确定ITS1序列对应真菌名称.
1.3 数据处理与分析
土壤微生物多样性指数可以反应微生物的多样性,Chao是用chao1算法估计群落中含OUT数目的指数,在生态学中常用来估计物种总数,由Chao(1984)最早提出;Ace也是用来估计群落中含有OUT数目的指数,但是与Chao1的算法不同;Simpson是用来估算样品中微生物的物种多样性指数之一,对物种丰富度更敏感,在生态学中常用来定量的描述一个区域的生物多样性; Shannon用来估算样品中微生物的多样性指数之一,对物种均匀度更为敏感.所有指数的计算采用QIIME (版本1.7.0)和R软件 (版本2.15.3).其计算公式分别如下[25]:
(2)
(3)
数据处理与分析采用Excel 2013和SPSS 18.0,运用单因素和Duncan法进行方差分析和样品多重比较.同时运用Canoco 5.0软件进行土壤理化性质和真菌群落结构的冗余分析(RDA),并利用origin9.0软件作图.表中的数据表现为平均值±标准差.
2 结果与分析
2.1 土壤基本理化性质

表2 土壤基本理化性质

续表2
注:同行不同小写字母表示不同作物之间差异显著(<0.05),下同.
3种类型梯田土壤基本理化性质如表2所示.土壤均为弱碱性,其容重变化范围为1.18~ 1.27g/cm3之间.土壤的SOC、TN、NO3--N含量均表现为间作>苹果>玉米,土壤TN含量在间作地显著大于玉米地.同时,苹果地、间作地的NO3--N含量均显著高于玉米地,间作地是玉米地2倍多.而NH4+-N含量表现为玉米地>间作地>苹果地.3种梯田土壤的AK、AP和C/N差异都不显著.
2.2 土壤真菌OTU与多样性指数
所有样品共获得梯田土壤真菌OUT数为688~862,得到13个门,87个纲,164个目,360科,514个属,655个种.3种作物类型下梯田土壤的Chao1、ACE、Shannon、Simpson指数也都表现为间作地和苹果地大于玉米地,但3种处理之间微生物多样性指数没有显著差异.
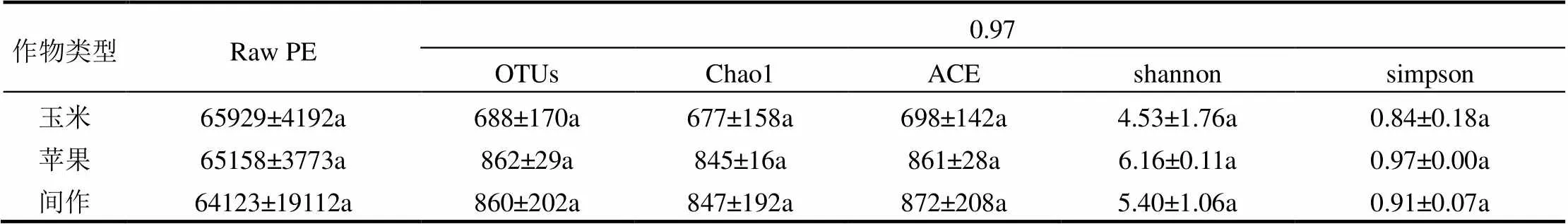
表3 不同种植类型下土壤真菌多样性指数
注:Raw PE:下机原始序列数; OTUs:以97%的一致性序列聚类而成;Chao1、ACE、shannon、simpson:微生物Alpha多样性指数.
2.3 土壤真菌群落组成分析
3种梯田土壤真菌门水平的优势物种的相对丰度如图2A所示,相对丰度大于0.2%的真菌门主要有子囊菌门()、接合菌门()、担子菌门()、未明确分类真菌(Unidentified)、壶菌门()、球囊菌门().其中,子囊菌门的相对丰度可以占到所有真菌门类的58%~82%,同时子囊菌门、担子菌门、接合菌门的相对丰度在3种梯田中平均可达76%以上,而在间作地这3个门的相对丰度可达94%.未明确分类门的相对丰度占所有真菌门类的1.5%~7.6%.不同种植类型之间土壤真菌门类相对丰度有差异,间作地的子囊菌门相对丰度为82%,大于苹果地(58.90%)和玉米地(58.56%).苹果地和玉米地接合菌门相对丰度分别为15.44%和12.95%,大于间作地的8.4%.
如图2B所示,3种梯田土壤中真菌纲水平的优势物种(相对丰度大于0.02%)主要有:粪壳菌纲(Sordariomycetes)、未定地位(Incertaesedis)、伞菌纲(Agaricomycetes)、散囊菌纲(Eurotiomycetes)、座囊菌纲(Dothideomycetes)、未明确分类真菌()、锤舌菌纲(Leotiomycetes)、古菌根菌纲(Archaeorhizomycetes)、其它纲()9个.3种种植类型下,粪壳菌纲的相对丰度可以占到所有真菌纲的41%~64%,同时表现为间作地大于苹果地和玉米地.
3种梯田土壤中20种优势种真菌的相对丰度如表4所示,20种优势种绝大部分属于子囊菌门.不同种植类型下在土壤真菌种水平下有差异:玉米地中的、、、、sp、HKB286种相对丰度高于苹果地和间作地,而、、21534、、5种的相对丰度则表现为间作地最大,玉米地最小.而的相对丰度在间作地最高,但在苹果地最小.苹果地中相对丰度高于其它两者的是:, Hypocreales 4种.
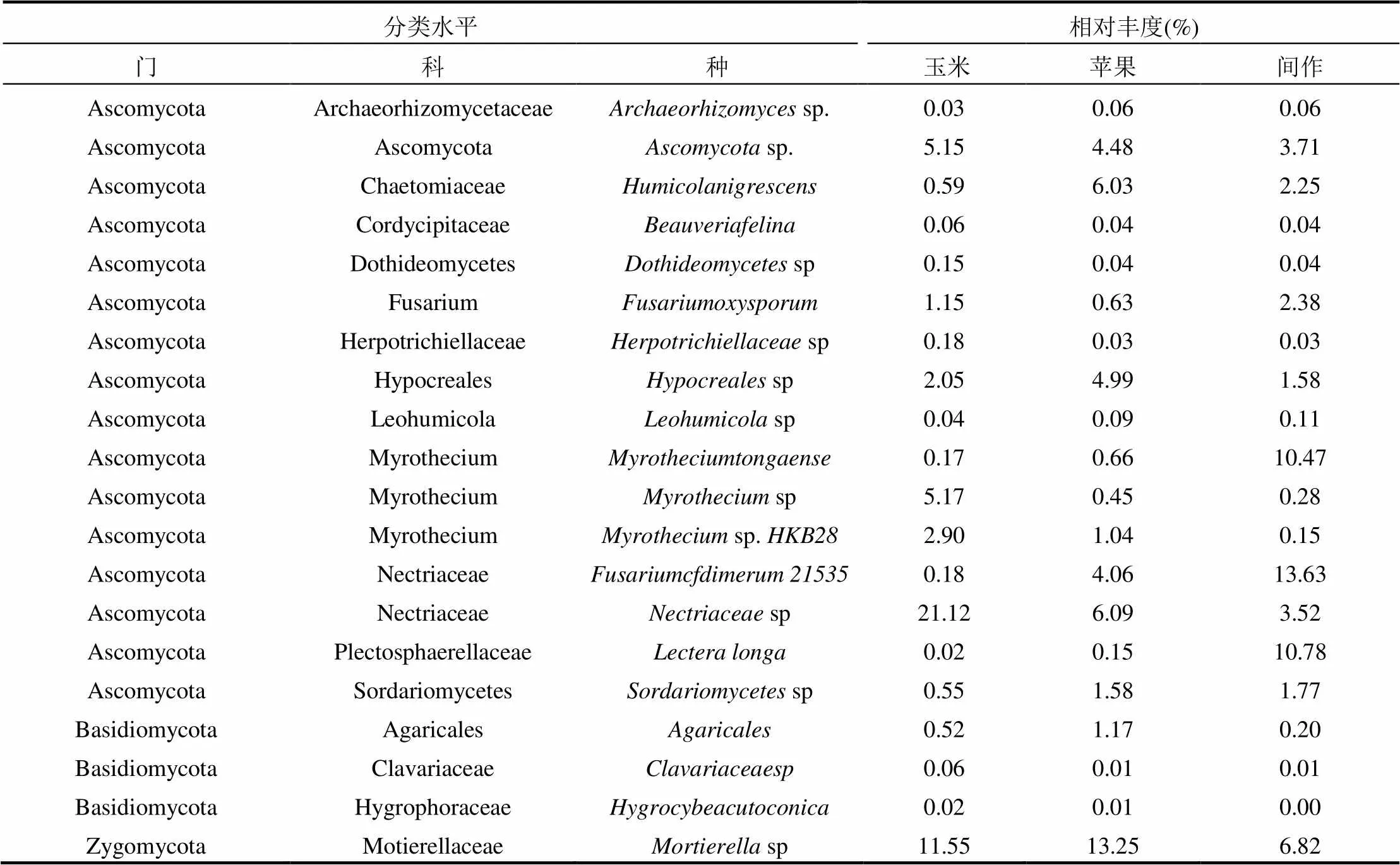
表4 土壤真菌20种优势种的相对丰度
2.4 土壤理化性质与真菌优势门之间的关系
从冗余分析(RDA)(图3)可以看出,子囊菌门和壶菌门与土壤有机碳含量、全氮含量、NO3--N含量以及速效磷呈正相关关系.球囊菌门和其他门与pH值呈正相关关系,接合菌门与速效磷、NO3--N呈正相关关系.可见,不同的优势真菌门对土壤中理化性质的反应不同.
3 讨论
3.1 不同种植类型下土壤真菌的群落组成和多样性特点
土壤微生物是土壤的重要组成成分,释放土壤酶,参与有机质降解、腐殖质合成、养分循环等生物化学过程[26].同时,不同种植方式[27]和不同的耕作措施[19]对土壤微生物群落结构多样性的变化均有较大的影响.研究结果表明,3种种植类型下梯田土壤真菌主要门类为子囊菌门、担子菌门、接合菌、壶菌门、主要纲类为粪壳菌纲、伞菌纲、散囊菌纲、座囊菌纲,其中子囊菌的相对丰度可以占到58%~82%,粪壳菌纲的相对丰度为41%~63%,与黔北不同种植模式[28]、黄土高原不同保护耕作措施[29]和丹麦不同豌豆类型[30]等对土壤真菌群落结构的影响研究相似,进一步说明了子囊菌为耕作土壤真菌的优势菌门,粪壳菌纲为优势菌纲.虽然不同种植类型之间土壤真菌群落物种组成相似,但不同种植类型之间土壤真菌门、纲、种的相对丰度不同,这可能就是黄土高原不同种植类型对土壤真菌群落组成影响造成的[31].同时,土壤微生物多样性指数表示生物群落中的物种多寡,数值愈大表示物种越丰富;优势度指数越大,生物群落内的优势种越突出[32].从结果可以看出,Chao1、ACE、Shannon、Simpson指数均表现为间作地和苹果地大于玉米地,同时间作地的子囊菌门的相对丰度大于苹果地和玉米地,说明子囊菌门的相对丰度受到作物类型的影响[33],间作地土壤为子囊菌提供了一个较好的环境,使其能够更好地利用作物残留的易降解部分,从而促进其快速增长[29].苹果地和玉米地的接合菌门相对丰度大于间作地,不同种植类型之间的土壤真菌在纲、属下的物种相对丰度也是有差异的,说明不同的种植类型因作物根系、残体以及分泌物与作物管理维护的不同,影响了土壤理化性质,进而改变了微生物物种组成和其结构[34].此外,传统的平板分析法只能得到土壤微生物的数量[35],PCR-DGGE也不能得到微生物不同分类水平的相对丰度[36],本研究采用高通量测序,具体分析了不同种植类型下土壤真菌门、纲、种的组成及相对丰度分布特征,发现20种优势种绝大部分属于子囊菌门,且没有发现植物的病原体-赤霉菌属,这些研究丰富了土壤真菌的理论知识,对于评估农业实践中微生物群落的影响有重要的意义[31].
3.2 影响土壤真菌群落组成和多样性特征的土壤理化性质
土壤肥力及土壤环境状况不同,土壤微生物种群数量也会存在某种程度的差别.研究结果表明,不同种植类型之间土壤有机碳、全氮、硝态氮等养分含量不同,土壤优势真菌门、纲、目的相对丰度也不同,说明土壤营养元素含量的变化导致了土壤真菌组成的变化[37],土壤真菌群落结构受到土壤养分含量的影响[38].有研究表明,土壤SOC是影响土壤真菌的主要因素[29,39],但本实验结果表明不同真菌与不同的土壤理化性质相关.间作地的速效钾、全氮含量最高,它的子囊菌门的相对丰度也最高,而担子菌门的相对丰度最低,RDA分析也表明土壤全氮、速效钾与子囊菌门呈正相关关系,速效磷不是影响子囊菌的主要因素,这与Lauber等[37]的研究结果磷的含量与子囊菌的丰度有密切关系相反.担子菌门与SOC、C/N呈负相关关系,可能是因为有的担子菌门,如白腐真菌可以分解木质素[37].同时,本研究还发现子囊菌门、担子菌门、接合菌门和壶菌门均与土壤容重呈负相关关系.此外,从相关分析和RDA分析还可以看出,土壤NH4+-N与未明确分类门呈正相关关系,有研究估计全世界的真菌种类约有150万,但至今被正式描述的不到10%[40],未明确分类的真菌值得进一步去研究发现.同时,有机肥料中的有机质成分通过改善土壤结构修复土壤肥力外,还能改变土壤真菌群落结构[38,41].本研究结果表明,间作地和苹果的有机碳、全氮、硝态氮含量高于玉米地,它们的真菌群落结构组成有差异,这可能是因为间作地和苹果地施用的农家有机肥大于玉米地,提高了土壤养分,影响了土壤基本理化性质、微生物群落结果的分布特征[42]以及土壤的微生物学性质[43].
4 结论
4.1 黄土高原不同种植类型梯田之间土壤真菌群落物种多样性相似,但真菌门、纲、种的组成和相对丰度不同:3种种植类型梯田土壤的优势真菌门主要为子囊菌门、担子菌门和接合菌门,而子囊菌门的相对丰度最大;主要真菌纲为粪壳菌纲、伞菌纲、散囊菌纲和座囊菌纲,相对丰度最大的为粪壳菌纲.
4.2 间作地和苹果地的土壤真菌Chao1、ACE、shannon、simpson指数均高于玉米地,子囊菌门和粪壳菌纲的相对丰度都在间作地最高,接合菌门的相对丰度在苹果地最高,而相对丰度最高的优势种种类在3种种植类型间各不相同.
4.3 土壤全氮和速效钾是影响子囊菌分布的关键因子,子囊菌门,担子菌门,接合菌门和壶菌门均受土壤容重的影响.
4.4 种植类型间因有机肥的施用不同而通过土壤理化性质的变化影响土壤真菌的群落组成,有机肥的施用可提高当地的土壤肥力.
[1] Zuazo V H D, Pleguezuelo C R R, Peinado F J M, et al. Environmental impact of introducing plant covers in the taluses of terraces: Implications for mitigating agricultural soil erosion and runoff [J]. Catena, 2011,84(s1–2):79-88.
[2] Kagabo D, Stroosnijder L, Visser S, et al. Soil erosion, soil fertility and crop yield on slow-forming terraces in the highlands of Buberuka, Rwanda [J]. Soil and tillage research, 2013,128: 23-29.
[3] 吴发启,张玉斌,宋娟丽,等.水平梯田环境效应的研究现状及其发展趋势 [J]. 水土保持学报, 2003,17(5):28-31.
[4] 马红斌,李晶晶,何兴照,等.黄土高原水平梯田现状及减沙作用分析 [J]. 人民黄河, 2015,37(2):89-93.
[5] Pietsch D, Mabit L. Terrace soils in the Yemen Highlands: Using physical, chemical and radiometric data to assess their suitability for agriculture and their vulnerability to degradation [J]. Geoderma, 2012,s185–186(1):48-60.
[6] 张 晶,张惠文,李新宇,等.土壤真菌多样性及分子生态学研究进展 [J]. 应用生态学报, 2004,15(10):1958-1962.
[7] Nair A, Ngouajio M. Soil microbial biomass, functional microbial diversity, and nematode community structure as affected by cover crops and compost in an organic vegetable production system [J]. Applied soil ecology, 2012,58(58):45-55.
[8] Brito I, Goss M J, De Carvalho M, et al. Impact of tillage system on arbuscularmycorrhiza fungal communities in the soil under Mediterranean conditions [J]. Soil and Tillage Research, 2012, 121(121):63-67.
[9] Wakelin S A, Colloff M J, Harvey P R, et al. The effects of stubble retention and nitrogen application on soil microbial community structure and functional gene abundance under irrigated maize [J]. FEMS microbiology ecology, 2007,59(3):661-670.
[10] Oh Y M, Kim M, Lee-cruz L, et al. Distinctive bacterial communities in the rhizoplane of four tropical tree species [J]. Microbial ecology, 2012,64(4):1018-1027.
[11] Altieri M A. The ecological role of biodiversity in agroecosystems [J]. Agriculture, Ecosystems & Environment, 1999,74(1):19-31.
[12] 井赵斌,程积民,张宝泉,等.基于454焦磷酸测序法的典型草原土壤真核生物多样性 [J]. 草业科学, 2013,30(11):1690-1697.
[13] Will C, Thrmer A, Wollherr A, et al. Horizon-specific bacterial community composition of German grassland soils, as revealed by pyrosequencing-based analysis of 16S rRNA genes [J]. Applied and Environmental Microbiology, 2010,76(20):6751-6759.
[14] Zeng Q, Dong Y, An S. Bacterial Community Responses to Soils along a Latitudinal and Vegetation Gradient on the Loess Plateau, China [J]. PloS one, 2016,11(4):e0152894.
[15] 刘 洋,曾全超,黄懿梅.基于454高通量测序的黄土高原不同乔木林土壤细菌群落特征[J]. 中国环境科学, 2016,36(11): 3487-3494.
[16] Zhang C, Liu G, Xue S, et al. Soil bacterial community dynamics reflect changes in plant community and soil properties during the secondary succession of abandoned farmland in the Loess Plateau [J]. Soil Biology & Biochemistry, 2016,(97):40-49.
[17] 尹承苗,王功帅,李园园,等.连作苹果园土壤真菌的T-RFLP分析 [J]. 生态学报, 2014,34(4):837-846.
[18] 温晓霞,殷瑞敬,高茂盛,等不同覆盖模式下旱作苹果园土壤酶活性和微生物数量时空动态研究 [J]. 西北农业学报, 2011,20(11):82-88.
[19] 何玉梅,张仁陟,张丽华,等.不同耕作措施对土壤真菌群落结构与生态特征的影响[J]. 生态学报, 2007,27(1):113-119.
[20] 于 寒,梁烜赫,张玉秋,等.不同秸秆还田方式对玉米根际土壤微生物及酶活性的影响 [J]. 农业资源与环境学报, 2015, 32(3):305-311.
[21] 张洪霞,谭周进,张祺玲,等.土壤微生物多样性研究的DGGEΠTGGE技术进展 [J]. 核农学报, 2009,23(4):721-727.
[22] Ferris M, Muyzer G, Ward D. Denaturing gradient gel electrophoresis profiles of 16S rRNA-defined populations inhabiting a hot spring microbial mat community [J]. Applied and Environmental Microbiology, 1996,62(2):340-346.
[23] Fromin N, Hamelin J, Tarnawski S, et al. Statistical analysis of denaturing gel electrophoresis (DGE) fingerprinting patterns [J]. Environmental Microbiology, 2002,4(11):634-643.
[24] 鲍士旦.土壤农化分析 [M]. 北京:中国农业出版社, 2000.
[25] 李 鑫,李娅芸,安韶山,等.宁南山区典型草本植物茎叶分解对土壤酶活性及微生物多样性的影响[J]. 应用生态学报, 2016,(10):3182-3188.
[26] Kennedy A, Smith K. Soil microbial diversity and the sustainability of agricultural soils [J]. Plant and soil, 1995, 170(1):75-86.
[27] 李 锐,刘 瑜,褚贵新.不同种植方式对绿洲农田土壤酶活性与微生物多样性的影响 [J]. 应用生态学报, 2015,26(2):490- 496.
[28] 陈丹梅,陈晓明,梁永江,等.种植模式对土壤酶活性和真菌群落的影响 [J]. 草业学报, 2015,24(2):77-84.
[29] Wang Z, Chen Q, Liu L, et al. Responses of soil fungi to 5-year conservation tillage treatments in the drylands of northern China [J]. Applied Soil Ecology, 2016,(101):132-140.
[30] Xu L, Ravnskov S, Larsen J, et al. Soil fungal community structure along a soil health gradient in pea fields examined using deep amplicon sequencing [J]. Soil Biology and Biochemistry, 2012,46(1):26-32.
[31] Degrune F, Dufr NE M, Colinet G, et al. A novel sub-phylum method discriminates better the impact of crop management on soil microbial community [J]. Agronomy for Sustainable Development, 2015,35(3):1157-1166.
[32] Hunter P R, Gaston M A. Numerical index of the discriminatory ability of typing systems: an application of Simpson's index of diversity [J]. Journal of clinical microbiology, 1988,26(11):2465-2466.
[33] Van Groenigen K-J, Bloem J, B TH E, et al. Abundance, production and stabilization of microbial biomass under conventional and reduced tillage [J]. Soil Biology and Biochemistry, 2010,42(1):48-55.
[34] Da Silva A P, Babujia L C, Franchini J C, et al. Soil structure and its influence on microbial biomass in different soil and crop management systems [J]. Soil and Tillage Research, 2014,142(1):42-53.
[35] 张社奇,王国栋,刘云鹏,等.黄土高原人工油松林地土壤微生物的分布特征 [J]. 激光生物学报, 2005,14(5):353-358.
[36] 褚洪龙,李 莎,唐 明.黄土高原油松根际土壤酶活性及真菌群落多样性研究—以黄龙山林场为例 [J]. 土壤学报, 2015, 52(1):154-161.
[37] Lauber C L, Strickland M S, Bradford M A, et al. The influence of soil properties on the structure of bacterial and fungal communities across land-use types [J]. Soil Biology and Biochemistry, 2008,40(9):2407-2415.
[38] 王 轶,李 季,曹志平,等.长期施肥对农田土壤真菌的影响 [J]. 中国生态农业学报, 2014,22(11):1267-1273.
[39] Liu J, Sui Y, Yu Z, et al. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of northeast China [J]. Soil Biology and Biochemistry, 2015,83:29-39.
[40] Hawksworth D L, Rossman A Y. Where are all the undescribed fungi? [J]. Phytopathology, 1997,87(9):888-891.
[41] Okoh A. Effect of long-term organic fertilizer application on soil microbial dynamics [J]. African Journal of Biotechnology, 2011,10(4):556.
[42] B Hme L, B Hme F. Soil microbiological and biochemical properties affected by plant growth and different long-term fertilisation [J]. European Journal of Soil Biology, 2006,42(1):1-12.
[43] Govi M, Francioso O, Ciavatta C, et al. Influence of long-term residue and fertilizer applications on soil humic substances: A study by electrofocusing [J]. Soil Science, 1992,154(1):8-13.
致谢:感谢师弟师妹的帮忙采样.感谢北京诺禾致源生物信息科技有限公司的测序和分析.
High-throughput sequencing sevealed soil fungal communities under three terrace agrotypes on the loess plateau.
XIAO Li, HUANG Yi-mei*, ZHAO Jun-feng, ZHOU Jun-ying, GUO Ze-hui, LIU Yang
(Key Laboratory of Plant Nutrition and The Agri-environment in Northwest China, Ministry of Agriculture, College of Natural Resource and Environment, Northwest A & F University, Yangling 712100, China)., 2017,37(8):3151~3158
Deep understanding of soil fungal communities and their relationships with soil physicochemical properties is of great importance for assessing soil fertility and environment effect, especially for terraces on the Loess Plateau. Soil fungal community composition and diversity was analyzed using the Hiseq high-throughput sequencing technology. Three typical crops soil (Corn field (CF), Apple field (AF) and Intercropping (apple and potatoes, IC) with similar terrace construction were chosen as experimental sites on Loess Plateau. The results showed among three sites, the number of the identified OTU ranged from 688 to 862 including 13 phylum, 87 class, 164 order, and the diversity index of the Chao1, ACE, Shannon and Simpson were all high in AF and IC than in CF. Three most abundant fungal taxa were Ascomycota, Basidiomycota and Zygomycota , with a highest relative abundance of Ascomycota found in IC, which mainly affected by the content of soil TN and AK. Composition of soil fungi was different for application of organic manure under terrace crop systems shifts soil fungi community composition by increased soil nutrient, and thus has potential to promote soil fertility in terrace agricultural ecosystem.
terrace;croptypes;high-throughput sequencing;soil fungi
X53,X172,S182
A
1000-6923(2017)08-3151-08
肖 礼(1990-),男,重庆人,西北农林科技大学,硕士研究生,主要从事生态环境工程研究.发表论文2篇.
2016-12-16
水利部公益性行业科研专项经费(201501045);国家自然科学基金资助项目(41101254)
* 责任作者, 副教授, ymhuang1971@nwsuaf.edu.cn

