白念珠菌氟康唑耐药株与敏感株SRB1、CDR1、ERG11表达比较分析
高来强 王海英 王学红 李爱兰 马强 张宏
(1.东营市人民医院皮肤科,东营 257091;2.暨南大学真菌病研究所,广州 510632)
·论著·
白念珠菌氟康唑耐药株与敏感株SRB1、CDR1、ERG11表达比较分析
高来强1王海英1王学红1李爱兰1马强1张宏2
(1.东营市人民医院皮肤科,东营 257091;2.暨南大学真菌病研究所,广州 510632)
目的 了解SRB1在白念珠菌氟康唑耐药株和敏感株表达差异,探讨与白念珠菌耐药性的关系。方法 使用同一亲本来源的白念珠菌氟康唑耐药株CA-16和敏感株CA-3为研究对象,采用实时荧光定量RT-PCR的方法扩增各菌株的目的基因SRB1、CDR1、ERG11,观察各菌株目的基因表达情况。结果 与白念珠菌氟康唑敏感株CA-3相比,在mRNA水平氟康唑耐药株CA-16的SRB1和耐药基因CDR1、ERG11表达升高,SRB1、CDR1、ERG11表达水平差异具有统计学意义 (P<0.05)。结论 白念珠菌SRB1的表达增高和白念珠菌对氟康唑耐药密切相关,SRB1可能是一个新的耐药候选基因。
白念珠菌;耐药;基因;PCR;SRB1
[Chin J Mycol,2017,12(3):148-151]
白念珠菌是皮肤黏膜的常见寄生菌之一,在正常情况下不发病,当致病性增强或宿主的免疫力损伤后可引发系统性念珠菌感染,在深部真菌病中白念珠菌导致的感染长期居于首位。目前,已有多种抗真菌药物广泛应用于临床,其中最有效的是三唑类药物,但随着唑类药物的应用,其临床耐药现象越来越普遍,耐药程度越来越高,从分子水平研究耐药机制是解决耐药问题、开发新药的有效途径。
从基因水平研究耐药机制是目前主要的研究手段,国内外关于白念珠菌耐药进行了广泛的研究。我们前期研究发现,汉防己甲素做为药物胁迫可下调白念珠菌氟康唑敏感株Srb1p[1],参与氟康唑抗白念珠菌的增效,srb1p是由SRB1翻译的参与细胞壁甘露聚糖合成的关键催化酶,1998年Warits等[2]对酿酒酵母SRB1进行了克隆及测序,这是对念珠菌SRB1首次系统性研究,考虑SRB1所处的位置及功能,结合既往发现,我们认为SRB1可能与白念珠菌耐药相关。因此,本文通过比较白念珠菌氟康唑耐药株和敏感株SRB1和耐药相关基因CDR1、ERG11表达差异,探讨SRB1与白念珠菌对氟康唑耐药的关系。
1 材料与方法
1.1 材料
菌株 菌株为白念珠菌氟康唑耐药株CA-16和白念珠菌敏感株CA-3,由美国西雅图生物医学研究所White教授惠赠。
主要试剂及仪器 The E.Z.N.A.TMYeast RNA Kit、cDNA逆转录Kit、SYBR Green Real time PCR Master Mix Kit、MiniOpticonTMReal-time PCR System (Bio-Rad)、LightCycler system software (Roche Diagnostics)。
1.2 方法
总RNA提取 常规活化白念珠菌,调整酵母细胞浓度至1.5×107,离心收集细胞。按照The E.Z.N.A.TMYeast RNA Kit说明提取,弃上清,加入2 mL SE/Lyticase混合溶液重悬浮沉淀,30℃孵育30 min,每10 min轻翻转试管1次。室温离心5 min,完全去除上清。沉淀加入350 μL YRL buffer/β-mercaptoethanol及50 mg玻璃珠,高速涡旋5 min裂解原生质体。离心3 min,上清转移至新离心管。上清加等体积70%乙醇涡旋15 s彻底混匀。将液体约700 μL转移至HiBind RNA mini column,放入2 mL collection tube,室温离心30 s,弃上清。加入500 μL的RNA wash buffer I到column,室温离心15 s,弃上清。置column到新2 mL collection tube,加入500 μL RNA wash buffer II,室温离心15 s,弃上清。wash buffer II用无水乙醇配。重复操作,加入500 μL RNA wash buffer II,室温离心15 s,弃上清。置column到新2 mL collection tube,室温离心1 min,弃上清干燥column。将column转移至1.5 mL EP管,加入50 μL DEPC水溶解,10 000 g离心1 min。收集样品分装备用,样品经1.5%琼脂糖凝胶电泳检测质量。
cDNA合成 将以上提取的RNA模板短暂离心后,将RNA模板2 μL,Oligo (dt)18 2 μL,RNase free dH2O 10 μL,各样品混合后于70℃水浴10 min;以上样品水浴后置冰上2 min,离心;反应体系:5XM-MLV Buffer 4 μL,dNTP (10 mmol/L)1 μL,RNase Inhibitor (40 U/μL)0.5 μL,RTase M-MLV (RNase H-)(200 U/μL)0.5 μL;于42℃水浴1 h,70℃保温15 min后冰上冷却;得到的cDNA溶液-20℃保存。
RT-PCR扩增 PCR反应体系为20 μL,按以下组份加入PCR反应管内,注意操作在冰上进行。PCR反应体系:2×SYBR Premix Ex Taq 10 μL+cDNA模板2 μL+dH2O 7.2 μL+基因上游引物 (10 μmol/L)0.4 μL+基因下游引物 (10 μmol/L)0.4 μL。PCR反应条件:95℃预变性10 s;PCR扩增定量程序:95℃变性10 s,55℃退火20 s,72℃延伸15 s,共40个循环。溶解曲线使用55℃~95℃,加热速率为每秒钟1℃。以18S rRNA作为内参标准,结果应用LightCycler system software version 3.5软件系统进行分析。菌株中各个基因的相对表达量用倍数变化来表示 (2-△△Ct法)。以敏感株CA-3中各个基因的表达量作为对照,计算耐药株CA-16的各个基因mRNA的相对表达量。引物设计根据文献[3]及使用Primer Premier 5.0软件,序列信息见表1。
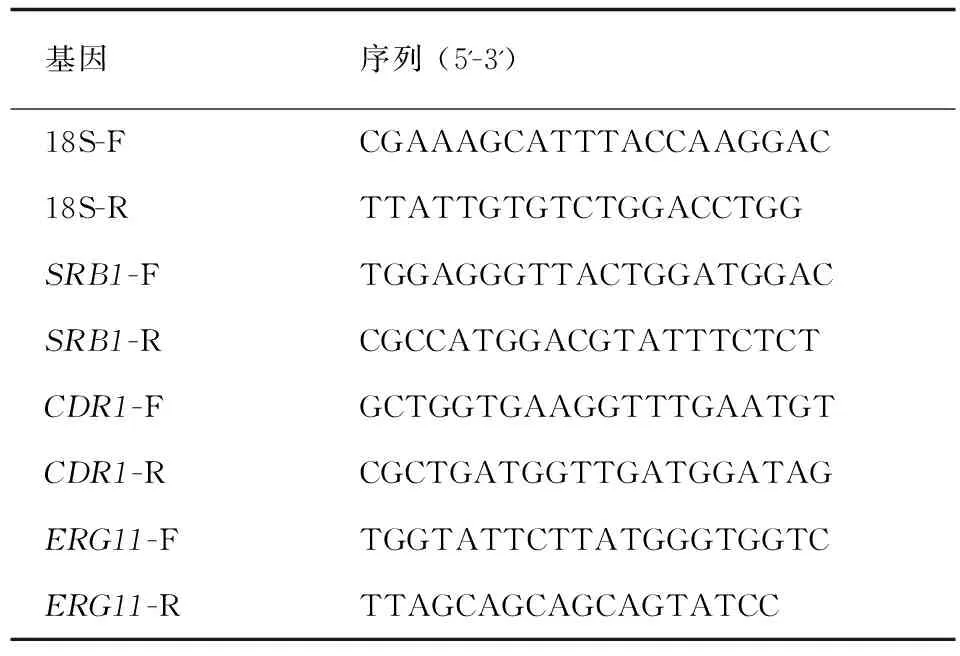
表1 内参基因和目的基因引物序列
1.3 统计学分析
实验重复3次,结果用 (均数±标准差)表示,各组间的数据采用独立t检验做统计学分析,统计软件用SPSS 19.0,P<0.05代表有统计学差异。
2 结 果
2.1 各目的基因表达图
基因表达图见图1。
2.2 各目的基因表达量值
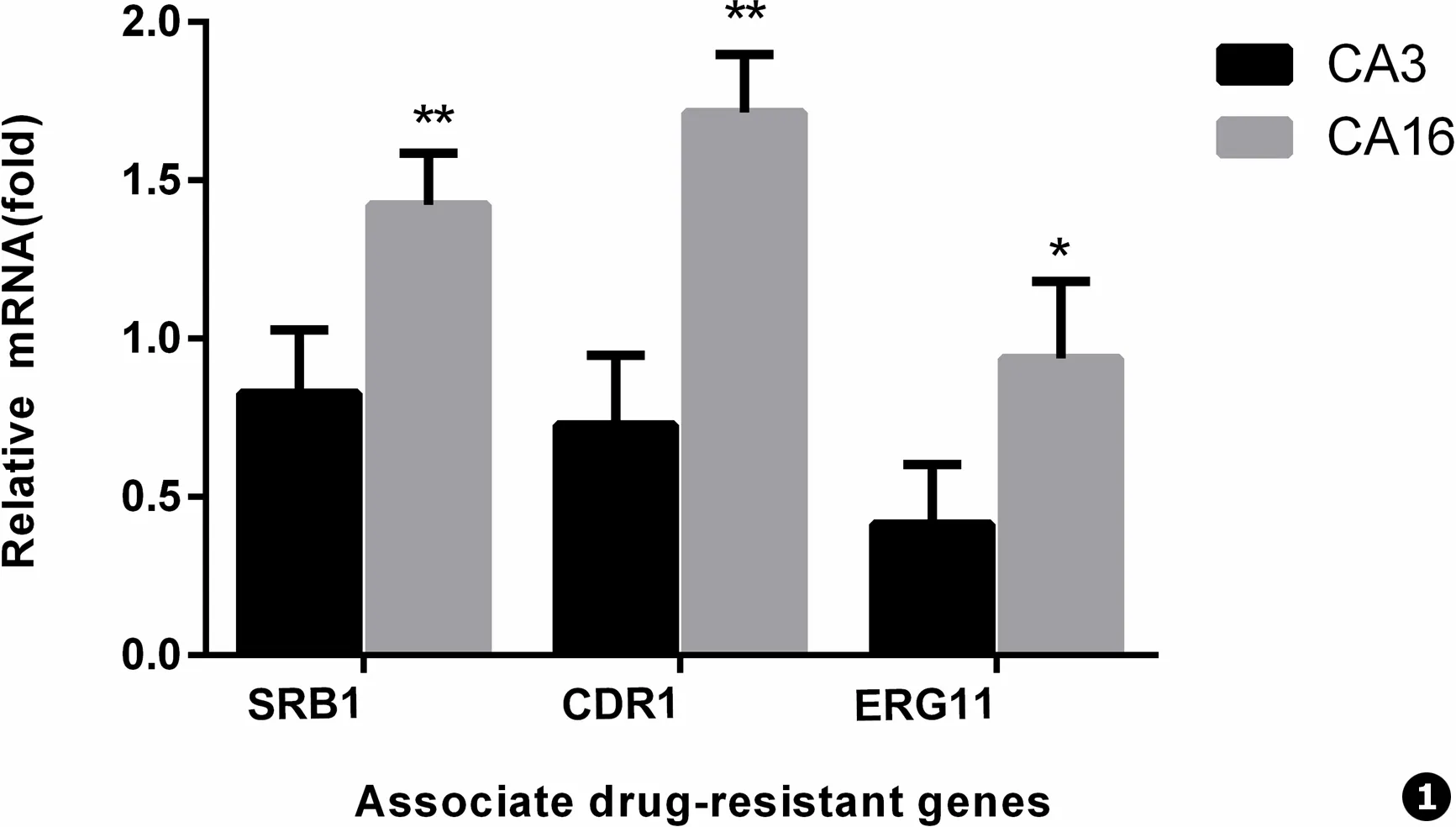
图1 白念珠菌SRB1、CDR1、ERG11 mRNA水平相对表达量,以白念珠菌氟康唑敏感株CA3为参照,各目的基因表达升高,差异具有统计学意义,*P<0.01,**P<0.001
Fig.1 The relative mRNA expression ofSRB1,CDR1,ERG11 in the CA-16,compared with those in the CA-3.Statistical significance of differences is indicated as follows:*P<0.01,**P<0.001
经SPSS 19.0软件统计分析后,各目的基因的mRNA水平相对量化及比较结果,见表2、3。
表2 白念珠菌耐药株和敏感株各目的基因相对表达量值
Tab.2 The relative mRNA expression levels of genes in the CA-3 and CA-16 strains

SRB1CDR1ERG11CA-30.827±0.2010.728±0.2190.415±0.187CA-161.423±0.1621.714±0.1830.937±0.244
表3 白念珠菌耐药株和敏感株各目的基因的表达量独立t检验的比较
Tab.3 The values of relative mRNA expression of target genes between groups were analyzed by independent samplettest
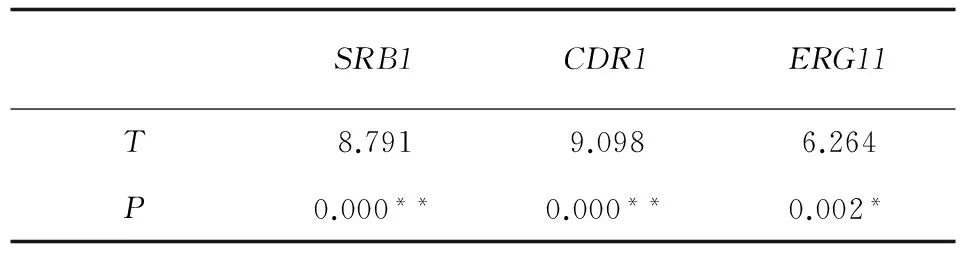
SRB1CDR1ERG11T8.7919.0986.264P0.000**0.000**0.002*
注:*P<0.01,**P<0.001
3 讨 论
RT-PCR是目前最成熟、应用最广泛的用于检测细胞或组织中基因表达水平的技术,具有步骤较少、耗时短、灵敏度高等特点,可用于多样本、多基因的检测。我们前期研究中使用了RT-PCR方法发现汉防己甲素30 μg/mL作用24 h后,可抑制白念珠菌药物外排泵基因CDR1、CDR2、MDR1、FLU1的表达[4],推测汉防己甲素在体外对氟康唑抗白念珠菌活性增效作用的分子机制与抑制药物外排泵基因MDR1、FLU1、CDR1、CDR2的表达均有关。
成功进行RT-PCR的关键是提取的总RNA中没有RNA酶和基因组DNA的污染,由于白念珠菌有坚硬的细胞壁,使用传统的Trizol法提取效率差、容易降解,而硅胶柱法提取的总RNA具有高产量、高纯度、没有DNA和蛋白质的污染的特点,因此我们选用硅胶柱法提取总RNA,提取的总RNA经1.5%琼脂糖凝胶电泳图谱分析,及紫外分光光度计测定OD260/OD280比值,结果显示RNA纯度较高、完整性较好、无蛋白质污染,适合做后续的实验。为了研究的准确性,本研究在相同条件下进行3次平行实验,并以其看家基因18S作为内参基因进行校正,最终结果中某些基因的表达符合以往研究[3-4],因此本实验采用RT-PCR的方法是可靠的。
外界刺激作用于细胞可诱导细胞产生应激反应,抗真菌药物做为外界刺激作用于白念珠菌,同样会产生应激反应,当抗真菌药物不能杀死细胞时,这种应激反应会产生耐药现象,有研究表明药物既可以诱发耐药性也可以引发应激反应,应激反应也可激活耐药相关基因[5-6]。
SRB1翻译的GDP-mannose pyrophosphorylase催化甘露糖-1-磷酸和GTP生成GDP-甘露糖[7],通过合成细胞壁主要结构成分甘露聚糖稳定细胞形态,还可通过糖基修饰影响细胞整体功能[8]。SRB1或srb1p的表达水平与其生长环境有关,在pH 8的碱性环境中,SRB1的表达上调,pH 4时未见到表达水平的变化[9],同样在培养基中放入重金属镉时,也诱导了白念珠菌SRB1表达的改变[10]。SRB1是酿酒酵母生长的关键基因[11],下调或敲除酿酒酵母SRB1可显著影响细胞壁完整性,导致絮凝、结构异常,甚至细胞溶解[12],值得注意的是下调SRB1增强了对抗真菌药物的敏感性[13],作为一个高度保守的基因,白念珠菌SRB1与酿酒酵母的SRB1同源率达到90%[2]。因此,我们认为白念珠菌SRB1同样参与外界应激信号的响应,进而参与白念珠菌致病及耐药的发生。
在我们前期研究中已经证实[14],白念珠菌耐药株及敏感株srb1p存在差异,在汉防己甲素对白念珠菌氟康唑敏感株作用前后srb1p表达也存在差异[1],由于细胞在基因水平和蛋白质水平的调控和修饰过程并不一致,差异表达的基因并不一定有差异表达的蛋白质,同时检索文献发现,在以往的研究中并没有对SRB1与白念珠菌耐药的关系做过系统研究,因此本研究从mRNA水平检测白念珠菌氟康唑耐药株和敏感株之间是否有SRB1差异表达,同时检测耐药基因CDR1、ERG11的表达,探讨SRB1在白念珠菌耐药机制中的可能作用。
结果显示,与白念珠菌敏感株CA-3相比,氟康唑耐药株CA-16的SRB1和耐药基因CDR1、ERG11的mRNA水平的表达升高,表达水平差异具有统计学意义 (P<0.05)。在转录水平和转录后水平我们都检测到SRB1在氟康唑耐药株中表达变化,提示SRB1和白念珠菌对氟康唑耐药密切相关。
我们推测,白念珠菌耐药性的形成,一般都是为了适应药物压力或在应激条件下生存而产生的一种适应性变化,这种变化必然需要大量能量来维持,在白念珠菌中两条主要的能量代谢途径是糖酵解和有氧呼吸,白念珠菌为了生存,这两条生成能量的途径会加强,然而大部分情况下,氧气的供应是不充足的,也就是说糖酵解途径应该在耐药形成过程中占主导作用,这也在氟康唑耐药株与敏感株差异膜蛋白质组学中得到证实[7]。糖酵解活化阶段产生了果糖-6-磷酸,从而进入糖酵解下游途径,产生大量ATP,而果糖-6-磷酸也是Srb1p催化合成GDP-甘露糖生物过程的中间产物,为了维持菌体生存,菌体一切代谢活动优先让位能量代谢,共同维持糖酵解的能量生成。
另外,在耐药性的维持阶段,白念珠菌主要耐药机制之一是细胞膜外排泵蛋白质高表达导致多种细胞内的药物排出细胞外,这类转运蛋白质家族,有类似的结构和功能,通过水解ATP提供能量,外排泵蛋白质表达增强主要是通过CDR1、CDR2表达水平增高实现的,这类泵蛋白质功能增强需要更多能量维持,在RT-PCR结果中,SRB1在耐药株中高表达,为了维持耐药性,SRB1参与的甘露糖合成必然提供更多果糖-6-磷酸合成ATP,提示SRB1与CDR1有某种联系,SRB1和CDR1可能在同一条通路上共同参与白念珠菌耐药性的形成。
细胞在应激刺激下导致细胞形态结构异常,以此对抗外界环境变化,白念珠菌细胞壁与细胞膜紧密相连,位于细胞壁的SRB1与ERG11具有结构上的紧密性,药物做为一种外源性刺激同样会导致SRB1异常表达,而结果中SRB1与ERG11表达差异同样具有统计学意义,细胞膜在胁迫刺激下会导致细胞膜成份分布或含量变化,因此我们推测SRB1也与ERG11之间存在着联系,与耐药的发生密切相关。
我们也观察到SRB1在mRNA水平与蛋白质水平表达不一致现象,除去蛋白质表达比mRNA表达滞后性因素外,主要认为srb1p参与的蛋白质糖基化修饰导致蛋白质亚细胞结构改变影响了蛋白质的丰度,结合文献分析及研究结果,我们认为对SRB1的研究将是一个有价值的研究方向,特别是对理解白念珠菌耐药机制的形成和抗真菌药物的研发提供有意义的线索。
[1] 高来强,张宏,张晓利,等.白念珠菌经汉防己甲素作用前后的差异蛋白质组学分析[J].中华皮肤科杂志,2011,44(8):560-563.
[2] Warit S,Walmsley RM,Stateva LI.Cloning and sequencing of theCandidaalbicanshomologue of SRB1/PSA1/VIG9,the essential gene encoding GDP-mannose pyrophosphorylase inSaccharomycescerevisiae[J].Microbiology,1998,144(Pt 9):2417-2426.
[3] Guo H,Zhang XL,Gao LQ,et al.Alcohol dehydrogenase I expression correlates with CDR1,CDR2 and FLU1 expression inCandidaalbicansfrom patients with vulvovaginal candidiasis[J].Chin Med J (Engl),2013,126(11):2098-2102.
[4] Zhang H,Gao AL,Li FX,et al.Mechanism of action of tetrandrine,a natural inhibitor ofCandidaalbicansdrug efflux pumps[J].Yakugaku Zasshi,2009,129(5):623-630.
[5] 贾健辉,王彦,姜远英.活性氧以Cap1p依赖的方式激活白念珠菌CaMDR1转录表达[J].第二军医大学学报,2007,28(7):737-739.
[6] Alarco AM,Raymond M.The bZip transcription factor Cap1p is involved in multidrug resistance and oxidative stress response inCandidaalbicans[J].J Bacteriol,1999,181(3):700-708.
[7] Ohta A,Chibana H,Arisawa M,et al.The VIG9 gene products from the human pathogenic fungiCandidaalbicansandCandidaglabrataencode GDP-mannose pyrophosphorylase[J].Biochim Biophys Acta,2000,1475(3):265-272.
[8] Mora-Montes HM,Bates S,Netea MG,et al.A multifunctional mannosyltransferase family inCandidaalbicansdetermines cell wall mannan structure and host-fungus interactions[J].J.Biol,Chem,2010,285(16):12087-12095.
[9] Bensen ES,Martin SJ,Li M,et al.Transcriptional profiling inCandidaalbicansreveals new adaptive responses to extracellular pH and functions for Rim101p[J].Mol Microbiol,2004,54(5):1335-1351.
[10] Yin Z,Stead D,Walker J,et al.A proteomic analysis of the salt,cadmium and peroxide stress responses inCandidaalbicansand the role of the Hog1 stress-activated MAPK in regulating the stress-induced proteome[J].Proteomics,2009,9(20):4686-4703.
[11] Hashimoto H,Sakakibara A,Yamasaki M,et al.SaccharomycescerevisiaeVIG9 encodes GDP-mannose pyrophosphorylase,which is essential for protein glycosylation[J].J Biol Chem,1997,272(26):16308-16314.
[12] Tomlin GC,Hamilton GE,Gardner DC,et al.Suppression of sorbitol dependence in a strain bearing a mutation in the SRB1/PSA1/VIG9 gene encoding GDP-mannose pyrophosphorylase by PDE2 overexpression suggests a role for the Ras/cAMP signal-transduction pathway in the control of yeast cell-wall biogenesis[J].Microbiology,2000,146(Pt9):2133-2146.
[13] Warit S,Zhang N,Short A,et al.Glycosylation deficiency phenotypes resulting from depletion of GDP-mannose pyrophosphorylase in two yeast species[J].Mol Microbiol,2000,36(5):1156-1166.
[14] 张晓利,高来强,吴喜福,等.白念珠菌对氟康唑耐药的差异性膜蛋白质组学分析[J].中华皮肤科杂志,2013,46(4):262-265.
[本文编辑] 王 飞
Analysis of expression ofSRB1、CDR1、ERG11 in fluconazole sensitive and resistantCandidaalbicansstrains
GAO Lai-qiang1,WANG Hai-ying1,WANG Xue-hong1,LI Ai-lan1,MA Qiang1,ZHANG Hong2
(1.DepartmentofDermatology,DongyingPeople'sHospital,Dongying257091;2.InstituteofMycology,JinanUniversity,Guangzhou510632,China)
Objective To investigate the differences in the expression ofCandidaalbicansSRB1 inCandidaalbicansfluconazol resistant strain and sensitive strain,and to explore the relationship betweenSRB1 and drug resistance inCandidaalbicans.Methods TwoCandidaalbicansstrains were from a same parent.We used real-time RT-PCR to observe the expression of the target genes ofSRB1,CDR1,ERG11 inCandidaalbicansfluconazole resistant strain CA-16 and sensitive strain CA-3.Result Compared with CA-3,the expression of the mRNA ofSRB1 and drug resistance geneCDR1,ERG11 in CA-16 increased.There was significant difference in the expression levels ofSRR1、CDR1andERG11 (P<0.05).Conclusion The increased expression ofSRB1 and theCandidaalbicansresistance to fluconazole was closely related,andSRB1 might be a new candidate genes associated with drug resistance.
Candidaalbicans;drug resistance;gene;PCR;SRB1
山东省自然科学基金项目 (ZR2015PH061)
高来强,男 (汉族),硕士,主治医师.E-mail:GLQ789@163.com
R 379.4
A
1673-3827(2017)12-0148-04
2017-02-15

