耐寡营养高效解磷菌株XMT-5的分离鉴定及解磷特性
李海峰,张月阳,曹 健,屈建航,田海龙
(1.河南工业大学 生物工程学院,河南 郑州 450001; 2.中原工学院,河南 郑州 450007)
耐寡营养高效解磷菌株XMT-5的分离鉴定及解磷特性
李海峰1,张月阳1,曹 健2,屈建航1,田海龙1
(1.河南工业大学 生物工程学院,河南 郑州 450001; 2.中原工学院,河南 郑州 450007)
为获得更加适应寡营养的自然环境条件的解磷菌株,以1/4蒙金娜培养基从土壤中分离筛选高效解磷菌株,并对其进行鉴定,分析其生长条件及解磷机制。结果表明,从土壤中共分离获得解磷菌9株,通过对解磷量的定量测定确定高效解磷菌株XMT-5,其最大解磷量为195.63 mg/L;从菌落特征、生理生化特性及16S rRNA基因序列分析三方面鉴定菌株XMT-5为根瘤菌(Rhizobiumsp.);菌株XMT-5在寡营养条件下可以分泌柠檬酸、酒石酸和乙酸3种有机酸,从而可使培养液pH值下降;菌株XMT-5可在温度4~42 ℃、pH值4~10、NaCl质量浓度0~80 g/L以及寡营养条件下生长,环境适应能力较强,具有良好的应用前景。
寡营养; 解磷菌; 解磷特性; 生物磷肥
磷是植物生长不可或缺的三大要素之一。随着化肥在世界范围内的普遍使用,土壤中的磷含量已达到400~1 200 mg/kg[1]。但是,看似丰富的磷元素却通常以植物难以吸收利用的不溶性金属化合物形态存在。在酸性土壤中,磷酸根一般与铁、铝和镁等离子结合[2],而在碱性土壤中则主要以磷酸钙等形态存在[3]。除了少部分含磷有机化合物以外,土壤中可供植物直接利用的磷只有1 mg/kg,甚至更少[1]。因此,为了保证农作物的产量,化肥的生产与使用量不断增加,土壤中的磷化合物也被动地连年累积,而作物可利用的磷形态却未有效增加。但是,化肥的过度施用在造成资源浪费的同时也导致了土壤质量恶化及环境污染问题[3-5]。因此,研究者一直致力于开发更加环保而且高效的磷肥类型,而对解磷菌的发现和深入了解,为新型生物磷肥的生产提供了新的希望。
解磷菌能够将植物难以吸收利用的不溶性磷转化为容易吸收利用的可溶性磷[6],在促进植物生长与磷吸收的同时[7-8],还能够帮助植物逐渐适应酸性、缺磷等不良环境[9-11]。目前,最为认可的一种解磷机制是解磷菌通过向环境中分泌小分子量的有机酸与金属离子螯合,从而把磷酸根释放出来成为溶解态磷[12]。目前,已报道的解磷细菌种类很丰富,包括芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas)、根瘤菌(Rhizobium)、土壤杆菌(Agrobacterium)、微球菌(Micrococcus)、黄杆菌(Flavobacterium)、欧文氏菌(Erwinia)、沙雷氏菌(Serratia)和克雷伯氏菌(Klebsiella)等[9,11],解磷量一般为8.7~519.5 mg/L[12-13]。除细菌以外,近年来陆续发现了具有解磷能力的真菌和放线菌[1],而真菌的解磷能力普遍比较强,解磷量能够达到181.42~956.00 mg/L[14-15]。解磷真菌的种类相对较少,主要包括青霉(Penicillium)、曲霉(Aspergillus)和根霉(Rhizopus);能够解磷的放线菌一般都是链霉菌(Streptomyces)[9],解磷量为29.67~73.94 mg/L[1,16]。
由于解磷菌具有有效解磷、促植物生长能力以及不易导致环境污染与资源浪费等优势,以往很多科学工作者一直致力于开发解磷菌剂以制备更高效的生物磷肥来改善目前的不良状况。但是,到目前为止,解磷菌剂的应用还存在一些问题:实验室中对解磷菌的培养条件与自然土壤的环境条件差别太大,培养基中的营养成分非常丰富,导致解磷菌在土壤这样相对寡营养的条件下不能很好地发挥作用。所以大多数解磷菌剂在实际应用中的促生长与改善土壤结构的效果还不尽人意。因此,本研究在接近自然环境的寡营养条件下分离筛选解磷能力较好且环境适应性较强的高效菌株,并对其进行鉴定及解磷机制分析,以期为高效解磷菌剂的开发以及土壤肥力的提高提供优良的菌种资源。
1 材料和方法
1.1 材料
1.1.1 土样 样品采集自郑州市田间含解磷菌数量比较丰富的小麦根际土壤。
1.1.2 培养基 1/4蒙金娜固体培养基(筛选培养基):葡萄糖2.5 g、(NH4)2SO40.125 g、NaCl 0.075 g、KCl 0.075 g、MgSO4·7H2O 0.075 g、Ca3(PO4)22.5 g、FeSO4·7H2O 7.5 mg、MnSO4·4H2O 7.5 mg、琼脂18 g,加蒸馏水溶解并定容至1 L,pH值7.2,设定此培养条件为寡营养条件。
1/4蒙金娜液体培养基:同1/4蒙金娜固体培养基(不添加琼脂)。
活化培养基(1/10 LB培养基):酵母粉0.5 g、蛋白胨1.0 g、NaCl 1.0 g,加蒸馏水溶解并定容至1 L,pH值7.2。
1.2 方法
1.2.1 菌悬液的制备与涂布 取0.5 g土样样品加入45 mL无菌水中,分别制成10-1、10-2、10-3、10-4等稀释度的菌悬液,每个稀释度取200 μL菌悬液在1/4蒙金娜固体培养基上涂布均匀,每个稀释度设3个平行。 将涂布好的平板置于28 ℃恒温培养箱中培养5~6 d,观察平板中菌落及透明圈的产生情况。
1.2.2 高效解磷菌株的筛选 将能产生透明圈的菌株在1/4蒙金娜固体平板上划线纯化,并分别标记为XMT-1、XMT-2、XMT-3、…,分别挑取各菌株的单菌落一环至1/4蒙金娜液体培养基中,28 ℃、160 r/min振荡培养72 h,取1 mL菌悬液于6 000 r/min离心10 min,吸取上清液200 μL,采用钼锑抗比色法[17]检测可溶性磷含量,并以不接种解磷菌的空白培养基为对照,选取解磷量最大的菌株作为高效解磷菌株。
1.2.3 高效解磷菌株的鉴定
1.2.3.1 高效解磷菌株的形态观察及生理生化特性分析 将所得高效菌株于1/4蒙金娜固体培养基上划线,28 ℃恒温培养24 h,得到单菌落并观察形态,常规的生理生化鉴定参照《常见细菌系统鉴定手册》[18]进行。
1.2.3.2 高效解磷菌株的16S rRNA基因序列分析及系统发育树构建 细菌总DNA采用DNA提取试剂盒提取。扩增引物为16S rRNA基因通用引物,27F:5′-AGAGTTTGATCCTGGCTCAG-3′、1492R:5′-CTACGGCTACCTTGTTACGA-3′。对16S rRNA基因进行克隆、测序与比对[19],并利用MEGA 3.1[20]以Neighbor-joining法[21]构建系统发育树。
1.2.4 高效解磷菌株XMT-5的生长特性 将处于对数期的菌株XMT-5接种到含有100 mL pH值分别为4、5、6、7、8、9、10,温度分别为4、15、20、28、37、42 ℃,NaCl质量浓度分别为0、10、30、50、80、100 g/L的1/4蒙金娜液体培养基中,在28 ℃、160 r/min条件下培养48 h,然后用分光光度计测定OD600,每个样品设置3个平行,计算平均值,研究寡营养条件下高效解磷菌株XMT-5对生长环境的适应能力。
1.2.5 高效解磷菌株XMT-5的解磷能力及培养液pH值变化情况 挑取生长24 h的菌株XMT-5的单菌落一环至100 mL 1/4蒙金娜液体培养基中,28 ℃、160 r/min振荡培养6 d,每天取5 mL菌液,于6 000 r/min离心10 min,吸取上清液200 μL,检测可溶性磷含量,其余上清液用于测定pH值,考察解磷量、溶液pH值随培养时间的变化情况。
1.2.6 高效解磷菌株XMT-5分泌有机酸的种类 取10 μL于1.2.5培养条件下产酸量最大时的菌液,6 000 r/min离心10 min,上清液经0.22 μm的微孔滤膜过滤,然后用高效液相色谱仪(美国岛津Waters 475,紫外检测器Waters 487)进行有机酸种类的测定,色谱条件为:分析柱C18,规格为4.6 mm×250 mm,检测波长为210 nm,流动相为pH值2.75的0.01 mol/L KH2PO4缓冲液,流速设置为1.0 mL/min,柱温为25 ℃[22]。
2 结果与分析
2.1 高效解磷菌株的筛选
在寡营养条件下,共筛选出具有解磷能力的菌株9株,各菌株的解磷情况如图1所示。其中,菌株XMT-5、XMT-6、XMT-16的解磷能力较好,解磷量分别为183.45、164.46、157.85 mg/L,解磷能力明显高于其他菌株,具有较好的解磷潜力。因此,确定菌株XMT-5为高效解磷菌株,用于后续研究。
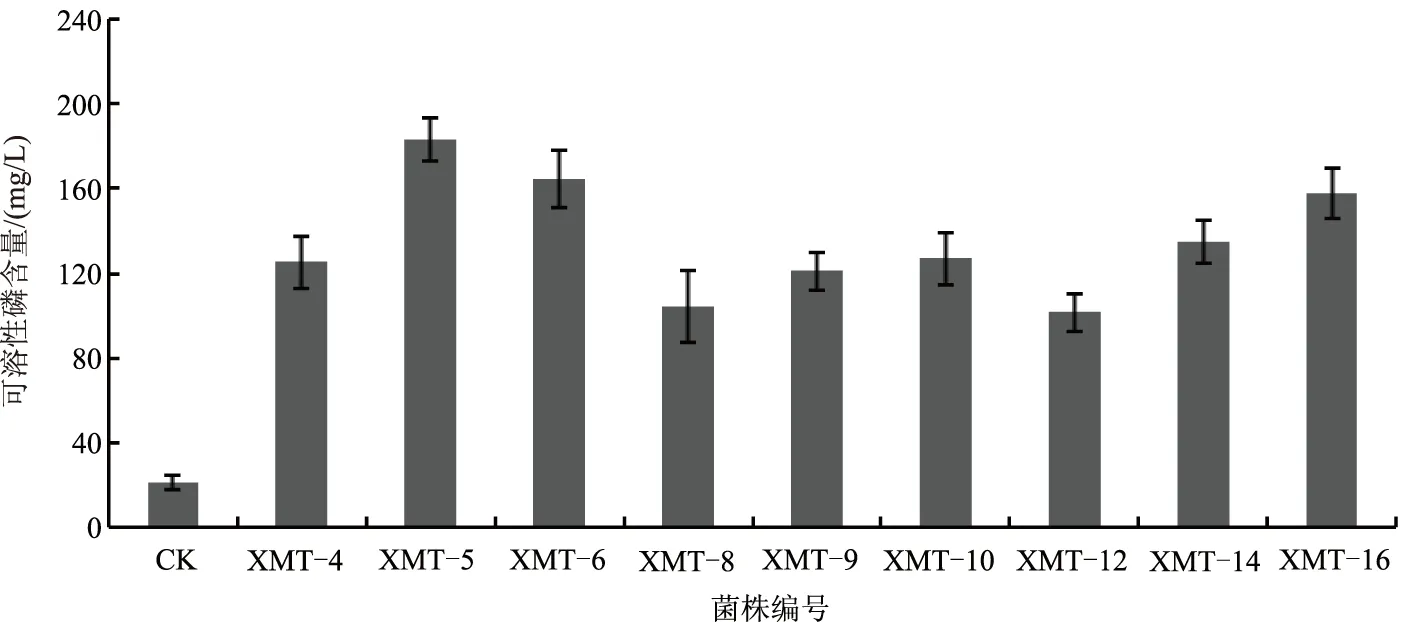
图1 耐寡营养解磷菌的定量筛选结果
2.2 菌株XMT-5的鉴定
本研究结合菌株XMT-5的菌落形态、生理生化特性和16S rRNA 基因序列综合对其进行鉴定。菌株XMT-5的菌落为白色、圆形、湿润、半透明,黏稠,甲基红试验、VP试验与柠檬酸盐利用试验结果均为阴性,可以产吲哚并水解明胶。碳源利用方面结果表明,其可利用葡萄糖、蔗糖、半乳糖、木糖和山梨糖,但不能利用乳糖。通过对菌株16S rRNA 基因的克隆,获得1 362 bp的序列(已提交至GenBank数据库,登录号为KR653316),比对结果表明,其与根瘤菌(Rhizobiumsp.) 的16S rRNA 基因序列同源性达到100%,且系统发育树的结果(图2)也显示,菌株XMT-5与根瘤菌属的菌株聚在一起,所以确定菌株XMT-5为根瘤菌(Rhizobiumsp.)。
2.3 菌株XMT-5的生长特性
由图3—5可知,在寡营养条件下,菌株XMT-5在温度4~42 ℃、pH值4~10、NaCl质量浓度0~80 g/L的条件下均可生长,其最适生长条件为温度37 ℃、pH值5~9、NaCl质量浓度0~10 g/L。表明该菌株有较广泛的温度适应范围,而大多数菌株很难在低于10 ℃的条件下生长[23],另外,能够耐受40 ℃以上高温的解磷菌株是在一些特殊土壤环境中用于生物解磷的必要基础[24];该菌株对酸碱度以及盐度的耐受能力也比较好。因此,将该菌株在寡营养条件下培养驯化之后应该更有利于适应营养相对贫乏的土壤等环境。
2.4 菌株XMT-5的解磷能力及培养液pH值变化情况
由图6可知,在寡营养条件下,菌株XMT-5的解磷能力随培养时间增加呈上升—平稳—上升—下降的趋势,在1 d内解磷量迅速上升到188.01 mg/L,随后的几天时间内,解磷量变化幅度不大;在培养5 d时解磷量达到最大值,为195.63 mg/L;到培养6 d时,解磷量稍有降低,为184.45 mg/L。随着培养时间增加,培养液的pH值先总体降低后稍微增加,这与菌株XMT-5的解磷能力变化趋势大体相反。大量研究表明,随着培养时间的延长,溶液pH值降低,解磷量也随之增大[25-26],本研究结果与之部分相符,培养液pH值在培养1 d大幅度降低,解磷量大幅度提高,之后总体变化不大。另外,在营养物质相对稀少的培养条件下,菌株XMT-5的解磷量与已报道的一些解磷菌株的能力(4.04~185.63 mg/L)相比亦不逊色[22]。当然,与目前所报道的高效菌株的解磷量(400.0~519.7 mg/L)相比,尚有一定的差距[13],这可能也与所设置的寡营养条件有关系。
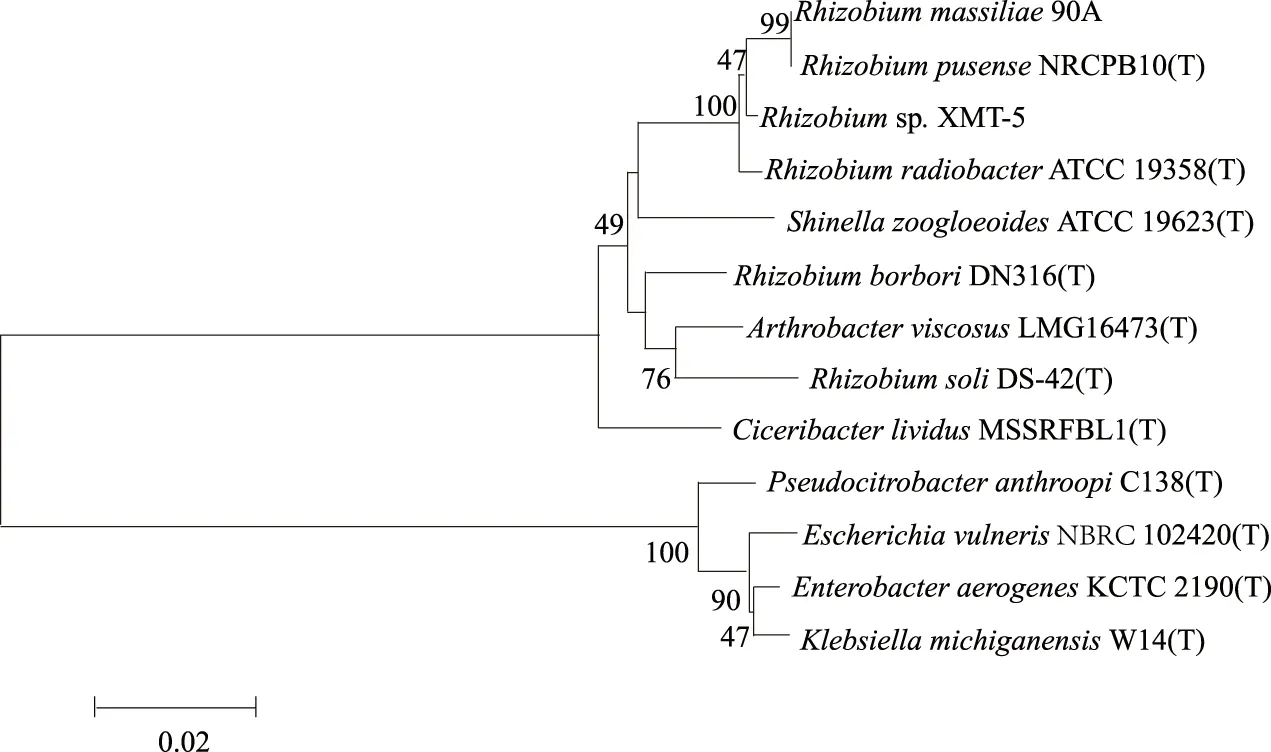
图2 菌株XMT-5基于16S rRNA基因序列的系统发育树
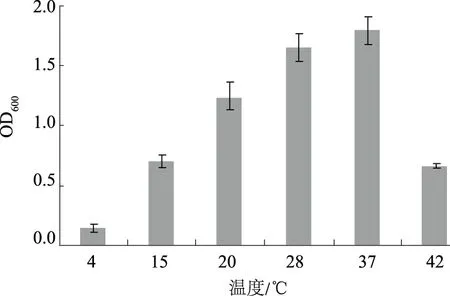
图3 温度对菌株XMT-5生长的影响
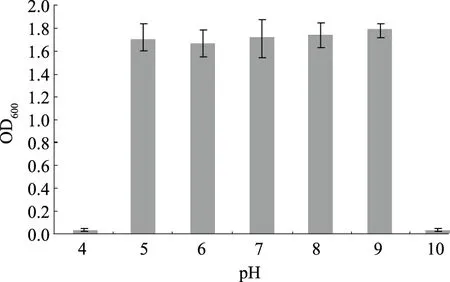
图4 pH值对菌株XMT-5生长的影响
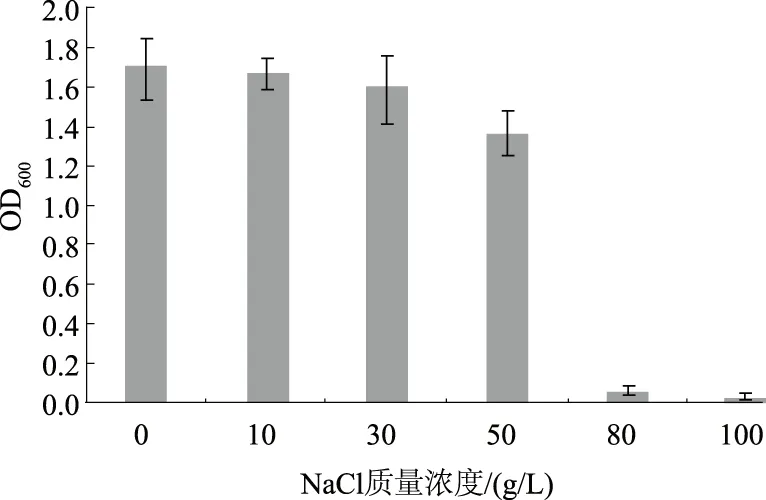
图5 NaCl质量浓度对菌株XMT-5生长的影响
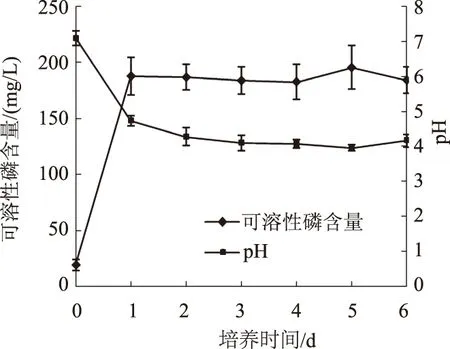
图6 菌株XMT-5在不同培养时间的解磷情况及培养液pH值变化情况
2.5 菌株XMT-5分泌有机酸的种类
经测定发现,菌株XMT-5主要分泌3种有机酸,分别为酒石酸、柠檬酸和草酸,所占比例分别为55.47%、22.68%和21.85%。目前研究普遍认为,解磷菌的解磷机制与其向环境中分泌的有机酸有关[13-14,27]。但是,有机酸对难溶性磷的活化作用不仅取决于有机酸的数量还决定于有机酸的种类,草酸和柠檬酸对各种难溶性磷源的解磷效果较好[13,28]。因此,菌株XMT-5在寡营养条件下的解磷效果应该与其向胞外分泌的有机酸种类有关。
3 结论
本研究以1/4蒙金娜固体培养基分离筛选到耐寡营养的高效解磷菌株XMT-5,经鉴定其为根瘤菌(Rhizobiumsp.)。该菌株的最适生长条件为:温度37 ℃、pH值5~9、NaCl质量浓度0~10 g/L,培养5 d时解磷量达到最大,为195.63 mg/L。另外,菌株XMT-5在温度4~42 ℃、pH值4~10、NaCl质量浓度0~80 g/L的条件下均可生长,环境适应能力较强,经过寡营养条件驯化后有较好的应用潜力。该菌株可以分泌酒石酸、柠檬酸和草酸,这可能是其解磷的一种机制。
[1] Hamdali H,Bouizgarne B,Hafidi M,etal.Screening for rock phosphate solubilizing Actinomycetes from Moroccan phosphate mines [J].Applied Soil Ecology,2008,38:12-19.
[2] Whitelaw M A.Growth promotion of plants inoculated with phosphate solubilizing fungi [J].Advances in Agronomy,2000,69:99-144.
[3] Gyaneshwar P,Kumar G N,Parekh L J,etal.Role of soil microorganisms in improving P nutrition of plants [J].Plant and Soil,2002,245(1):83-93.
[4] Reddy M S,Kumar S,Khosla B.Biosolubilization of poorly soluble rock phosphates byAspergillustubingensisandAspergillusniger[J].Bioresource and Techonology,2002,84:187-189.
[5] Bayer C,Martin-Neto L,Mielniczuk J,etal.Changes in soil organic matter fractions under subtropical no-till cropping systems[J].Soil Science Society of America Journal,2001,65(5):1473-1478.
[6] Oliveira C A,Alves V,Marriel I E,etal.Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome[J].Soil Biology & Biochemistry,2009,41(9):1782-1787.
[7] Hameeda B,Harini G,Rupela O P,etal.Growth promotion of maize by phosphate solubilizing bacteria isolated from composts and macrofauna[J].Microbiological Research,2008,163(2):234-242.
[8] Kaur G,Reddy M S.Effects of phosphate-solubilizing bacteria,rock phosphate and chemical fertilizers on maize-wheat cropping[J].Pedosphere,2015,25(3):428-437.
[9] Zaidi A,Khan M S,Ahemad M,etal.Plant growth promotion by phosphate solubilizing bacteria[J].Acta Microbiologicaet Immunologica Hungarica,2009,56(3):263-284.
[10] Wani P A,Khan M S,Zaidi A.Co-inoculation of nitrogen fixing and phosphate solubilizing bacteria to promote growth,yield and nutrient uptake in chickpea [J].Acta Agronomic Academiae Scientiarum Hungaricae,2007,55:315-323.
[11] 金术超,杜春梅,平文祥,等.解磷微生物研究进展[J].微生物学杂志,2006,26(2):73-76.
[12] Chen Y P,Rekha P D,Arun A B,etal.Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities [J].Applied Soil Ecology,2006,34(1):33-41.
[13] Pereira S I A,Castro P M L.Phosphate-solubilizing rhizobacteria enhanceZeamaysgrowth in agricultural P-deficient soils [J].Ecological Engineering,2014,73:526-535.
[14] 史发超,殷中伟,江红梅,等.一株溶磷真菌筛选鉴定及其溶磷促生效果[J].微生物学报,2014,54(11):1333-1343.
[15] 范丙全,金继运,葛诚.溶磷草酸青霉筛选及其溶磷效果的初步研究[J].中国农业科学,2002,35(5):525-530.
[16] 张炳火,李汉全,罗娟艳,等.放线菌JXJ-0136对白菜和豇豆生长的影响及其解磷作用[J].中国农业科学,2016,49(16):3152-3161.
[17] 国家环保总局.水和废水监测法[M].4版.北京:中国环境科学出版社,2002.
[18] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[19] 李海峰,李志建,屈建航.高效聚磷鞘氨醇杆菌XF-5的分离与鉴定[J].河南农业科学,2012,42(9):68-72.
[20] Kumar S,Tamura K,Nei M.MEGA3:Integrated software for molecular evolutionary genetics analysis and sequence alignment [J].Brief Bioinform,2004,5(2):150-163.
[21] Saitou N,Nei M.The neighbor-joining method:A new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution,1987,4(4):406-425.
[22] 席琳乔,王静芳,龚明福,等.棉花根际解磷菌的解磷能力和分泌有机酸的初步测定[J].微生物学杂志,2007,27(5):70-74.
[23] Zhao K,Penttinen P,Zhang X P,etal.Burkholderiacepaciawith phosphate solubilizing and antifungal abilities [J].Microbiological Research,2014,169:76-82.
[24] Xiao C Q,Chi R A,Li W S,etal.Biosolubilization of phosphorus from rock phosphate by moderately thermophilic and mesophilic bacteria[J].Mineral Engineering,2011,24(8):956-958.
[25] 柯春亮,陈宇丰,周登博,等.香蕉根际土壤解磷细菌的筛选、鉴定及解磷能力[J].微生物学通报,2015,42(6):1032-1042.
[26] 陶涛,叶明,刘冬,等.无机解磷细菌的筛选、鉴定及其溶磷能力研究[J].合肥工业大学学报,2011,34(2):304-308.
[27] Gupta M,Kiran S,Gulati A,etal.Isolation and identification of phosphate solubilizing bacteria able to enhance the growth and aloin—A biosynthesis ofAloebarbadensisMiller [J].Microbiological Research,2012,167(6):358-363.
[28] 徐卫红,黄河,王爱华,等.根系分泌物对土壤重金属活化及其机理研究进展[J].生态环境,2006,15(1):184-189.
Isolation,Identification and Phosphorolysis Characteristics of High-efficient Phosphate-solubilizing Bacterium XMT-5 under Oligotrophic Conditions
LI Haifeng1,ZHANG Yueyang1,CAO Jian2,QU Jianhang1,TIAN Hailong1
(1.College of Bioengineering,Henan University of Technology,Zhengzhou 450001,China;2.Zhongyuan University of Technology,Zhengzhou 450007,China)
In order to obtain strains which could adapt more oligotrophic natural environmental conditions,Monkina medium diluted by 4 times was used to isolate high-efficient phosphate-solubilizing bacteria,and the bacteria were identified,the growth condition and phosphorolysis mechanism were studied.The results showed that nine phosphate-solubilizing strains were screened out,and the high-efficient phosphate-solubilizing strain XMT-5 was determined through the quantitative determination of phosphate-solubilizing quantity,which could solubilizing phosphate 195.63 mg/L.According to the colony morphology,physiological and biochemical characteristics and 16S rRNA gene sequence analysis,strain XMT-5 was identified asRhizobiumsp.Under the oligotrophic condition,strain XMT-5 could secrete citric acid,tartaric acid and acetic acid,so lead to a drop of pH value.Strain XMT-5 could grow under the oligotrophic condition with 4—42 ℃,pH value of 4—10 and NaCl of 0—80 g/L.The strain had strong adaptability to the environment,and good application prospect.
oligotrophic; phosphate-solubilizing bacteria; phosphorolysis characteristics; biological phosphorus fertilizer
2017-02-20
国家自然科学基金项目(31400103,31370147);河南省高校科技创新团队支持计划项目(15IRTSTHN019)
李海峰(1984-),女,河北涿鹿人,副教授,博士,主要从事微生物与磷循环研究。E-mail:hfli@haut.edu.cn
S154.39
A
1004-3268(2017)08-0067-05

